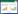中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 周雪娟, 马春草, 李亚楠, 胡倡, 李友国. 2019
- Xuejuan Zhou, Chuncao Ma, Yanan Li, Chang Hu, Youguo Li. 2019
- 华癸根瘤菌urtB基因突变株的构建与共生固氮表型分析
- Construction and analysis of symbiotic phenotypes of urtB mutant in Mesorhizobium huakuii 7653R
- 微生物学报, 59(2): 374-385
- Acta Microbiologica Sinica, 59(2): 374-385
-
文章历史
- 收稿日期:2018-04-20
- 修回日期:2018-05-23
- 网络出版日期:2018-07-17
根瘤菌具有多种多样的物质运输系统,能够利用土壤和根际中的各种复合物[1-2],如运输氨基酸的ABC转运系统(ABC transporter)等。ABC型尿素转运体是典型的ABC转运系统,包括1个锚定基底物结合蛋白、2个整合膜转运亚基和2个ATP结合蛋白。该系统是由urtABCDE基因簇编码,其中urtA编码脂质锚定尿素结合蛋白,urtB和urtC编码整合膜蛋白,由尿素透性酶的2个亚基组成,而urtD和urtE编码ATP结合蛋白[3]。在蓝细菌中,urtA、urtB和urtE的突变导致蓝细菌减少尿素的吸收[4]。在缺乏氮素的条件下,ABC转运体才会诱导表达和合成,尿素的吸收能力提高3倍以上。但是在有氮培养基中,尿素转运会停止或尿素吸收也被阻碍。根瘤菌是一种能够以类菌体形式存在于豆科植物根瘤中的革兰氏阴性菌,一方面将氮气固定成植物所需氮源,另一方面利用植物所提供的碳源、氮源生存。有研究报道,在豌豆根瘤菌(Rhizobium leguminosarum)中,编码氨基酸透性酶Aap和Bra基因双突变后,由于不能利用谷氨酸、谷氨酰胺、脯氨酸及天冬氨酸等氨基酸,根瘤菌生长受到明显影响[5]。另外,在肺炎链球菌(Streptococcus pneumoniae)中发现作为ABC转运体的psa透性酶不仅参与Mn2+转运,同时在系统毒性和抵御超氧化物及过氧化物中发挥重要作用[6]。特别值得关注的是有研究报道在耻垢分枝杆菌中,在氮饥饿处理条件下,urtB基因上调表达19.17[7]。
华癸中慢生根瘤菌为我国特色的固氮资源,具有宿主专一性,其宿主为紫云英[8-9]。7653R基因组序列已注释完成,根据本实验室RNA-sequence和Microarray以及建立的共生固氮子网络,urtB、urtD和urtE在共生固氮中均上调表达,其中urtB基因上调16.8,其余分别为9.4和5.1[10]。本研究利用生物信息学分析UrtB蛋白的结构特征及生物学功能,通过荧光定量和启动子原位表达技术检测urtB在自生和共生条件下的时空和组织表达特征,采用插入失活突变技术构建urtB突变株,进行植物盆栽实验鉴定其共生表型,以期获得直接证据阐明urtB基因在结瘤和固氮中的重要功能,为深入研究urtB基因的功能机制奠定工作基础和科学思路。
1 材料和方法 1.1 材料 1.1.1 菌株和质粒: 本实验所用供试菌株和质粒见表 1。| Strains/Plasmids | Characteristics | Source |
| M. huakuii 7653R | Wild type, Strr | This lab |
| E. coli DH5α | Host of recombinant plasmids | This lab |
| E. coli S17-1 | Host of transformation plasmids | This lab |
| pMD19-T(simple) | TA cloning vector, Ampr | TaKaRa Co. |
| pK19mob | Mutant strains construction vector, Kanr | This lab |
| pRG960 | Strr, Sper | This lab |
1.1.2 主要试剂及试剂盒: Ex Taq DNA聚合酶、dNTPs、2×Taq Master Mix、限制性内切酶、T4-DNA连接酶、M-MuLV反转录酶、RNase抑制剂购自Ferments公司和TaKaRa公司,琼脂糖凝胶电泳Marker购自东盛公司,PCR产物凝胶回收试剂盒购自上海华舜(Watson)生物公司,抗生素、培养基相关组分等分子生物学常规药品及试剂均购自中国国药集团。本研究所用PCR引物由武汉天一辉远生物科技有限公司合成,DNA测序工作由天一辉远公司和南京金斯瑞生物科技有限公司完成。 1.1.3 引物: 本实验所用引物见表 2。
| ID of primers | Sequences of primers(5′→3′) | Characteristics |
| urtB-F | CCCAAGCTTAATTCGACATTGGCGCTTTG | The forward primer of urtB exchange fragment |
| urtB-R | GCTCTAGACAGCACCAGCACGACGATC | The reverse primer of urtB exchange fragment |
| urtB-D | AAAGTATGCCGCAATAGCCC | The verification primer of urtB mutant |
| M13-F | CGCCAGGGTTTTCCCAGTCACGAC | The common forward primer of pK19 vector |
| M13-R | AGCGGATAACAATTTCACACAGG | The common reverse primer of pK19 vector |
| urtB-RT-F | TCGGGAGCGGTGAAGGA | The quantitative forward primer of urtB |
| urtB-RT-R | CGACGAAGGTGGTGTAGGC | The quantitative reverse primer of urtB |
| urtB-p-F | AACTGCAGCGGCGAAATCCAGGCCGA | The forward promoter primer of urtB |
| urtB-p-R | CGGGATCCCGTCATCGGCTTCTGTTAACCCCTT | The reverse promoter primer of urtB |
1.2 培养基和培养条件
大肠杆菌的培养采用LB培养基,在37 ℃培养。7653R、突变株和定位菌株培养采用TY培养基,筛选突变株采用AMS培养基,在28 ℃培养。
AMS培养基(g/L):MOPS 4.190,K2HPO4·3H2O 0.114,NaCl 0.200,MgSO4·7H2O 0.500,加入1 mL Solution A和2 mL Solution B后,调节pH至7,1×105 Pa灭菌30 min。Solution A (g/L):EDTA-Na2 15.000,ZnSO4·7H2O 0.160,NaMoO4 0.200,H3BO3 0.250,MnSO4·4H2O 0.200,CuSO4·5H2O 0.020,CoCl2·4H2O 0.001,4 ℃长期保存。Solution B:CaCl2·2H2O 1.28 g (定容至50 mL),FeSO4·7H2O 0.33 g (定容至50 mL),随后混匀为100 mL,混合溶液现配现用,混合溶液4 ℃贮存不超过1周。Solution C (g/L):Thiamine hydrochloride 1.000,D-Pantothenic acid calcium salt Biotin 2.000,Biotin 0.001,过滤除菌,4 ℃保存。
1.3 urtB突变株、启动子表达定位菌株的构建及筛选 1.3.1 重组质粒的构建: 以7653R菌株基因组DNA为模板,urtB-F和urtB-R引物扩增同源交换臂。PCR反应条件:95 ℃ 5 min,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经DNA凝胶回收试剂盒回收后连接载体pMD19-T (simple)并转化至DH5α,PCR验证后将阳性克隆送至南京金斯瑞测序。抽提测序正确的阳性克隆质粒和载体pK19mob质粒[11]。以Hind Ⅲ、Xba Ⅰ双酶切阳性克隆质粒和pK19mob,回收双酶切后的目的片段、载体,用T4-DNA连接酶连接后转化至S17-1。PCR检测阳性克隆并将正确的阳性克隆菌株命名为urtB-pK19mob。 1.3.2 启动子表达定位菌株的构建: 通过网站(http://www.cbs.dtu.dk/services/Promoter/)预测urtB基因启动子序列,PCR克隆目的片段并连接到pRG960载体[12],将构建好的重组质粒urtB-pRG960和空载pRG960质粒分别通过电转化到7653R感受态中。随后将通过GUS染色筛选得到的阳性菌株,分别命名为urtB-promoter和pRG960-CK。随后分别接种在紫云英根部。之后分别收取10、17、25、30 d的根,经过简单清洗后放到GUS染液中,37 ℃染色3 h以上,随后在普通光学显微镜和体式显微镜下观察[13]。GUS染液:0.01 mol/L K4[Fe(CN)6],0.50 mol/L EDTA,0.001% Triton X-100,20%甲醇,0.019 mol/L X-Gluc,0.050 mol/L PBS (pH 7.0)。
1.3.3 7653R△urtB单交换突变株的筛选: 以urtB-pK19mob为供体菌、7653R为受体菌,进行两亲本接合转移。将urtB-pK19mob导入7653R,基因通过同源重组交换将质粒整合到染色体上,从而使靶基因失活。采用含有Str+Neo的AMS选择性平板上筛选突变体[14]。将筛选获得的单菌落转移到含有Str+Neo抗性的TY平板上,以载体pK19mob、通用引物M13-F与酶切位点对应的目的基因筛选引物D进行PCR检测,同时用野生型7653R基因组DNA为模板作对照[15]。 1.4 植物盆栽实验及共生表型的测定 1.4.1 植物盆栽实验: 用75%乙醇清洗紫云英种子表面5 min,2% (V/V)的NaClO溶液表面消毒10 min,再用无菌水清洗8-10次,彻底洗去NaClO残留,消毒后的种子吸水膨胀4-8 h后铺于无菌素琼脂平板表面,于22 ℃培养箱(16 h光照,8 h黑暗)中培养约2-3 d催芽。催芽后的种子播种含Fahareus无氮植物营养液的无菌沙盆,每组处理5株,约3-5 d植物幼苗长出第一片真叶后,在根系接种1 mL (OD600=0.5)相对应的根瘤菌悬液,光照培养箱培养30 d。另外以Fahareus无氮植物营养液为基本营养液和NH4NO3配制所需营养液的无菌双层沙盆。 1.4.2 共生表型的测定: 观察植株长势并测定地上部分鲜重、瘤数、瘤重、固氮酶活(乙炔还原法)[17]。 1.5 目标基因在自生和共生条件下的荧光定量表达检测分别抽提自生条件下培养的华癸中慢生根瘤菌7653R、接种7653R的紫云英9、12、14、18、21、25、30、45、50 d根瘤的RNA,纯化后测定RNA浓度,均调至2000 ng,并进行反转录。RT-PCR程序:42 ℃ 1 h;72 ℃ 10 min。
1.6 荧光定量PCR先用普通PCR将内参基因亮度调一致,然后用目标基因进行扩增,若条带单一,大小正确,再进行荧光定量PCR检测,内参基因为rnpB。Real-time qPCR程序:95 ℃ 5 min;95 ℃ 30 s;60 ℃ 20 s,72 ℃ 20 s,40个循环。信号检测染料使用SYBR Green,分析相对表达量采用2-△△CT值的方法[18-19]。
1.7 目标基因的生物信息学分析利用NCBI网站根据目标基因的ID名称查找编码蛋白质的序列及名称,然后通过NCBI Conserved Domain Search网页分析靶蛋白的保守结构域,根据保守结构域预测靶蛋白的功能;将蛋白序列通过BLASTp比对查找同源蛋白,挑选不同物种的同源蛋白序列,使用DNAMAN软件进行蛋白同源比对分析,使用Clustal X和MEGA7软件的邻位相接法系统(bootstrap N-J Tree)来构建系统发育树。
2 结果和分析 2.1 urtB基因编码蛋白的结构域和功能分析基于前期工作基础,我们分析了系列目标基因在共生根瘤中的表达变化,发现urtB、urtD和urtE等在共生固氮条件下均显著上调表达,其中urtB上调16.8倍,urtD上调9.4倍,urtE上调5.1倍[10-20]。这表明ABC型尿素转运体在共生固氮中应该发挥重要功能。urtB基因全长1614 bp,编码537个氨基酸,分子量预期大小为56.6 kDa。我们进一步在NCBI上分析了urtB基因编码蛋白的保守结构域(图 1)。
|
| 图 1 UrtB保守结构域示意图 Figure 1 Structure diagram of the conserved domain of UrtB protein. |
通过基本的生物信息分析发现,UrtB蛋白氨基酸序列包含一个TM-ABC transporter signature motif和urea_trans_UrtB结构域,含有该结构域的蛋白超家族参与尿素的代谢和循环。蓝细菌中的研究结果表明该基因缺失造成高亲和力尿素转运的缺失[4]。UrtB在苜蓿根瘤菌2011中的同源基因蛋白是SMb20604,在苜蓿根瘤中该基因在侵染区、过渡区和固氮区均有表达,其中在侵染区和固氮区的表达量最高。因此,以上分析提示该类基因在根瘤固氮中具有重要作用。
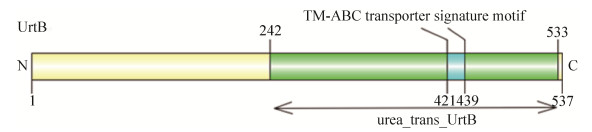
2.2 urtB基因的同源性比对和系统发育分析将urtB基因编码的氨基酸序列在NCBI中进行BLASTp比对分析,将搜索得到的不同物种中该基因的同源蛋白构建一个子系统发育树(图 2)。从系统发育树可看出,urtB基因在中慢生根瘤菌中构成一个相对独立的进化枝,且与Mesorhizobium sp. SEMIA 3007 (WP_069092226.1)、Mesorhizobium loti (WP_064985651.1)等关系更近。这表明urtB基因在中慢生根瘤菌属中相当保守。进一步选取urtB基因编码蛋白与几种较近的中慢生根瘤菌同源蛋白进行氨基酸序列比对,结果表明UrtB与Mesorhizobium loti (WP_064985651.1)氨基酸序列同源性最高。
|
| 图 2 UrtB及同源蛋白的系统发育分析 Figure 2 Phylogenetic analysis of the UrtB and homologous proteins. The phylogenetic tree of UrtB was constructed basing on amino acid sequences. The phylogenetic tree showing relationships between UrtB protein and some highly homologous members from Mesorhizobium sp. SEMIA 3007 (WP_069092226.1) and Mesorhizobium loti (WP_064985651.1). The neighbor-joining phylogenetic tree was constructed using MEGA 7.0 software. Bootstrap values (%) were calculated by 1000 resampling repetitions. The number in parentheses represents the accession of protein. Node number represents the confidence level of relatives, the length of branches represents the evolutionary distance and the coefficient is 0.020. |
2.3 urtB基因在自生和共生条件下的表达水平和动态变化
为了探究urtB基因在7653R中的表达特性,分别收获接种M. huakuii 7653R生长到第9、12、14、18、21、25、30、45、50天的根瘤以及自生条件下培养到对数期的7653R,抽提RNA并反转录获得cDNA,进行Real-time PCR定量分析。PCR定量分析以编码RNaseP的rnpB为内参基因。结果显示在共生根瘤的各个时期urtB基因均增强表达,且在12、14 d表达量提高10倍以上(图 3)。
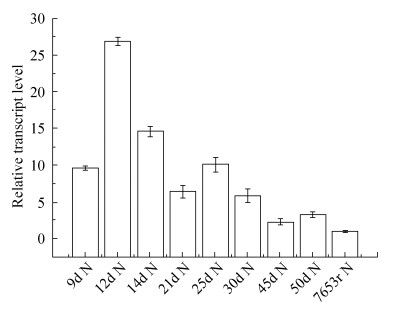
|
| 图 3 urtB在培养条件和不同时期根瘤中的动态表达 Figure 3 The dynamic expression patterns of urtB under free-living condition and different-staged root nodules. From left to right: nodules collected at 9, 12, 14, 21, 25, 30, 45 and 50 d respectively; 7653R of free-living cells. The error bars represent the standard deviations of three independent experiments. |
2.4 urtB基因启动子在共生条件下的原位表达分析
本文进行了urtB基因启动子表达定位的GUS染色和检测,结果显示urtB基因在早期侵染的根毛、侵染线以及早期根瘤中不表达。但是,urtB基因在接种10 d根瘤中的侵染区有少量表达(图 4-A),在17-30 d的根瘤固氮区中大量表达(图 4-B-D)。这表明urtB基因与根瘤发育和共生固氮功能密切相关。
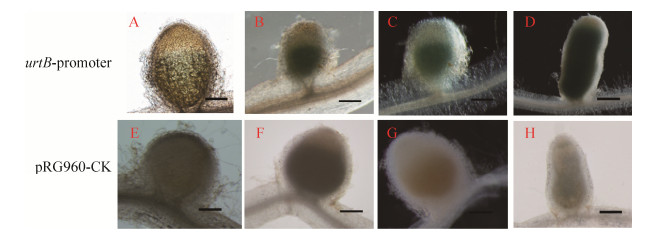
|
| 图 4 urtB启动子在根瘤发育过程中的原位时空表达检测 Figure 4 Spatial and temporal expression analysis of urtB promoter in nodules. A-D: urtB fusion with GUS staining observation of nodules collected at 10, 17, 25 and 30 d respectively; E-H: pRG960-CK GUS staining observation of nodules at 10, 17, 25 and 30 d respectively; Bar=500 μm (A); Bar=100 μm (B-H). |
2.5 7653R urtB突变体菌株的构建和鉴定
以7653R总基因组DNA为模板,扩增大小为849 bp的同源片段,电泳结果表明大小与预期相符(图 5-A);测序正确克隆经Hind Ⅲ和Xba Ⅰ双酶切与同样双酶切的载体pK19mob酶连,转化E. coli DH5α,抽提质粒酶切验证。重组质粒导入华癸根瘤菌7653R中,重组质粒上交换片段与根瘤菌基因组中的urtB基因发生同源重组,整合到染色体上,进而将该基因失活。

|
| 图 5 7653R△urtB突变株的PCR检测鉴定 Figure 5 Identification of 7653R△urtB mutant by PCR. M: DL2000 DNA marker; lane 1: PCR product of urtB mutant genomic DNA; lane 2: PCR products of wild-type 7653R genomic DNA. |
抽提菌落总DNA进行PCR,以载体pK19mob的通用引物M13-F与酶切位点对应的目的基因的筛选引物urtB-D进行PCR验证,同时采用野生型7653R总DNA模板为阴性对照,使用M13-F和urtB-D扩增的△urtB突变株的PCR产物约为1215 bp (图 5-B),片段大小与预期相符,7653R阴性对照组无条带扩出。结果表明△urtB突变体构建正确。
2.6 7653R△urtB突变株的共生固氮表型检测和分析以7653R和7653RΔurtB为接种菌株,不接菌为对照,进行紫云英盆栽实验。光照培养箱中培养30 d后收集植株。由地上部分长势可看出,接种7653R的紫云英植株,长势正常、叶片绿色,而接种7653RΔurtB的紫云英植株长势矮小、叶片发黄,表现出明显的氮饥饿状态(图 6-A)。同时,观察植株地下部分表型可见,接种7653R的植株根系发达,根瘤数量多且为粉色根瘤,而突变株根瘤为白色根瘤,对照植株不结瘤(图 6-B)。石蜡切片结果显示接种30 d的野生型植株所结根瘤正处于旺盛的固氮时期,各个分区明显,且固氮区占大部分,含菌组织体积较大(图 6-C左),这表明根瘤固氮活力旺盛。而突变植株根瘤固氮区含菌细胞明显较少,部分细胞呈现衰老裂解状态(图 6-C右),这与植物长势矮小,固氮酶活降低的盆栽表型相吻合。表明urtB基因在固氮时期发挥重要作用。进一步,对植株地上部分鲜重、瘤数、瘤重及固氮酶活性进行数据统计分析(图 7),结果发现接种突变体菌株与野生型菌株相比,在地上部分鲜重、瘤数、瘤重及根瘤固氮酶活性均存在显著性差异(P<0.05, n=12)。
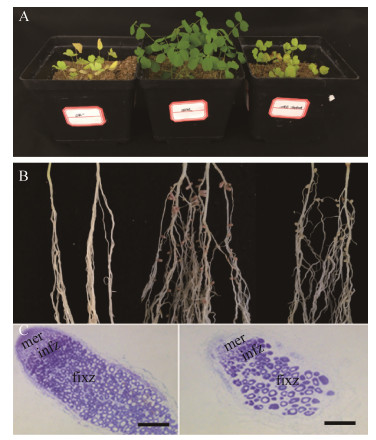
|
| 图 6 7653R△urtB突变株与紫云英的共生表型测定分析 Figure 6 Symbiosis phenotypes of 7653R△urtB mutant tested on Astragalus sinicus. A: Appearances of plant growth, negative control (without inoculation of any rhizobia strain) (left), 7653R-wild type (middle) and 7653R△urtB mutant (right); B: Appearances of root nodulations, control (left), 7653R-wild type (middle) and 7653R△urtB mutant (right); C: Microscopic observations for the development of root nodules. Paraffin-embedded slides of longitudinal section of 30 d nodules stained with toluidine blue. 7653R nodule (left) and 7653R△urtB mutant nodule (right). mer, meristem; infz, infection zone; fixz, nitrogen fixation zone. Bars=500 μm. |
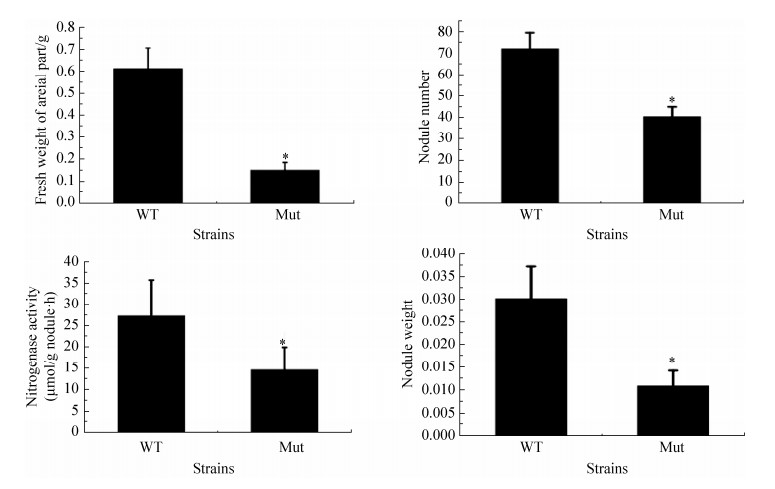
|
| 图 7 植株地上部分鲜重、瘤数、瘤重及固氮酶活的比较测定 Figure 7 Comparative quantification of the fresh weight of plant, number of nodule, nitrogenase activity and fresh weight of nodule induced by 7653R△urtB mutant. *: significant difference at P < 0.05; the error bars represent the standard deviations of three independent experiments. |
2.7 补加氮素处理可恢复7653R△urtB的共生固氮缺陷表型
为了确认上述共生固氮缺陷表型(植株所表现出的缺氮特征)确实是由于目标基因urtB的功能失活所导致的,我们进一步在盆栽中额外补充氮素,并检测在接种7653R△urtB后紫云英的共生表型。结果表明,野生型组根瘤为正常粉色根瘤,加氮处理组突变株所结根瘤仍为白色小根瘤,但植物叶片呈绿色(图 8)。经统计学分析,瘤数、瘤重及固氮酶活与野生型相比仍表现出显著性差异,但地上部分鲜重较野生型无显著性差异(表 3)。所以不难看出,补充氮素能够弥补由于urtB基因氮素转运功能缺失所导致的共生植株缺氮表型,使得植物此时能够正常生长,从而地上部分生物量与野生型无差异。这个结果进一步说明该基因可能参与共生固氮过程中类菌体所固定有机氮素的转运或同化吸收。
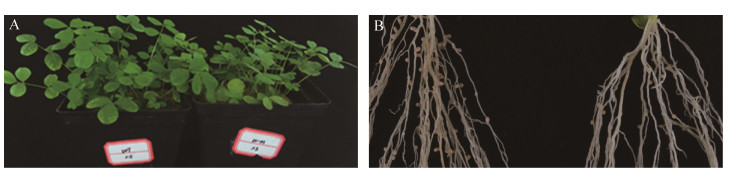
|
| 图 8 补加氮素处理条件下urtB突变株共生固氮缺陷表型的恢复 Figure 8 Symbiosis phenotype restoration of urtB mutant after N addition treatment in pot plant experiment. A: Appearances of plant growth, 7653R-wild type (left, no nitrogen addition) and 7653R△urtB mutant (right, with nitrogen addition); B: Appearances of root nodulations, 7653R-wild type (left, no nitrogen addition) and 7653R△urtB mutant (right, with nitrogen addition). |
| Group | Fresh weight of plant/(g/plant) | Number of nodule/(plant) | Fresh weight of nodule/(g/plant) | Nodule nitrogenase activity/(μmol/g nodule h) |
| WT-7653R | 0.57a±0.06 | 36.5a±0.16 | 0.09a±0.01 | 13.88a±2.52 |
| 7653R△urtB+N | 0.48a±0.04 | 20.67b±0.33 | 0.02b±0.02 | 6.27b±1.11 |
| The data is average of three replicates; values in each column followed by the different letter indicate significance difference (P < 0.05). | ||||
3 讨论
生物固氮是指固氮微生物将空气中的N2还原成NH4+的过程。根瘤菌与宿主豆科植物相互作用形成根瘤,主要以类菌体(bacteroids)形式进行生物固氮作用。根瘤菌与宿主豆科植物两者互利共生,宿主豆科植物为根瘤菌提供作为碳源、能源以及还原力的四碳二羧酸,作为回报[21],根瘤菌将类菌体中固定的有机氮分泌供给植物利用,同时自身生长也需要氮素。
在蓝细菌的研究报道中发现,urtB基因可能参与运输、结合蛋白、氨基酸、肽和胺,该超家族蛋白对于氮素转运非常重要。在耻垢分枝杆菌中有研究报道,调控氮代谢的转运体也包括尿素ABC转运体[21]。通过生物信息学分析,我们发现7653R urtB基因的保守结构域与蓝细菌非常相似。系统发育分析该基因在中慢生根瘤菌中较为保守,暗示了urtB基因可能参与中慢生根瘤菌中共生体的形成及共生固氮中N素的运输。为了探究华癸根瘤菌urtB基因对根瘤发育及共生固氮的影响,本文进行了一系列实验及检测分析。转录组分析显示urtB基因在共生固氮时期上调表达16.8。荧光定量测定显示,该基因在根瘤形成及共生固氮过程中的表达量都明显升高,说明了urtB基因参与根瘤形成与共生固氮过程。我们构建筛选了urtB基因单交换突变体[22-23],并检测在缺氮条件下接种紫云英的共生表型。盆栽实验结果显示,urtB基因突变株地上部分矮小,叶片发黄,根瘤颜色为白色,根瘤较小。突变体植株地上部分鲜重、瘤数、瘤重及固氮酶活均显著性降低。石蜡切片观察发现urtB基因突变导致根瘤含菌细胞少、类菌体数量少。这些结果均表明urtB基因与根瘤发育及共生固氮密切相关。在有氮条件下接种urtB突变株后发现,突变株所结根瘤仍为白色小根瘤,瘤数、瘤重及固氮酶活仍然很低,但地上部分长势和叶色与接种野生型7653R菌株无明显差异,这进一步说明该基因可能参与根瘤发育和共生固氮过程中氮素的运输。另外共生体膜上还存在大量其他的转运系统,如MgtE在豌豆根瘤中被推测为Mg2+转运子,它的缺失突变影响到镁的代谢及Mg2+-ATP参与的固氮作用,产生结瘤不固氮的共生表型(Fix-)[24];百脉根硫转运子SST1缺失突变后,影响到电子传递而产生结瘤不固氮的共生表型(Fix-)[25];urtB基因缺失之后导致了紫云英结瘤不固氮,可能影响到类菌体所固定有机氮素的转运或同化吸收。
本文首次研究了根瘤菌中尿素ABC转运体在氮素转运中对共生固氮的影响。我们通过生物信息学及实验结果分析,认为中慢生根瘤菌中urtB基因可能在根瘤发育及共生固氮过程中参与氮素的转运,但具体的转运机制还有待进一步实验研究。可通过免疫电镜来观察根瘤中该基因蛋白的表达定位;还可通过抽提突变株根瘤RNA,采用荧光定量方法检测其上下游基因urtD、urtE表达情况,以及固氮酶铁蛋白nifH及谷氨酰胺合成酶GS基因等的表达[10]。
| [1] | Galibert F, Finan TM, Long SR, Pühler A, Abola P, Ampe F, Barloy-Hubler F, Barnett MJ, Becker A, Boistard P, Bothe G, Boutry M, Bowser L, Buhrmester J, Cadieu1 E, Capela D, Chain P, Cowie A, Davis RW, Dréano S, Federspiel NA, Fisher RF, Gloux S, Godrie T, Goffeau A, Golding B, Gouzy J, Gurjal M, Hernandez-Lucas I, Hong A, Huizar L, Hyman RW, Jones T, Kahn D, Kahn ML, Kalman S, Keating DH, Kiss E, Komp C, Lelaure V, Masuy D, Palm C, Peck MC, Pohl TM, Portetelle D, Purnelle B, Ramsperger U, Surzycki R, Thébault P, Vandenbol M, Vorhölter FJ, Weidner S, Wells DH, Wong K, Yeh KC, Batut J. The composite genome of the legume symbiont Sinorhizobium meliloti. Science, 2001, 293(5530): 668-672. DOI:10.1126/science.1060966 |
| [2] | Young JP, Crossman LC, Johnston AW, Thomson NR, Ghazoui ZF, Hull KH, Wexler M, Curson AR, Todd JD, Poole PS, Mauchline TH, East AK, Quail MA, Churcher C, Arrowsmith C, Cherevach I, Chillingworth T, Clarke K, Cronin A, Davis P, Fraser A, Hance Z, Hauser H, Jagels K, Moule S, Mungall K, Norbertczak H, Rabbinowitsch E, Sanders M, Simmonds M, Whitehead S, Parkhill J. The genome of Rhizobium leguminosarum has recognizable core and accessory components. Genome Biology, 2006, 7(4): R34-R89. DOI:10.1186/gb-2006-7-4-r34 |
| [3] | Sachs G, Kraut JA, Wen Y, Feng J, Scott DR. Urea transport in bacteria:acid acclimation by gastric Helicobacter spp. The Journal of Membrane Biology, 2006, 212(2): 71-82. DOI:10.1007/s00232-006-0867-7 |
| [4] | Valladares A, Montesinos ML, Herrero A, Flores E. An ABC-type, high-affinity urea permease identified in Cyanobacteria. Molecular Microbiology, 2002, 43(3): 703-715. DOI:10.1046/j.1365-2958.2002.02778.x |
| [5] | Hosie AHF, Allaway D, Galloway CS, Dunsby HA, Poole PS. Rhizobium leguminosarum has a second general amino acid permease with unusually broad substrate specificity and high similarity to branched-chain amino acid transporters (Bra/LIV) of the ABC family. Journal of Bacteriology, 2002, 184(15): 4071-4080. DOI:10.1128/JB.184.15.4071-4080.2002 |
| [6] | McAllister LJ, Tseng HJ, Ogunniyi AD, Jennings MP, McEwan AG, Paton JC. Molecular analysis of the PSA permease complex of Streptococcus pneumoniae. Molecular Microbiology, 2004, 53(3): 889-901. DOI:10.1111/j.1365-2958.2004.04164.x |
| [7] | Jessberger N, Lu Y, Amon J, Titgemeyer F, Sonnewald S, Reid S, Burkovski A. Nitrogen starvation-induced transcriptome alterations and influence of transcription regulator mutants in Mycobacterium smegmatis. BMC Research Notes, 2013, 6(10): 482-524. |
| [8] |
Li YX, Li F, Zhou XL, Xie FL, Li YG. Screening proteins interacting with the outer membrane protein opa22 in Mesorhizobium huakuii 7653R with bacterial two-hybrid library. Journal of Huazhong Agricultural University, 2014, 33(2): 28-33.
(in Chinese) 李一星, 李芳, 周鑫兰, 谢福莉, 李友国. 利用细菌双杂交文库筛选华癸中慢生根瘤菌7653R中与外膜蛋白Opa22互作的蛋白. 华中农业大学学报, 2014, 33(2): 28-33. DOI:10.3969/j.issn.1000-2421.2014.02.005 |
| [9] |
Li YX, Wang JY, Shi XF, Chen DS, Li YG. Activity in vitro and function of a non-specific lipid transfer protein AsIB259 from Astragalus sinicus in symbiotic nitrogen fixation. Journal of Huazhong Agricultural University, 2014, 33(2): 19-25.
(in Chinese) 李一星, 王建云, 石晓峰, 陈大松, 李友国. 紫云英非特异性转脂蛋白AsIB259的体外酶活性及在共生固氮中的功能. 华中农业大学学报, 2014, 33(2): 19-25. |
| [10] | Peng JL, Hao BH, Liu L, Wang SM, Ma BG, Yang Y, Xie FL, Li YG. RNA-Seq and microarrays analyses reveal global differential transcriptomes of Mesorhizobium huakuii 7653R between bacteroids and free-living cells. PLoS One, 2014, 9(4): e93626. DOI:10.1371/journal.pone.0093626 |
| [11] | Heil JR, Cheng J, Charles TC. Site-specific bacterial chromosome engineering:Ф31 integrase mediated cassette exchange (IMCE). Journal of Visualized Experiments, 2012(61): e3698. |
| [12] | van den Eede G, Deblaere R, Goethals K, van Montagu M, Holsters M. Broad host range and promoter selection vectors for bacteria that interact with plants. Molecular Plant Microbe Interact, 1992, 5(3): 228-234. DOI:10.1094/MPMI-5-228 |
| [13] | Wang C, Zhu H, Jin LP, Chen T, Wang LX, Kang H, Hong ZJ, Zhang ZM. Splice variants of the SIP1 transcripts play a role in nodule organogenesis in Lotus japonicus. Plant Molecular Biology, 2013, 82(1/2): 97-111. |
| [14] | Tang GR, Li NN, Liu YM, Yu LM, Yu LL, Yan JH, Luo L. Sinorhizobium meliloti glutathione reductase is required for both redox homeostasis and symbiosis. Applied and Environmental Microbiology, 2018, 84(3). DOI:10.1128/AEM.01937-17 |
| [15] |
Li YN, Zeng XB, Zhou XJ, Li YG. Cloning, mutagenesis and symbiotic phenotype of three lipid transfer protein encoding genes from Mesorhizobium huakuii 7653R. Acta Microbiologica Sinica, 2016, 56(12): 1901-1911.
(in Chinese) 李亚楠, 曾小波, 周雪娟, 李友国. 华癸中慢生根瘤菌7653R3个脂质转运蛋白基因的克隆、突变及共生表型. 微生物学报, 2016, 56(12): 1901-1911. |
| [16] |
Kuai JL, Liu XJ, Li WQ. Effects of different nitrogen levels on the growth characteristics of alfalfa inoculated with rhizobium. Grassland and Turf, 2011, 31(3): 56-59, 63.
(in Chinese) 蒯佳林, 刘晓静, 李文卿. 不同氮素水平对接种根瘤菌紫花苜蓿生长特性的影响. 草原与草坪, 2011, 31(3): 56-59, 63. DOI:10.3969/j.issn.1009-5500.2011.03.011 |
| [17] | Li YX, Zhou L, Li YG, Chen DS, Tan XJ, Lei L, Zhou JC. A nodule-specific plant cysteine proteinase AsNODF32 is involved in nodule senescence and nitrogen fixation activity of the green manure legume Astragalus sinicus. New Phytologist, 2008, 180(1): 185-192. DOI:10.1111/nph.2008.180.issue-1 |
| [18] | Estrada-Navarrete G, Cruz-Mireles N, Lascano R, Alvarado-Affantranger X, Hernández-Barrera A, Barraza A, Olivares JE, Arthikala M, Cárdenas L, Quinto C, Sanchez F. An autophagy-related kinase is essential for the symbiotic relationship between Phaseolus vulgaris and both Rhizobia and Arbuscular Mycorrhizal Fungi. The Plant Cell, 2016, 28(9): 2326-2341. DOI:10.1105/tpc.15.01012 |
| [19] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [20] | Wang SM, Hao BH, Li JR, Gu HL, Peng JL, Xie FL, Zhao XY, Frech C, Chen NS, Ma BG, Li YG. Whole-genome sequencing of Mesorhizobium huakuii 7653R provides molecular insights into host specificity and symbiosis island dynamics. BMC Genomics, 2014, 15: 440. DOI:10.1186/1471-2164-15-440 |
| [21] | Prell J, Poole P. Metabolic changes of rhizobia in legume nodules. Trends in Microbiology, 2006, 14(4): 161-168. DOI:10.1016/j.tim.2006.02.005 |
| [22] | Schafer A, Tauch A, Jäger W, Kalinowski J, Thierbach G, Pühler A. Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19:selection of defined deletions in the chromosome of Corynebacterium glutamicum. Gene, 1994, 145(1): 69-73. DOI:10.1016/0378-1119(94)90324-7 |
| [23] | Abd-ElKarem Y, Elbers T, Reichelt R, Steinbüchel A. Heterologous expression of Anabaena sp. PCC7120 cyanophycin metabolism genes cphA1 and cphB1 in Sinorhizobium (Ensifer) meliloti 1021. Applied Microbiology and Biotechnology, 2011, 89(4): 1177-1192. DOI:10.1007/s00253-010-2891-x |
| [24] | Karunakaran R, Ramachandran VK, Seaman JC, East AK, Mouhsine B, Mauchline TH, Prell J, Skeffington A, Poole PS. Transcriptomic analysis of Rhizobium leguminosarum biovar viciae in symbiosis with host plants Pisum sativum and Vicia cracca. Journal Bacteriology, 2009, 191(12): 4002-4014. DOI:10.1128/JB.00165-09 |
| [25] | Krusell L, Krause K, Ott T, Desbrosses G, Krämer U, Sato S, Nakamura Y, Tabata S, James EK, Sandal N, Stougaard J, Kawaguchi M, Miyamoto A, Suganuma N, Udvardi MK. The sulfate transporter SST1 is crucial for symbiotic nitrogen fixation in Lotus japonicus root nodules. The Plant Cell, 2005, 17(5): 1625-1636. DOI:10.1105/tpc.104.030106 |
 2019, Vol. 59
2019, Vol. 59