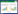中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 章文锦, 张皎皎, 李艳红, 蒋艳红, 姚维志, 吴正理. 2019
- Wenjin Zhang, Jiaojiao Zhang, Yanhong Li, Yanhong Jiang, Weizhi Yao, Zhengli Wu. 2019
- 蜡状芽孢杆菌S458-1对水产养殖系统中水质调节的作用
- Water quality control in aquaculture system by Bacillus cereus S458-1
- 微生物学报, 59(11): 2182-2193
- Acta Microbiologica Sinica, 59(11): 2182-2193
-
文章历史
- 收稿日期:2019-01-10
- 修回日期:2019-04-03
- 网络出版日期:2019-04-22
2. 西南大学渔业资源环境研究中心, 重庆 400715;
3. 淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715
2. Research Center of Fishery Resources and Environment, Southwest University, Chongqing 400715, China;
3. Key Laboratory of Freshwater Fish Reproduction and Development(Southwest University), Ministry of Education, Chongqing 400715, China
磷是构成水生生态系统的必需营养元素,在初级生产力中发挥重要作用[1]。在水生环境中,磷的溶解形式(即活性磷)几乎完全被初级生产者摄取,并且掺入到组织中构成化合物(骨骼和牙齿中磷灰石,细胞膜中的磷脂)、遗传物质(DNA、RNA)和能量储存物质(ATP)[2]。了解水生生态系统中磷的生物利用度对于生物生产至关重要,在水产养殖中,培养浮游植物通常需施加适当的磷肥以促进其生长,但大量含磷饵料和肥料投入池塘后,多沉积于底泥,转化为难溶性有机磷(insoluble organic phosphorus,IOP),仅有一小部分含磷饵料和肥料被浮游藻类利用,造成水中活性磷(soluble reactive phosphorus,SRP)含量偏低,而池塘沉积物总磷(total phosphorus,TP)含量偏高[3]。解磷微生物细胞内存在的水解酶类,能够将初级生产者不易吸收利用的难溶性有机磷转化为可吸收的活性磷[1-2, 4-5]。因此,解磷微生物的存在,是提高水体中磷利用率的有效方法之一。利用微生物的解磷作用弥补环境中有效磷缺乏一直是国内外的研究热点。解磷微生物最早报道于1908年从土壤中筛选出36株在平板上可形成溶磷圈的细菌[6],迄今已报道的解磷菌有39属、89种以及数以万计的菌株[2]。
穆国俊等研究苏云金芽孢杆菌Bt-3701与巨大芽孢杆菌Bm-107种间原生质体融合,融合子既具有一定的杀虫活性又具有一定的解磷活性[7]。Rice等研究发现解磷菌与根瘤菌或菌根菌配合应用,对提高农作物的产量以及土壤中的有效磷都具有良好的功效[8]。Vessey等利用菌株Penicillium bilaii接种豌豆的研究,表明该菌株具有强大的解磷能力,能促进豌豆的生长[9]。从南方红豆杉根际分离筛选得到一株蜡状芽孢杆菌CLY07,初步揭示了蜡状芽孢杆菌的解磷能力,并通过改变培养条件提升该菌株的解磷能力[10]。然而目前报道的解磷微生物菌株主要分离于土壤,应用于农作物栽培上并取得了良好的经济效益;解磷菌作为益生菌应用于水产养殖生产报道较多,但解磷微生物分离于水产养殖环境的报道较少。在“芽孢杆菌-罗非鱼-水培莴苣”生态系统中,芽孢杆菌作为植物生长促进剂可提高磷的利用率[11];从喜盐草根际沉积物中分离纯化得到具有高效固氮解磷能力的菌株,作为益生菌应用于南美白对虾养殖中可减轻池塘沉积物中有机物和难溶性磷的污染[12];根基土壤中分离的伯克霍尔德氏菌MB14 (Burkholderia glathei)能降解湖泊或池塘沉积物中的难溶性磷[13];芽孢杆菌YC4作为益生菌在水产养殖过程中使用,显著增加了水体的活性磷的浓度[14]。然而利用陆生环境分离的解磷菌应用于水产养殖中,细菌的生长繁殖性能并不理想,从水产养殖环境中分离解磷菌是解决这一问题的手段之一。
本实验室前期研究中从养殖池塘分离得到一株高产淀粉酶的蜡状芽孢杆菌S458-1,本研究旨在检测菌株S458-1是否可作为益生菌应用于水产养殖生产上,并确定其投放水体最适浓度。结果表明菌株S458-1具有脱氮解磷作用,尤其是可显著提高水体中的活性磷含量,并且可显著降低养殖对象血清中谷草转氨酶(GOT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)含量,增强养殖对象的生理健康状态,具有较大的应用前景。本研究为该菌株的后续开发与应用提供了理论基础。
1 材料和方法 1.1 材料 1.1.1 菌株来源: 菌株编号为S458-1,保存于西南大学渔业资源环境研究中心。 1.1.2 培养基: (1) LB固体培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,琼脂粉15,加蒸馏水至1 L,pH 7.0。121 ℃高压灭菌15 min。(2) LB液体培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,pH 7.0。121 ℃高压灭菌15 min。 1.1.3 生物材料与试验基地: (1) 供试鱼种:当年中科3号鲫鱼鱼种,体重20 g左右,购于重庆市北碚区歇马镇人和水产养殖场;试验开始之前,鱼种经7 d驯养。(2)试验饲养饲料:采用正常养殖鲫鱼专用规格饲料(粗蛋白 > 34.0%,粗脂肪 > 3.0%)。(3)试验基地:西南大学试验养殖基地,1000 L圆台形玻璃钢养殖桶。 1.1.4 主要试剂及仪器: 纳氏试剂、抗坏血酸、萘乙二胺、四水合钼酸盐、氯化亚锡、对氨基苯磺酸、醋酸钠、硫酸锌(成都市科龙化工试剂厂),盐酸α-萘胺(上海双喜助剂厂),过硫酸钾(天津市致远化学试剂有限公司),碘化汞(姜堰市环球试剂厂),硫酸(川东化工厂),钼酸铵(天津市科密欧化学试剂有限公司),以上药品与试剂均为分析纯;GPT、GOT、AKP、MDA测定试剂盒(南京建成生物工程研究所),SOD、GSH-Px测定试剂盒(上海优选生物科技有限公司);恒温生化培养箱(施都凯仪器设备有限公司,BI 250A),紫外可见分光光度计(翱艺仪器有限公司,UV 1800),酶标仪(美国伯乐公司,Bio-Rad680)。 1.2 养殖试验 1.2.1 菌株S458-1最适添加浓度试验: 选取健康无病、规格整齐的中科3号鲫鱼120尾,随机分成4组、每组3个重复,分别养殖于12个1000 L的圆台形玻璃钢养殖桶中,溶氧控制在5.0–7.0 mg/L,水温控制在25–28 ℃,pH 6.8–7.5。试验组每隔6 d投加1次S458-1菌液,共投加3次,终浓度分别为0 (对照组,CG)、106 CFU/mL (低浓度组,LCG)、107 CFU/mL (中浓度组,MCG)、108 CFU/mL (高浓度组,HCG)。养殖周期为18 d,养殖过程中不换水,适量补充曝气自来水控制水位,按2%的日投喂量分两次定时投喂饲料。每隔3 d取1次水样进行水质检测,水样采取时间为上午8:30 (当日喂食前)。养殖结束后,从每个试验桶中随机选取鲫鱼2尾,麻醉后擦干体表,用5 mL的一次性注射器从鱼的尾动脉抽取血液,放入2 mL离心管内,室温静置2 h后,4000 r/min冷冻离心10 min,分离血清,–20 ℃保存。 1.2.2 模拟池塘养殖试验: 选取健康无病、规格整齐的中科3号鲫鱼60尾,随机分成2组、每组3个重复,分别养殖于6个1000 L的圆台形玻璃钢养殖桶中,每缸装入15 cm深的底泥,溶氧控制在5.0–7.0 mg/L、水温控制在25–28 ℃、pH 6.8–7.5。每隔3 d取一次水样进行水质检测,水样采取时间为上午8:30 (当日喂食前)。试验组每6 d投加1次S458-1菌液,终浓度分别为0 (对照组,CG)、107 CFU/mL (试验组,TG)。养殖周期为45 d,养殖过程中不换水,适量补充曝气自来水控制水位,按2%的日投喂量分两次定时投喂饲料。 1.3 水化指标测定 1.3.1 总氮(TN)测定: 采用“碱性过硫酸钾消解紫外分光光度法”(GB/T 11849-1989)进行测定。10 mL水样于25 mL消解管中,加入5 mL碱性过硫酸钾,140 ℃高温消解15 min后冷却至室温,加入1 mL盐酸,用无氨水定容至25 mL,分别测定220、275 nm处吸光度,通过标准曲线计算水样中总氮含量。 1.3.2 氨氮(NH4+-N)测定: 采用“纳氏试剂比色法”(GB/T 7479-1987)进行测定。100 mL水样中加入1 mL ZnSO4、0.5 mL NaOH,充分摇匀后过滤。取50 mL滤液,加入1 mL酒石酸钾钠、1 mL纳氏试剂,静置10 min,波长420 nm处测定吸光度,通过标准曲线计算水样中氨氮含量。 1.3.3 硝态氮(NO3–-N)测定: 采用“紫外分光光度法”(HJ/T 346-2007)进行测定。100 mL水样中加入2 mL Al(OH)3悬浮液充分摇匀后过滤。取50 mL滤液,加入1 mL盐酸摇匀,波长220、275 nm处分别测定其吸光度,通过标准曲线计算水样中硝态氮浓度。 1.3.4 亚硝态氮(NO2–-N)测定: 采用“盐酸萘乙二胺分光光度法”(GB/T 7493-1987)进行测定。100 mL水样中加入2 mL Al(OH)3悬浮液,充分摇匀后过滤。取50 mL滤液,加入1 mL对氨基苯磺酸摇匀,静置2 min后,再加入1 mL醋酸钠、1 mL α-萘胺摇匀,静置10 min,波长540 nm处测定其吸光度,通过标准曲线计算水样中亚硝态氮。 1.3.5 总磷(TP)测定: 采用“钼酸铵分光光度法”(GB/T 11893-1989)进行测定。15 mL水样于25 mL消解管中,加入2.5 mL过硫酸钾,140 ℃高温消解15 min后冷却至室温,再用无氨水定容至25 mL,加入0.6 mL抗坏血酸混匀,30 s后加入1.2 mL钼酸盐溶液充分摇匀,静置15 min,波长700 nm处测定其吸光度,通过标准曲线计算水样中总磷。 1.3.6 活性磷(SRP)测定: 采用“钼酸铵分光光度法”(GB/T 11893-1989)进行测定(不含消解步骤)。50 mL水样加入1 mL硫酸-钼酸铵混合液,混匀、放置3 min,再加入1 mL抗坏血酸,静置10 min,波长700 nm处测定其吸光度,通过标准曲线计算水样中活性磷含量。 1.4 血清生化指标测定 1.4.1 ELISA法检测: 采用ELISA双抗夹心法进行测定血清中的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)含量。酶标板中加入50 µL样品或标准品,再加入100 µL酶标抗体,37 ℃放置1 h;洗涤3次后,加入底物,37 ℃避光显色15 min,酶标仪450 nm测定吸光度。 1.4.2 酶促反应: 血清谷丙转氨酶(GPT)、血清谷草转氨酶(GOT)、碱性磷酸酶(AKP)以及丙二醛(MDA)的含量,采用南京建成生物工程研究所的试剂盒,并按操作说明进行测定。 1.5 数据统计分析采用Excel2010进行数据初步处理,试验数据用平均值±标准误(mean±SE)表示。采用SPSS23.0软件对数据进行统计分析,对数据进行单因素方差分析(one-way ANOVA),利用Duncan’s检验进行多重比较,P < 0.05表示有显著性差异。Origin9.0软件绘制图表。
2 结果和分析 2.1 菌株S458-1调节水体中氮元素变化 2.1.1 不同浓度菌株S458-1调节鲫鱼养殖水质氮元素的变化: 研究结果显示,随着养殖时间的不断延长,菌株S458-1不同浓度处理组养殖水体中N元素具有由氨氮、亚硝态氮向硝态氮转化的趋势,但各组间差异并不显著(图 1)。总氮变化呈上升趋势,但各组之间无显著性差异(P > 0.05,图 1-A)。氨氮的变化在各组间无显著差异(P > 0.05,图 1-B),CG和HCG组在养殖过程中氨氮浓度呈现持续上升的趋势;但第三周开始,LCG和MCG组氨氮浓度呈现明显下降趋势;在试验结束时,各组氨氮浓度表现为CG > HCG > LCG > MCG。硝态氮随着养殖时间的延长,各组间具有显著差异(P < 0.05,图 1-C),第二周开始,MCG组硝态氮呈明显上升趋势,其他各组先上升后下降;且在试验结束时,MCG组硝态氮浓度达到最高,且与其他各组有显著差异(P < 0.05),而CG组硝态氮浓度最低。随着养殖时间的不断延长,各组亚硝态氮呈缓慢上升趋势,各组间无显著差异(P > 0.05);在试验结束时,水体亚硝态氮浓度表现为MCG > HCG > LCG > CG (图 1-D)。结果表明,菌株S458-1能促进水体中N元素的转变,可将氨氮和亚硝态氮转变成硝态氮,且中浓度组(MCG)效果较好。
|
| 图 1 不同浓度菌株S458-1调节鲫鱼养殖水质氮元素的变化 Figure 1 Changes of nitrogen content in water quality of gibel carp culture by different concentrations of strain S458-1. Values are the mean±SE. Values with different letters (a, b) are significantly different (P < 0.05) |
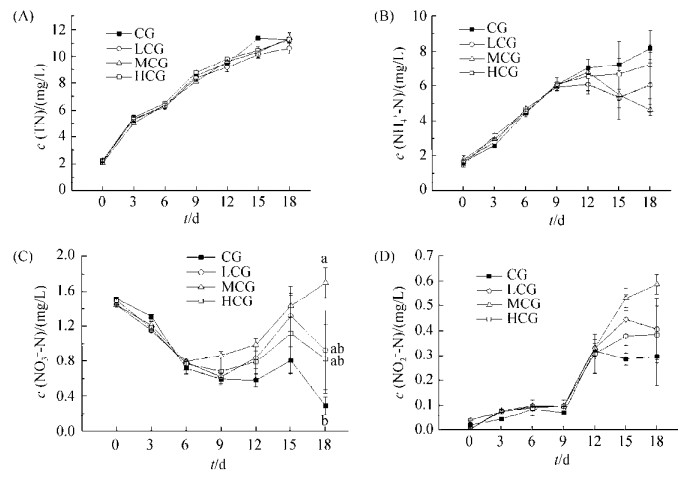
2.1.2 最佳浓度菌株S458-1调节鲫鱼养殖水质氮元素的变化: 根据上述结果,本试验选取菌株S458-1最佳添加浓度107 CFU/mL作为试验处理组(TG)。结果显示:随着养殖时间的延长,养殖水体中总氮(图 2-A)、氨氮(图 2-B)、硝态氮(图 2-C)、和亚硝态氮(图 2-D)的浓度均呈现持续上升的趋势,但试验组与对照组之间均无显著性差异(P > 0.05)。但与对照组比较,试验组养殖水体中的氨氮和亚硝态氮浓度均低于对照组,而硝态氮浓度高于对照组,说明菌株S458-1在养殖水体中具有脱氮作用。
|
| 图 2 最佳浓度菌株S458-1调节鲫鱼养殖水质氮元素的变化 Figure 2 Optimal concentration of strain S458-1 regulates nitrogen content changes in water quality of gibel carp culture. Values are the mean±SE |
2.2 菌株S458-1促进水体中有效磷产生 2.2.1 不同浓度菌株S458-1促进鲫鱼养殖水质磷元素的转化: 研究结果显示,随着养殖时间的不断延长,添加菌株S458-1不同浓度的试验组和对照组养殖水体中总磷和有效磷浓度均呈上升趋势(图 3)。各组之间总磷浓度无显著差异(P > 0.05,图 3-A);试验开始第9天后各组水体中的活性磷开始呈现出显著性差异(P < 0.05,图 3-B),水体中活性磷含量分别为HCG > MCG > LCG > CG,说明蜡状芽孢杆菌S458-1能促进水体磷元素的转变,增加水体中的有效磷含量。

|
| 图 3 不同浓度菌株S458-1促进鲫鱼养殖水质磷元素的转化 Figure 3 Different concentrations of strain S458-1 promote the conversion of phosphorus in water quality of gibel carp culture. Values are the mean±SE. Values with different letters (a, b) are significantly different (P < 0.05) |
2.2.2 最佳浓度菌株S458-1促进鲫鱼养殖水质磷元素的转化: 根据上述的试验结果,本试验选取菌株S458-1最佳添加浓度107 CFU/mL作为试验处理组(TG)。整个养殖周期内,随着养殖时间的延长,总磷(TP)和有效磷(SRP)浓度均呈不断上升趋势(图 4)。对照组(CG)总磷含量略高于试验组(TG),但差异不显著(P > 0.05,图 4-A)。从试验第二周开始,试验组水体活性磷含量显著大于对照组(P < 0.05,图 4-B)。结果进一步表明菌株S458-1具有解磷作用,可显著增加养殖水体中的活性磷。

|
| 图 4 单一浓度菌株S458-1鲫鱼养殖水质磷含量变化 Figure 4 Changes of phosphorus content in water quality of gibel carp culture of single concentration strain S458-1. Values are the mean±SE. Values with different letters (a, b) are significantly different (P < 0.05) |
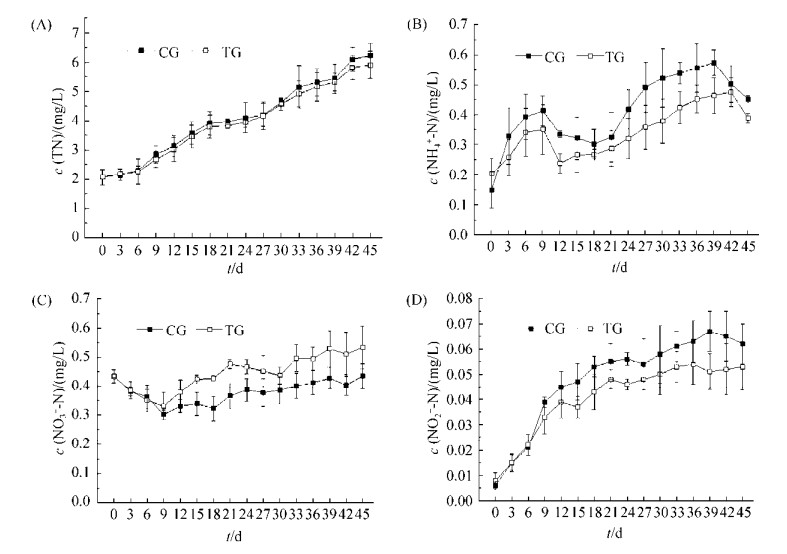
2.3 菌株S458-1对养殖鲫鱼血清酶类的影响 2.3.1 菌株S458-1对转氨酶的影响: 谷草转氨酶(GOT)和谷丙转氨酶(GPT)主要存在于细胞内,而正常情况下血清中的活性很低。当机体组织细胞受损时,可能有大量的GOT和GPT从细胞内逸出进入血液,使血清中的这两种转氨酶活性升高,因此通常根据血清中这两种转氨酶活性的变化判断肝脏等组织器官的功能状况[15]。试验结果表明,养殖水体中加入菌株S458-1后,能显著降低鲫鱼血清中GOT的含量(P < 0.05,图 5-A),但菌株S458-1添加不同浓度试验组间并无显著差异(P > 0.05)。各试验组和对照组鲫鱼血清中GPT的含量并无显著差异(P > 0.05,图 5-B)。结果表明,养殖水体中添加菌株S458-1对养殖对象无毒负作用,且能够显著降低鲫鱼血清中的转氨酶浓度,对养殖对象具有一定的免疫保护作用。
|
| 图 5 菌株S458-1影响养殖鲫鱼血清转氨酶的变化 Figure 5 Effect of strain S458-1 on serum transaminase in cultured gibel carp. Values are the mean±SE. Values with different letters (a, b) are significantly different (P < 0.05) |
2.3.2 菌株S458-1对氧化还原酶的影响: 血清中超氧化物歧化酶(SOD)活力、谷胱甘肽过氧化物酶(GSH-Px)活力、丙二醛含量(MDA)以及碱性磷酸酶(AKP)活力常作为鱼类非特异性免疫指标,其活性及含量与鱼体内存在的自由基相关。SOD和GSH-Px可清除体内超氧阴离子自由基,保护细胞免受损伤[16]。MDA是脂质过氧化物的主要产物,可导致细胞死亡,可以反映细胞受损程度以及脂质过氧化程度[17]。AKP是衡量机体免疫机能和健康状况的重要指标,其参与磷酸基团的转移和代谢,将代谢产物水解成磷酸和乙醇,然后将水解生成的小分子物质排出体外[18]。上述这些酶类通常需同步测定,其含量及活性高低间接反映养殖对象的健康状态及生理状况。试验结果表明(图 6),水体中添加菌株S458-1后,各试验处理组养殖鲫鱼血清SOD、GSH-Px、MDA浓度均显著低于对照组(P < 0.05),但各试验处理组之间差异不显著(P > 0.05);而AKP含量在各组间无显著差异(P > 0.05)。各处理组养殖鲫鱼血清SOD含量显示CG > HCG > MCG > LCG (图 6-A);GSH-Px含量表现为CG > HCG > LCG > MCG (图 6-B);MDA含量表现为CG > HCG > LCG > MCG (图 6-C);AKP含量在各组间差异不明显,但MCG含量相对较高(图 6-D)。根据各种酶类检测结果,在养殖水体中添加菌株S458-1,能降低鲫鱼机体的抗氧化能力,能降低细胞受损程度以及脂质过氧化程度,可提高磷酸基团代谢等,说明添加菌株S458-1,有助于养殖鲫鱼维持内环境的稳定,减轻对环境的应激反应。
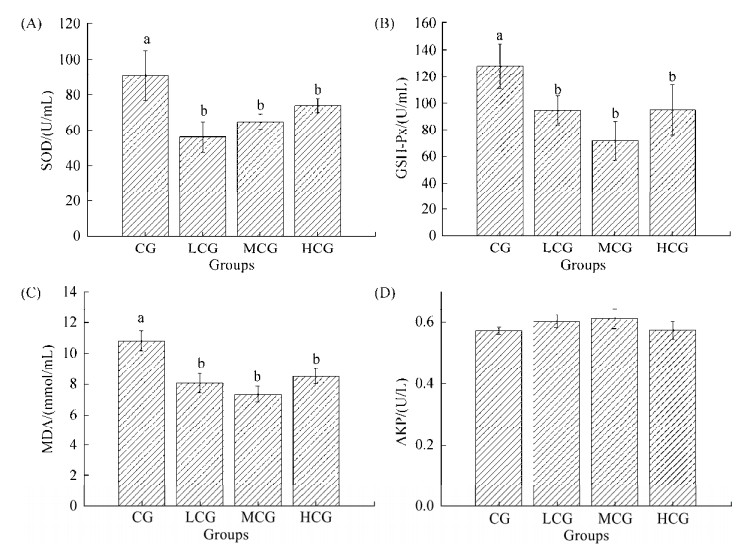
|
| 图 6 菌株S458-1影响养殖鲫鱼血清氧化还原酶的变化 Figure 6 Strain S458-1 Affects changes of serum oxidoreductase in cultured gibel carp. Values are the mean±SE. Values with different letters (a, b) are significantly different (P < 0.05) |
综合上述试验结果,表明在养殖水体中添加菌株S458-1,有助于改善水质,具有脱氮解磷的作用;有助于改善养殖对象的生理健康状况,能维持机体内环境的稳定,增强机体抗应激能力。菌株S458-1可作为益生菌应用于后续的生产试验,且添加浓度为107 CFU/mL。
3 讨论和结论本试验菌株S458-1添加试验组鲫鱼养殖系统中水体NH4+-N和NO2–-N转化为NO3–-N的趋势明显,水体中有效磷含量显著升高;养殖鲫鱼血清GOT、SDO、GSH-Px、MDA含量显著下降。尤其是养殖水体中有效磷含量的变化非常明显,随着养殖时间的不断延长,菌株S458-1不同浓度处理组鲫鱼养殖水体中总磷无显著性差异,而活性磷含量从添加菌株S458-1第二周后均呈显著上升;试验处理组与对照组相比,加入菌株S458-1,明显促进了水体中难溶性磷向有效磷的转化,增加了水体的活性磷含量,有利于水体中磷元素的循环,减轻水体富营养化水平。表明菌株S458-1具有改善养殖水体水质、脱氮解磷的作用,并具有维持养殖对象内环境稳定的功能,可作为水产养殖益生菌应用于养殖生产。通过比较菌株S458-1几种浓度添加试验组结果,表明水体中添加终浓度为107 CFU/mL菌株S458-1时,效果最好。
相关研究报道表明,不同的条件和环境也会对解磷菌的解磷效果产生影响。如在水体中难溶性磷的浓度对解磷菌的解磷能力有一定的影响[19-20];在含硫泥土的磷矿石中,细菌的解磷作用依赖于低pH以及磷矿石的硫化物,才能达到解磷效果[21];以及不同的碳氮比,不仅影响到菌株的解磷能力,而且影响到微生物的代谢[22]。本试验在可控条件下完成,包括水温、溶氧、pH以及养殖密度均保持在一定的范围内,结果显示菌株S458-1添加浓度不同,对水质改良和维持养殖对象机体健康方面仍有较大差异,表明水体中细菌的添加量是十分重要的参数之一。另外,实际养殖生产过程中,环境因素基本不可控,因此菌株S458-1作为益生菌应用还有待进一步生产试验。由于蜡状芽孢杆菌的安全性方面存在一些负面报道,使得其在水产养殖应用上受限。如在印度的凡纳滨对虾养殖业,面临着一种由蜡状芽孢杆菌引起的新型细菌性疾病的严重问题,感染后的虾出现严重病变,虾壳出现发白蓝色不透明的斑点、肌肉发白坏死以及虾食欲不振等[23]。虽然这类负面报道较少,但安全因素方面不容忽视。因此,在菌株S458-1实际应用到水产养殖前,还需进行全面的安全性评价分析,包括菌株S458-1是否引起养殖对象致病以及何种环境条件下致病、该菌株与其他益生菌的配伍使用条件、该菌株在水体中生长繁殖条件等。
本研究采用了两种养殖模式,分别是无底泥养殖和有底泥养殖。结果表明,菌株S458-1在两种养殖模式下均能促进水体中N、P元素的转化,起到脱氮解磷的作用。但无底泥养殖系统中水体N、P含量增长较快,说明养殖系统中的底泥对水体N、P具有吸附和缓冲作用,无底泥养殖系统更应及时监测水体中的N、P含量,防止氨氮、亚硝态氮对养殖对象的损伤。
| [1] |
Wang H, Wang JJ, Xu S, Zhao W, Han YF, Wang XB, Huang ZY. Screening and growth promoting characteristics of efficient organophosphate-degradation bacteria. Acta Microbiologica Sinica, 2017, 57(5): 667-680.
(in Chinese) 王欢, 王敬敬, 徐松, 赵维, 韩一凡, 王兴彪, 黄志勇. 有机磷降解菌的筛选及其促生特性. 微生物学报, 2017, 57(5): 667-680. |
| [2] | Ruttenberg KC, Sulak DJ. Sorption and desorption of dissolved organic phosphorus onto iron (oxyhydr)oxides in seawater. Geochimica et Cosmochimica Acta, 2011, 75(15): 4095-4112. DOI:10.1016/j.gca.2010.10.033 |
| [3] | Behera BC, Singdevsachan SK, Mishra RR, Dutta SK, Thatoi HN. Diversity, mechanism and biotechnology of phosphate solubilising microorganism in mangrove—A review. Biocatalysis and Agricultural Biotechnology, 2014, 3(2): 97-110. DOI:10.1016/j.bcab.2013.09.008 |
| [4] |
Bi JT, Sun Q, Li SJ, Liu XQ, Du W. Research advances in phosphorous solubilizing microorganisms. Journal of Agricultural Sciences, 2009, 30(4): 58-64.
(in Chinese) 毕江涛, 孙权, 李素剑, 刘雪琴, 杜伟. 解磷微生物研究进展. 农业科学研究, 2009, 30(4): 58-64. DOI:10.3969/j.issn.1673-0747.2009.04.016 |
| [5] |
Shi GY, Mo YM, Cen ZL, Zeng Q, Yu GM, Yang LT, Hu CJ. Identification of an inorganic phosphorus-dissolving bacterial strain BS06 and analysis on its phosphate solubilization ability. Microbiology China, 2015, 42(7): 1271-1278.
(in Chinese) 史国英, 莫燕梅, 岑贞陆, 曾泉, 余功明, 杨丽涛, 胡春锦. 一株高效解无机磷细菌BS06的鉴定及其解磷能力分析. 微生物学通报, 2015, 42(7): 1271-1278. |
| [6] | Sackett WG, Pattern AG, Brown CW. The solvent action of soil bacteria upon the insoluble phosphates of raw bone meal and natural raw rock phosphate. Central Bacterial, 1908, 20: 688-703. |
| [7] |
Mu GJ, Dong YK, Huang GH. Interspecific protoplast fusion between Bacillus Thuringensis Bt-3701 and Bacillus Megaterium Bm-107. Acta Microbiologica Sinica, 1995, 35(5): 322-326.
(in Chinese) 穆国俊, 董毓琨, 黄冠辉. 苏云金芽孢杆菌Bt-3701与巨大芽孢杆菌Bm-107种间原生质体融合. 微生物学报, 1995, 35(5): 322-326. |
| [8] | Rice WA, Lupwayi NZ, Olsen PE, Schlechte D, Gleddie SC. Field evaluation of dual inoculation of alfalfa with Sinorhizobium meliloti and Penicillium bilaii. Canadian Journal of Plant Science, 2000, 80(2): 303-308. DOI:10.4141/P99-055 |
| [9] | Vessey JK, Heisinger KG. Effect of Penicillium bilaii inoculation and phosphorus fertilisation on root and shoot parameters of field-grown pea. Canadian Journal of Plant Science, 2001, 81(3): 361-366. DOI:10.4141/P00-083 |
| [10] |
Bai BX, Chen YB, Ren JH. Study on organophosphate-solubilizing characteristics of Bacillus cereus CLY07. Journal of Southwest Forestry University, 2016, 36(4): 75-81.
(in Chinese) 白变霞, 陈艳彬, 任嘉红. 蜡状芽孢杆菌CLY07菌株的解有机磷特性研究. 西南林业大学学报, 2016, 36(4): 75-81. |
| [11] | Cerozi BDS, Fitzsimmons K. Use of Bacillus spp. to enhance phosphorus availability and serve as a plant growth promoter in aquaponics systems. Scientia Horticulturae, 2016, 211: 277-282. DOI:10.1016/j.scienta.2016.09.005 |
| [12] | Wang YB, He ZL. Effect of probiotics on alkaline phosphatase activity and nutrient level in sediment of shrimp, Penaeus vannamei, ponds. Aquaculture, 2009, 287(1/2): 94-97. |
| [13] | Kim YH, Bae B, Choung YK. Optimization of biological phosphorus removal from contaminated sediments with phosphate-solubilizing microorganisms. Journal of Bioscience and Bioengineering, 2005, 99(1): 23-29. DOI:10.1263/jbb.99.23 |
| [14] |
Yang YY, Yang K, Liang XH, Chen YQ. Adaptability of phosphate solubilizing bacteria YC4 to aquaculture environment and its effect of phosphate solubilization. Chinese Fishery Quality and Standards, 2015, 5(4): 23-28.
(in Chinese) 杨莺莺, 杨铿, 梁晓华, 陈永青. 解磷菌YC4对养殖环境条件的适应性及其溶磷效果. 中国渔业质量与标准, 2015, 5(4): 23-28. |
| [15] |
Chen C, Huang F, Shu QY, Zhang L, Zhou YP. Effects of dietary conjugated linoleic acids on growth performance, muscle composition, AST and ALT activities in serum in juveniles grass carp (Ctenopharyngodon idellus). Acta Hydrobiologica Sinica, 2010, 34(3): 647-651.
(in Chinese) 陈晨, 黄峰, 舒秋艳, 张丽, 周艳萍. 共轭亚油酸对草鱼生长、肌肉成分、谷草转氨酶及谷丙转氨酶活性的影响. 水生生物学报, 2010, 34(3): 647-651. |
| [16] | Scandalios JG. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses. Brazilian Journal of Medical and Biological Research, 2005, 38(7): 995-1014. DOI:10.1590/S0100-879X2005000700003 |
| [17] |
Song ZM, Liu JY, Zhuang P, Wang Y, Zhang LZ, Hu Y, Gong P. Influence of low-temperature stress on the antioxidant enzymes activities and malondialdehyde contents in liver of juvenile Siganus guttatas. Marine Fisheries, 2015, 37(2): 142-150.
(in Chinese) 宋志明, 刘鉴毅, 庄平, 王妤, 章龙珍, 胡艳, 龚盼. 低温胁迫对点篮子鱼幼鱼肝脏抗氧化酶活性及丙二醛含量的影响. 海洋渔业, 2015, 37(2): 142-150. DOI:10.3969/j.issn.1004-2490.2015.02.007 |
| [18] | Pinoni SA, López Mañanes AA. Alkaline phosphatase activity sensitive to environmental salinity and dopamine in muscle of the euryhaline crab Cyrtograpsus angulatus. Journal of Experimental Marine Biology and Ecology, 2004, 307(1): 35-46. DOI:10.1016/j.jembe.2004.01.018 |
| [19] | 周婷.富营养化湖泊底泥中解磷菌的筛选及解磷影响因素的研究.湖南农业大学硕士学位论文, 2011. |
| [20] |
Zhao XR, Lin QM, Zhao ZJ, Li BG. Dynamics of rock phosphate solubilization by Aspergillus 2TCiF2. Journal of China Agricultural University, 2003, 8(3): 43-46.
(in Chinese) 赵小蓉, 林启美, 赵紫鹃, 李保国. 一株曲霉Aspergillus2TCiF2溶解磷矿粉的动态. 中国农业大学学报, 2003, 8(3): 43-46. DOI:10.3321/j.issn:1007-4333.2003.03.010 |
| [21] | Bhatti TM, Yawar W. Bacterial solubilization of phosphorus from phosphate rock containing sulfur-mud. Hydrometallurgy, 2010, 103(1/4): 54-59. |
| [22] |
Zhao XR, Lin QM, Li BG. Effect of C, N sources and C/N ratio on the solubilization of rock phosphate by some microorganisms. Plant Nutrition and Fertilizer Science, 2002, 8(2): 197-204.
(in Chinese) 赵小蓉, 林启美, 李保国. C、N源及C/N比对微生物溶磷的影响. 植物营养与肥料学报, 2002, 8(2): 197-204. DOI:10.3321/j.issn:1008-505X.2002.02.013 |
| [23] | Velmurugan S, Palanikumar P, Velayuthani P, Donio MBS, Babu MM, Lelin C, Sudhakar S, Citarasu T. Bacterial white patch disease caused by Bacillus cereus, a new emerging disease in semi-intensive culture of Litopenaeus vannamei. Aquaculture, 2015, 444: 49-54. DOI:10.1016/j.aquaculture.2015.03.017 |
 2019, Vol. 59
2019, Vol. 59