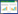中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 宋冰, 李雪飞, 史泽宇, 李长田, 付永平, 李玉. 2019
- Bing Song, Xuefei Li, Zeyu Shi, Changtian Li, Yongping Fu, Yu Li. 2019
- 钴60诱变选育平菇新菌株的研究
- Breeding of new Pleurotus ostreatus strain by mutation with 60Co-γ irradiation
- 微生物学报, 59(11): 2155-2164
- Acta Microbiologica Sinica, 59(11): 2155-2164
-
文章历史
- 收稿日期:2018-12-11
- 修回日期:2019-04-10
- 网络出版日期:2019-07-16
平菇,学名Pleurotus ostreatus (Fr.) Kummer,亦称糙皮侧耳,是世界主要的食用菌栽培品种,并可利用多种农业废弃物进行栽培[1-2]。平菇味道鲜美,其含有丰富的多糖、维生素、蛋白质和矿物质,具有改善人体新陈代谢、增强体质、调节神经功能等作用,对肝炎、胃肠疾病、软骨病、高血压、夜盲症等皆有疗效,可以降低血胆固醇和防治尿道结石,对妇女更年期综合症也具一定的调节作用[3-5]。
优良食用菌品种是食用菌产业健康和快速发展的关键。食用菌育种方法主要包括野生菌株的驯化、杂交育种和诱变育种。前两个方法都属于常规方法,选育周期较长、操作较为繁琐,而诱变育种则可以创造出一些新性状,且选育周期较短,可以选育出性状优良的食用菌品种。诱变育种方法根据使用诱变剂的种类可分为物理诱变和化学诱变。物理诱变使用的诱变剂主要包括紫外线[6-7]、钴60 (60Co-γ射线)[8-9]、宇宙射线等[10]。
60Co是金属钴的一种放射性同位素,是强γ射线源,当γ射线辐射受体生物后导致DNA结构发生改变,进而导致受体生物发生突变。60Co辐射诱变可以获得较高的突变率和较宽的突变谱,同时还有利于筛选新的突变型。目前,医药行业中所需的抗生素高产菌株基本上都是通过60Co诱变得到的[11-12]。最初,60Co只是应用在食药用菌的保鲜储藏方面[13],也有用于提高子实体中维生素D含量的研究[14-15]。Zhu等利用60Co诱变选育出16株可以耐受低温的草菇突变株[9]。李前红等利用不同剂量的60Co辐照双孢蘑菇孢子,筛选得到12株优良突变株,选育出4株高产菌株[16]。
诱变后的菌株需要进行进一步的鉴定才可进行下一步的研究和利用。研究人员往往利用食药用菌的菌丝拮抗试验[17]、同工酶分析[18]、分子标记技术[AFLP (amplified fragment length polymorphism)、SSR (simple sequence repeat)等]来验证诱变材料是否已经发生突变[19]。但是拮抗试验和同工酶分析都各自有一些缺点,受影响的因素很多,其中,不同品种的食用菌的拮抗反应不一,且亲缘关系较近的菌株难以通过拮抗试验来区分。同工酶分析受环境干扰较大,结果不稳定。而SSR分子标记技术已经广泛应用于动植物种质资源鉴定中。
本文通过60Co-γ射线诱变平菇原生质体悬浮液,通过拮抗反应进行初步筛选,再利用SSR分子标记技术鉴定突变菌株,并构建突变菌株的分子身份证[20-21],通过出菇试验确定其农艺性状和生长特性。目前,尚未见到有关平菇60Co诱变育种的任何报道,因此本文对于食用菌诱变育种研究具有重要意义。
1 材料和方法 1.1 供试菌株平菇菌株:灰美2号,为吉林农业大学食药用菌教育部工程研究中心保藏菌株。
1.2 诱变处理挑取活化后平菇菌丝体放入30 mL MYG液体培养基(maltose yeast glucose liquid medium,自配)中,置于25 ℃、140 r/min的振荡培养箱中培养,菌丝体经溶壁酶酶解后,用0.6 mol/L的甘露醇稀释到1×106个/mL,将制备好的平菇原生质体悬浮液置于60Co-γ射线放射源下,辐射条件为0.9、1.2、1.5 KGy,剂量率为10 Gy/min。
1.3 突变菌株的初步筛选60Co-γ射线辐照结束后,将处理过的原生质体悬浮液涂布于含有0.6 mol/L的甘露醇的MYG再生培养基中,扩置于25 ℃的培养箱中培养。5 d后取出进行观察并统计致死率,致死率(%)=诱变处理后再生的单菌落数/未处理再生的菌落数× 100%。
挑取再生的平菇单菌落于PDA (potato dextrose agar)试管中,并进行编号,称为第1代诱变菌株;待第1代诱变菌株长满斜面后,再挑取菌丝尖端到1个新的PDA试管中,以此循环,共转接5代,找出性状相对稳定的菌株,再将诱变菌株利用DAPI进行核染色,通过荧光显微镜观察细胞核数量,并利用显微镜观查诱变菌株的菌丝是否具有锁状联合,筛选出双核菌株作为后续试验材料。将筛选到的诱变处理双核菌株与出发菌株(CK)分别接种在平板中,测量菌丝生长速度,观察和记录菌株的生长情况。
再分别将诱变菌株和CK置于同一PDA平板上,25 ℃避光培养6 d,观察和记录两接种块交界处的拮抗现象,初步筛选发生突变的平菇菌株。
1.4 利用SSR分子标记筛选突变菌株根据本实验室针对平菇的转录组数据,筛选出的9对特异性平菇SSR引物对突变菌株的多态性进行检测,分别构建诱变菌株的分子身份证,用以检测诱变菌株的突变情况。平菇SSR引物具体信息见表 1,引物交由北京鼎国生物技术公司合成。
| Primer name | Sense-primer | Antisense-primer |
| 13 | CTGGAGAATCGTAGCCGC | ACAAGCGCTCGGAATACA |
| 82 | CATAGGGACGACAGCGAG | ACTGAGCCTTCAGCACCA |
| 148 | CGCGAGACAATTAAACGC | ACAGTTCCTGGAGCCCAT |
| 194 | TGTCTATGGGTTACGGCG | TGCAAAGCAAATCGGAAC |
| 212 | TGGTAGCAGGTTGTTGGG | CCGCTAAGCCACTGTTTG |
| 239 | TGCGTTTGCTCGGTTAAT | CGCTACTACGTCGATCCG |
| 240 | TGATTGGTTTGAATGGGC | GCACGATGAGGATGCAGT |
| 243 | TATGGAACGGTGCGAAGT | GCCGTCAAAAGGGAACTC |
| 251 | AGTGCATATGCCCGACAC | CGTCGTAGATGCAGGCTC |
(1) 采用SSR法进行诱变菌株的筛选:以普通平菇(CK)和诱变菌株的基因组DNA为模板进行PCR扩增:在20 μL反应体系中分别加入10×PCR buffer (Mg2+) 2 μL,2 mmol/L dNTPs 0.2 μL,5 U Taq DNA polymerase 0.2 μL,正向引物0.5 μL,反向引物0.5 μL,50 ng/μL DNA模板2 μL。使用BioRad PCR仪进行DNA扩增,具体步骤为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 50 s,72 ℃ 50 s,32个循环;72 ℃ 10 min。
(2) 将步骤(1)制得的PCR产物稀释5倍后,通过LabChip GX Touch生物大分子分析仪进行检测,并对电泳产物条带进行分析,通过特异性条带进行聚类分析,并构建不同菌株的分子身份证以鉴别不同的诱变菌株。根据带型转换成0-9数值(在同一引物所扩增出的条带,带型一致的均为1,出现的第二种类型条带为2,第三种类型为3,以此类推,第十种类型为0),以此数字构建菌株的分子身份证。
利用9对SSR引物电泳后得到的多态性条带转换成0-1数值(有条带记为1,无条带记为0),将得到的0-1数值表录入Excel表中,利用生物统计软件NTsys 2.10将之前统计的数值进行0-1型变量聚类分析,得到平菇突变菌株的UPGMA聚类图。
1.5 对筛选到的突变菌株进行出菇试验栽培料参照普通平菇的栽培配方:杂木屑78%,麦麸20%,蔗糖1%,碳酸钙1%,料水比1.0:1.8,每袋湿料1.0 kg,121 ℃灭菌85 min,冷却室温备用。置于智能化出菇房进行出菇管理,记录菌丝满袋时间,原基形成时间,出菇时间;调查子实体农艺性状,包括菌盖长径、菌盖短径、菌柄长度和直径、菌盖厚度、菌盖颜色、产量。
2 结果和分析 2.1 诱变剂量的筛选根据诱变处理5 d后再生的单菌落数量统计不同剂量处理的致死率,发现0.9 KGy的诱变处理致死率为0%,1.2 KGy的诱变处理下菌株致死率63.33%,1.5 KGy的诱变处理下菌株致死率为76.67%。将转接5代后鉴定为双核菌株的单菌落转出培养7 d后,发现不同诱变剂量下的菌株生长态势各不相同,0.9 KGy的诱变处理菌株菌丝生长有所抑制,表面呈淡红色,菌落不规整。1.2 KGy诱变处理的菌株菌丝生长速度约为出发菌株的一半,菌落形态不规整,表面淡红色,菌落稀疏。1.5 KGy的诱变处理的菌株菌丝生长速度更慢,菌落形态也不规整,表面也呈淡红色,菌落稀疏。1.2 KGy接近于平菇菌株的半致死剂量,可作为平菇60Co诱变育种使用的剂量,具体结果如表 2。
| Mutation dose/KGy | Bacterium shape | Mycelial growth vigor | Mycelial growth rate/(cm/d) | The number of regeneration single colonies | The number of dikaryon single colonies | Survival rate/% | Lethality rate/% |
| 0 | Round, complete | ++++ | 1.10±0.15a | 30.00±1.00a | 22.00±2.00a | 100a | 0c |
| 0.9 | Round, complete | +++ | 0.82±0.06ab | 30.00±1.00a | 21.00±0.57a | 100ab | 0c |
| 1.2 | Round, incomplete | ++ | 0.51±0.02bc | 11.00±1.00bc | 20.00±1.00a | 36.67bc | 63.33bc |
| 1.5 | Round, incomplete | ++ | 0.39±0.02c | 7.00±1.00c | 23.00±1.00a | 23.33c | 76.67a |
| “+” means the mycelial growth vigor; more “+” means mycelial growth luxuriantly. Different lowercase letters represent significant difference at P < 0.05. The same below. | |||||||
2.2 突变菌株的筛选
将诱变后转板活化后5代的菌株与出发菌株进行拮抗试验,发现8个菌株与出发菌株有不同程度的拮抗现象,分别命名为1.2-P1、1.2-P2、1.2-P3、1.2-P4、1.2-P5、1.2-P8、1.5-P2、1.5-P4,初步确定为诱变得到的突变平菇菌株(表 3)。
| Strain | 1.2-P1 | 1.2-P2 | 1.2-P3 | 1.2-P4 | 1.2-P5 | 1.2-P8 | 1.5-P2 | 1.5-P4 |
| CK | ++ | + | + | + | ++ | ++ | ++ | ++ |
| “+” means have obviously antagonism; more “+” means have more obviously antagonism. | ||||||||
经拮抗试验鉴定出的突变菌株经SSR鉴定结果表明,8个诱变菌株在9对引物的扩增下呈现出不同的特异条带,表明这些菌株发生了突变,根据各个引物下的带型分别构建了9个菌株(包含CK)的分子身份证,部分结果见图 1。构建原则如下,每个菌株的分子身份证由9位数字组成,分别对应上述的9对SSR引物,不同数字代表引物扩增出带型在标准扩增图谱中的编号,9位数字从左到右的顺序对应的引物顺序依次分别是引物148、引物82、引物240、引物212、引物194、引物251、引物13、引物243、引物239。以CK为例,其分子身份证ID为111111111,表示在上述引物顺序下第1对引物的第1种带型,第2对引物的第1种带型,第3对引物的第1种带型,依此类推。结果表明各个突变菌株在9对引物下构成的分子身份证均不同于出发菌株,利用聚类分析软件分析后表明,在0.91处8个突变菌株可与CK分开,其中1.2-P2和1.5-P2聚类到一起,二者分子身份证也一样,表明二者突变位点相同或者相近,详见表 4和图 2。

|
| 图 1 引物239在不同样品间的扩增情况 Figure 1 Amplification bands between different genotypes of primer 239. |
| Strain | Primer 251 | Primer 13 | Primer 243 | Primer 239 | Primer 194 | Primer 212 | Primer 240 | Primer 82 | Primer 148 |
| CK | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 1.2-P1 | 1 | 1 | 1 | 2 | 1 | 2 | 1 | 1 | 1 |
| 1.2-P2 | 1 | 1 | 2 | 1 | 1 | 2 | 2 | 1 | 1 |
| 1.2-P3 | 1 | 1 | 1 | 2 | 1 | 2 | 2 | 1 | 2 |
| 1.2-P4 | 1 | 1 | 2 | 2 | 1 | 2 | 1 | 1 | 1 |
| 1.2-P5 | 1 | 1 | 1 | 3 | 1 | 2 | 2 | 1 | 1 |
| 1.2-P8 | 1 | 1 | 2 | 2 | 1 | 2 | 1 | 1 | 1 |
| 1.5-P2 | 1 | 1 | 2 | 1 | 1 | 2 | 2 | 1 | 1 |
| 1.5-P4 | 2 | 1 | 1 | 2 | 2 | 2 | 1 | 1 | 1 |
|
| 图 2 突变菌株的聚类分析 Figure 2 Cluster analysis for mutation strains. |
2.3 突变菌株农艺性状的变化
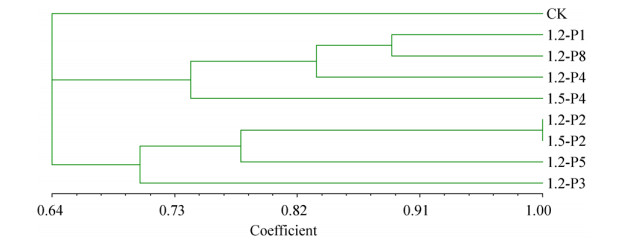
出菇试验结果表明,突变菌株1.2-P1的产量较对照菌株提高了9.76%,生物学效率较CK提高了10.38%,其菌丝生长速度快于对照2.70%,但生育期延长了4 d,其菌盖长径、菌盖厚度、菌柄直径、菌柄长度均要大于对照。其他突变菌株的产量都接近或者低于对照菌株,其中突变菌株1.5-P4的产量较对照降低了41.92%,生物学效率降低了44.61%,产量下降的另一个原因是其只出了两潮菇,此外该菌株在菇蕾期,其菇蕾数量剧增,明显高于对照,但子实体形成后菌盖明显小于对照。具体结果如表 5、图 3和图 4所示。
| Strains | Growth period/d |
Yield/(g/bag) | Stipe diameter/cm |
Stipe length/cm |
Fruitbody shape |
Biological efficiency/% |
Pileus Diameter/cm |
Pileus Thickness/cm |
Pileus color |
| CK | 52.00±1.81c | 399.02±21.06b | 2.80±0.13a | 3.30±0.21c | Regular | 106.41±2.32b | 10.50±0.13b | 1.40±0.04bcd | Gray-black |
| 1.2-P1 | 56.00±3.27bc | 437.95±12.22a | 2.30±0.12b | 4.20±0.53abc | Regular | 116.79±3.13a | 11.20±1.09b | 2.50±0.05a | Gray-black |
| 1.2-P2 | 52.00±0.81c | 343.50±8.34d | 2.30±0.23b | 5.10±0.68a | Regular | 91.60±1.12d | 10.70±1.12b | 1.60±0.13b | Gray-black |
| 1.2-P3 | 70.00±1.63a | 337.10±2.31d | 2.70±0.03a | 4.30±0.22ab | Irregular | 89.90±2.10d | 18.80±1.03a | 1.60±0.13b | Gray |
| 1.2-P4 | 53.00±2.16c | 266.50±6.35e | 1.60±0.05d | 2.40±0.13d | Regular | 71.07±1.63e | 7.70±0.73c | 1.20±0.09d | Dark grey black |
| 1.2-P5 | 55.00±1.41b | 371.92±8.32c | 2.20±0.03b | 3.60±0.28bc | Regular | 99.18±1.83c | 10.70±0.83b | 1.50±0.11bc | Gray-black |
| 1.2-P8 | 59.00±1.63b | 264.83±5.23e | 2.20±0.03b | 4.30±0.63ab | Irregular | 70.62±1.11e | 10.20±0.25b | 1.30±0.01cd | Dark grey black |
| 1.5-P2 | 52.00±0.82c | 332.55±8.15d | 2.30±0.03b | 5.00±0.81a | Regular | 86.01±1.43d | 10.60±0.63b | 1.52±0.22bc | Gray-black |
| 1.5-P4 | 55.00±2.16bc | 231.76±3.23f | 2.00±0.03c | 4.60±0.61a | Regular | 61.80±1.01f | 7.20±0.43c | 1.40±0.20bcd | Gray-black |

|
| 图 3 突变菌株的子实体 Figure 3 The fruit body of mutation strains. A: CK; B: 1.2-P1; C: 1.2-P2; D: 1.2-P3; E: 1.2-P4; F: 1.2-P5; G: 1.2-P8; H: 1.5-P2; I: 1.5-P4. |
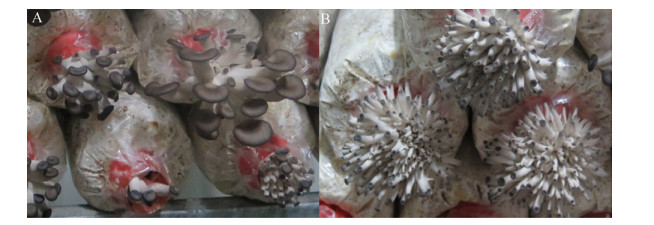
|
| 图 4 突变菌株1.5-P4和CK的幼菇 Figure 4 The young fruit body of 1.5-P4 and CK. A: CK; B: 1.5-P4. |
3 讨论
刚诱变后的菌株均出现不同程度的损伤情况,表现为生长速度降低[22],菌落形态不规则,并有色素分泌,菌丝呈淡粉色。这一时期的菌株由于刚刚接受了高剂量的辐射,细胞和细胞内的遗传物质均受到损伤,遗传物质有可能发生了一定的突变,受伤的细胞作出了一定的应激反应。转接出的诱变菌株在培养7 d后,部分菌株直接死亡,表现为菌丝块发黑,没有任何生长迹象。本试验设置的剂量梯度,还没有探索出试验菌株的致死和半致死剂量,这需要在后续的试验中增加诱变剂量梯度。为了让诱变后的菌株恢复其基本活性,我们将存活后的菌株分别转接了5代,以期获得性状稳定的突变菌株,使突变菌株的细胞受损情况得以恢复,可用于菌株生长性状的观察和后续试验。转接5代后的菌株菌落形态逐步趋于正常[23],只是生长速度和菌落形态与出发菌株有差异。
拮抗现象广泛存在于各种丝状真菌中[24],不同的物种或者品种在同一菌板生长时,在菌丝接触处会出现拮抗现象,由于体细胞不亲和性,表现为分泌特殊化学物质,菌丝弯曲和排斥,在两个菌株菌丝交接处产生一定程度的拮抗线[25]。利用拮抗现象可以作为突变菌株的初步筛选的方法,并根据拮抗的强弱来鉴定亲缘关系的远近,此方法已广泛用于丝状真菌亲缘关系的鉴定[26-27]。由于突变菌株从出发菌株诱变得到,大部分遗传物质可能没有发生变化,8个突变菌株与出发菌株的拮抗现象不明显,但菌落形态与对照有差异。然而不同的食用菌品种拮抗现象表现不同[28],个别食用菌品种在自身菌株进行接种时候,也会表现出一定的拮抗现象,所以我们不能单独以拮抗试验作为突变菌株的筛选方法。本文利用本实验室依据转录组数据筛选好的9对平菇特异性SSR引物,用于突变菌株的鉴定和分子身份证的构建,结果表明所用引物可将9个菌株分开。
结合之前的结果,8个突变菌株中有6个是1.2 KGy诱变出的,2个是1.5 KGy剂量下诱变得到的。可见,1.2 KGy较为适合作为平菇60Co诱变育种的诱变剂量。
鉴定出来的突变菌株,只有筛选出具有优良性状或者特定性状的菌株才能够利用。出菇试验发现,除了1.2-P1的产量高于出发菌株,其余7个突变菌株产量均低于对照。可见,物理诱变育种导致菌株产生不定向的突变,有的菌株能够出现优良的性状,有的菌株出现较差或者无用的性状,这就需要我们加大诱变菌株的数量,加大选择力度,才能从大量诱变菌株筛选出优良的突变菌株。
同时,我们发现幼菇数量剧增的突变菌株1.5-P4,这个菌株可以作为选育优良平菇新品种的基础材料。当然,产量是品种选择的一个重要育种目标,但不是唯一的目标,选育生育期短、抗病性好、品质优良、品相好或者易保存的菌株都是我们食用菌育种的目标[29]。此外,在以往的研究中有些突变菌株产生了一些较差的性状,这些性状可以作为杂交育种的亲本材料,或者利用分子标记技术定位控制农艺性状的位点[29],通过杂交选育一些特定性状的食用菌品种[30],可为食用菌产业的发展提供更多的种质资源。
| [1] | Aggelis G, Iconomou D, Christou M, Bokas D, Kotzailias S, Christou G, Tsagou V, Papanikolaou S. Phenolic removal in a model olive oil mill wastewater using Pleurotus ostreatus in bioreactor cultures and biological evaluation of the process. Water Research, 2003, 37(16): 3897-3904. DOI:10.1016/S0043-1354(03)00313-0 |
| [2] | Sánchez C. Cultivation of Pleurotus ostreatus and other edible mushrooms. Applied Microbiology and Biotechnology, 2010, 85(5): 1321-1337. DOI:10.1007/s00253-009-2343-7 |
| [3] | Girmay Z, Gorems W, Birhanu G, Zewdie S. Growth and yield performance of Pleurotus ostreatus (Jacq. Fr.) Kumm (oyster mushroom) on different substrates. AMB Express, 2016, 6: 87. DOI:10.1186/s13568-016-0265-1 |
| [4] | Mattila P, Könkö K, Eurola M, Pihlava JM, Astola J, Vahteristo L, Hietaniemi V, Kumpulainen J, Valtonen M, Piironen V. Contents of vitamins, mineral elements, and some phenolic compounds in cultivated mushrooms. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2343-2348. DOI:10.1021/jf001525d |
| [5] | Qu JB, Zhao MR, Hsiang T, Feng XX, Zhang JX, Huang CY. Identification and characterization of small noncoding RNAs in genome sequences of the edible fungus Pleurotus ostreatus. BioMed Research International, 2016, 2016: 2503023. |
| [6] | Lee JE, Lee IS, Kim KC, Yoo ID, Yang HM. ROS scavenging and anti-wrinkle effects of Clitocybin A isolated from the mycelium of the mushroom Clitocybe aurantiaca. Journal of Microbiology and Biotechnology, 2017, 27(5): 933-938. DOI:10.4014/jmb.1702.02050 |
| [7] | Zolan ME, Tremel CJ, Pukkila PJ. Production and characterization of radiation-sensitive meiotic mutants of Coprinus cinereus. Genetics, 1988, 120(2): 379-387. |
| [8] | Wang ZM, Zhao ZZ, Lu J, Chen ZJ, Mao AW, Teng GJ, Liu FJ. A comparison of the biological effects of 125I seeds continuous low-dose-rate radiation and 60Co high-dose-rate gamma radiation on non-small cell lung cancer cells. PLoS One, 2015, 10(8): e0133728. DOI:10.1371/journal.pone.0133728 |
| [9] | Zhu ZP, Wu X, Lv BB, Wu GG, Wang JB, Jiang W, Li P, He JH, Chen JZ, Chen MJ, Bao DP, Zhang JS, Tan Q, Tang XM. A new approach for breeding low-temperature-resistant Volvariella volvacea strains: genome shuffling in edible fungi. Biotechnology and Applied Biochemistry, 2016, 63(5): 605-615. DOI:10.1002/bab.1420 |
| [10] | Zhao C, Tian XM, Wang GY, Song AR, Liang WX. High-Level Production of exopolysaccharides by a cosmic radiation-induced mutant M270 of the maitake medicinal mushroom, Grifola frondosa (Agaricomycetes). International Journal of Medicinal Mushrooms, 2016, 18(7): 621-630. DOI:10.1615/IntJMedMushrooms.v18.i7.70 |
| [11] | Jin HX, Ouyang XK, Hu ZC. Enhancement of epoxide hydrolase production by 60Co gamma and UV irradiation mutagenesis of Aspergillus niger ZJB-09103. Biotechnology and Applied Biochemistry, 2017, 64(3): 392-399. |
| [12] | Tsuji K, Rahn PD, Steindler KA. 60Co-irradiation as an alternate method for sterilization of penicillin G, neomycin, novobiocin, and dihydrostreptomycin. Journal of Pharmaceutical Sciences, 1983, 72(1): 23-26. |
| [13] | Akram K, Ahn JJ, Baek JY, Yoon SR, Kwon JH. Absorbed-dose estimation and quality attributes of gamma-irradiated fresh shiitake mushrooms. Journal of the Science of Food and Agriculture, 2013, 93(3): 634-640. DOI:10.1002/jsfa.5875 |
| [14] | Tsai SY, Mau JL, Huang SJ. Enhancement of antioxidant properties and increase of content of vitamin D2 and non-volatile components in fresh button mushroom, Agaricus bisporus (higher Basidiomycetes) by γ-irradiation. International Journal of Medicinal Mushrooms, 2014, 16(2): 137-147. DOI:10.1615/IntJMedMushr.v16.i2.40 |
| [15] | Wu WJ, Ahn BY. Statistical optimization of ultraviolet irradiate conditions for vitamin D2 synthesis in oyster mushrooms (Pleurotus ostreatus) using response surface methodology. PLoS One, 2014, 9(4): e95359. DOI:10.1371/journal.pone.0095359 |
| [16] |
Li QH. Breed new strain of Agaricus bisporus by the technique of radioisotope 60Co mutagenesis. Master Dissertation of Sichuan Agricultural University, 2013. (in Chinese) 李前红.利用放射性同位素60Co诱变技术创制双孢蘑菇育种新材料研究.四川农业大学硕士学位论文, 2013. |
| [17] | Xiang XZ, Wang XX, Bian YB, Xu ZY. Development of crossbreeding high-yield-potential strains for commercial cultivation in the medicinal mushroom Wolfiporia cocos (Higher Basidiomycetes). Journal of Natural Medicines, 2016, 70(3): 645-652. DOI:10.1007/s11418-016-0995-z |
| [18] | Bleve G, Lezzi C, Spagnolo S, Tasco G, Tufariello M, Casadio R, Mita G, Rampino P, Grieco F. Role of the C-terminus of Pleurotus eryngii Ery4 laccase in determining enzyme structure, catalytic properties and stability. Protein Engineering, Design and Selection, 2013, 26(1): 1-13. |
| [19] | Amaradasa BS, Everhart SE. Effects of sublethal fungicides on mutation rates and genomic variation in fungal plant pathogen, Sclerotinia sclerotiorum. PLoS One, 2016, 11(12): e0168079. DOI:10.1371/journal.pone.0168079 |
| [20] | Bruvo R, Michiels NK, D'Souza TG, Schulenburg H. A simple method for the calculation of microsatellite genotype distances irrespective of ploidy level. Molecular Ecology, 2004, 13(7): 2101-2106. DOI:10.1111/j.1365-294X.2004.02209.x |
| [21] | Tabima JF, Everhart SE, Larsen MM, Weisberg AJ, Kamvar ZN, Tancos MA, Smart CD, Chang JH, Grunwald NJ. Microbe-ID: an open source toolbox for microbial genotyping and species identification. PeerJ, 2016, 4: e2279. DOI:10.7717/peerj.2279 |
| [22] | Braghini R, Pozzi CR, Aquino S, Rocha LO, Corrêa B. Effects of γ-radiation on the fungus Alternaria alternata in artificially inoculated cereal samples. Applied Radiation and Isotopes, 2009, 67(9): 1622-1628. DOI:10.1016/j.apradiso.2009.03.004 |
| [23] | Mukherjee M, Sengupta S. Mutagenesis of protoplasts and regeneration of mycelium in the mushroom Volvariella volvacea. Applied and Environmental Microbiology, 1986, 52(6): 1412-1414. |
| [24] | Lind M, Stenlid J, Olson Å. Genetics and QTL mapping of somatic incompatibility and intraspecific interactions in the basidiomycete Heterobasidion annosum s.l. Fungal Genetics & Biology, 2007, 44(12): 1242-1251. |
| [25] | Giovannetti M, Sbrana C, Strani P, Agnolucci M, Rinaudo V, Avio L. Genetic diversity of isolates of Glomus mosseae from different geographic areas detected by vegetative compatibility testing and biochemical and molecular analysis. Applied and Environmental Microbiology, 2003, 69(1): 616-624. DOI:10.1128/AEM.69.1.616-624.2003 |
| [26] | Ceresini PC, Shew HD, Vilgalys RJ, Cubeta MA. Genetic diversity of Rhizoctonia solani AG-3 from potato and tobacco in North Carolina. Mycologia, 2002, 94(3): 437-449. DOI:10.1080/15572536.2003.11833209 |
| [27] | Johannesson H, Stenlid J. Nuclear reassortment between vegetative mycelia in natural populations of the basidiomycete Heterobasidion annosum. Fungal Genetics and Biology, 2004, 41(5): 563-570. DOI:10.1016/j.fgb.2004.01.002 |
| [28] | Micali CO, Smith ML. On the independence of barrage formation and heterokaryon incompatibility in Neurospora crassa. Fungal Genetics and Biology, 2003, 38(2): 209-219. |
| [29] | Sonnenberg ASM, Baars JJP, Gao W, Visser RGF. Developments in breeding of Agaricus bisporus var. bisporus: progress made and technical and legal hurdles to take. Applied Microbiology and Biotechnology, 2017, 101(5): 1819-1829. DOI:10.1007/s00253-017-8102-2 |
| [30] | Liu XB, Feng B, Li J, Yang ZL. Genetic diversity and breeding history of winter mushroom (Flammulina velutipes) in China uncovered by genomic SSR markers. Gene, 2016, 591(1): 227-235. DOI:10.1016/j.gene.2016.07.009 |
 2019, Vol. 59
2019, Vol. 59