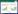中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 程着, 谢伟, 张传伦. 2019
- Zhuo Cheng, Wei Xie, Chuanlun Zhang. 2019
- 泉古菌醇与绿素在东海陆架区的分布及关系研究
- Distribution and relationship between crenarchaeol and chlorin in East China Sea Continental Shelf
- 微生物学报, 59(1): 123-133
- Acta Microbiologica Sinica, 59(1): 123-133
-
文章历史
- 收稿日期:2018-02-25
- 修回日期:2018-04-07
- 网络出版日期:2018-06-21
2. 南方科技大学海洋科学与工程系, 广东 深圳 518055
2. Department of Ocean Science & Engineering, Southern University of Sceince and Technology, Shenzhen 518055, China
Chuanlun Zhang, E-mail: zhangcl@sustc.edu.cn
自从1990年Carl Woese等基于16S rRNA序列首次提出将古菌作为一个新的域后,关于古菌的研究日益增多[1]。古菌的营养类型多种多样,拥有多种能量来源[2]。有利用太阳光能的光能营养型,利用无机物的无机自养型及利用有机物的有机营养型。2005年,Konneke等首次成功分离出纯的氨氧化古菌菌株[3]。2008年,Borchier-Armanet等首次通过核糖体蛋白质进行分类,提出将中温泉古菌单独分为一个新的门类——奇古菌,也就是氨氧化古菌[4],它属于化能自养型,可以通过氧化铵获得能量。氨氧化古菌的生物标志物为含有4个五元环和1个六元环的泉古菌醇(crenarchaeol)[5] (图 1-A)。

|
| 图 1 泉古菌醇(A)与绿素(B)结构示意图 Figure 1 The structures of crenarchaeol (A) and chlorin (B). |
绿素是海洋沉积物中常用的初级生产力指标[6] (图 1-B)。植物体内的色素可以吸收特定波长的光从而进行光合作用,因此又称为光合色素。光合色素可以分为三大类:叶绿素、类胡萝卜素和藻胆素,其中叶绿素普遍存在于各种高等植物及藻类的体内。由于叶绿素a普遍存在于大部分的浮游植物体内,因此通常使用叶绿素a的浓度或含量来表征海水中浮游植物的生物量,即初级生产力。叶绿素a在环境中及其容易降解,其降解过程不仅发生于沉积过程中,即使其沉降到沉积物表面,由于微生物降解、沉积物矿化等作用,仍会导致色素发生降解[7]。沉积物中叶绿素a及其降解产物绿素的比值可以用来表征沉积物中有机质的新鲜程度[8],绿素的同位素变化也可以用来指示水生环境变化[9]与水体中食物网的研究[10]。
Wuchter等对太平洋东北部和阿拉伯海的季节性沉积物样品中的泉古菌醇与绿素进行比较分析,研究结果显示,两者之间呈现显著的正相关关系[11]。在湖泊沉积物中,Bechtel等也发现在瑞士一些湖泊的水体及沉积物中,泉古菌醇的高浓度时期与高浮游植物生产力刚好相一致[12]。Fietz通过研究在4个不同位置的沉积柱中泉古菌醇与浮游植物生物标志物在百年及千年尺度上呈现出显著的相关性关系[13];该研究同时也显示,东北大西洋在Heinrich2事件时期,泉古菌醇受环境变化的影响比绿素更加剧烈,提示该地质时间内,初级生产力之外的其他环境因素影响了奇古菌的生长,表明对泉古菌醇与绿素的相关性的解释仍然存在多解性。
相对于上述时间序列下对泉古菌醇与绿素相关性的广泛研究,在现代环境下对两者之间在空间分布上相关性的研究则仍然较少,但是对于更深刻理解古环境变化具有指示意义。本文以东海陆架为研究区域,对泉古菌醇与绿素进行空间分布上关系的解析,以深入理解两类有机指标在生物地球化学过程中的相互关系及可能的耦合机理。
1 材料和方法 1.1 样品来源东海陆架区流系复杂,受江浙沿岸流、台湾暖流以及黄海混合水等多个水团共同作用,存在明显的季节变化,该区域的复杂的洋流活动使得该区域海洋化学环境变化显著,从而提供了较大的环境化学梯度,东海在一个恒星年的初级生产力平均可达每天每平米400 mg碳,在7月达到最高值,每天每平米500 mg碳[14]。本次研究的沉积物样品来自2015年8月25日至9月5日的东海陆架公共航次。采样地点的纬度为29.12°N– 32.26°N,经度为122.00°E–124.00°E。采样过程中,通过抓斗抓取表层沉积物,之后分装到4个45 mL NEST管中,保存于–20 ℃环境。
1.2 沉积物总有机碳及碳同位素检测首先将样品冻干,在研磨之后,取200 mg沉积物样品置于特氟龙管中,加入过量1 mol/L的浓盐酸,超声5 min,静置12 h后,再次超声5 min,使用3000 r/min的速度离心5 min后,去掉上清液。重复使用去离子水进行超声及离心,直至上清液为中性。将样品冷冻干燥后,使用Thermo NE1112型碳氮元素分析仪,经Conflo Ⅲ与Delta Plus AD同位素质谱仪连接,进行总有机碳及碳同位素分析。
| Site | Longitude | Latitude | Salinity | Chlorin /(μg/g) | Crenarchaeol /(ng/g) | TOC/% | δ13C | BIT |
| A1-1 | 122.000 | 32.256 | 28.85 | 0.13 | 90.21 | 1.46 | –25.64 | 0.70 |
| A1-2 | 122.309 | 32.256 | 29.46 | 0.81 | 131.26 | 0.54 | –25.26 | 0.21 |
| A1-4 | 122.743 | 32.256 | 31.97 | 0.40 | 80.54 | 0.44 | –25.75 | 0.13 |
| A1-5 | 123.000 | 32.256 | 31.58 | 0.00 | 52.30 | 0.24 | –25.44 | 0.06 |
| A1-6 | 123.259 | 32.256 | 31.13 | 0.00 | 44.29 | 0.37 | –25.95 | 0.05 |
| A1-8 | 123.750 | 32.250 | 30.79 | 0.00 | 84.17 | 0.36 | –24.73 | 0.06 |
| A1-9 | 124.000 | 32.250 | 30.75 | 0.19 | 154.68 | 0.47 | –25.51 | 0.07 |
| A2-1 | 122.178 | 31.953 | 28.56 | 1.40 | 223.50 | 0.82 | –24.23 | 0.17 |
| A2-2 | 122.500 | 31.911 | 31.35 | 0.71 | 158.81 | 0.58 | –25.22 | 0.10 |
| A2-3 | 122.699 | 31.887 | 32.10 | 0.52 | 130.37 | 0.60 | –25.12 | 0.08 |
| A2-4 | 123.000 | 31.844 | 32.44 | 0.00 | 25.19 | 0.23 | –25.00 | 0.08 |
| A3-2 | 122.312 | 31.655 | 30.42 | 0.04 | 75.58 | 0.95 | –25.06 | 0.54 |
| A3-3 | 122.420 | 31.631 | 31.32 | 0.36 | 94.72 | 0.92 | –25.24 | 0.39 |
| A3-4 | 122.624 | 31.580 | 33.00 | 0.00 | 58.18 | 0.23 | –25.32 | 0.07 |
| A3-6 | 123.000 | 31.500 | 33.02 | 0.00 | 7.46 | 0.31 | –25.89 | 0.12 |
| A3-7 | 123.227 | 31.446 | 32.78 | 0.00 | 12.60 | 0.31 | –25.64 | 0.14 |
| A3-9 | 123.743 | 31.336 | 32.77 | 2.23 | 549.41 | 0.61 | –23.31 | 0.03 |
| A4-3 | 122.500 | 31.309 | 33.01 | 1.02 | 116.86 | 0.79 | –25.19 | 0.24 |
| A4-4 | 122.613 | 31.264 | 33.48 | 2.90 | 210.46 | 1.31 | –24.64 | 0.22 |
| A4-5 | 122.751 | 31.226 | 33.87 | 1.04 | 181.56 | 0.87 | –23.94 | 0.20 |
| A4-6 | 122.897 | 31.178 | 34.18 | 1.08 | 303.48 | 0.72 | –23.94 | 0.12 |
| A4-7 | 123.256 | 31.066 | 34.28 | 3.15 | 312.63 | 0.43 | –23.88 | 0.04 |
| A4-8 | 123.500 | 31.000 | 34.30 | 0.94 | 273.52 | 0.46 | –23.17 | 0.05 |
| A4-9 | 123.750 | 30.920 | 34.16 | 5.70 | 483.82 | 0.91 | –23.25 | 0.04 |
| A4-10 | 124.000 | 30.840 | 34.19 | 0.48 | 276.52 | 0.46 | –25.28 | 0.06 |
| A6-2 | 122.237 | 30.951 | 21.63 | 0.70 | 88.30 | 0.74 | –24.51 | 0.35 |
| A6-3 | 122.382 | 30.909 | 21.59 | 0.48 | 97.64 | 0.63 | –24.49 | 0.26 |
| A6-4 | 122.502 | 30.869 | 28.55 | 0.75 | 153.26 | 0.92 | –25.09 | 0.18 |
| A6-5 | 122.649 | 30.821 | 30.17 | 2.01 | 373.23 | 0.97 | –24.50 | 0.14 |
| A6-6 | 122.807 | 30.773 | 30.90 | 1.59 | 284.30 | 1.08 | –25.01 | 0.13 |
| A6-8 | 123.249 | 30.638 | 34.36 | 1.03 | 275.46 | 0.49 | –25.07 | 0.06 |
| A6-9 | 123.500 | 30.559 | 34.38 | 1.03 | 169.57 | 0.52 | –25.19 | 0.06 |
| A6-11 | 124.000 | 30.408 | 34.18 | 0.67 | 246.48 | 0.65 | –24.86 | 0.04 |
| A7-XQS | 122.241 | 30.437 | 19.69 | 0.09 | 89.71 | 1.00 | –25.35 | 0.25 |
| A7-0 | 122.241 | 30.527 | 20.40 | 0.00 | 29.74 | 0.75 | –25.12 | 0.55 |
| A7-1 | 122.249 | 30.643 | 17.65 | 0.16 | 67.09 | 0.82 | –25.22 | 0.33 |
| A7-2 | 122.504 | 30.564 | 29.96 | 0.11 | 53.95 | 1.20 | –25.50 | 0.38 |
| A7-3 | 122.766 | 30.500 | 34.29 | 1.67 | 247.60 | 1.04 | –24.51 | 0.17 |
| A7-4 | 122.999 | 30.409 | 34.29 | 2.86 | 252.02 | 0.87 | –24.55 | 0.08 |
| A7-5 | 123.254 | 30.331 | 34.38 | 0.58 | 95.38 | 0.54 | –24.24 | 0.07 |
| A7-6 | 123.500 | 30.257 | 34.38 | 1.11 | 206.28 | 0.57 | –24.14 | 0.06 |
| A7-7 | 123.750 | 30.180 | 34.36 | 1.23 | 220.70 | 0.86 | –24.61 | 0.05 |
| A7-8 | 124.000 | 30.100 | 34.28 | 0.89 | 223.34 | 0.46 | –24.49 | 0.05 |
| A8-1 | 122.500 | 30.280 | 25.48 | 0.00 | 56.75 | 0.79 | –25.02 | 0.30 |
| A8-2 | 122.697 | 30.216 | 31.46 | 3.04 | 178.38 | 1.14 | –24.24 | 0.18 |
| A8-3 | 122.846 | 30.173 | 33.80 | 1.46 | 211.58 | 1.16 | –24.14 | 0.14 |
| A8-4 | 123.000 | 30.126 | 34.08 | 2.36 | 197.92 | 0.62 | –24.17 | 0.10 |
| A8-5 | 123.240 | 30.049 | 34.37 | 0.70 | 189.16 | 0.75 | –24.69 | 0.07 |
| A8-6 | 123.500 | 29.969 | 34.36 | 1.67 | 370.48 | 0.61 | –24.14 | 0.05 |
| A8-7 | 123.750 | 29.900 | 33.41 | 0.76 | 262.33 | 0.65 | –24.97 | 0.05 |
| A9-3 | 122.639 | 29.953 | 33.32 | 0.12 | 129.82 | 1.11 | –25.12 | 0.14 |
| A10-1 | 122.500 | 29.749 | 30.99 | 0.01 | 53.36 | 1.04 | –25.24 | 0.26 |
| A10-2 | 122.575 | 29.718 | 33.86 | 1.45 | 169.89 | 0.88 | –24.49 | 0.13 |
| A10-3 | 122.730 | 29.669 | 34.29 | 0.90 | 83.23 | 0.81 | –24.21 | 0.17 |
| A10-4 | 122.854 | 29.632 | 21.15 | 5.68 | 330.07 | 1.17 | –23.88 | 0.07 |
| A10-5 | 123.112 | 29.558 | 34.38 | 2.83 | 324.79 | 0.74 | –24.77 | 0.07 |
| A10-6 | 123.362 | 29.481 | 34.31 | 0.63 | 145.92 | 0.83 | –23.58 | 0.06 |
| A12-1 | 122.374 | 29.280 | 30.66 | 0.64 | 113.25 | 1.21 | –24.79 | 0.20 |
| A12-2 | 122.438 | 29.260 | 32.77 | 1.91 | 160.88 | 1.13 | –24.30 | 0.12 |
| A12-3 | 122.531 | 29.227 | 34.11 | 2.63 | 204.09 | 1.26 | –24.11 | 0.09 |
| A12-4 | 122.647 | 29.194 | 34.11 | 6.96 | 260.66 | 1.11 | –24.95 | 0.09 |
| A12-5 | 122.904 | 29.118 | 34.42 | 4.47 | 348.72 | 0.98 | –24.04 | 0.06 |
1.3 沉积物中古菌GDGTs提取与检测
将冷冻干燥后的沉积物样品研磨后,称取约5 g样品,至于30 mL的特氟龙管中。加入15 mL二氯甲烷对其进行萃取,超声10 min,使用3000 r/min的速度离心10 min,取其上清液置于500 ℃灼烧过的玻璃瓶中,重复1次;随后加入二氯甲烷和甲醇1:1混合液及甲醇溶液,使用同样的方法,各萃取2次。整个萃取共得到60 mL膜脂萃取液。使用柔和的氮气将其吹干后,使用硅胶柱分离组分。使用正己烷浸泡硅胶柱,非极性组分使用正己烷:二氯甲烷=9:1溶液冲淋;极性组分使用二氯甲烷:甲醇=1:1进行冲淋。收集极性组分,使用柔和的氮气吹干后,溶于正己烷:异丙醇=99:1并转移到2 mL细胞瓶中,使用安捷伦公司的高效液相色谱/大气压电离质谱(HPLC/APCI-MS)进行检测,色谱柱采用美国Alltech公司的正相氰基柱。
IGDGTs (isoprenoid GDGTs,类异戊二烯GDGTs)在海洋中主要氨氧化古菌产生的膜脂化合物,而海洋沉积物中的bGDGTs (branched GDGTs,支链GDGTs)则主要由陆源细菌产生而通过河流输入到海洋中,称之为支链GDGTs。根据两者之间的比值计算的BIT (branched isoprenoid tetraether)指标能够很好地指示陆源输入与海洋输入贡献比例[15] (公式1)。

|
公式(1) |
其中,crenarchaeol是泉古菌醇,GDGT-Ⅰ、GDGT-Ⅱ、GDGT-Ⅲ分别是带有4个、5个和6个甲基支链的细菌四醚膜脂。细菌四醚膜脂通常认为是陆地环境下产生。
1.4 沉积物中绿素提取与检测取200 mg冷冻干燥并研磨过的沉积物,先用90%的丙酮超声萃取2次,每次15 min,萃取后,用2500 r/min的速度离心5 min,收集萃取液。再用100%的丙酮萃取1次,收集萃取液,使用3 mL甲醇定容后,用0.22 μm的一次性滤头过滤后,用高效液相色谱(HPLC)分析。使用仪器为美国Waters公司E600高效液相色谱,流动相为色谱级纯度甲醇,流速为1 mL/min。浓度定量的方法为,取一系列总有机碳含量不同的沉积物进行萃取,测定其在可见光分光光度计波长666 nm处的吸收值。根据Beer-Lambert定律计算出浓度,再由计算出的浓度与荧光测定的峰面积绘制出相关曲线。样品的绿素浓度即可通过荧光检测器得出的峰面积与紫外分光光度计测定的浓度的关系式计算得出。
2 结果和讨论 2.1 样品整体分析古菌iGDGTs在东海陆架区广泛分布,这与之前研究者通过生物学方法得出的结论一致[16-17]。在邻近长江口区域,古菌iGDGTs总含量平均为350 ng/g,含量为15.01–1042.65 ng/g,其分布随空间差异变化剧烈。在含量最高的站位A3-9,其总量可达到1042 ng/g,而在含量最低的站位A3-6,总含量只有15 ng/g。这个可能与沉积物类型有关,站位A3-6主要是沙质沉积物,而到了站位A3-9则以泥质沉积物为主。除了整体的空间分布不均衡外,各种类型的iGDGTs分布也不平均,带有0个六元环的GDGT-0平均含量为58 ng/g,GDGT-1为14 ng/g,GDGT-2为10 ng/g,GDGT-3为4 ng/g,GDGT-4为81 ng/g。泉古菌醇的平均含量为194 ng/g。泉古菌醇在长江口的分布与总iGDGTs分布非常类似,均在站位A3-9达到最高,而在A3-6最低。
绿素的整体含量为0–6.96 μg/g,该浓度范围与金海燕[18]报道的东海海域的绿素浓度0.03– 7.71 μg/g相一致。绿素在样品整体中的分布差异极大,在某些位点,绿素的含量甚至低于检测线,无法检测。在靠近长江口区域,绿素含量整体偏低,在较远的沿岸流地区,绿素含量升高。在站位A12-4,绿素含量最高,达到了6.96 μg/g。
样品的盐度为17.6‰–34.4‰,这与采样地区为靠近河口及近岸的地质背景相一致。总有机碳分布为0.23%–1.46%,空间差异明显并且与离岸距离呈现明显的相关性,在靠近陆地的地方,总有机碳含量高。其中,有机碳含量在站位A1-1达到最高值。由此推断沉积物中的总有机碳大部分是陆地来源,这与之前报道相一致[19],即与陆源的有机质从靠近河口区到开阔陆架区被迅速氧化的结论一致。碳同位素的分布则与总有机碳的截然不同。碳同位素分布从空间分布上来看,与站点到陆地的距离无明显关系,而与泉古菌醇及绿素的空间分布类似。
BIT的值在0和1之间变化,越接近0说明样品中海洋来源的四醚脂类越多;反之,则是来自陆地的四醚膜脂占据主导地位。沉积物样品中的BIT值为0.03–0.70,随着离陆地的距离下降,变化非常剧烈。在靠近陆地的地方,尤其是站位A1-1,BIT值达到0.7,属于受陆源输入影响明显的环境。而随着与陆地距离的增大,BIT值迅速降低,大部分站位的BIT值低于0.2,属于典型的海洋输入占主导地位的沉积环境。
2.2 泉古菌醇与绿素来源讨论BIT和总有机碳作为两个用于指示陆源输入的指标,各个站位的值与它们到陆地的距离呈现明显的关系。距离陆地越近,BIT值与总有机碳含量也越高,而随着与陆地距离的增加,两者都在下降。在站位A1-1,BIT与总有机碳值同时达到最高,说明了该站点的沉积物受到陆源输入的影响最为剧烈(图 2)。
|
| 图 2 东海沉积物中绿素(A)、TOC (B)、泉古菌醇(C)及BIT(D)的分布 Figure 2 The chlorin concentrations (μg/g dry sediment, A), TOC percentages (%, B), crenarchaeol concentrations (ng/g dry sediment, C) and BIT values (D) of the sediments from East China Sea. |
以东经122.5°为界的近岸区域,泉古菌醇在近岸点分布较少,平均浓度为(103.0+48.1) ng/g,显著低于远岸区域(225.5+181.5) ng/g。绿素的分布在空间上存在类似特征,在靠近陆地的一系列站点,沉积物中的绿素含量已经低于仪器的检测限而无法检测到沉积物中含有绿素。泉古菌醇含量最高的站位是A3-9 (123.7°E,31.3°N),丰度达到549 ng/g,而在该地点,BIT值接近0,说明该站位几乎没有来自陆源的四醚脂类。因此认为站位A3-9的高泉古菌醇含量为海洋来源。
绿素在靠近长江口区域呈现点状分布的特征,以站位A4-9 (123.8°E,31.3°N)和站位A12-4 (122.6°E,29.2°N)为中心的2个区域有较多的分布。对比绿素与总有机碳的分布,虽然总有机碳的分布整体上呈现出一种近岸多、远岸少的分布特征,但是在绿素含量较高的点,其总有机碳仍会比周围高一些。而在总有机碳最高的点A1-1反而没有检测到绿素,因此认为在远岸点,可能是由于海洋来源的绿素高含量提升了总有机碳。这一结论也与在东海进行的其他研究的结论相一致。将本次研究的绿素含量归一化到nmol/g TOC,研究区域的绿素含量为从低于检测线到2017.96 nmol/g TOC,平均值为(503.08±523.77) nmol/g TOC。李栋,对东海类似区域的研究中,检测分析发现表面沉积物中绿素的含量范围为231–2485 nmol/g TOC,平均值为(974±522) nmol/g TOC。在其研究中,绿素的2个高值点分别在(122.5°E,31°N)和(122.5°E,29.5°N)附近,这与本次研究中发现的2个绿素高值点位置非常接近[20]。因此,推测这2个绿素的高值点可能是持续存在的。绿素是叶绿素的降解产物,因此绿素的分布情况也可以表征初级生产力在此海域中的分布情况。东海地区水动力环境复杂,长江冲淡水、浙闽沿岸流、台湾暖流、黑潮等都会影响到表层沉积物中的物质的分布[17]。综合以上,初步认为可能是由于地区的水文条件特点,使得2个绿素高值区所在点附近刚好是上升流区域,上升流带来的营养盐,使得初级生产力勃发,最终表现为绿素含量高。
泉古菌醇、绿素及其他参数的相关性分析结果显示,泉古菌醇、绿素与碳同位素呈现正相关,这可能是古菌和初级生产力对于碳同位素的分选在沉积物中的体现;BIT和总有机碳指数存在明显的正相关关系(图 3)。BIT和总有机碳之间相关性显著,为0.47。两者均是陆源输入的指标,相互印证,它们与经纬度之间的相关性显著也说明了沉积物受到陆源输入的影响与其空间位置相关(图 3)。
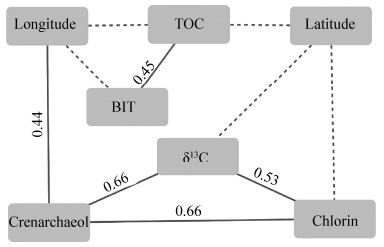
|
| 图 3 泉古菌醇、色素与环境参数相关性网络图 Figure 3 The network diagram between crenarchaeol, Chlorin, TOC, δ13C, BIT, longitude and latitude of the sediments from East China Sea. Based on Pearson correlations, R2 > 0.4, P < 0.001. |
2.3 泉古菌醇与绿素相关性分析
将泉古菌醇与绿素在每个站位的含量投影到指数坐标轴上,可以发现两者存在很好的指数相关关系。绿素和泉古菌醇在研究区域相关系数为0.66。相较于泉古菌醇,绿素在整体的含量变动要更剧烈。Fietz在2011年对贝加尔湖、南大洋、东北大西洋及弗雷姆海峡的四根沉积柱进行研究,检测沉积柱中泉古菌醇与绿素的相关关系,发现在四根沉积柱中,泉古菌醇和绿素均存在显著的线性相关关系[13]。长江口的绿素与泉古菌醇相关性比例关系与贝加尔湖和弗雷姆海峡接近。绝对含量上,长江口绿素和泉古菌醇的含量与贝加尔湖接近。但是由于Fietz的数据是时间序列上的相关性,而在东海我们所研究的是空间上的相关性,因此,虽然两者的相关性趋势类似,这种类似性背后的机制仍有待进一步研究。另一方面,结合我们的与Fietz的研究可以发现,从淡水湖泊到河口沿岸带,从海峡到开放大洋,在各种水文条件下,我们都可以观察到泉古菌醇和绿素在含量上的线性相关。同时,这种相关性不论在冰期或间冰期,古代或现代的海洋中均存在,因此,我们认为绿素与泉古菌醇的相关关系可能存在于各种水环境中,提示使用两种指标结合反映历史时期水环境中初级生产力变化的可行性。
对于绿素与泉古菌醇的正相关关系存在两种解释,一是它们共同受控于同一个外在环境因素的变化(例如温度、盐度等),另一个是它们直接存在代谢上的相互依存关系。针对第一种假设,已有的研究报道显示,产生泉古菌醇的海洋氨氧化古菌对温度的响应存在较强的地域性差异,例如大西洋北部的北海区域及南极洲昂韦尔岛附近海域,氨氧化古菌的量均呈现出显著的季节性差异,在冬季的丰度更高[21-22],而在地中海西北部海域,氨氧化古菌的量则是呈现出夏季更高的趋势[23]。Fietz等[13]对不同海域的沉积物中绿素与泉古菌醇丰度的检测结果也显示,不管是在寒冷的冰期还是在温暖的间冰期,绿素与泉古菌醇的丰度一直存在较好的正相关,表明两者之间正相关关系不是由于它们对温度的响应引起的。从代谢角度来看,绿素是有由光合自养生物产生,光合自养生物的降解会释放出铵根离子,而这些铵根离子则是氨氧化古菌重要的能量来源,氨氧化古菌对铵根离子的吸收速率,是随着铵根离子浓度的增加而呈指数增加[24],提示海洋中氨氧化古菌的生长速率与铵根离子的浓度成正相关。由此可推测,产生绿素的光能自养生物的增长,能够释放更多的铵根离子,供产生泉古菌醇的氨氧化古菌生长,使得沉积物中检测到的绿素与泉古菌醇之间具有相关性,因此,泉古菌醇可以作为绿素的有效补充指标,检测共同地质历史时期海洋初级生产力的变化。同时,由于泉古菌醇的醚脂结构更加稳定,能够在地质体中保存最多至27亿年的晚太古代[25],因此,该化合物还具备反映更长时间尺度的海洋初级生产力变化的潜力。本研究结果也证实,在控制反映水团混合的盐度及反映陆源输入的BIT指标时,绿素与泉古菌醇的丰度的相关性依然显著(图 4),表明在东海陆架区绿素与泉古菌醇之间的耦合关系并未受到水团混合及陆源输入的影响,泉古菌醇在该区域可以作为绿素的有效补充,反映该区域地质历史时期的初级生产力的变化。

|
| 图 4 东海及全球其他区域绿素与泉古菌醇的相关性(图中虚线数据来自Fietz et al., 2011) Figure 4 The linear corralations between chlorin and crenarchaeol of the sediments from East China Sea and other regions. |
3 结论
通过高效液相色谱与高效液相色谱质谱连用,对长江口及东海部分海域的表层沉积物中的泉古菌醇和绿素进行研究。两者在长江口及东海均有分布,但是其分布并不均匀。在河口及近岸分布较少,而在陆架分布较多。两者的空间分布模式较为类似,含量最高站位位置接近。从具体数据来看,两者存在指数线性相关关系。这种相关关系背后的机制在于,产生绿素的光合藻类能够释放出铵根离子,铵根离子的增加促进了产生泉古菌醇的古菌的生长。因此,本研究证实了泉古菌醇能够成为绿素的有效补充,共同指示东海陆架区域初级生产力的历史演变。
致谢:感谢国家海洋局第二海洋研究所金海燕研究员帮助完成绿素的测定。感谢同济大学“2015长江口到东海陆架开放航次”的支持。
| [1] | Woese CR, Kandler O, Wheelis ML. Towards a natural system of organisms:proposal for the domains Archaea, Bacteria, and Eucarya. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(12): 4576-4579. DOI:10.1073/pnas.87.12.4576 |
| [2] | Valentine DL. Adaptations to energy stress dictate the ecology and evolution of the Archaea. Nature Reviews Microbiology, 2007, 5(4): 316-323. DOI:10.1038/nrmicro1619 |
| [3] | Könneke M, Bernhard AE, de la Torre JR, Walker CB, Waterbury JB, Stahl DA. Isolation of an autotrophic ammonia-oxidizing marine archaeon. Nature, 2005, 437(7058): 543-546. DOI:10.1038/nature03911 |
| [4] | Brochier-Armanet C, Boussau B, Gribaldo S, Forterre P. Mesophilic Crenarchaeota:proposal for a third archaeal phylum, the Thaumarchaeota. Nature Reviews Microbiology, 2008, 6(3): 245-252. DOI:10.1038/nrmicro1852 |
| [5] | Pitcher A, Hopmans EC, Mosier AC, Park SJ, Rhee SK, Francis CA, Schouten S, Damsté JS. Core and intact polar glycerol dibiphytanyl glycerol tetraether lipids of ammonia-oxidizing archaea enriched from marine and estuarine sediments. Applied and Environmental Microbiology, 2011, 77(10): 3468-3477. DOI:10.1128/AEM.02758-10 |
| [6] | Harris PG, Zhao M, Rosell-Melé A, Tiedemann R, Sarnthein M, Maxwell J. Chlorin accumulation rate as a proxy for Quaternary marine primary productivity. Nature, 1996, 383(6595): 63-65. DOI:10.1038/383063a0 |
| [7] | Chen NH, Bianchi TS, Bland JM. Implications for the role of pre-versus post-depositional transformation of chlorophyll-a in the Lower Mississippi River and Louisiana shelf. Marine Chemistry, 2003, 81(1/2): 37-55. |
| [8] | Schubert C, Klockgether G, Niggemann J, Ferdelman T, Jorgensen B. The Chlorin-Index:A new parameter for organic matter freshness in sediments. Geochimica et Cosmochimica Acta, 2002, 66(15 A): A689-A689. |
| [9] | Tyler J, Kashiyama Y, Ohkouchi N, Ogawa N, Yokoyama Y, Chikaraishi Y, Staff RA, Ikehara M, Bronk Ramsey C, Bryant C, Brock, Gotanda K, Haraguchi T, Yonenobu H, Nakagawa T. Tracking aquatic change using chlorin-specific carbon and nitrogen isotopes:The last glacial-interglacial transition at Lake Suigetsu, Japan. Geochemistry, Geophysics, Geosystems, 2010, 11(9): Q09010. |
| [10] | Ishikawa NF, Yamane M, Suga H, Ogawa NO, Yokoyama Y, Ohkouchi N. Chlorophyll a-specific Δ14C, δ13C and δ15N values in stream periphyton:implications for aquatic food web studies. Biogeosciences, 2015, 12(22): 6781-6789. DOI:10.5194/bg-12-6781-2015 |
| [11] | Wuchter C, Schouten S, Wakeham SG, Sinninghe Damsté JS. Archaeal tetraether membrane lipid fluxes in the northeastern Pacific and the Arabian Sea:Implications for TEX86 paleothermometry. Paleoceanography, 2006, 21(4): PA4208. |
| [12] | Bechtel A, Smittenberg RH, Bernasconi SM, Schubert CJ. Distribution of branched and isoprenoid tetraether lipids in an oligotrophic and a eutrophic Swiss lake:insights into sources and GDGT-based proxies. Organic Geochemistry, 2010, 41(8): 822-832. DOI:10.1016/j.orggeochem.2010.04.022 |
| [13] | Fietz S, Martínez-Garcia A, Rueda G, Peck VL, Huguet C, Escala M, Rosell-Melé A. Crenarchaea and phytoplankton coupling in sedimentary archives:Common trigger or metabolic dependence?. Limnology and Oceanography, 2011, 56(5): 1907-1916. DOI:10.4319/lo.2011.56.5.1907 |
| [14] | Gong GC, Wen YH, Wang BW, Liu GJ. Seasonal variation of chlorophyll a concentration, primary production and environmental conditions in the subtropical East China Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2003, 50(6/7): 1219-1236. |
| [15] | Hopmans EC, Weijers JW, Schefuẞ E, Herfort L, Sinninghe Damsté JS, Schouten S. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids. Earth and Planetary Science Letters, 2004, 224(1/2): 107-116. |
| [16] | Xing L, Zhang HL, Yuan ZN, Sun Y, Zhao MX. Terrestrial and marine biomarker estimates of organic matter sources and distributions in surface sediments from the East China Sea shelf. Continental Shelf Research, 2011, 31(10): 1106-1115. DOI:10.1016/j.csr.2011.04.003 |
| [17] | Zhu C, Weijers JWH, Wagner T, Pan JM, Chen JF, Pancost RD. Sources and distributions of tetraether lipids in surface sediments across a large river-dominated continental margin. Organic Geochemistry, 2011, 42(4): 376-386. DOI:10.1016/j.orggeochem.2011.02.002 |
| [18] |
Jin HY. Sedimentary records of changing structures of phytoplankton communities for the last hundred years in the Changjiang Estuary. Doctor Dissertation of Zhejiang University, 2009. (in Chinese) 金海燕.近百年来长江口浮游植物群落变化的沉积记录研究.浙江大学博士学位论文, 2009. |
| [19] | Zhu C, Wagner T, Talbot HM, Weijers JWH, Pan JM, Pancost RD. Mechanistic controls on diverse fates of terrestrial organic components in the East China Sea. Geochimica et Cosmochimica Acta, 2013, 117: 129-143. DOI:10.1016/j.gca.2013.04.015 |
| [20] |
Li D. Biogeochemical processes of sedimentary organic carbon and historical reconstruction of eco-environmental changes in the Changjiang Estuary and East China Sea inner shelf. Doctor Dissertation of Ocean University of China, 2015. (in Chinese) 李栋.长江口-东海内陆架沉积有机碳的生物地球化学过程及生态环境演变历史的重建.中国海洋大学博士学位论文, 2015. |
| [21] | Herfort L, Schouten S, Abbas B, Veldhuis MJW, Coolen MJL, Wuchter C, Boon JP, Herndl GJ, Damsté JSS. Variations in spatial and temporal distribution of Archaea in the North Sea in relation to environmental variables. FEMS Microbiology Ecology, 2007, 62(3): 242-257. |
| [22] | Murray AE, Preston CM, Massana R, Taylor LT, Blakis A, Wu K, DeLong EF. Seasonal and spatial variability of bacterial and archaeal assemblages in the coastal waters near Anvers Island, Antarctica. Applied and Environmental Microbiology, 1998, 64(7): 2585-2595. |
| [23] | Alonso-Sáez L, Balagué V, Sà EL, Sánchez O, González JM, Pinhassi J, Massana R, Pernthaler J, Pedrós-Alió C, Gasol JM. Seasonality in bacterial diversity in north-west Mediterranean coastal waters:assessment through clone libraries, fingerprinting and FISH. FEMS Microbiology Ecology, 2007, 60(1): 98-112. |
| [24] | Martens-Habbena W, Berube PM, Urakawa H, de la Torre JR, Stahl DA. Ammonia oxidation kinetics determine niche separation of nitrifying Archaea and Bacteria. Nature, 2009, 461(7266): 976-979. DOI:10.1038/nature08465 |
| [25] | Ventura GT, Kenig F, Reddy CM, Schieber J, Frysinger GS, Nelson RK, Dinel E, Gaines RB, Schaeffer P. Molecular evidence of Late Archean archaea and the presence of a subsurface hydrothermal biosphere. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(36): 14260-14265. DOI:10.1073/pnas.0610903104 |
 2019, Vol. 59
2019, Vol. 59