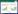中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张铮, 朱坤, 朱伟云, 毛胜勇. 2019
- Zheng Zhang, Kun Zhu, Weiyun Zhu, Shengyong Mao. 2019
- 发酵饲料对生长育肥猪结肠微生物发酵及菌群组成的影响
- Effect of a fermented feed on colonic fermentation and microbial composition in finishing pig
- 微生物学报, 59(1): 93-102
- Acta Microbiologica Sinica, 59(1): 93-102
-
文章历史
- 收稿日期:2018-02-10
- 修回日期:2018-04-03
- 网络出版日期:2018-06-21
生长育肥猪的健康状况直接影响到猪生产的经济效益。为改善猪体健康,传统方法是在饲料中添加饲用抗生素来实现该目的,但随着人们对饲用抗生素带来的药物残留及生态安全等问题的认识不断深入,饲料中禁用饲用抗生素已是大势所趋[1];发酵饲料作为一种绿色、环保的新型健康饲料,一定程度上可以减少饲用抗生素的使用,降低养殖成本[2],因而受到养殖界的广泛关注。
猪后肠具有复杂的微生物菌群,这些微生物在维持动物机体健康、改善机体代谢及维持肠道稳态等方面起着重要作用。研究表明,使用发酵饲料可以减少肠道致病菌的定植,改善肠道健康[3],然而,目前仍不清楚使用发酵饲料对猪肠道菌群组成的具体影响,为阐明这一问题,本试验以复合菌发酵饲料饲喂生长育肥猪,利用高通量测序手段研究了育肥猪结肠黏膜及其内容物中细菌菌群组成的变化,拟为生物发酵饲料在育肥猪中的合理应用提供理论依据。
1 材料和方法 1.1 试验动物、试验日粮与试验设计试验于2017年4月–5月进行,选用健康、日龄基本一致、体重约60 kg的杜×长×大三元杂交猪24头,随机分为2组,分别为基础日粮组(对照组)、复合菌发酵饲料组(试验组),每组4个重复,每重复3头猪。日粮配方及营养水平见表 1。
| Nutrients composition | Content |
| Maize/% | 67.00 |
| Soybean meal/% | 18.00 |
| Wheat bran/% | 10.00 |
| Premix*/% | 5.00 |
| DE/(kcal/kg) | 3150 |
| Crude protein/% | 16.00 |
| Calcium/% | 0.90 |
| Lysine/% | 1.20 |
| Total phosphorus/% | 0.55 |
| *Premix provided the following per kg of the diet: Vitamin A, 3200 IU; Vitamin D3, 500 IU; Vitamin E, 15 IU; Vitamin K3, 1 mg; Vitamin B1, 2.5 mg; Vitamin B2, 2.5 mg; Vitamin B6, 1.5 mg; Nicotinic acid, 25.0 mg; Folic acid, 0.5 mg; Pantothenic acid, 12.5 mg; Choline chloride, 250.0 mg; Iron, 75.0 mg; Copper, 30.0 mg; Manganese, 15.0 mg; Zinc, 60.0 mg; Iodine, 0.175 mg; Selenium, 0.125 mg. | |
复合菌发酵饲料的制作程序如下:采用南京农业大学动物科技学院消化道微生物实验室保存的唾液乳杆菌L79、枯草芽孢杆菌B1121和酿酒酵母菌S1145制备菌液,并按质量比2:2:1进行混合(复合菌的总数量约为1×109 CFU/g),取对照组基础日粮,按2 g/kg复合菌液添加于日粮中,调节饲料湿度为40%,混合均匀后分装至单通阀发酵袋中,于37 ℃发酵2 d,饲喂前再与基础日粮以1:4的比例混合,将混合饲料作为试验组日粮。试验期间,每日饲喂2次,自由采食,自动饮水。试验期为30 d。
1.2 样品采集与制备于试验正式开始后第30天,每组每个重复随机选择一头猪屠宰,屠宰后迅速取出整个消化道,分肠段进行结扎,结肠全部内容物迅速混匀后,测定内容物pH值,另取部分内容物按1:1的质量比与去离子水混合,5000×g下离心10 min后,一部分上清液冻存于–20 ℃冰箱中用于乳酸浓度的测定,另一部分上清液中以5:1的比例加入25% (W/V)偏磷酸与巴豆酸混合液,混匀后冻存于–20 ℃冰箱中用于挥发性脂肪酸浓度的测定;取部分样品于–20 ℃保存,用于细菌DNA提取;无菌剪刀剪取结肠中段,无菌冰磷酸缓冲液清洗干净,采用无菌载玻片将黏膜和肌肉层分离开,刮取黏膜,样品于–80 ℃保存备用。
1.3 结肠内容物中pH、乳酸和挥发性脂肪酸的测定采用固体pH计(HANNA,美国)测定结肠内容物pH,乳酸含量采用南京建成生物工程研究所的乳酸测试盒测定。样品解冻后,12000×g离心5 min,取0.3 μL上清液于GC-14B型气相色谱仪(Shimadzu,日本)测定挥发性脂肪酸浓度[4]。
1.4 结肠黏膜和内容物中DNA提取及MiSeq测序选用美国MoBio公司PowerSoil-htp 96 Well Soil DNA Isolation Kit试剂盒对结肠黏膜样本的基因组DNA进行提取;采用CTAB法提取结肠内容物中DNA,取0.3 g解冻的结肠内容物,加入2 mL磷酸缓冲液后涡旋混匀、12000×g离心,类似操作,清洗样品2–3次。在所得沉淀中加入1 mL CTAB溶液,混匀后转移至含有0.3 g灭菌锆珠的锆珠管中,采用珠磨仪(Biospec,美国)破碎细胞,再采用酚-氯仿-异戊醇提取结肠内容物中细菌总DNA[5]。采用NanoDrop ND-2000 spectrophotometer (Thermo fisher,美国)测取DNA浓度。在Illumina (MiSeq)平台进行DNA双端测序。使用细菌16S rRNA基因的V4区作为模板,进行PCR扩增,引物序列为515F (5′-barcode-GTG CCAGCMGCCGCGGTAA-3)和806R (5′-GGACT ACCVGGGTATCTAAT-3′)。扩增条件为:95 ℃ 2 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,25个循环;72 ℃ 5 min。
1.5 生物信息学分析根据Barcode的信息,将单个样品数据拆分出来,删除引物序列,进行测序序列质量控制,将不含样品信息的序列、过短或过长的序列、出现ambiguous碱基及含有过多homologous碱基的序列去除;通过质量检查的优质序列,应用QIIME (v.1.8.0)软件进行分析处理,应用Ribosomal Database Project (RDP) Classifier 2.3进行分类,使用SILVA数据库(v.1.1.9)进行序列比对(alignment),确定每条序列的分类等级。OTUs (operational taxonomic units,分类操作单元)划分以序列相似性97%为标准。
1.6 多样性分析通过丰富度指数(Chao、Ace)、多样性指数(Shannon、Simpson)对样品中物种Alpha多样性进行分析;采用随机抽样的方法抽取OTU数据,以抽到的序列数与它们所能代表的OTU数目构建曲线,即得稀疏曲线;基于OTU相对丰度对结肠黏膜及内容物样本中菌落组成进行门水平、属水平分析。
1.7 统计分析试验所得数据经Excel (2010)初步处理后,常规数据采用SPSS 20.0软件中的独立样本t检验方法进行分析,高通量测序结果采用Kruskal-Wallis进行非参数检验。显著性水平(P值)置于0.05。
2 结果和分析 2.1 结肠内容物中发酵参数的测定表 2为育肥猪结肠内容物中pH、乳酸及VFA浓度的测定,与对照组比较,采食20%复合菌发酵饲料的猪结肠内容物中仅丁酸水平显著升高(P < 0.05),而两组间在pH、乳酸、乙酸、丙酸、异丁酸、戊酸、异戊酸和总挥发性脂肪酸含量方面无显著差异(P > 0.05)。
| Item | CON | TR | SEM | P-value |
| pH | 6.59 | 6.67 | 0.19 | 0.682 |
| Lactate/(μmol/g) | 1.84 | 2.09 | 0.17 | 0.512 |
| Acetate/(μmol/g) | 71.84 | 37.76 | 10.57 | 0.134 |
| Propionate/(μmol/g) | 22.77 | 20.48 | 1.26 | 0.403 |
| Butyrate/(μmol/g) | 8.32 | 11.56 | 0.69 | 0.003 |
| Isobutyrate/(μmol/g) | 1.63 | 1.48 | 0.08 | 0.358 |
| Valerate/(μmol/g) | 2.72 | 2.20 | 0.24 | 0.306 |
| Isovalerate/(μmol/g) | 3.87 | 3.10 | 0.51 | 0.491 |
| Total VFA/(μmol/g) | 111.40 | 76.58 | 10.67 | 0.138 |
| All indexes in this table were analyzed with the individual pig as the experimental unit (n=4). SEM=standard error of the means. | ||||
2.2 结肠黏膜及内容物OTU水平分析
由图 1可见,结肠黏膜(A)及内容物(B)的稀疏曲线显示,随着测序深度增加,曲线逐渐趋于平缓,说明测序数据量合理。

|
| 图 1 结肠黏膜(A)及内容物(B)中细菌的稀疏曲线 Figure 1 Rarefaction curves based on OTUs in the colonic mucosa (A) and digesta (B). |
2.3 结肠黏膜及内容物细菌群落的多样性分析
由表 3可见,饲喂含发酵饲料的日粮对育肥猪结肠黏膜及内容物中细菌的OTU数量、ACE及Chao等特种丰度和多样性指数并没有显著影响(P > 0.05)。由图 2可见,PCA图显示,对照组与处理组两组间均可明显区分开,说明两组菌群之间存在差异性。进一步AMOVA分析显示饲喂复合菌发酵饲料显著影响了育肥猪结肠黏膜(Fs=2.19,P=0.025)和内容物(Fs=1.92,P=0.026)的细菌群落。
|
| 图 2 结肠黏膜(A)和内容物(B)中细菌的主成分分析 Figure 2 Principal component analysis (PCA) of bacteria in colonic mucosa (A) and digesta (B). |
| Item | Mucosa | SEM | P-value | Digesta | SEM | P-value | ||
| CON | TR | CON | TR | |||||
| OTUs | 405 | 409 | 2.65 | 0.180 | 393 | 396 | 4 | 0.772 |
| Ace | 408 | 412 | 2.82 | 0.386 | 400 | 401 | 5 | 0.773 |
| Chao | 409 | 414 | 3.32 | 0.248 | 401 | 400 | 4 | 1.000 |
| Shannon | 4.89 | 5.05 | 0.08 | 0.083 | 4.77 | 4.94 | 0.14 | 0.248 |
| Simpson | 0.02 | 0.01 | 0.01 | 0.131 | 0.02 | 0.01 | 0.01 | 0.155 |
2.4 结肠黏膜及内容物细菌类群分析
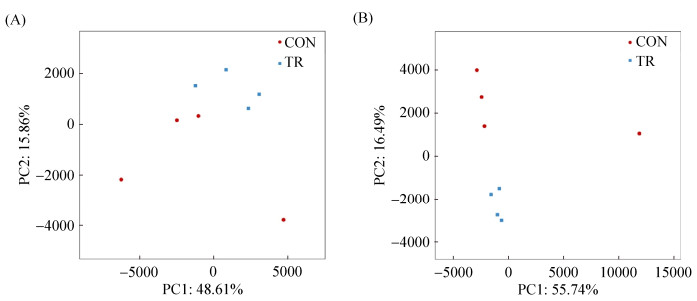
Venn图可反映样本间及组间共有和特有的OTU数目,从而直观地反映出样本间及组间细菌菌群组成的重叠情况。图 3-A中可以看出结肠黏膜中共有的细菌OTU数目为411个,代表物种分别属于肠球菌属(Enterococcus)、魏斯菌属(Weissella)、肠杆菌科(Enterobacteriaceae)、乳酸杆菌属(Lactobacillus)等。其中,对照组独有的细菌OTU分别属于金黄杆菌属(Chryseobacterium)、乳杆菌目(Lactobacillales);发酵饲料组独有的细菌OTU分别属于芽孢杆菌科(Bacillaceae)、葡糖杆菌属(Gluconobacter)、醋酸杆菌属(Acetobacter)、明串珠菌属(Leuconostoc)、魏斯菌属(Weissella)、绿脓杆菌属(Pseudomonas)。
|
| 图 3 结肠黏膜(A)和内容物(B)中细菌Venn图 Figure 3 Venn diagrams of bacteria in the colonic mucosa (A) and digesta (B). |
从图 3-B中可以看出,结肠内容物中共有的OTU数目为405个,代表物种分别属于肠球菌属(Enterococcus)、魏斯菌属(Weissella)、乳酸杆菌属(Lactobacillus)、弯曲杆菌属(Campylobacter)等。其中,对照组育肥猪结肠内容物中独有的细菌OTU分别属于黏胶球形菌门(Lentisphaerae)、拟杆菌目(Bacteroidales)、密螺旋体属(Treponema)、厌氧螺菌属(Anaerobiospirillum)、乳杆菌目(Lactobacillales);发酵饲料组独有的细菌OTU分别属于芽孢杆菌科(Bacillaceae)、葡糖杆菌属(Gluconobacter)、醋酸杆菌属(Acetobacter)、拟杆菌目(Bacteroidales)、明串珠菌属(Leuconostoc)、魏斯菌属(Weissella)。
2.5 结肠细菌门水平分析由图 4可见,育肥猪结肠黏膜细菌菌群中有14个菌门,其中优势菌门为厚壁菌门(46.40%)、拟杆菌门(31.74%)、变形菌门(11.00%),在门丰度上,两组之间未有显著变化;在内容物中的细菌菌群共检测到14个菌门,其中优势菌门为厚壁菌门(52.66%)、拟杆菌门(37.77%)、变形菌门(3.27%)。与对照组比较,饲喂发酵饲料组的育肥猪结肠内容物中螺旋体菌门的相对丰度显著升高(P < 0.05),但对其他菌门的丰度无显著影响(P > 0.05).

|
| 图 4 结肠黏膜(A)及内容物(B)中细菌门水平的相对丰度(%) Figure 4 The relative abundances of bacteria in colonic mucosa (A) and digesta (B) at phyla level (%). |
2.6 结肠细菌属水平分析
育肥猪结肠黏膜(图 5-A)及内容物(图 5-B)中细菌属水平相对丰度如图 5所示,育肥猪结肠内容物中共检测到114个菌属,以相对丰度0.5%为标准筛选出35个优势菌属,与对照组比较,发酵饲料组未分类菌属、Subdoligranulum菌属、脱硫弧菌属和魏斯菌属的相对丰度显著升高(P < 0.05)。黏膜中共检测到114个菌属,以相对丰度0.5%为标准筛选出34个优势菌属,与对照组比较,发酵饲料组中的未分类菌属、柔嫩梭菌属和魏斯菌属的相对丰度显著升高(P < 0.05)。

|
| 图 5 结肠黏膜(A)及内容物(B)中细菌属水平的相对丰度(%) Figure 5 The relative abundances of bacteria in colonic mucosa (A) and digesta (B) at genera level (%). |
2.7 结肠细菌群落的功能预测
利用PICRUSt作为一种预测工具对结肠黏膜及内容物中细菌功能进行预测,在所有样品中,总共发现39个基因家族;通过对KEGG通路的PCA分析,显示无论结肠黏膜还是内容物,两组样品之间未区分开,表明两组之间的功能存在一定的相似性(图 6)。这些基因家族中,大部分基因与膜转运(对照组在黏膜中为11.92%,内容物中为11.62%;试验组分别为11.72%,11.78%)、碳水化合物代谢(对照组在黏膜和内容物中分别为9.80%,10.13%;试验组分别为9.85%,10.13%)、氨基酸代谢(对照组在黏膜和内容物中分别为9.61%,9.72%;试验组分别为9.63%,9.68%)相关。在所有基因家族中,结肠黏膜细菌中,涉及免疫系统(P=0.021)和翻译(P=0.021)的基因家族的相对丰度显著高于对照组,而有关复制和修复(P=0.043)、膜转运(P=0.040)的基因家族相对丰度显著低于对照组;在结肠内容物细菌菌群中,饲喂发酵饲料组的细菌菌群中有关遗传信息处理(P=0.021)的基因家族相对丰度显著高于对照组,而有关免疫系统疾病(P=0.021)和神经系统(P=0.043)的基因家族相对丰度显著低于对照组。
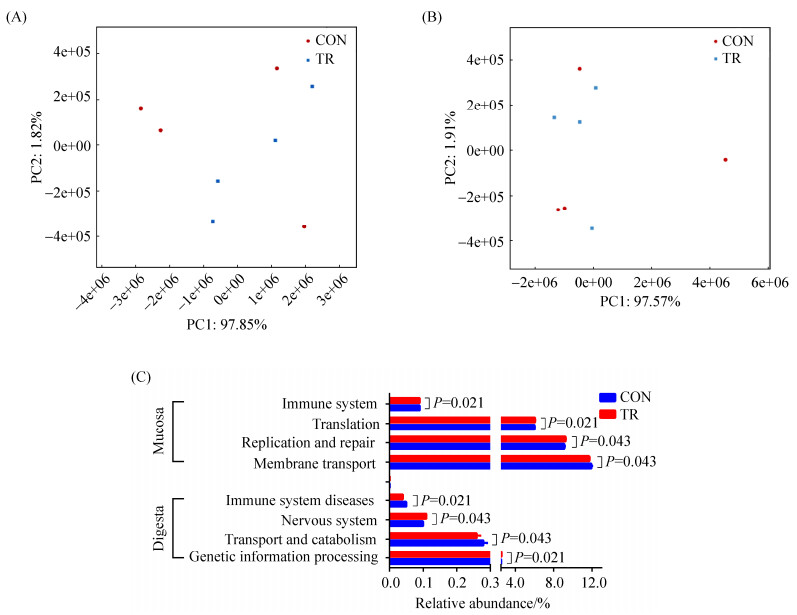
|
| 图 6 结肠细菌的功能多样性 Figure 6 Functional diversity of the bacterial microbiota in colonic mucosa and digesta.A: Principal component analysis (PCA) of KEGG pathways encoded in the bacteria of colonic mucosa in CON and TR group; B: Principal component analysis (PCA) of KEGG pathways encoded in the bacteria of colonic digesta in CON and TR group; C: Influence of combined microbial fermented feed on the abundance of KEGG pathways in the colonic mucosa and digesta. |
3 讨论
消化道微生态是猪机体最为重要和复杂的微生态系统之一,其中菌群的数量及种类可随着机体的生长发育而不断发生变化,维持一种复杂的动态平衡,在长期进化过程中,猪消化道微生态与宿主形成了互利共生的关系。猪微生物消化的主要场所位于消化道后段,胃和小肠未吸收的营养素进入后肠,经微生物进一步发酵,发酵产物可被吸收,进入机体起到供能及调控宿主代谢与免疫的作用。本实验发现,饲喂含发酵饲料的日粮的猪结肠中丁酸含量显著升高,由于丁酸是动物体内肠上皮细胞组织再生和修复的主要营养物质,其还可抑制肠道内的病原菌或腐败菌生长,促进益生菌的发育和增殖[6];此外,已有研究表明,丁酸还可通过多种途径影响结肠屏障功能,改善结肠上皮细胞防御功能,缓解肠炎[7-8]。因此,发酵饲料组猪结肠中丁酸含量升高,说明饲喂发酵饲料有利于猪后肠道健康。
本试验在育肥猪结肠黏膜中检测到14个菌门和114个菌属,内容物中共检测到14个菌门和114个菌属。在门水平上,本研究发现,厚壁菌门和拟杆菌门是结肠黏膜及内容物中相对丰度最高的两个细菌门类,目前关于这类细菌的主要生理功能的研究显示,这两个菌门主要参与日粮中多糖物质和蛋白质降解[9-10]。同时,有研究表明,厚壁菌门和拟杆菌门是肠道细菌中主要的菌门[11],因此,在猪结肠黏膜及内容物中,厚壁菌门和拟杆菌门在结肠微生物发酵及微生态平衡中起着关键作用。在属水平上,本研究发现,柔嫩梭菌是厚壁菌门的主要成员之一,前人研究表明,该类细菌菌群可利用底物中的纤维素发酵产生包含丁酸在内的多种挥发性脂肪酸,Subdoligranulum菌属是柔嫩梭菌属的一个亚属,其特性与柔嫩梭菌属相似。本试验中,试验组育肥猪结肠黏膜中柔嫩梭菌属和内容物中Subdoligranulum菌属相对丰度显著升高,由于柔嫩梭菌属和Subdoligranulum菌属为丁酸产生菌,其相对丰度升高会导致结肠中丁酸水平上升,该结果也与发酵饲料组结肠内容物中丁酸水平显著升高相印证。
猪肠道黏膜菌群是一类主要定殖在猪肠道黏膜上的微生物,这类微生物菌群可形成生物膜,起到微生物屏障作用。有研究显示,宿主肠道内微生物屏障可阻碍病原菌在肠壁上的定殖[12],并可促进肠黏膜细胞增殖,增强机体的免疫机能[13]。而一旦肠道菌群与宿主间的动态平衡被打破,致病菌可大量增殖,就有可能导致各类疾病的发生。魏斯菌属是乳酸菌的一种,有研究表明,魏斯菌属对多种革兰氏阳性和阴性菌有抑制作用[14],魏斯菌属可产生一种葡聚糖,促进有益菌如双歧杆菌、嗜酸乳杆菌的生长[15]。本试验中,试验组育肥猪结肠内容物中魏斯菌属的相对丰度显著升高,该结果说明,日粮中添加发酵饲料有利于改善猪结肠的菌群结构。同时,本研究在发酵饲料组猪结肠中检测到大量有益菌如葡糖杆菌[16]和醋酸杆菌[17],而一些在对照组猪结肠中检测到的致病菌如密螺旋体属[18]、产吲哚金黄杆菌[19]等并未在发酵饲料猪结肠黏膜上检测到;这些结果进一步说明,饲喂复合菌发酵饲料可增加育肥猪结肠黏膜上有益菌数量,抑制有害菌增殖。
相关研究表明,肠道细菌对维持机体代谢与健康起着重要作用[20],本试验应用PICRUSt软件预测了育肥猪结肠黏膜和内容物上附着细菌的潜在功能。结果显示,饲喂发酵饲料组的育肥猪结肠黏膜及内容物中细菌菌群的潜在功能与对照组之间皆存在显著差异,说明细菌群落的改变可能会导致其功能的改变。与对照组比较,试验组育肥猪结肠有关免疫系统的细菌基因丰度增多,而有关免疫系统疾病的细菌基因比例减少,结果说明,饲喂复合菌发酵饲料可改善育肥猪后肠健康;此外,试验组育肥猪结肠中有关遗传信息处理及翻译的细菌基因的百分比升高,这说明饲喂复合菌发酵饲料后,肠道细菌可能对自身遗传信息的表达能力增强,从而增强其活性。
综上所述,本试验研究表明,饲喂复合菌发酵饲料可改变育肥猪结肠中微生物组成与功能,提高有益菌的丰度,并可显著提高结肠中丁酸水平,改善育肥猪结肠健康。
| [1] |
Li YK, Mao SY, Zhu WY. Current situation in research and application of fermented feed with probiotics. Animal Husbandry & Veterinary Medicine, 2009, 41(3): 90-93.
(in Chinese) 李永凯, 毛胜勇, 朱伟云. 益生菌发酵饲料研究及应用现状. 畜牧与兽医, 2009, 41(3): 90-93. |
| [2] | Wang C, Shi CY, Zhang Y, Song DG, Lu ZQ, Wang YZ. Microbiota in fermented feed and swine gut. Applied Microbiology and Biotechnology, 2018, 102(7): 2941-2948. DOI:10.1007/s00253-018-8829-4 |
| [3] | Canibe N, Jensen BB. Fermented and nonfermented liquid feed to growing pigs:effect on aspects of gastrointestinal ecology and growth performance. Journal of Animal Science, 2003, 81(8): 2019-2031. DOI:10.2527/2003.8182019x |
| [4] |
Qin WL. Determination of rumen volatile fatty acids by means of gas chromatography. Journal of Nanjing Agricultural University, 1982, 5(4): 110-116.
(in Chinese) 秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进. 南京农业大学学报, 1982, 5(4): 110-116. |
| [5] | Khafipour E, Li SC, Plaizier JC, Krause DO. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [6] | Kuroiwa T, Iwanaga M, Kobari K, Higashionna A, Kinjyo F, Saito A. Preventive effect of Clostridium butyricum M588 against the proliferation of Clostridium difficile during antimicrobial therapy. The Journal of the Japanese Association for Infectious Diseases, 1990, 64(11): 1425-1432. |
| [7] | Venkatraman A, Ramakrishna BS, Shaji RV, Kumar NSN, Pulimood A, Patra S. Amelioration of dextran sulfate colitis by butyrate:role of heat shock protein 70 and NF-κB. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2003, 285(1): G177-G184. DOI:10.1152/ajpgi.00307.2002 |
| [8] | Kinoshita M, Suzuki Y, Saito Y. Butyrate reduces colonic paracellular permeability by enhancing PPARγ activation. Biochemical and Biophysical Research Communications, 2002, 293(2): 827-831. DOI:10.1016/S0006-291X(02)00294-2 |
| [9] | Van Der Meulen R, Makras L, Verbrugghe K, Adriany T, De Vuyst L. In vitro kinetic analysis of oligofructose consumption by Bacteroides and Bifidobacterium spp. indicates different degradation mechanisms. Applied and Environmental Microbiology, 2006, 72(2): 1006-1012. DOI:10.1128/AEM.72.2.1006-1012.2006 |
| [10] | Ray AK, Roy T, Mondal S, Ringø E. Identification of gut-associated amylase, cellulase and protease-producing bacteria in three species of Indian major carps. Aquaculture Research, 2010, 41(10): 1462-1469. |
| [11] | Lamendella R, Domingo JWS, Ghosh S, Martinson J, Oerther DB. Comparative fecal metagenomics unveils unique functional capacity of the swine gut. BMC Microbiology, 2011, 11(1): 103-119. DOI:10.1186/1471-2180-11-103 |
| [12] | Ohland CL, MacNaughton WK. Probiotic bacteria and intestinal epithelial barrier function. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2010, 298(6): G807-G819. DOI:10.1152/ajpgi.00243.2009 |
| [13] | Ashida H, Ogawa M, Kim M, Mimuro H, Sasakawa C. Bacteria and host interactions in the gut epithelial barrier. Nature Chemical Biology, 2012, 8(1): 36-45. DOI:10.1038/nchembio.741 |
| [14] | Patterson MF, McKay AM, Connolly M, Linton M. Effect of high pressure on the microbiological quality of cooked chicken during storage at normal and abuse refrigeration temperatures. Food Microbiology, 2010, 27(2): 266-273. DOI:10.1016/j.fm.2009.10.007 |
| [15] | Tingirikari JMR, Kothari D, Goyal A. Superior prebiotic and physicochemical properties of novel dextran from Weissella cibaria JAG8 for potential food applications. Food & Function, 2014, 5(9): 2324-2330. |
| [16] |
Feng J, Shi QS, Ouyang YS, et al. Advance in classification and main application of Gluconobacter. Journal of Microbiology, 2010, 30(2): 86-90.
(in Chinese) 冯静, 施庆珊, 欧阳友生, 等. 葡糖杆菌属分类及其主要应用的研究进展. 微生物学杂志, 2010, 30(2): 86-90. DOI:10.3969/j.issn.1005-7021.2010.02.018 |
| [17] |
Sun DP, Xu J, Zhou LL, et al. Advances on bacterial cellulose fermented by Acetobacter. Journal of Biology, 2004, 21(1): 12-14, 22.
(in Chinese) 孙东平, 徐军, 周伶俐, 等. 醋酸杆菌发酵生产细菌纤维素的研究进展. 生物学杂志, 2004, 21(1): 12-14, 22. DOI:10.3969/j.issn.2095-1736.2004.01.005 |
| [18] |
Wang LX, Zhang W, An J. Advances on bacterial cellulose fermented by acetobacter. Journal of Beijing University of Agriculture, 2011, 26(2): 78-80.
(in Chinese) 王黎霞, 张伟, 安健. 猪密螺旋体痢疾的诊断方法研究进展. 北京农学院学报, 2011, 26(2): 78-80. DOI:10.3969/j.issn.1002-3186.2011.02.022 |
| [19] | Chen FL, Wang GC, Teng SO, Ou TY, Yu FL, Lee WS. Clinical and epidemiological features of Chryseobacterium indologenes infections:analysis of 215 cases. Journal of Microbiology, Immunology and Infection, 2013, 46(6): 425-432. DOI:10.1016/j.jmii.2012.08.007 |
| [20] | Saleh M, Trinchieri G. Innate immune mechanisms of colitis and colitis-associated colorectal cancer. Nature Reviews Immunology, 2011, 11(1): 9-20. DOI:10.1038/nri2891 |
 2019, Vol. 59
2019, Vol. 59