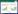中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李夏, 顾文杰, 杨少海, 卢钰升, 孙丽丽, 吴杭涛, 解开治. 2019
- Li Xia, Gu Wenjie, Yang Shaohai, Lu Yusheng, Sun Lili, Wu Hangtao, Xie Kaizhi. 2019
- 一株地膜降解真菌的筛选及其降解性能分析
- Screening of a plastic mulch film degrading fungus
- 微生物学报, 59(1): 56-67
- Acta Microbiologica Sinica, 59(1): 56-67
-
文章历史
- 收稿日期:2018-02-06
- 修回日期:2018-07-18
- 网络出版日期:2018-08-09
2. 广东省农业科学院作物研究所, 广东 广州 510640
2. Institute of Crops Research, Guangdong Academy of Agricultural Science, Guangzhou 510640, Guangdong Province, China
20世纪50年代塑料工业迅猛发展,日本及欧美等发达国家率先将地膜应用到农业生产中。地膜覆盖给农业生产力带来了很大飞跃,快速地推动了农业的现代化进程,尤其对恶劣生产土地有明显增产效果[1]。我国从20世纪70年代末引进塑料地膜覆盖栽培技术并开始进行相关研究,至2014年,我国地膜覆盖面积已达1.814×107 hm2,农用塑料薄膜用量高达2.58×106 t,地膜使用量达1.44×106 t[2],成为世界上塑料地膜使用最多的国家,同时我国也是世界上最大的地膜生产国。塑料地膜使用在促生和提高经济产量的同时,也给环境和生态带来了许多难以回避、难以解决的问题。塑料地膜的主要成分是聚乙烯(Polyethylene,PE),是一种线性饱和碳氢化合物,其基本结构为-[CH2CH2]-n,结构上和石蜡、长链烷烃相似[3],属于高分子量烷烃,是一种稳定性很好的聚合物,不易降解,使用后处理不当容易造成“白色污染”。薄农用地膜或者超薄农用地膜在使用过程中不好回收处理,人工成本高,很多时候都是使用后直接丢弃在土壤或者田间直接燃烧处理,对土壤环境、生态环境造成的污染问题日趋严重,不利于农业的可持续发展。目前地膜污染现象已受到广大学者的重视,通过借鉴他国经验以及结合我国实际情况,学者们提出许多对地膜污染防治的建议和措施,包括减少地膜使用、提高地膜回收率、“一膜多用”、可降解地膜研究和推广等,其中研制可降解地膜是相对环保可行、值得推行的措施之一。
目前在国内外可降解地膜的研究工作正有条不紊地进行,许多种类已经被应用到农业生产中,主要有非(或不完全)生物降解的光降解地膜、光生物双降解地膜和全生物降解的淀粉基生物降解地膜、聚酯类生物降解地膜等,其他还有植物纤维地膜、液态喷洒地膜等[4]。这些新型地膜类型中,有的属于降解不完全类型,被称为“假降解塑料”,其残留的PE小颗粒仍对土壤环境造成不可计量的伤害;有的存在使用成本高的缺点;有的存在使用范围限制和使用作物限制等缺点;即使是完全生物降解类地膜,成本高、降解过程复杂且需要土著微生物的参与以及其降解时间无确定性,限制了它的推广使用。上述新型地膜的使用限制因素,导致目前市场应用依然以传统的聚乙烯地膜为主,新型地膜为辅。为了解决地膜造成的“白色污染”问题,寻找能降解聚乙烯材料的微生物或快速降解全生物降解地膜的微生物显得尤为重要。
据相关文献报道[5],目前发现聚乙烯材料降解微生物主要有细菌和真菌,其中真菌又以霉菌为主,多为曲霉属真菌。Matsunaga等[6]报道黑曲霉(Aspergillus niger)、毛壳菌属(Chaetomium sp.)、瘤孢棒囊孢壳(Corynascus sepedonium)、镰刀菌属(Fusarium sp.)、拟青霉(Paecilomyces variotti)、葡萄穗霉属(Stachybotrys sp.)、木霉属(Trichoderma sp.)等真菌能利用经UV处理过的线性低密度聚乙烯地膜生长。Zahra等[7]发现烟曲霉菌(Aspergillus fumigatus)、土曲霉(A. terreus)、镰孢菌(Fusarium solani)能降解线性低密度聚乙烯薄膜。Khan等[8]发现宾曲霉(Aspergillus tubingensis)能降解聚酯类薄膜。其他真菌包括尖孢镰刀菌(Fusarium oxysporum)[9]、简青霉(Penicillium simplicissimum YK)等[10],真菌能降解的聚乙烯数均分子量范围从几百到几万不等[10]。细菌类降解菌有蜡样芽孢杆菌(Bacillus cereus)、玫瑰红红球菌(Rhodococcus rhodochrous)、假单胞菌(Pseudomonas spp.)、奈瑟氏球菌科(Neisseriaceae)、醋酸钙不动杆菌(Acinetobacter calcoaceticus)等,能够降解的聚乙烯数均分子量范围从几百到几千不等[10]。Santosh等[11]发现解淀粉芽孢杆菌(Bacillus amyloliquefaciens)能降解线性低密度聚乙烯薄膜。Yoshida等[9]发现Ideonella sakaiensis能完全降解聚对苯二甲酸乙二醇酯(PET)。高分子量聚乙烯降解菌鲜有报道。本研究分离到一株能降解聚乙烯材料的真菌(桔青霉Penicillium citrinum PT1),发现其能降解重均分子量为400000的高分子量聚乙烯粉末,能快速降解聚酯类生物降解地膜(黑色膜、透明膜),能侵蚀降解传统聚乙烯地膜(透明膜),研究同时探讨了桔青霉PT1对常用农用地膜的降解能力,为利用微生物降解农用地膜提供素材。
1 材料和方法 1.1 聚乙烯材料重均分子量(Mw)2000和400000的聚乙烯粉末(中国石油化工股份有限公司茂名分公司);聚酯类生物降解地膜(广东省生物工程研究所);传统聚乙烯地膜(东莞全球环保科技有限公司)。
1.2 培养基 1.2.1 基础无机盐液体培养基[5](g/L): K2HPO4 0.7,KH2PO4 0.7,MgSO4·7H2O 0.7,NH4NO3 1.0,NaCl 0.005,FeSO4·7H2O 0.002,ZnSO4·7H2O 0.002,MnSO4·H2O 0.001,自然pH。 1.2.2 基础无机盐固体培养基[5](g/L): 在基础无机盐液体培养基中添加1.7%的琼脂粉。 1.2.3 聚乙烯粉末降解菌筛选培养基(g/L): 基础无机盐平板培养基中添加一定量聚乙烯粉末。 1.2.4 马铃薯葡萄糖琼脂培养基(PDA,g/L)[5]: 马铃薯200,葡萄糖20,琼脂17,自然pH。 1.3 聚乙烯材料灭菌聚乙烯粉末灭菌方法:将2种分子量(2000,400000)的聚乙烯粉末分别置于干燥无菌不锈钢盘中,平铺成薄层,超净台紫外灯下共照射4 h,间隔约0.5 h翻动1次。
聚酯类生物降解地膜和传统聚乙烯地膜灭菌方法:将地膜裁剪为9 cm×9 cm和12 cm×2 cm大小膜条,3% KCl溶液(已灭菌)浸泡30 min以上(浸泡过程需要搅动,利于消毒充分),无菌水冲洗3次后,酒精浸泡15 min (浸泡过程需要搅动,利于消毒充分),无菌水冲洗3次,无菌滤纸吸干表面水分,超净台风干,紫外灯照射0.5 h。
1.4 聚乙烯粉末降解菌的分离与筛选初筛:分别称取1 g重均分子量(Mw)为2000和400000的聚乙烯粉末(聚乙烯粉末事先暴露在自然环境中7 d),超净工作台上将该粉末均匀洒于基础无机盐培养基平板上,30 ℃培养3–7 d。
挑取能在聚乙烯粉末上生长的菌株,在固体培养基上划线获取单菌落,4 ℃保存备用。
复筛:将上述分离的菌株分别接种到含重均分子量(Mw)为2000和400000的聚乙烯粉末(5 g/L)、传统聚乙烯膜条及聚酯类生物降解地膜条(黑色膜、透明膜)的液体无机盐培养基中,150 r/min、30 ℃摇床培养,观察菌株对聚乙烯粉末和膜条的降解情况,筛选获有效降解菌株。
1.5 聚乙烯粉末降解菌鉴定 1.5.1 形态观察: 将分离的菌株在PDA平板上划线培养3–5 d,观察菌株的生长状态并拍照,同时取生长期为4 d的目的菌株通过高分辨场发射扫描电子显微镜进行观察。 1.5.2 分子鉴定: 将上述筛选到的菌株用上海生工柱式真菌基因组DNA抽提试剂盒提取基因组总DNA,采用ITS通用引物ITS5 (5′-GGAAGTAA AAGTCGTAACAAGG-3′)和ITS4 (5′-TCCTCCGC TTATTGATATGC-3′)扩增ITS1-5.8S-ITS2片段。PCR反应体系为25 μL;反应条件为:94 ℃ 5 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 60 s、35个循环,72 ℃ 5 min,4 ℃保存[12]。经1%琼脂糖凝胶电泳检测PCR产物,PCR扩增产物送华大基因(广州)进行DNA序列测定。测序结果利用BLAST在GenBank基因库中进行同源性比较并进行鉴定。利用MEGA 7进行基因序列的比对与系统发育树的构建(采取Neighbor-Joining法,Bootstrap value为1000)。 1.6 菌株聚乙烯材料效果研究 1.6.1 菌株对不同分子量聚乙烯粉末降解效果: 250 mL三角烧瓶中加入100 mL基础无机盐培养基,灭菌备用,无菌条件下添加2种分子量(2000,400000)聚乙烯粉末(已灭菌),添加量为5 g/L。接种环接入目的菌株,150 r/min、30 ℃摇床培养,观察聚乙烯粉末的变化情况。(1)参考复筛时Mw 2000和400000的聚乙烯粉末在目的菌株作用下的变化情况,定期(1、3、5、10、15 d)收集摇瓶内聚乙烯粉末含量,计算聚乙烯粉末的减少量;(2)每7 d采集降解效果影像。每种分子量聚乙烯粉末设置3个重复,以不接菌为对照。 1.6.2 菌株对传统聚乙烯地膜的降解效果: 无菌条件下,将目的菌株接种到含传统聚乙烯地膜的液体基础无机盐培养基中,150 r/min、30 ℃摇床培养,培养到45 d和100 d后,经扫描电子显微镜(HITACHI S-3400N)观察地膜变化情况,检测目的菌株对地膜的降解效能;另外取样将地膜表面菌体在自来水下冲洗干净后,自然风干,经傅里叶变换红外光谱仪(VERTEX 70)扫描估测地膜降解情况,以不接菌为对照,试验设置3个重复。 1.6.3 菌株对聚酯类生物降解地膜的降解效果: 无菌条件下,将目的菌株接种到含聚酯类生物降解地膜的液体基础无机盐培养基中,150 r/min、30 ℃摇床培养,观察地膜变化情况,培养至7 d,将地膜碎片经常规固定等处理后,在高分辨场发射扫描电子显微镜观察,检测目的菌株对地膜的降解效能。另外,按上述方法进行培养,分别在7 d、14 d、21 d、28 d和35 d测定地膜的失重率。试验设置3个重复,以不接菌为对照。失重率按公式(1)计算。

|
公式(1) |
28 ℃恒温培养4 d后发现,铺有重均分子量为2000的线性低密度聚乙烯粉末的平板上有真菌生长(图 1-A),6 d后分离、纯化得到5株真菌,分别命名为PT1、PT2、PT3、PT4和PT5菌株。将5株真菌分别接种至含重均分子量为2000和400000的聚乙烯粉末、聚酯类生物降解膜条(黑色膜、透明膜)及传统聚乙烯膜条的液体基础无机盐培养基,150 r/min、30 ℃摇床培养,定期观察聚乙烯粉末和膜条降解情况。5 d后发现PT1菌株已能很好地利用聚乙烯粉末(图 1-C、E),7 d后PT1菌株已将聚酯类生物降解膜条表面覆盖,膜条出现穿孔或断裂情况(图 2-B、D),其他4株真菌虽能利用粉末和聚酯类生物降解膜条生长,但生长速度缓慢,覆盖面小;7 d后观察5株真菌对传统聚乙烯膜条的利用情况并不明显;所以本试验选取PT1作为目的菌株开展后续试验。

|
| 图 1 聚乙烯粉末形态及与PT1菌株共培养后效果图 Figure 1 Polyethylene powder form and its efficiency of co-culture with PT1 strain. A: the fungi on the plate with polyethylene powder; B: polyethylene powder form (Mw=2000) in a shake flask after 5 days with no strain; C: degradation efficiency of polyethylene powder (Mw=2000) by PT1 stain after 5 days; D: polyethylene powder form (Mw=400000) in a shake flask after 5 days with no strain; E: degradation efficiency of polyethylene powder (Mw=400000) by PT1 stain after 5 days. |
|
| 图 2 PT1菌株降解黑色、透明聚酯类生物降解地膜的效果图 Figure 2 Degradation efficiency of black and white biodegradable polyester films by PT1 strain. A: black polyester biodegradable film form in a tube after 7 days with no strain; B: degradation efficiency of black polyester biodegradable film by PT1 strain after 7 days; C: white polyester biodegradable film form in a tube after 7 days with no strain; D: degradation efficiency of white polyester biodegradable film by PT1 stain after 7 days. |
2.2 聚乙烯粉末降解菌的鉴定
聚乙烯材料降解菌PT1菌株在PDA固体培养基上的菌落由中心白色慢慢变为灰绿色(图 3-A),扫描电镜下可见分生孢子梗有横隔,顶端生有扫帚状的分生孢子头(图 3-B),分生孢子表面粗糙(图 3-C)。PT1菌株经ITS1-5.8S-ITS2基因片段进行分子鉴定,得到其片段基因序列长度为548 bp (GenBank:MF991147),该菌株与青霉属菌株CF18的KM979730的ITS序列同源性均为99%,构建PT1菌株系统发育树,归于青霉属(Penicillium)桔青霉(Penicillium citrinum)分枝(图 4),结合培养形态特性可以初步确定聚乙烯材料降解菌PT1为桔青霉P. citrinum。

|
| 图 3 PT1菌株的形态特征 Figure 3 Characteristics of PT1 strain. A: colony morphology of PT1 strain on PDA medium; B: conidiophore morphology under the scanning electron microscopy; C: conidia morphology under the scanning electron microscopy. |

|
| 图 4 聚乙烯材料降解菌PT1菌株系统发育树 Figure 4 Phylogenetic tree of polyethylene degradation PT1 strain. The GenBank accession numbers are given in parentheses. The number at each branch points is the percentage supported by bootstrap. Bar 0.05 at the bottom is the sequence divergence. |
2.3 桔青霉PT1对聚乙烯材料的降解效果 2.3.1 桔青霉PT1对聚乙烯粉末降解效果: 结果如图 5所示,桔青霉PT1能以重均分子量2000和400000的聚乙烯粉末为碳源迅速生长,并将其降解。从图 5可知,桔青霉PT1更易利用重均分子量为2000的聚乙烯粉末,第7天溶液已经十分浑浊(图 5-A),14 d明显看见三角摇瓶壁上有菌体(图 5-B),此时的扫描电镜图片显示聚乙烯粉末表面完全被菌体覆盖、有大量碎片产生(图 5-G),共培养试验进行到63 d时瓶内几乎看不到聚乙烯粉末(图 5-C);相对而言,桔青霉PT1对重均分子量为400000的聚乙烯粉末利用速度略慢,14 d时摇瓶内溶液浑浊(图 5-E),经扫描电镜图片可以观察到此时的聚乙烯粉末被菌体完全包裹,并且表面有碎片产生(图 5-H),试验进行到63 d时有少量聚乙烯粉末残留(图 5-F)。

|
| 图 5 桔青霉PT1对聚乙烯粉末降解效果图示 Figure 5 Degradation efficiency of polyethylene powder by P. citrinum PT1 strain. A: degradation efficiency of polyethylene powder (Mw=2000) by PT1 strain after 7 days; B: degradation efficiency of polyethylene powder (Mw=2000) by PT1 strain after 14 days; C: degradation efficiency of polyethylene powder (Mw=2000) by PT1 strain after 63 days; D: degradation efficiency of polyethylene powder (Mw=400000) by PT1 strain after 7 days; E: degradation efficiency of polyethylene powder (Mw=400000) by PT1 strain after 14 days; F: degradation efficiency of polyethylene powder (Mw=400000) by PT1 strain after 63 days; G: SEM figure of degradation efficiency of polyethylene powder (Mw=2000) by Penicillium citrinum PT1 strain after 14 days; H: SEM figure of degradation efficiency of polyethylene powder (Mw=400000) by Penicillium citrinum PT1 strain after 14 days. |
2.3.2 桔青霉PT1降解聚乙烯粉末量的变化: 桔青霉PT1降解摇瓶内聚乙烯粉末(Mw 2000和Mw 400000)而导致聚乙烯粉末减少。桔青霉PT1能快速利用Mw 2000的聚乙烯粉末生长并将其包裹,实验进行至15 d左右,粉末与桔青霉PT1菌球已经生长在一起,无法很好地分离,为保证该实验数据的准确性,Mw 2000的聚乙烯粉末减少量仅测定至15 d,聚乙烯粉末随着培养时间延长,粉末减少量上升(图 6);桔青霉PT1降解Mw 400000的聚乙烯粉末实验进行至20 d后,聚乙烯粉末被桔青霉PT1菌体包裹,不能很好地将菌体和粉末分离,为保证试验的真实性,该数据止于20 d,聚乙烯粉末随着培养时间延长,粉末减少量上升(图 6);对照组(未接菌)聚乙烯粉末量没有发生改变。Mw 2000和Mw 400000聚乙烯粉末原始重量均为3 g。

|
| 图 6 随培养时间延长聚乙烯粉末量的变化 Figure 6 Variation of polyethylene powder with the culture time. Error bars are standard deviation from triplicate. PT1 (2000) means polythylene powder of Mw=2000 with P. citrinum. PT1 (400000) means polythylene powder of Mw=400000 with P. citrinum. CK (2000) means polythylene powder of Mw=2000 with no P. citrinum. CK (400000) means polythylene powder of Mw=400000 with no P. citrinum. |
2.3.3 桔青霉PT1对传统聚乙烯地膜降解电镜观察结果: 桔青霉PT1与传统聚乙烯地膜共培养过程中,发现该菌能附着在传统聚乙烯地膜表面生长且生长状态良好,肉眼观察可见传统聚乙烯地膜保留基本形状,于是试验通过扫描电镜对其进行观察,图 7-B为试验进行至100 d时高分辨场发射电镜扫描传统聚乙烯地膜表面照片,放大600倍后明显可见桔青霉PT1附着在该传统聚乙烯地膜上,放大1500倍可以清晰看到桔青霉PT1菌丝侵蚀到地膜内使地膜产生了碎片(图 7-C),同期培养对照组地膜(未接桔青霉PT1)放大600倍观察发现表面无碎片产生(图 7-A),由此可见桔青霉PT1能侵蚀降解传统聚乙烯地膜。

|
| 图 7 不同处理条件下传统聚乙烯地膜的高分辨场发射扫描效果图 Figure 7 Scanning electron microscope images of traditional polyethylene film by different treatment. A: scanning electron microscope images of traditional polyethylene film treated by no P. citrinum PT1 strain. B, C: scanning electron microscope images of refractory polyethylene film by P. citrinum PT1 strain last for 100 days. |
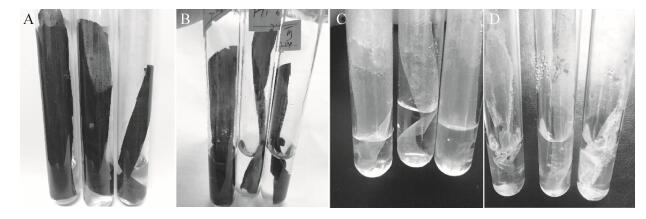
2.3.4 桔青霉PT1对传统聚乙烯地膜降解红外扫描结果: 图 8是未经桔青霉PT1培养处理的传统聚乙烯地膜以及桔青霉PT1培养处理45 d、100 d后传统聚乙烯地膜红外图谱。发现处理45 d样品红外图谱与未经处理样品差异不明显,仅表现在2900 cm–1附近的伸缩振动峰和1465 cm–1附近的弯曲振动峰的宽度差异以及位置偏移,其中45 d样品图谱峰表现得略窄,推测此处的特征官能团数量已减少,已知传统聚乙烯地膜原材料主要是聚乙烯,是一种线性饱和碳氢化合物,峰宽度差异间接说明此时桔青霉PT1已在攻击利用传统聚乙烯地膜而导致C-H含量减少的结果[6]。处理100 d样品红外图谱与未经处理样品图谱差异明显,主要表现在一些波长峰的消减,消失的振动峰主要有670 cm–1、875 cm–1、1738 cm–1和3638 cm–1等,在2900 cm–1附近的伸缩振动峰、1465 cm–1附近的弯曲振动峰、1020 cm–1和730 cm–1等振动峰的明显削弱和位置偏移,其中削弱的2900 cm–1附近表征是聚乙烯C-H伸缩振动特征峰,1465 cm–1和730 cm–1表征的是C-H面内弯曲振动峰,该实验组与对照组红外图谱的差异表明桔青霉PT1具有降解传统聚乙烯地膜的能力。
|
| 图 8 不同处理条件下的传统聚乙烯地膜的红外图谱 Figure 8 FTIR spectrogram of polyethylene films incubation with P. citrinum PT1 for 100 days, 45 days and no P. citrinum PT1 treated sample, respective (From up to down). |
2.3.5 桔青霉PT1对聚酯类生物降解地膜降解电镜观察结果: 聚酯类生物降解黑色膜与桔青霉PT1共培养7 d已从整张膜变成细碎片(图 9-A右),说明桔青霉PT1能快速降解聚酯类生物降解黑色膜;扫描电镜下观察,此时聚酯类生物降解黑色膜已出现明显的裂痕和穿孔(图 10-B),未经桔青霉PT1处理的聚酯类生物降解黑色膜表面未见裂痕或穿孔(图 10-A)。聚酯类生物降解透明膜与桔青霉PT1共培养7 d整张膜部分被降解成细条(图 9-B右),扫描电镜下观察,聚酯类生物降解透明膜表面出现穿孔以及横竖裂痕(图 10-D)。聚酯类生物降解黑色、透明地膜与桔青霉PT1继续培养至12 d后,摇瓶中出现了粉末状颗粒(图 9-B/D),地膜逐渐被桔青霉PT1向更彻底的方向降解。

|
| 图 9 桔青霉PT1降解聚酯类生物降地膜效果图 Figure 9 Degradation efficiency of black and transparent biodegradable polyester films by Penicillium citrinum PT1 strain. A: P. citrinum PT1 co-cultured with polyester biodegradable black membrane for 7 days (left: no P. citrinum PT1, right: treated by P. citrinum PT1); B: P. citrinum PT1 co-cultured with polyester biodegradable black membrane for 12 days; C: P. citrinum PT1 co-cultured with polyester biodegradable transparent membrane for 7 days (left: no P. citrinum PT1, right: treated by P. citrinum PT1); D: P. citrinum PT1 co-cultured with polyester biodegradable transparent membrane for 12 days. |
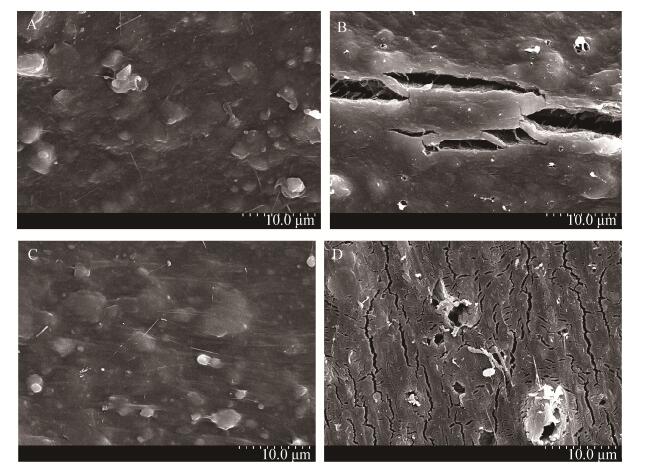
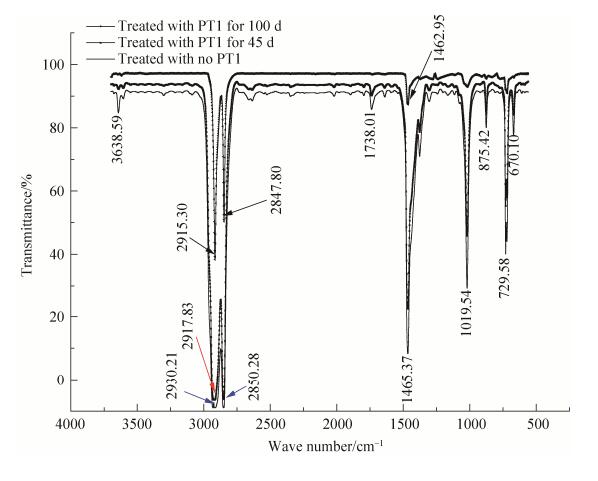
|
| 图 10 桔青霉PT1降解聚酯类生物降解黑色、透明地膜电镜扫描效果图 Figure 10 Scanning electron microscope images of black and white biodegradable polyester films. A: treated by nothing of balck biodegradable polyester films; B: treated by PT1 of black biodegradable polyester films last for 7 days; C: treated by nothing of white biodegradable polyester films; D: treated by PT1 of white biodegradable polyester films last for 7 days. |
2.3.6 聚酯类生物降解地膜失重率: 将桔青霉PT1孢子液接种到含聚酯类生物降解地膜的液体基础无机盐培养基中,150 r/min、30 ℃摇床培养,观察地膜变化情况。结果显示,桔青霉PT1能利用聚酯类生物降解黑色、透明地膜生长,随着共培养时间延长,地膜的失重率逐步上升(图 11)。总体来说,桔青霉PT1对黑膜降解速度高于透明膜,培养35 d聚酯类生物降解黑色、透明地膜失重率分别达到56.57%和46.38%。

|
| 图 11 桔青霉PT1降解聚酯类生物降解黑色、透明地膜失重率 Figure 11 Weight loss of black and transparent polyester biodegradable film treated by PT1 strain. Error bars are standard deviation from triplicate. Black means black polyester biodegrade biofilm. Transparent means transparent polyester biodegrade biofilm. |
3 讨论
本研究获得一株聚乙烯材料降解真菌——桔青霉(Penicillium citrinum) PT1,菌株PT1能侵蚀降解重均分子量为2000和400000聚乙烯粉末、聚酯类生物降解地膜(黑色膜、透明膜)以及传统聚乙烯地膜(透明膜)。桔青霉是一类营腐生生活的真菌,是自然界中生物有机成分的重要分解者之一,隶属于子囊菌门(Ascomycota)、散囊菌纲(Eurotiomycetes)、散囊菌目(Eurotiales)、发菌科(Trichocomaceae)、青霉属(Penicillium)。已有研究发现桔青霉具有降解煤炭、木质素、纤维素等的能力[13]、高产工业核酸酶P1[14]、降解芳香环杀虫剂毒虫畏[15]以及分泌生物物质抑制肿瘤细胞增殖[14]等能力。据已有报道[5],聚乙烯材料降解真菌主要为曲霉属真菌。笔者未查到桔青霉降解聚乙烯类材料的相关报道。
微生物降解地膜通常经历附着或黏附、菌丝生长繁殖和产酶降解等几个步骤[10]。目的菌株桔青霉PT1降解聚酯类生物降解地膜(黑色膜、透明膜)和传统聚乙烯地膜试验也基本遵循了这几个步骤,本研究所有试验从菌株黏附地膜表面、菌株利用地膜生长至地膜被降解的过程,均在寡营养条件下进行,其中聚酯类生物降解地膜的降解效果显著,7 d时间聚酯类生物降解地膜被降解为碎片,14 d地膜变成了碎末,35 d时失重率达50%左右;Khan等[8]发现的宾曲霉在MSM额外添加2%葡萄糖的培养条件下,经过60 d时间可将聚酯型聚氨酯地膜降解成碎片。研究人员拟参考Khan等[8]报道的宾曲霉降解聚酯型聚氨酯地膜试验,从优化菌株的培养条件(培养基不同pH值、添加表面活性剂、尝试不同碳源氮源以及不同的培养温度等)、探讨作用水解酶类和优化产酶能力等方向深入挖掘该菌株对其他聚乙烯类材料的降解潜能。同样可以参考Merina等[11]的方法,对地膜进行一定的预处理或在地膜菌株共培养试验中添加生长旺盛期菌液,以保证作用菌株的活力。Merina等[11]将低密度聚乙烯粉末和地膜经二甲苯或酒精预处理以及高温烘干后,加入两种目标菌液(3 mL)经过60 d作用后,发现低密度聚乙烯地膜分别被降解了11%和16%。各国研究者在针对菌株与聚乙烯材料作用时选择添加营养液或者加入生长状态良好目的菌株,共同目的都是给菌株提供好的生长条件以更好发挥目的菌株的降解功能。目前虽然报道降解聚乙烯的主要微生物类群很多,但尚未发现只催化聚乙烯特定底物的酶[3]。以往研究报道降解聚乙烯主要的酶有胞外水解酶、双加氧酶、单加氧酶、漆酶和脂肪酸氧化酶类等[5]。
近期Yoshida等[9]详尽地报道一株高效降解聚对苯二甲酸乙二醇酯的细菌(Ideonella sakaiensis)和相关降解机制,该试验研究发现Ideonella sakaiensis细菌是通过分泌两种酶类PETase (ISF6-4831和ISF6-0224)经过6个星期将一块PET (聚对苯二甲酸乙二酯)薄片完全降解成简单的分子结构。塑料垃圾是我们全球人类都必须要面对的大问题,它的降解周期很长,该研究发现或为后期开发新方法来处理每年全球产生的超过数千万吨特殊类型的塑料垃圾提供了一定思路。本试验目的菌株桔青霉PT1能侵蚀降解聚乙烯材料,在寡营养条件下,60 d几乎能将Mw为400000的低密度聚乙烯粉末完全降解,100 d后使得传统聚乙烯地膜结构发生了较大的改变(图 8),这样的实验条件下桔青霉PT1对聚乙烯材料的降解速度偏慢,但是依然是人类对抗塑料的战争中的希望。桔青霉PT1与传统聚乙烯地膜共培养实验可以通过改善菌株降解地膜的培养条件等方式来提高它的降解能效,同时了解降解聚乙烯材料作用的水解酶类将有利于推测聚乙烯生物降解产物以及降解机制,能为揭示聚乙烯材料环保降解提供方向。桔青霉PT1是一株可降解聚乙烯材料的真菌,深入挖掘其在降解聚乙烯材料方面应用潜力,将为农业环保领域增光添彩。
| [1] | 吴国. 环境降解地膜降解产物对作物生长代谢及土壤关键酶活性的影响. 四川师范大学硕士学位论文, 2013. |
| [2] | 国家统计局农村社会经济调查司. 中国农村统计年鉴. 北京: 中国统计出版社, 2015: 41. |
| [3] |
Yang J, Song YL, Qin XY. Biodegradation of polyethylene. Environmental Science, 2007, 28(5): 1165-1168.
(in Chinese) 杨军, 宋怡玲, 秦小燕. 聚乙烯塑料的生物降解研究. 环境科学, 2007, 28(5): 1165-1168. DOI:10.3321/j.issn:0250-3301.2007.05.041 |
| [4] | 胡宏亮.生物降解地膜的产量效应和降解特性及大田示范研究.浙江大学硕士学位论文, 2015. |
| [5] | 罗贝旭.聚乙烯降解菌的筛选、鉴定和降解特性的研究.四川师范大学硕士学位论文, 2013. |
| [6] | Matsunaga M, Whitney PJ. Surface changes brought about by corona discharge treatment of polyethylene film and the effect on subsequent microbial colonisation. Polymer Degradation and Stability, 2000, 70(3): 325-332. DOI:10.1016/S0141-3910(00)00105-1 |
| [7] | Zahra S, Abbas SS, Mahsa MT, Mohsen N. Biodegradation of low-density polyethylene (LDPE) by isolated fungi in solid waste medium. Waste Management, 2010, 30(3): 396-401. DOI:10.1016/j.wasman.2009.09.027 |
| [8] | Khan S, Nadir S, Shah ZU, Shah AA, Karunarathna SC, Xu JC, Khan A, Munir S, Hasan F. Biodegradation of polyester polyurethane by Aspergillus tubingensis. Environmental Pollution, 2017, 225: 469-480. DOI:10.1016/j.envpol.2017.03.012 |
| [9] | Yoshida S, Hiraga K, Takehana T, Taniguchi I, Yamaji H, Maeda Y, Toyohara K, Miyamoto K, Kimura Y, Oda K. A bacterium that degrades and assimilates poly(ethylene terephthalate). Science, 2016, 351(6278): 1196-1199. DOI:10.1126/science.aad6359 |
| [10] |
Luo Q, Peng C, Ye BP. New advances in research of the genus Penicillium. Pharmaceutical Biotechnology, 2016, 23(5): 452-456.
(in Chinese) 罗清, 彭程, 叶波平. 青霉属真菌研究新进展. 药物生物技术, 2016, 23(5): 452-456. |
| [11] | Das MP, Kumar S. An approach to low-density polyethylene biodegradation by Bacillus amyloliquefaciens. 3 Biotech, 2015, 5(1): 81-86. DOI:10.1007/s13205-014-0205-1 |
| [12] | Yan JY, Xie Y, Zhang W, Wang Y, Liu JK, Hyde KD, Seem RC, Zhang GZ, Wang ZY, Yao SW, Bai XJ, Dissanayake AJ, Peng YL, Li XH. Species of Botryosphaeriaceae involved in grapevine dieback in China. Fungal Diversity, 2013, 61(1): 221-236. DOI:10.1007/s13225-013-0251-8 |
| [13] | 曲小爽.高效桔青霉纤维素分解菌筛选及酶学初探.东北农业大学硕士学位论文, 2009. |
| [14] | Liu QY, Zhou T, Zhao YY, Chen L, Gong MW, Xia QW, Ying MG, Zheng QH, Zhang QQ. Antitumor effects and related mechanisms of penicitrinine A, a novel alkaloid with a unique spiro skeleton from the marine fungus Penicillium citrinum. Marine Drugs, 2015, 13(8): 4733-4753. DOI:10.3390/md13084733 |
| [15] | Oliveira BR, Penetra A, Cardoso VV, Benoliel MJ, Barreto Crespo MT, Samson RA, Pereira VJ. Biodegradation of pesticides using fungi species found in the aquatic environment. Environmental Science and Pollution Research, 2015, 22(15): 11781-11791. DOI:10.1007/s11356-015-4472-0 |
 2019, Vol. 59
2019, Vol. 59