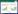中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李新新, 柏映国, 华晨, 马锐, 石鹏君, 罗会颖, 姚斌. 2019
- Li Xinxin, Bai Yingguo, Hua Chen, Ma Rui, Shi Pengjun, Luo Huiying, Yao Bin. 2019
- 毕赤酵母表达的嗜热蓝状菌β-葡萄糖苷酶N-糖基化修饰的作用与功能
- Effect of N-glycosylation on enzymatic properties of β-glucosidase from Talaromyce leycettanus
- 微生物学报, 59(1): 37-47
- Acta Microbiologica Sinica, 59(1): 37-47
-
文章历史
- 收稿日期:2018-01-25
- 修回日期:2018-03-21
- 网络出版日期:2018-04-03
自然界中纤维素降解需要通过一系列的纤维素降解酶系协同作用实现,主要包括内切葡聚糖酶(endo-gluconate,EG)、外切纤维素酶(cellobiohydrolase,CBH)和β-葡萄糖苷酶(β-glucosidase,BG)[1-2]。其中,β-葡萄糖苷酶在纤维素降解酶系中扮演着重要角色。β-葡萄糖苷酶(EC3.2.1.21)是能特异性地催化水解低聚糖(通常2–6个单糖残基)、烷基和芳香族羟基末端非还原性的β-D-葡萄糖苷键,从而释放葡萄糖单糖分子和相应配基的糖苷水解酶(glycoside hydrolase,GH)类的总称,又称β-D-葡萄糖苷葡萄糖水解酶[3]。在纤维素降解过程中,β-葡萄糖苷酶能够高效地作用于内切葡聚糖酶和外切纤维素酶降解纤维素的产物(纤维二糖或着纤维寡糖),而进一步将纤维二糖降解为可利用的葡萄糖。由于可有效地消除纤维二糖对外切纤维素酶的产物抑制作用,从而提高整体纤维素酶的催化效率,β-葡萄糖苷酶也被称为纤维素降解过程的关键限速酶[4]。因此,研究β-葡萄糖苷酶结构特征,寻找关键位点并理性改造,对提高β-葡萄糖苷酶降解纤维素效率至关重要。
对于β-葡萄糖苷酶的研究主要集中于微生物来源的β-葡萄糖苷酶,已有大量微生物来源的β-葡萄糖苷酶基因在原核或真核宿主中成功重组表达并进行了生化性质的测定。表达β-葡萄糖苷酶基因的原核宿主一般为大肠杆菌,但是由于其表达量低、纯化困难等问题,一般常选择真核表达宿主。毕赤酵母(Pichia pastoris)表达系统是近年来被公认最有效的外源蛋白真核表达系统之一,其具有诸多优点,被广泛用于生产重组蛋白,但是真核生物毕赤酵母表达蛋白通常存在糖基化修饰,N-糖基化是真核生物所特有的糖基化修饰[5-6]。同时N位糖基化也是蛋白糖基化类型最多的一种,它主要发生在内质网和高尔基体内,由糖基转移酶催化,是在内分泌蛋白和膜结合蛋白的天冬氨酸残基上结合寡糖的过程。N-乙酰氨基葡萄糖(GlcNAc)还原端与蛋白质肽链中Asn-X- Ser/Thr(其中X为除脯氨酸之外的任何氨基酸)结构的Asn的酰胺氮以β-1, 4糖苷键连接[7],少数情况下Asn-Xaa-Cys序列也作为糖基化位点。
N-糖基化修饰既可提高也可降低糖蛋白的稳定性,这取决于糖基化修饰发生的位置,当糖基化修饰发生在折叠有序的区域时,会减少其稳定性,而当糖基化修饰发生在混乱无序的位置时则会増加蛋白质的稳定性[8]。同时,也有很多报道表明N-糖基化会影响酶的活性和分泌,例如维生素K依赖型羧化酶[9]、隐球菌磷脂酶B[10]等。本文利用NetNGlyc 1.0 Server软件在线分析来源于嗜热真菌蓝状菌的β-葡萄糖苷酶Bgl3A基因中易发生N-糖基化修饰的潜在位点,利用定点突变技术,将β-葡萄糖苷酶潜在N-糖基化位点上最后一位氨基酸苏氨酸或者丝氨酸(T/S)用同为中性氨基酸的丙氨酸(A)取代。比较突变体表达的重组酶与野生酶的表达量、酶学性质以及催化效率方面的差异,进而探讨N-糖基化对嗜热蓝状菌来源β-葡萄糖苷酶的影响,为后续对GH 3家族的β-葡萄糖苷酶通过糖基化位点的改造以提高纤维素酶活性和热稳定性的定向进化提供理论依据。
1 材料和方法 1.1 材料 1.1.1 菌种和载体: 嗜热真菌蓝状菌(Talaromyces leycettanus JCM12802)购自日本微生物保存中心(Japan Collection of Microorganisms, JCM, http://jcm.brc.riken.jp/en/)。毕赤酵母Pichia pastoris GS115购自Invitrogen公司,大肠杆菌Escherichia coli Trans1-T1和质粒pEASY-T3购自北京全式金生物技术有限公司。实验所用重组载体pPIC9r-bgl3A为本实验室构建并保存。 1.1.2 试剂和仪器: 底物对硝基苯β-D-葡萄糖苷(p-nitrophenyl β-D-glucopyranoside,pNPG)和纤维二糖(cellobiose)购买自Sigma公司;FastPfu DNA聚合酶、HiFi高保真Taq酶购自北京全式金生物技术有限公司;限制性内切酶Dra Ⅰ购买自TaKaRa公司;Endo-H酶购自NEB公司;DNA琼脂糖凝胶回收试剂盒购自OMEGA公司;质粒小提中量试剂盒购自TianGen公司;蛋白定量试剂盒购自Bio-Rad公司;蛋白Marker购买于北京GeneStar生物公司;酵母浸提物、蛋白胨、氨苄青霉素(ampicillin,Amp)等其它化学试剂为进口或国产分析纯。引物由北京梓熙生物技术有限公司合成。PCR、电转仪和凝胶成像系统(美国Bio-Rad),高速冷冻离心机(日本HIMAC),酶标仪(美国Thermo),紫外分光光度计(日本JASO),HiTrap Q XL阴离子柱(美国GE),其他仪器及试剂均为国产。
1.2 主要培养基LB培养基:蛋白胨1.0%,酵母提取物0.5%,NaCl 1.0%;YPD培养基:酵母提取物1.0%,蛋白胨2.0%,葡萄糖2.0%;BMGY培养基:1.00%酵母提取物,2.00%蛋白胨,1.34% YNB,0.00004% Biotin,1.00%甘油(V/V),pH自然;BMMY培养基:除以0.5%甲醇代替甘油,其余成分均与BMGY相同,pH自然;MD培养基(固体):葡萄糖20.0 g/L,琼脂糖20.0 g/L,YNB 13.4 g/L,生物素4 mg/L。
1.3 在线软件分析β-葡萄糖苷酶Bgl3A中潜在N-糖基化位点利用在线N-糖基化预测网站(http://www.cbs.dtu.dk/services/NetNGlyc/)分析嗜热真菌蓝状菌来源的β-葡萄糖苷酶Bgl3A中潜在的天然N-糖基化修饰的位点,根据预测结果对N-糖基化位点构建突变体。
1.3.1 突变载体的构建: 利用定点突变技术将潜在的N-糖基化位点上(Asn-X-Ser/Thr)最后一个氨基酸(Ser/Thr)突变为Ala,突变后该位点将不能再发生N-糖基化修饰。以实验室构建并保存的重组质粒pPIC9r-bgl3A为模板,利用FastPfu DNA聚合酶通过上游引物和下游引物对质粒进行扩增。PCR反应体系(50 μL)如下:FastPfu buffer 10 μL,dNTPs 5 μL,硫酸镁5 μL,pPIC9r-Bgl3A质粒模板1 μL,引物F 1 μL,引物R 1 μL,FastPfu酶1 μL,ddH2O 28 μL。
PCR扩增程序为:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 5 min,34个循环;72 ℃ 10 min。本实验所用引物如下,该引物均利用Vector NTI软件设计见表 1,并由北京梓熙生物技术有限公司合成。
| Names | Sequences (5′→3′) |
| T44A-F | CTGAACAAGCTCAACCAGGCCGAGAAGGT |
| T44A-R | GGTGACGATACCAACCTTCTCGGCCTGGTTG |
| S228A-F | GCCTGGTCCTGTGAGAATGATGCTCTTCTCAAC |
| S228A-R | CTCAGTCTTCAACAGACCGTTGAGAAGAGCATCATT |
| S299A-F | CAGCACACCACGGTCAACAGCGCCAACTCG |
| S299A-R | AGGCATGGTCATATCGAGACCCGAGTTGGCGCTGTT |
PCR产物在1%琼脂糖凝胶上电泳,切下PCR产物中的目的条带并纯化,溶25 μL ddH2O,用DMT酶在37 ℃处理2 h后转化DMT感受态细胞,在含有100 μg/mL的氨苄青霉素的固体LB培养基平板上筛选获得阳性转化子。挑单克隆至600 μL含有100 μg/mL的氨苄青霉素的液体LB培养基上过夜培养,次日提取质粒并进行测序,将测序结果与pPIC9r-bgl3A比对以确定是否突变成功。
1.3.2 毕赤酵母重组菌株的构建: 将测序正确的突变体质粒进行单酶切(Dra Ⅰ)线性化,切胶回收后电击转化到GS115感受态细胞中,涂布至MD平板,30 ℃培养3 d。然后,挑取板上的单克隆于BMGY培养基中培养2 d,后更换至BMMY诱导培养基培养2 d,4500 r/min离心收集上清进行酶活的筛选。 1.3.3 重组β-葡萄糖苷酶的诱导表达和纯化: 将筛选出的酶活高的转化子在YPD进行培养16 h,接入到装有400 mL BMGY培养基的1 L三角瓶中,30 ℃、200 r/min摇床培养48 h。将菌液进行离心(6000 r/min,10 min),上清液去掉,然后加入200 mL BMGY培养基重悬菌体,30 ℃、200 r/min摇床培养,每12 h补加2 mL甲醇溶液,摇床培养48 h。将培养基上清液于12000 r/min离心10 min,弃菌体得到粗酶液后用30 kDa的膜包进行超滤浓缩。浓缩后的酶液用磷酸-柠檬酸缓冲液(pH 6.5)过夜透析进行脱盐处理。将处理后的酶液加入已平衡的HiTrap QXL阴离子柱,用0–1 mol/L的NaCl进行梯度洗脱,并用96孔板收集。对收集管中的β-葡萄糖苷酶活性进行测定,将有酶活的酶液收集,取7 μL进行N-糖基化的脱糖基处理(Endo-H),并进行SDS-PAGE检测。 1.3.4 重组β-葡萄糖苷酶活性的测定方法: pNPG底物酶活力测定反应步骤如下:250 μL 4 mmol/L pNPG底物与250 μL适当稀释的酶液,于75 ℃下反应10 min,加入1.5 mL 1 mol/L的Na2CO3终止反应,使用分光光度计测定OD405值。纤维二糖底物酶活力测定反应步骤如下:70 μL 4 mmol/L纤维二糖底物与70 μL适当稀释的酶液,于75 ℃下反应10 min,煮沸5 min终止反应,然后加入2.1 mL GOD显色液显色10 min,使用分光光度计测定OD520值。
酶活单位U的定义:在给定反应条件下,每分钟分解底物 pNPG生成1 μmol/L对硝基苯酚或分解纤维二糖底物生成1 μmol/L葡萄糖所需的酶量为1个β-葡萄糖苷酶活性单位(U)。
1.3.5 重组β-葡萄糖苷酶最适pH和温度的测定: 将pNPG底物加入100 mmol/L的柠檬酸-磷酸氢二钠缓冲液中,在不同pH条件(pH 3.0–5.0,间隔0.5个pH)下加入适当稀释倍数的酶液,于75 ℃反应10 min,设置3个平行及空白对照,根据测定结果绘制β-葡萄糖苷酶野生型以及各突变体(T44A/ S228A/S299A)的最适pH曲线。在pH 4.5的条件下将β-葡萄糖苷酶在不同温度(60–80 ℃,间隔5 ℃)下反应10 min测定酶活,设置3个平行和空白对照,根据测定结果绘制β-葡萄糖苷酶野生型以及各突变体(T44A/S228A/ S299A)的最适温度曲线。
1.3.6 重组β-葡萄糖苷酶温度稳定性的测定: 热力学稳定性:准备突变体与野生型β-葡萄糖苷酶蛋白,浓度0.15–0.20 mg/mL,体积500 μL,利用差量量热仪扫描各β-葡萄糖苷酶的Tm值。动力学稳定性:将稀释一定倍数的β-葡萄糖苷酶在60 ℃和70 ℃下分别保温处理10、20、30、40、50、60 min后,以pNPG为底物,在75 ℃、pH 4.5条件下测定其残余酶活力,设置3个平行和空白对照,以未处理的酶液作为对照(100%),根据测定结果,绘制各β-葡萄糖苷酶的热稳定性曲线。
1.3.7 重组β-葡萄糖苷酶不同底物动力学常数的测定: 葡萄糖苷酶动力学常数的反应时间为5 min,分别以不同浓度的pNPG和纤维二糖为底物,在各种酶最适pH的柠檬酸-磷酸氢二钠缓冲液体系中,最适温度下测定酶活性,测定结果根据双倒数作图法(Lineweaver-Burk法)计算酶促反应动力学常数Km和Vmax,进一步计算酶催化效率值kcat/Km。 1.3.8 重组β-葡萄糖苷酶同源建模与纤维二糖底物对接: 以一致性为73%的来源于里氏木霉Hypocrea jecorina第3家族β-葡萄糖苷酶Cel3A (PDB: 3ZYZ)为模板,通过Discovery Studio 2017 Client软件中的Macromolecules模块对野生型酶蛋白以及各突变体进行单模板同源建模,后利用Minimization工具和Verify 3D优化程序对模建结果进行能量最小化和结构优化。利用Small Molecules模块对纤维二糖底物优化,利用Receptor-Ligand Interections模块中Dock对β-葡萄糖苷酶和纤维二糖进行分子对接。 2 结果和分析 2.1 野生型葡萄糖苷酶N-糖基化位点的预测利用在线N-糖基化预测网站(http://www.cbs.dtu.dk/services/NetNGlyc/)分析嗜热真菌蓝状菌来源的β-葡萄糖苷酶Bgl3A蛋白序列,预测易发生天然N-糖基化修饰的位点。由表 2可知,Bgl3A中5个具有N-糖基化特征序列(Asn-Xaa-Ser/Thr)的位点,其中阈值超过0.5的有3个。因此,Bgl3A具有3个潜在的糖基化位点,分别为N42、N226和N297。并利用定点突变技术去除这些位点的糖基化,将N-糖基化序列的(Asn-X-Ser/Thr)最后一个氨基酸(Ser/Thr)突变为对蛋白构象影响最小的Ala。
| Position | Potential | Jury agreement | N-Glyc result |
| 42 NQTE | 0.6 | (8/9) | + |
| 226 NGSW | 0.6 | (8/9) | + |
| 297 NGSV | 0.5 | (6/9) | + |
| 434 NITT | 0.4 | (5/9) | – |
| 591 NITP | 0.1 | (9/9) | – |
2.2 三种重组突变体与野生型蛋白的表达与纯化
将构建成功的突变体在毕赤酵母中表达。通过酶活初筛,成功挑取高酶活的转化子并进行摇瓶诱导。粗酶液经过浓缩、脱盐、阴离子交换柱等步骤进行蛋白纯化后,通过SDS-PAGE验证其蛋白分子量大小及其纯度(图 1-A),并用内切β-N-乙酰氨基葡萄糖苷酶H(Endo-β-N-acetylglucosaminidase H,Endo H)处理,切割与糖肽和酶蛋白的天冬氨酸残基连接的寡聚糖。

|
| 图 1 β-葡萄糖苷酶的SDS-PAGE分析 Figure 1 SDS-PAGE analysis of purified recombinant β-glucosidase. A: lane 1: Bgl3A wild-type; lane 2; T44A; lane 3; S228A; lane 4; S299A. B: 1A/2A/3A/4A treated by Endo H, respectively. |
如图 1-A所示,纯化后的各β-葡萄糖苷酶突变体在约75 kDa处出现蛋白条带,并且β-葡萄糖苷酶由于潜在N-糖基化位点不同,使突变体蛋白条带存在差异。其中T44A和S299A突变体的蛋白条带与野生型Bgl3A相似,而S228A蛋白条带在蛋白浓度方面发生明显变化,浓度远小于T44A、S299A和野生型Bgl3A。对T44A、S299A和Bgl3A的酶液进行不同程度的稀释,同时对S228A酶液进行浓缩。然后用Endo H对各突变体进行处理,如图 1-B所示,各突变体大小基本一致,处理后的蛋白的分子量均在70 kDa左右。
2.3 三种重组突变体与野生型Bgl3A的比较 2.3.1 最适pH、最适温度比较: β-葡萄糖苷酶的最适作用pH为4.0 (图 2-A),在pH 4.0–4.5具有较高酶活。其中T44A、S299A与野生型Bgl3A一致,最适pH没有发生变化,并且在pH 4.5能够保持50%左右的相对酶活力。S228A最适pH发生轻微变化,为4.5,在pH 4.0能够保持70%左右的相对酶活力。
|
| 图 2 重组葡萄糖苷酶Bgl3A野生型以及突变体酶学性质 Figure 2 Enzymatic properties of wild-type and mutants of recombinant β-glucosidase Bgl3A. A: Effect of pH on enzyme activity; B: Effect of temperature on enzyme activity. Each value in the panel represents the mean±SD (n=3). |
β-葡萄糖苷酶为中高温酶,最适温度为75 ℃。其中T44A、S299A与野生型Bgl3A一致,最适温度均为75 ℃,S228A最适温度为70 ℃ (图 2-B)。在60 ℃和75 ℃也均有50%左右的相对酶活。
2.3.2 稳定性比较(热力学稳定性和动力学稳定性): 表 3结果表明2个突变体T44A、S299A的热力学稳定性略高于野生型(S228A由于蛋白分泌过低,未测定),其中T44A、S299A的Tm分别较野生型Bgl3A提高0.3 ℃、0.7 ℃。| Enzyme | Wild-type | T44A | S299A |
| Tm | 60.1 | 60.4 | 60.8 |
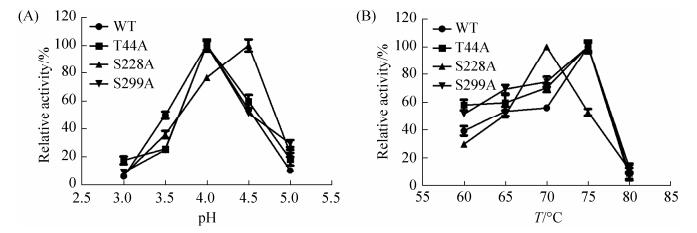
突变体的动力学稳定性优于野生型(图 3),突变体T44A和S299A在70 ℃处理60 min后,仍能残余50%左右的相对酶活力,而野生型Bgl3A在70 ℃处理20 min后,残余酶活力仅剩不足20%。
|
| 图 3 重组Bgl3A野生型以及突变体热动力学稳定性 Figure 3 Thermo dynamic stability of recombinant Bgl3A wild-type and mutants. Each value in the panel represents the mean±SD (n=3). |
2.3.3 动力学参数比较: 在最适反应条件下测定毕赤酵母表达的野生型Bgl3A和3个突变体的酶促反应动力学参数。如表 4所示,整体来讲,N-糖基化修饰位点的突变对酶的催化能力有明显影响。
| Substrate | Enzymes | Km/(mmol/L) | Vmax/μmol/(min·mg)] | kcat/(/s) | kcat/Km/[s/(mMol/L] |
| pNPG | Wild-type | 1.0±0.0 | 12451±235 | 16227±306 | 15339±361 |
| T44A | 2.73±0.20 | 9664±516 | 12596±67 | 4611±68 | |
| S228A | 4.48±1.40 | 230±61 | 300±80 | 67±4 | |
| S299A | 0.17±0.00 | 1766±63 | 2302±83 | 13120±203 | |
| Cellobiose | Wild-type | 17.9±2.7 | 1218±127 | 1587±165 | 89±4 |
| T44A | 21.0±3.2 | 1384±161 | 1803±210 | 84±2 | |
| S228A | – | – | – | – | |
| S299A | 11.4±5.0 | 1772±186 | 1963±621 | 183±3 |
对pNPG底物,突变体T44A、S228A以及S299A的催化能力均降低,分别为4611 mmol/(s·L)、67 mmol/(s·L)和13120 mmol/(s·L)。其中突变体T44A的Km为2.73 mmol/L,提高至野生型Bgl3A的2.6倍,说明其亲和能力下降。另外,Vmax和kcat数值相比Bgl3A也有所下降,导致其催化能力(kcat/km)仅为野生型Bgl3A的30%;S299A亲和力km为0.17 mmol/L,较野生型Bgl3A提高5倍。但其Vmax和kcat数值明显下降,因此,其催化效率为野生型酶的86%。
对纤维二糖底物的催化能力,不同位点N-糖基化突变体也有所差异。突变体T44A催化效率与野生型Bgl3A基本一致,S228A检测不到活性。突变体S299A的Km为11.4 mmol/L,较野生型降低0.6倍,即亲和力提高,导致催化能力较野生型Bgl3A提高1.1倍。
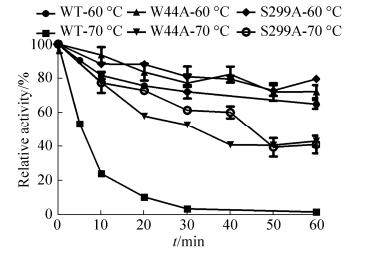
2.4 野生型Bgl3A同源建模、二糖对接以来源于里氏木霉Hypocrea jecorina第3家族β-葡萄糖苷酶Cel3A (PDB: 3ZYZ)为模板,通过用Discovery Studio 2017 Client软件进行单模板同源建模,并与纤维二糖对接(图 4)。
|
| 图 4 野生型Bgl3A同源建模以及与二糖底物对接 Figure 4 Homology modeling of wild-type Bgl3A and its docking with cellobiose. |
如图 4标示,β-葡萄糖苷酶的酸碱催化碱基为口袋附近的Asp 254和Glu 466。Asn 42、Asn 226和Asn 297为β-葡萄糖苷酶3个潜在N-糖基化位点(Asn-X-Ser/Thr)。其中,Asn 226糖链距离催化口袋关键残基(Asp 254和Glu 466)最近,去除该位点处的糖链(突变体S228)可能会对催化口袋造成影响,会改变酶蛋白构象,从而使酶活降低。
3 讨论 3.1 N-糖基化影响蛋白表达及分泌自然界中,蛋白质存在多种翻译后修饰方式,主要有糖基化、磷酸化、泛素化、脂基化、甲基化和乙酰化等[11-12],超过半数的蛋白质是经过糖基化修饰的,其中四分之三是N-糖基化修饰。同时,近几十年,蛋白糖基化的研究逐渐关注N-糖基化对酶分泌能力的作用。N-糖基化有助于酶蛋白的正确折叠表达以及外分泌。例如Wei等[13]报道的来源于曲霉的葡萄糖苷酶基因在毕赤酵母中的表达,存在4个天然的N-糖基化位点,其中N224糖基化位点突变后,突变酶对pNPG底物基本无降解活性;转录水平分析表明N224突变体蛋白因错误折叠不能分泌至胞外且在胞内被降解。另外,West等[14]报道的谷氨酰转移酶去除N95糖基化修饰后,会使蛋白在分泌之前自催化裂解。本文研究了毕赤酵母表达嗜热真菌蓝状菌Bgl3A的N226糖基化位点出现相同结果,突变酶S228A对pNPG底物的比活力较野生型降低227倍,对纤维二糖底物基本丧失活性。以上分析表明,对于第3家族葡萄糖苷酶,曲霉的葡萄糖苷酶的N224位点和Bgl3A的N226位点的N-糖基化对酶的分泌和折叠起到至关重要的作用,其机制可能是N-糖基化防止了酶在胞内被蛋白酶降解。
3.2 N-糖基化影响酶热稳定性已有大量研究表明N-糖基化修饰会对酶蛋白的稳定性产生影响。关于N-糖基化能增强酶的稳定性报道有许多,例如Xi等[15]发现N-糖基化修饰的亮氨酸氨基肽酶具有较高的热稳定性;此外来源于真菌曲霉的糖化酶在去除N-连接的多糖残基后导致蛋白热稳定性下降,并且在一些补充实验中,人工引入了新的N-糖基化位点,表现出热稳定性增强的现象[16]。但是,也有文献报道糖基化修饰不会0显著影响酶的热稳定性甚至会使其热稳定性降低[6]。通过差量量热仪扫描的热力学稳定性显示,突变体T44A、S299A的Tm值分别较野生型Bgl3A提高0.3 ℃和0.7 ℃;动力学稳定性也呈现相似趋势,突变体T44A和S299A在70 ℃处理60 min后,仍能保持残余50%左右的相对酶活力,而野生型Bgl3A在70 ℃处理20 min后,残余酶活力仅剩不足20%。以上结果表明,Bgl3A在这2个位点的N-糖基化对酶的热稳定性具有负面作用,其原因可能是糖链位于蛋白表面,导致酶的整体结构趋于不稳定。
3.3 N-糖基化影响催化效率同时,N-糖基化对酶催化效率的影响,也受到广泛关注。已有报道表明,随着N-糖基化的位点不同、数目不同和糖链的结构不同,其对酶催化活性的影响有显著差异[17-19]。例如,William等[20]对里氏木霉表达的纤维二糖水解酶TrCBHI N-糖基化研究,将TrCBHI的N384突变后,发现该位点突变体对纤维素水解活性提升70%,而其他糖基化位点的突变体催化活性呈现一定程度的降低。这一定程度说明了不同位置的糖链对酶催化活性影响的不确定性。同样,本研究中的3个去N-糖基化突变体对纤维二糖底物的催化活性也不相同,突变体T44A催化效率与野生型Bgl3A基本一致,S228A几乎检测不到活性。突变体S299A的Km较野生型降低0.6倍,即亲和力提高,导致催化效率较野生型Bgl3A提高1.1倍。N-糖基化对纤维二糖催化效率的影响机制可能是由于不同糖基化发生在蛋白的不同结构区域,对蛋白质结构的影响从而导致酶对底物催化效率的变化。但总体来说,由于2个N-糖基化T44A和S299A均位于蛋白质表面,远离催化中心,对酶的催化效率影响不会起到明显作用。
总的来说,本实验成功构建了3个β-葡萄糖苷酶的去N-糖基化突变体T44A、S228A和S299A,并且比较了它们在最适温度、最适pH、热稳定性及催化效率等方面与野生型Bgl3A的差异。其中T44A和S299A与Bgl3A一致,最适pH均为4.0,S228A最适pH发生轻微变化,为4.5。Bgl3A为中高温酶,最适作用温度为70–75 ℃。3个突变体中,T44A和S299A与野生型Bgl3A一致,最适温度均为75 ℃,S228A最适温度发生变化,为70 ℃。热稳定性分析表明,突变体T44A和S299A的热稳定性略高于野生型。酶促反应动力学分析表明以pNPG为底物,3个突变体的催化能力均下降,其中突变体T44A的催化效率(kcat/Km)低至野生型Bgl3A的3.3倍;以纤维二糖为底物,突变体T44A的催化能力基本没变化,突变体S299A催化能力较野生型Bgl3A提高1.1倍,而突变体S228A由于蛋白表达量过低,导致其对两种底物的催化能力均明显下降甚至无法检测到活性。由此可见,不同位点的N-糖基化修饰对酶学性质影响不同,N226位点的N-糖基化对于第3家族的β-葡萄糖苷酶至关重要,而N297位点糖基化的去除有利于其对纤维二糖底物的降解。
致谢:感谢实验室课题组姚斌老师和罗会颖老师给予实验经费的支持,感谢石鹏君老师对实验的整体设计以及指导,感谢柏映国老师对实验结果分析的点拨,感谢马锐老师对论文的整体修改和润色,感谢华晨同学对实验数据测定过程的帮助。
| [1] | Horn SJ, Vaaje-Kolstad G, Westereng B, Eijsink VG. Novel enzymes for the degradation of cellulose. Biotechnology for Biofuels, 2012, 5(1): 45-52. |
| [2] | Nelson CE, Rogowski A, Morland C, Wilhide JA, Gilbert HJ, Gardner JG. Systems analysis in Cellvibrio japonicus resolves predicted redundancy of β-glucosidases and determines essential physiological functions. Molecular Microbiology, 2017, 104(2): 294-305. DOI:10.1111/mmi.2017.104.issue-2 |
| [3] | Zhang Z, Liu JL, Lan JY, Duan CJ, Ma QS, Feng JX. Predominance of Trichoderma and Penicillium in cellulolytic aerobic filamentous fungi from subtropical and tropical forests in China, and their use in finding highly efficient β-glucosidase. Biotechnology for Biofuels, 2014, 7(1): 107-115. |
| [4] | Singhania RR, Patel AK, Sukumaran RK, Larroche C, Pandey A. Role and significance of beta-glucosidases in the hydrolysis of cellulose for bioethanol production. Bioresource Technology, 2013, 127: 500-511. DOI:10.1016/j.biortech.2012.09.012 |
| [5] | Macauley-Patrick S, Fazenda ML, McNeil B, Harvey LM. Heterologous protein production using the Pichia pastoris expression system. Yeast, 2005, 22(4): 249-270. DOI:10.1002/(ISSN)1097-0061 |
| [6] |
Ma Q, Cai R, Jiang FC, Ma LJ, Du LP, Xiao DG. Effect of N-glycosylation on the heterologous expression of β-mannanase in Pichia pastoris. Food Science, 2017, 38(16): 86-91.
(in Chinese) 马清, 蔡瑞, 姜风超, 马立娟, 杜丽平, 肖冬光. N-糖基化对β-甘露聚糖酶在毕赤酵母中异源表达的影响. 食品科学, 2017, 38(16): 86-91. DOI:10.7506/spkx1002-6630-201716013 |
| [7] | Yang MM, Johnson SC, Murthy PPN. Enhancement of alkaline phytase production in Pichia pastoris:influence of gene dosage, sequence optimization and expression temperature. Protein Expression and Purification, 2012, 84(2): 247-254. DOI:10.1016/j.pep.2012.06.001 |
| [8] | Mignon P, Pidko EA, van Santen RA, Geerlings P, Schoonheydt RA. Understanding the reactivity and basicity of zeolites:a periodic DFT study of the disproportionation of N2O4 on alkali-cation-exchanged zeolite Y. Chemistry, 2008, 14(17): 5168-5177. DOI:10.1002/(ISSN)1521-3765 |
| [9] | Tie JK, Zheng MY, Pope RM, Straight DL, Stafford DW. Identification of the N-linked glycosylation sites of vitamin K-dependent carboxylase and effect of glycosylation on carboxylase function. Biochemistry, 2006, 45(49): 14755-14763. DOI:10.1021/bi0618518 |
| [10] | Turner KM, Wright LC, Sorrell TC, Djordjevic JT. N-linked glycosylation sites affect secretion of cryptococcal phospholipase B1, irrespective of glycosylphosphatidylinositol anchoring. Biochimica et Biophysica Acta (BBA)-General Subjects, 2006, 1760(10): 1569-1579. DOI:10.1016/j.bbagen.2006.07.002 |
| [11] | Veenstra TD. Proteomic Analysis of Posttranslational Modifications. John Wiley & Sons, Inc., 2013: 87-116. |
| [12] |
Hu J, Guo YT, Li YM. Research progress in protein post-translational modification. Chinese Science Bulletin, 2005, 50(11): 1061-1072.
(in Chinese) 胡笳, 郭燕婷, 李艳梅. 蛋白质翻译后修饰研究进展. 科学通报, 2005, 50(11): 1061-1072. DOI:10.3321/j.issn:0023-074X.2005.11.001 |
| [13] | Wei W, Chen L, Zou G, Wang QF, Yan X, Zhang J, Wang CS, Zhou ZH. N-glycosylation affects the proper folding, enzymatic characteristics and production of a fungal β-glucosidase. Biotechnology and Bioengineering, 2013, 110(12): 3075-3084. DOI:10.1002/bit.v110.12 |
| [14] | West MB, Wickham S, Quinalty LM, Pavlovicz RE, Li CL, Hanigan MH. Autocatalytic cleavage of human g-glutamyl transpeptidase is highly dependent on N-glycosylation at asparagine 95. Journal of Biological Chemistry, 2011, 286(33): 28876-28886. |
| [15] | Xi HX, Tian YP, Zhou ND, Shen W. Characterization of an N-glycosylated Bacillus subtilis leucine aminopeptidase expressed in Pichia pastoris. Journal of Basic Microbiology, 2015, 55(2): 236-246. |
| [16] | Liu HL, Doleyres Y, Coutinho PM, Ford C, Reilly PJ. Replacement and deletion mutations in the catalytic domain and belt region of Aspergillus awamori glucoamylase to enhance thermostability. Protein Engineering, 2000, 13(9): 655-659. |
| [17] | Wu G, Wei L, Liu W, Lin J, Wang L, Qu Y, Zhuang G. Asn 64-glycosylation affects Hypocrea jecorina (syn. Trichoderma reesei) cellobiohydrolase Cel7A activity expressed in Pichia pastoris. World Journal of Microbiology & Biotechnology, 2010, 26(2): 323-328. |
| [18] | Qi FF, Zhang WX, Zhang FJ, Chen GJ, Liu WF. Deciphering the effect of the different N-glycosylation sites on the secretion, activity, and stability of cellobiohydrolase Ⅰ from Trichoderma reesei. Applied and Environmental Microbiology, 2014, 80(13): 3962-3971. |
| [19] | Siadat SOR, Mollasalehi H, Heydarzadeh N. Substrate affinity and catalytic efficiency are improved by decreasing glycosylation sites in Trichoderma reesei cellobiohydrolase Ⅰ expressed in Pichia pastoris. Biotechnology Letters, 2015, 38(3): 483-488. |
| [20] | Adney WS, Jeoh T, Beckham GT, Chou YC, Baker JO, Michener W, Brunecky R, Himmel ME. Probing the role of N-linked glycans in the stability and activity of fungal cellobiohydrolases by mutational analysis. Cellulose, 2009, 16(4): 699-709. DOI:10.1007/s10570-009-9305-1 |
 2019, Vol. 59
2019, Vol. 59