中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李倩, 张平, 廖柏寒, 彭佩钦, 梅金星, 徐继敏. 2019
- Li Qian, Zhang Ping, Liao Bohan, Peng Peiqin, Mei Jinxing, Xu Jimin. 2019
- 一株耐Cd菌株的分离、鉴定及基本特性
- Isolation, identification and characterization of a Cd resistant bacterium
- 微生物学报, 59(1): 11-24
- Acta Microbiologica Sinica, 59(1): 11-24
-
文章历史
- 收稿日期:2017-12-29
- 修回日期:2018-03-28
- 网络出版日期:2018-04-08
重金属污染是世界各国尤其是发展中国家所面临的一个严重的环境问题。重金属镉(Cd)作为采矿、金属冶炼、电镀等行业所产生的工业废水中的主要污染物质,被大量排放于环境中,导致环境中Cd污染严重[1]。近年来我国水体Cd污染事件频发,如2012年1月15日发生的龙江河Cd污染事件,造成下游部分河段水体Cd浓度超过《地表水环境质量标准》Ⅲ类水质标准80倍[2];2016年4月,江西新余仙女湖因为中安公司的生产废水仅用石灰中和处理,并铺设暗管将废水直接排入河流,导致废水池中残存废水Cd浓度达5980 mg/L[3]。以上事件说明当前我国水体Cd污染形势不容乐观。在Cd暴露条件下,人类的肝脏、肾脏、骨骼均会受到一定程度损害[4-5]。当前,用于含Cd废水的治理方法有化学沉淀法、离子交换法、膜滤法、浮选法、吸附法和生物法等[6-7]。微生物吸附法[8]是指利用微生物细胞作为吸附剂,经过一系列生物化学作用吸附溶液中的污染物质。相比于传统物理化学法,微生物吸附法具有来源广、成本低、处理效果好、易于管理与操作、无二次污染等优点,近年来愈来愈受到人们的重视,成为Cd污染生物修复研究的热点[9-12]。
环境中占主导地位的细菌、真菌和微藻类均可被制成各种类型吸附剂用于吸附去除重金属[13]。Loukidou等[14]利用Aeromonas caviae作为生物吸附剂吸附溶液中的Cd2+,其最大吸附量可达155 mg/g;Ziagova等[15]利用菌种Pseudomonas sp.和Staphylococcus xylosus对Cd2+溶液进行生物吸附,最大吸附量分别可达278 mg/g和250 mg/g。上述研究表明,微生物吸附法能够有效地去除溶液中的Cd2+,但菌种不同,其对Cd2+的吸附能力不同。另外,Flouty等[16]分别研究了藻类(Chlamydomonas reinhardtii)的活细胞和死细胞对Pb2+和Cu2+的吸附能力,结果表明,活细胞和死细胞对Pb2+和Cu2+的去除率分别为8%、40%和28%、55%,死细胞表现出更好的吸附性能;Kaduková等[17]的研究结果表明藻类(Chlorella kessleri)活细胞对铜的结合能力明显低于死细胞。这些说明,微生物的活细胞和死细胞对重金属均有一定的吸附能力。在实际情况下,重金属离子往往会对活细胞产生毒害作用从而影响吸附效果。相比较于活细胞,死细胞虽然少了生物积累作用,但在吸附过程中,不需要营养物质且不易受外界环境因素影响,吸附性能较稳定,且因热处理破坏了细胞结构的完整性,暴露出更多内部官能团,为吸附提供更多的吸附位点,使其吸附能力得到显著提高[18-19]。
生物吸附主要是利用细胞表面的一些具有配位、络合能力的基团(如氨基、羧基、羟基等)与重金属离子相结合,该吸附过程主要涉及的机制包括物理吸附、离子交换作用、表面络合与螯合作用、化学沉淀等[20]。另外,生物吸附材料是否能有稳定的吸附效果还与反应条件如pH、温度、吸附时间等密切相关。其中,pH是影响生物吸附效果的一个重要因素,pH的改变不仅会影响重金属溶液的化学性质,还会改变吸附剂表面电荷与电离度等;温度在一定范围内对吸附产生影响相对较小;而吸附过程中另一个重要的影响因素是吸附平衡时间,吸附时间过短可能会导致吸附不完全,吸附时间过长可能会使被吸附的金属离子发生解析,这两者均会导致重金属离子的吸附量下降,因而吸附过程中需综合考虑吸附时间。
基于上述考虑,本文报道从活性污泥中分离得到1株耐Cd细菌菌株,通过分子生物学及溶血试验和蛋白质毒素结晶试验对该菌株进行了初步鉴定,并研究了该菌株的最佳生长条件及死细胞对溶液中Cd2+吸附的优化条件和机理分析,以期能为后续的重金属污染水体的微生物修复提供菌株资源和应用技术参考。
1 材料和方法 1.1 材料 1.1.1 菌株来源: 分离自长沙洋湖污水处理厂所采集的活性污泥。该污水处理厂于2012年8月建成投入运行,活性污泥中总Cd、总Pb和总Cr含量分别为0.9、70.8、54.0 mg/kg。 1.1.2 培养基: (1) 牛肉膏蛋白胨培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,去离子水1000 mL,pH 7.0–7.2;(2)固体培养基:在上述牛肉膏蛋白胨培养基中加入18 g琼脂。 1.2 耐Cd菌株的筛选及鉴定 1.2.1 纯种分离: 在Cd2+含量为50 mg/L的牛肉膏蛋白胨培养基中,投加一定量活性污泥,于温度为28 ℃、转速为150 r/min的恒温摇床中连续培养3 d后,取1 mL污泥悬液样品进行10倍梯度稀释至10–5。从稀释倍数为10–4与10–5样品中吸取0.1 mL涂布到Cd2+浓度为50 mg/L的固体培养基上,28 ℃恒温培养箱倒置培养2 d。挑取培养基上不同的典型单个菌落,再进行平板划线与培养,观察是否为单一菌落,如不纯继续进行划线培养,直至菌落形态单一。 1.2.2 耐Cd菌株的驯化: 将经过反复划线、分离、纯化所得到的菌株,用接种环挑取少量菌于Cd2+浓度为150 mg/L的牛肉膏蛋白胨固体培养基上划线,28 ℃下倒置培养2 d,观察菌株在培养基上是否生长及生长程度。若生长,则依次逐步提高Cd2+浓度为250、300、350、400 mg/L,直至无菌生长并得到菌株的最大Cd2+耐受浓度。 1.2.3 耐Cd菌株的鉴定: (1) 分子生物学鉴定:16S rRNA基因PCR扩增测序,采用细菌通用引物27F (5'-AGAGTTTGATCCTGGCTCAG-3')和1492R (5'-GGTTACCTTGTTACGACTT-3')。由泰和永昌(长沙)生物技术有限公司完成菌株H6的分子生物学鉴定部分。所得的序列结果在NCBI中进行BLAST分析,获得与该菌的16S rRNA序列同源性最高的已知序列,并从GenBank数据库中调取出相似性较高的相关菌株的基因序列构建系统发育树。(2) 溶血试验:将分离菌株接种至胰酪胨大豆羊血琼脂(TBBS)平板上,30 ℃恒温培养箱中培养(24±2) h,观察是否产生溶血现象。
(3) 蛋白质毒素结晶试验:取经(30±1) ℃培养(24±2) h并于室温放置3–4 d的营养琼脂培养物少许于载玻片上,滴加蒸馏水混匀并涂成薄膜。经自然干燥,微火固定后,加甲醇作用30 s后倾去,再通过火焰干燥,之后于载玻片上滴满0.5%碱性复红,放火焰上加热(微见蒸气,勿使染液沸腾)持续1–2 min,移去火焰,更换染色液再次加温染色30 s,倾去染液用洁净自来水彻底清洗、晾干后镜检。观察有无游离芽孢(浅红色)和染成深红色的菱形、正方形或其他形状的蛋白结晶体。如发现游离芽孢形成不丰富,应再将培养物置室温2–3 d后进行检查。除苏云金芽孢杆菌外其他芽孢杆菌不产生蛋白结晶体。
1.3 菌株H6的培养条件优化将筛选、纯化的菌株H6用牛肉膏蛋白胨培养基培养,主要考察初始pH值、培养时间、培养温度、接种量及转速对其生长量的影响。
1.3.1 菌悬液的制备: 将经酒精灯灼烧灭菌的接种环从牛肉膏蛋白胨培养基上挑取已分离、纯化好的纯种菌落,接种到种子培养基中,180 r/min、28 ℃条件下培养18 h,6000 r/min条件下离心10 min,弃去上清液,无菌水洗涤菌体,离心,再次弃去上清液,如此重复洗涤3次,收集菌体,加入适量无菌0.85% NaCl (W/V)溶液,制成菌悬液,使菌浓度为7×108 cells/mL,4 ℃冰箱保存备用。 1.3.2 培养基初始pH对分离菌株H6生长的影响: 在6组100 mL三角瓶中,分别加入40 mL牛肉膏蛋白胨液体培养基,各组初始pH值分别调节为4.00、4.25、4.50、4.75、5.00、6.00、7.00、8.00、9.00,然后按5% (V/V,下同)的接种量接种,于28 ℃、120 r/min条件下培养,测定不同时间下光密度值OD600。实验设3个重复,各pH条件下设不加菌的培养液作为对照(下同)。 1.3.3 培养时间和培养温度对分离菌株H6生长的影响: 在3组100 mL三角瓶中,分别加入40 mL牛肉膏蛋白胨液体培养基,各组初始pH值均调节为7.0,摇床转速为120 r/min,按5%的接种量接种,分别于20、28、37 ℃条件下培养。分别测定不同温度、不同时间下的光密度值OD600、培养液pH值。 1.3.4 接种量与转速对H6生长的影响: 取5组100 mL锥形瓶,分别加入40 mL牛肉膏蛋白胨液体培养基,各组初始pH均调节为7.0,培养温度为28 ℃,分别于90、120、150、180、210 r/min条件下培养60 h,测定光密度值OD600。实验设计时,为考虑同一转速、不同接种量的影响,在上述5个转速条件下,分别设计不同接种量(1%、2%、3%、4%、5%),培养60 h,测定光密度值OD600。
1.4 分离菌株H6菌粉对Cd2+吸附条件的正交优化 1.4.1 分离菌株H6菌粉的制备: 将经1.3.1离心收集到的菌体,于80 ℃下烘干24 h后,在研钵中粉碎,将粉末于121 ℃下高压蒸汽灭菌锅中灭菌20 min,80 ℃下烘干,置于干燥器中备用。 1.4.2 菌株H6的吸附特性研究: 采用正交实验优化吸附条件,以确定分离菌株H6菌粉对Cd2+的最佳吸附条件。选择菌粉用量(g/L)、吸附时间(h)、体系pH和温度4个因素,每个因素各设计3个水平进行正交实验L9(34),具体设计见表 1。| Level | Biosorbent dose/(g/L) | t/h | pH | T/℃ |
| 1 | 0.125 | 1 | 4.0 | 20 |
| 2 | 0.250 | 2 | 5.0 | 30 |
| 3 | 0.375 | 3 | 6.0 | 40 |
实验时,按表 1的正交实验条件进行吸附。将吸附后的溶液于5000 r/min下离心10 min,上清液过滤,用火焰原子吸收分光光度法测定滤液中Cd2+浓度。实验设3个重复,并以不加菌的Cd2+溶液作为对照。
吸附量(q)按照计算公式(1)计算。
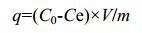
|
公式(1) |
式中:C0、Ce分别为Cd2+初始浓度、平衡时Cd2+浓度(mg/L);q为吸附容量(mg/g);V为吸附溶液体积(L);m为吸附剂质量(g)。
1.5 菌株H6对Cd2+吸附机理分析取H6菌粉(0.5 g/L),加入Cd2+浓度为0、50 mg/L的水溶液中,于28 ℃、150 r/min条件下吸附2 h,吸附后溶液于5000 r/min下离心10 min,收集菌粉于80 ℃下烘干24 h,用研钵充分研磨样品,再将样品进行SEM-EDS分析和FTIR分析。
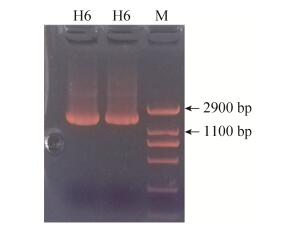
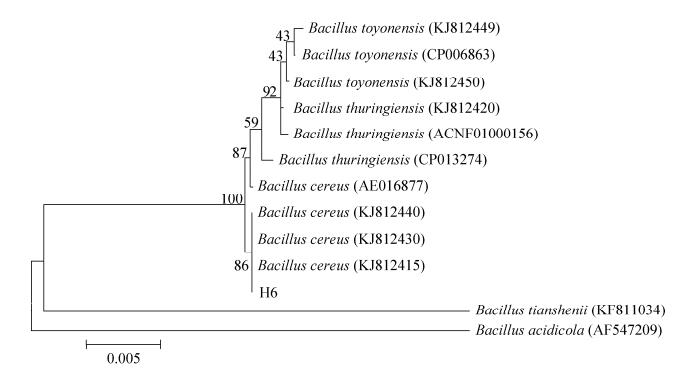
2 结果和分析 2.1 耐Cd菌株的筛选与鉴定通过对活性污泥中的微生物进行耐Cd筛选,得到1株耐Cd细菌菌株,命名为H6,该菌株的最大Cd2+耐受浓度为350 mg/L。菌株H6在固体培养基上的菌落颜色为乳白色,近圆形,表面湿润,有光泽,边缘不整齐,容易挑起(图 1)。经电泳观察,分离菌株H6的PCR扩增产物琼脂糖凝胶电泳图谱如图 2所示;将菌株H6的测序结果在NCBI数据库(NCBI登录号为MG386505)中与已知核酸序列进行BLAST相似性比对,结果表明,菌种所测得的16S rRNA基因序列与芽孢杆菌的16S rRNA基因序列有99%以上的同源性,可确定菌属为芽孢杆菌属,与已知菌种的匹配中,与蜡样芽孢杆菌(Bacillus cereus)、苏云金芽孢杆菌(Bacillus thuringiensis)的16S rRNA序列有99%以上的同源性。选取同源性相近的菌株,用软件MEGA5.05采用邻接法(Neighbour-Joining)构建菌株H6的系统进化发育树,如图 3。

|
| 图 1 分离菌株H6在牛肉膏蛋白胨固体培养基上形态 Figure 1 Morphology of strain H6 on the solid culture medium of beef extract. |
|
| 图 2 分离菌株H6的PCR扩增产物琼脂糖凝胶电泳图谱 Figure 2 Agarose gel electrophoresis of PCR amplification of strain H6. |
|
| 图 3 分离菌株H6系统进化发育树 Figure 3 Phylogenetic tree of strain H6. Numbers in parentheses represent the sequences' accession number in GenBank. The number at each branch points is the percentage supported by bootstrap (1000 re-samplings). Bar: 0.5% sequence divergence. |
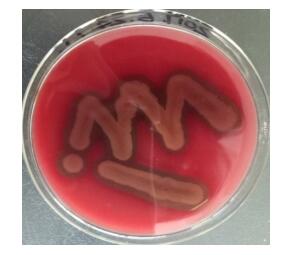
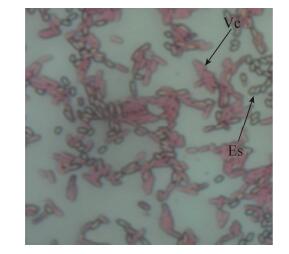
为进一步确定菌株H6是蜡样芽孢杆菌(Bacillus cereus)还是苏云金芽孢杆菌(B. thuringiensis),进行了溶血试验和蛋白质毒素结晶试验。图 4表明,分离菌株H6在TBBS培养基上菌落周围呈现明显的溶血现象,有草绿色溶血环,为阳性反应;图 5表明,分离菌株H6不产生蛋白结晶体,染色后没有染成深红色的菱形蛋白结晶体出现,为阴性反应。综合上述分子生物学鉴定结果及溶血试验、蛋白质毒素结晶试验结果,可将分离的耐Cd菌株初步鉴定为蜡样芽孢杆菌(Bacillus cereus)。
|
| 图 4 分离菌株H6在TBBS培养基上的溶血现象 Figure 4 The hemolysis of strain H6 on TBBS medium. |
|
| 图 5 分离菌株H6的蛋白质毒素结晶染色现象(1000×) Figure 5 Protein crystallization dying experiment of strain H6(1000×). Vc: Vegetative cell s; Es: Spores. |
2.2 菌株H6的培养条件优化结果 2.2.1 培养基初始pH对菌株生长的影响: 微生物的生命活动、物质代谢与pH有着密切关系,不同初始pH对菌株H6生长的影响结果如图 6。当初始pH为4.00、4.25、4.50、4.75时,菌株H6生长明显受到抑制,基本未生长;当初始pH为5.0时,菌株H6在前18 h生长缓慢,18 h后,其进入对数生长期;当初始pH为6.0、7.0、8.0时,菌株H6在0–6 h生长量变化微小,在6 h后进入对数生长期;当初始pH为9.0时,菌株H6在10 h后进入对数生长期。在初始pH为5.0、6.0、7.0、8.0、9.0时,菌株H6的最大比生长速率分别为0.187、0.134、0.128、0.132、0.171 h–1。综上可知,菌株H6在初始pH为5.0–9.0时均能较好生长,但不同pH条件下其达到对数生长期时间不同。因此,分离菌株H6的最佳生长初始pH值为6.0–8.0。

|
| 图 6 培养基初始pH对菌株H6生长的影响 Figure 6 Effect of initial pH on growth of strain H6. Error bars in figure represent standard deviation. |
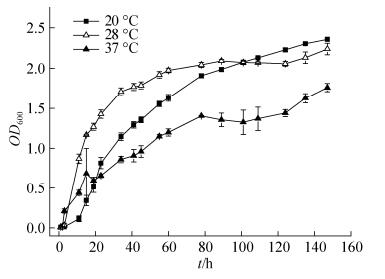
2.2.2 培养时间和培养温度对菌株生长的影响: 温度是微生物的重要生存因子,在不同温度条件下,菌株H6的生长曲线如图 7所示。当温度为20 ℃时,菌株对环境适应时间相对较长,生长缓慢,11 h后才开始进入对数生长期,但进入对数期后其生长情况较好;当培养温度为28 ℃时,菌株H6在0–3 h时处于迟缓期,此阶段为菌株H6对环境的适应过程,3 h后,菌株H6开始进入对数生长期,培养至60 h左右,菌株H6生长进入稳定期;当温度为37 ℃时,菌株在较短时间内进入对数生长期,但23 h后,其生长量反而低于20 ℃和28 ℃的生长量,说明温度相对过高,会抑制菌株的生长与繁殖。由上述分析可知,温度相对过高会抑制菌株H6的生长与繁殖,温度相对过低,菌株H6在培养初期对环境的适应能力较慢。因此,在实验设定的温度条件下,分离菌株H6的最适生长温度为28 ℃。
|
| 图 7 各温度条件下菌株H6的生长曲线 Figure 7 The growth curve of strain H6 at different temperatures. Error bars in figure represent standard deviation. |
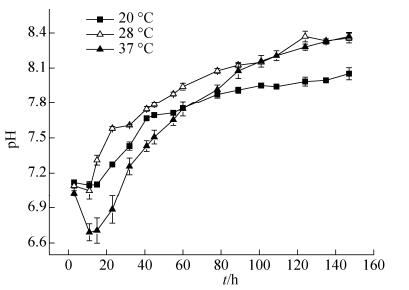
由图 8可知,在不同温度条件下,菌株H6在培养过程中,培养液的pH值均是变化的,均呈现先稍微下降然后不断上升的趋势,但温度不同,其pH值的变化幅度也不同,这可能是在不同温度条件下,菌株H6所产生的代谢产物不同所致。在不同温度条件下,菌株在培养初期,培养液pH值下降,此时菌株可能处于适应时期,是一个产酸的过程,生长量较少;当培养至一定时期,菌株进入对数生长期,生长、代谢速度加快,随着生长量及代谢产物量的增加,培养液pH也不断上升,说明菌株在培养过程中产生了碱性代谢产物,这可能是微生物对培养基中的中性物质蛋白胨和牛肉膏的利用与分解,发生脱氨基作用所致。唐珂心等[21]研究也表明,蜡样芽孢杆菌对蛋白胨的分解利用是培养液pH上升的主要原因,与本研究结果相一致。
|
| 图 8 各温度条件下菌株H6的培养液pH值变化 Figure 8 The trend of pH change during the growth of strain H6 at different temperatures. Error bars in figure represent standard deviation. |
2.2.3 接种量与摇床转速对菌株生长的影响: 接种量与摇床转速对菌株H6生长的影响如图 9。在摇床转速为90 r/min条件下,不同接种量下H6菌株的生长量均明显低于其他转速下的接种量,在此转速条件下,1%的接种量时OD600值最大,这可能是因为菌株为好氧菌,当接种量为1%时,菌株生长良好,而当通气量一定,接种量较多时,因为通气量的不足,反而不利于菌株的生长繁殖。但当通气量达到一定程度(摇床转速为120–210 r/min)时,随接种量的增加,菌株生长量变化不明显,这可能是培养液的营养成分有限所致。

|
| 图 9 摇床转速及接种量对菌株H6生长的影响 Figure 9 Effect of speed and inoculation on growth of strain H6. Error bars in figure represent standard deviation. |
2.3 分离菌株H6菌粉对Cd2+吸附条件的正交实验优化结果
正交实验结果及分析见表 2。据表 2可知,各因素不同水平间的变化趋势分别为ⅠA > ⅡA > ⅢA、ⅡB > ⅢB > ⅠB、ⅡC > ⅢC > ⅠC、ⅡD > ⅠD > ⅢD,表明在各因素所选定的范围内,H6菌粉吸附溶液中Cd2+的最佳条件为A1B2C2D2,即最佳吸附条件为菌粉用量0.125 g/L,吸附时间为2 h,pH为5.0,温度为30 ℃。
| Experiment number | Biosorbent dose/(g/L) (A) | t/h (B) | pH (C) | T/℃ (D) | Biosorption capacity/(mg/g) |
| 1 | 0.125 | 1 | 4.0 | 20 | 64 |
| 2 | 0.125 | 2 | 5.0 | 30 | 205 |
| 3 | 0.125 | 3 | 6.0 | 40 | 135 |
| 4 | 0.250 | 1 | 5.0 | 40 | 35 |
| 5 | 0.250 | 2 | 6.0 | 20 | 85 |
| 6 | 0.250 | 3 | 4.0 | 30 | 27 |
| 7 | 0.375 | 1 | 6.0 | 30 | 16 |
| 8 | 0.375 | 2 | 4.0 | 40 | 40 |
| 9 | 0.375 | 3 | 5.0 | 20 | 69 |
| Ⅰj | 404 | 115 | 131 | 218 | |
| Ⅱj | 147 | 330 | 309 | 248 | |
| Ⅲj | 125 | 231 | 236 | 210 | |
| kj | 3 | 3 | 3 | 3 | |
| Ⅰj/Kj | 135 | 38 | 44 | 73 | |
| Ⅱj/Kj | 490 | 110 | 103 | 83 | |
| Ⅲj/Kj | 42 | 77 | 79 | 70 | |
| Range | 93 | 72 | 59 | 13 |
由极差分析可知,4个影响菌粉吸附溶液中Cd2+的因素的主次顺序为A > B > C > D,即菌粉的用量对溶液中Cd2+吸附的影响最大,吸附时间的影响次之,温度影响最小。
2.4 分离菌株H6菌粉对Cd2+吸附机理的分析 2.4.1 分离菌株H6菌粉吸附Cd2+的SEM观察: 分离菌株H6菌粉吸附Cd2+前后的SEM照片如图 10所示,从图中可以看出菌粉吸附前表面较为光滑,吸附Cd2+后表面出现明显褶皱且形成凸起,表明菌株H6菌粉可有效吸附Cd2+。

|
| 图 10 菌株H6菌粉吸附Cd2+前后的扫描电镜照片(50000×) Figure 10 SEM images of bacteria powder loaded with and without Cd(Ⅱ) (50000×). A: 0 mg/L Cd2+; B: 50 mg/L Cd2+. |
2.4.2 分离菌株H6菌粉吸附Cd2+的EDS分析: 对分离菌株H6菌粉进行能谱EDS分析结果见图 11。在菌粉吸附Cd2+之前,表面存在C、O、P、S和Ca峰,而吸附50 mg/L Cd2+后,出现了Cd的吸收峰,Ca的吸收峰消失,说明菌粉表面Ca2+位点被Cd2+所取代,即Cd2+和Ca2+发生了离子交换;同时,P的吸收峰有所减弱,说明Cd2+可能与菌粉表面含P基团结合形成螯合物。
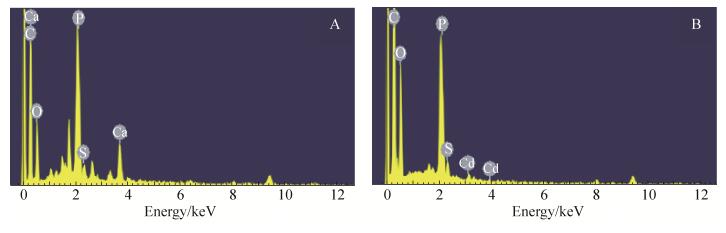
|
| 图 11 H6菌粉吸附Cd2+前后的EDS能谱图 Figure 11 EDX spectra of bacteria powder before and after Cd(Ⅱ) loading. A: 0 mg/L Cd2+; B: 50 mg/L Cd2+. |
2.4.3 分离菌株H6菌粉吸附Cd2+的FTIR分析: 分离菌株H6菌粉吸附Cd2+前后的红外光谱图见图 12。根据相关文献[22-24],对比图中H6吸附Cd2+前后的红外谱图可知,吸附Cd2+后,位于3302.13 cm–1处的-OH(伸缩振动)的最大吸收峰峰型变窄,且位置迁移至3300.20 cm–1;在1728.21 cm–1(-COOH吸收带)处,吸收峰强度增加;在1649.13 cm–1处,是细胞蛋白质酰胺Ⅰ带,是酰胺基的C=O的伸缩振动,1537.26 cm–1处为蛋白质酰胺Ⅱ带,主要是-NH的弯曲振动和-CN伸展振动引起,吸附后吸收峰强度均增加且分别迁移至1651.06 cm–1和1539.19 cm–1;在1228.65 cm–1处,可能是因为细胞壁主要成分多糖中的C-O-C伸缩振动引起的,吸附后吸收峰迁移至1230.58 cm–1处;979.83 cm–1处的C-O-P伸缩振动引起的吸收峰较吸附前减弱;此外,在吸附后698.23 cm–1处的C-H的弯曲振动吸收峰几乎消失;位于516.92 cm–1处的吸收峰是由C-N-S的剪式弯曲振动引起,吸附后迁移至520.78 cm–1处且峰强度减弱。

|
| 图 12 H6菌粉吸附Cd2+前后的红外光谱图 Figure 12 FTIR spectrum of bacteria powder before and after biosorption of Cd2+. A: 0 mg/L Cd2+; B: 50 mg/L Cd2+. |
以上分析表明,菌株H6菌粉的官能团羟基、羧基、羰基、酰胺基和烷基等基团都参与了吸附Cd2+的过程,吸附后其特征峰强度和位置均发生了不同程度的变化。
3 讨论近年来,有关微生物处理重金属污染废水的研究很多,但菌种不同,其生长特性不同。例如,陈美标等[25]从Cd污染土壤中分离的强耐Cd菌株YN-8(Cupriavidus)和YN-19(Leifsonia),最适生长pH分别为4.0和6.0;耿印印等[26]从Cd污染土壤中分离出的耐Cd菌株Z11和Z13,均为Pseudomonas aeruginosa,最适生长pH分别为5.0–7.0和7.0–9.0,2株菌在20 ℃和25 ℃下均生长良好,但高温会抑制其生长。刘艳等[27]从内循环厌氧反应器颗粒污泥中分离、纯化得到一株对Cd2+具有一定耐受能力的硫酸盐还原菌DSRBa (Desulfovibrio sp.),其最适生长温度和最适生长pH分别为30–35 ℃、7.0。本研究从活性污泥中分离出1株蜡样芽孢杆菌(Bacillus cereus)菌株H6,其在LB培养基中培养时,可在初始pH为5.0–9.0时均生长良好,而当初始pH < 5.0时,其生长明显受到抑制。说明菌株适宜在偏酸性、中性和偏碱性条件下生长,即菌株H6对pH变化的适应能力较强,这有利于其在实际废水处理中的应用。
菌粉对溶液中Cd2+吸附的正交实验优化结果表明,在最佳吸附条件下,吸附量为205 mg/g,Huang等[28]研究了蜡样芽孢杆菌死细胞对溶液中Cd2+的吸附能力,其经朗格缪尔等温吸附线拟合得到死细胞的最大吸附量为32 mg/g,本实验分离菌株在最佳吸附条件下的Cd2+吸附量远高于这一数值,其中2个实验的吸附条件如溶液pH、温度及接触时间基本一致,本实验菌株的吸附量与其存在差异的原因可能是:(1)投加量的差异。本实验的投加量为0.125 g/L,而Huang的实验投加量为1 g/L。投加量与吸附过程中吸附位点相关,当投加量在一定范围时,随着投加量增加吸附量会增加,但当投加量过多时,吸附剂单位吸附量反而可能会降低;(2)不同菌株的死细胞吸附能力本身存在差异。因此,不同菌株死细胞的吸附量不相同,一方面可能与其本身吸附能力有关,另一方面还与吸附条件密切相关。
黄飞[18]的研究阐明了B. cereus RC-1死细胞吸附Cd2+主要与死细胞表面展示了更多负电荷量和吸附位点有关。周赓[29]研究表明耐镉链霉Cd TB01的干菌粉主要靠细胞壁和代谢产物上的活性基团对Cd2+进行吸附。孙永亮等[30]通过对吸附Cd2+前后的菌粉进行红外扫描,结果表明,菌粉吸附主要是利用细胞表面的醇羟基O-H键、氨基和酰胺基团与Cd2+结合。以上研究表明死细胞去除重金属离子主要与细胞壁上的官能团密切相关。本实验通过对H6菌粉吸附Cd2+前后的SEM-EDS和FTIR分析,表明H6菌粉主要通过表面的官能团羟基、羧基、羰基、酰胺基和烷基等基团与Cd2+发生络合,此外,菌粉表面的Ca2+位点被Cd2+取代,发生了离子交换作用,这与相关研究提出的Cd2+可与羟基、酰胺基、羧基和羰基等相互作用及Ca2+和Cd2+发生离子交换作用的结论相似[18, 31-32]。
本实验分离得到的菌株H6的吸附实验结果表明,菌粉对Cd2+具有较好去除效果,最高吸附量可达205 mg/g,可为后续重金属微生物修复试验与应用提供指导作用,但在实际应用中可能还会面临许多困难和挑战,将其运用于实际废水处理还需进一步深入探索与研究。
4 结论(1) 本研究从活性污泥中分离出1株耐Cd细菌菌株,该菌株的最大Cd2+耐受浓度350 mg/L,经16S rRNA基因序列分析及溶血试验、蛋白质毒素结晶试验,得到该菌株属于芽孢杆菌属,鉴定为蜡样芽孢杆菌(Bacillus cereus),暂命名为H6。
(2) 通过单因素实验对菌株H6的培养条件进行优化,得到其在牛肉膏蛋白胨培养基中最佳培养条件为初始pH 6.0–8.0,温度28 ℃,转速120–210 r/min,接种量1%–5%。菌株H6在培养过程中,培养液pH值呈现先稍微下降然后上升的趋势。
(3) 分离菌株H6菌粉对溶液中Cd2+吸附的正交优化条件为:菌粉用量0.125 g/L,吸附时间2 h,pH 5.0,温度30 ℃,此条件下吸附量为205 mg/g。
(4) 机理研究表明,菌株H6菌粉对Cd2+的吸附主要是通过Ca2+与Cd2+发生离子交换作用,及菌粉表面官能团羟基、羧基、羰基、酰胺基和烷基等基团与Cd2+发生络合作用。
| [1] |
Wen XF, Du CY, Yuan HY, Zhang JF, Chen H, Yu GL, Hu XY, Peng XX. Adsorption of Cd2+ in wastewater through modified magnetic nanoparticles immobilizing endogenous bacterium Bacillus nealsonii. Acta Scientiae Circumstantiae, 2016, 36(12): 4376-4383.
(in Chinese) 文晓凤, 杜春艳, 袁瀚宇, 张金帆, 陈宏, 余关龙, 胡旭跃, 彭向训. 改性磁性纳米颗粒固定内生菌Bacillus nealsonii吸附废水中Cd2+的特性研究. 环境科学学报, 2016, 36(12): 4376-4383. |
| [2] |
Dong JQ, Zhang HZ, Wang JN, Zhang TZ. Modeling of cadmium speciation in Longjiang River during an emergent environmental incident. China Environmental Science, 2015, 35(10): 3046-3052.
(in Chinese) 董璟琦, 张红振, 王金南, 张天柱. 龙江河突发环境事件河流镉污染化学形态模拟. 中国环境科学, 2015, 35(10): 3046-3052. DOI:10.3969/j.issn.1000-6923.2015.10.023 |
| [3] |
Zhang XJ, Lin PF, Chen C. Emergent water supply in environmental accident of cadmium, hallium and arsenic in Xiannvhu Lake in Xinyu City. China Water & Wastewater, 2017, 33(9): 1-10.
(in Chinese) 张晓健, 林朋飞, 陈超. 江西新余仙女湖镉铊砷突发环境事件应急供水. 中国给水排水, 2017, 33(9): 1-10. |
| [4] | Tran TA, Popova LP. Functions and toxicity of cadmium in plants:recent advances and future prospects. Turkish Journal of Botany, 2013, 37(1): 1-13. |
| [5] | Godt J, Scheidig F, Grosse-Siestrup C, Esche V, Brandenburg P, Reich A, Groneberg DA. The toxicity of cadmium and resulting hazards for human health. Journal of Occupational Medicine and Toxicology, 2006, 1: 22. DOI:10.1186/1745-6673-1-22 |
| [6] |
Cao Z, Luo SL, Zeng GM, Xiao X, Wan Y, Su F. Removal of Cd2+ by an endophytic bacteria SDE06 obtained from Solanum Nigrum L. Microbiology China, 2009, 36(3): 328-333.
(in Chinese) 曹喆, 罗胜联, 曾光明, 肖潇, 万勇, 苏峰. 一株龙葵内生细菌SDE06去除Cd2+的实验. 微生物学通报, 2009, 36(3): 328-333. |
| [7] | Fu FL, Wang Q. Removal of heavy metal ions from wastewaters:a review. Journal of Environmental Management, 2011, 92(3): 407-418. DOI:10.1016/j.jenvman.2010.11.011 |
| [8] | Ye JJ, Xiao HL, Xiao BL, Xu WS, Gao LX, Lin G. Bioremediation of heavy metal contaminated aqueous solution by using red algae Porphyra leucosticta. Water Science & Technology, 2015, 72(9): 1662-1666. |
| [9] |
Xiao CW, Luo XY, Tian Y, Lu XY. Research progress of bioremediation of heavy metal cadmium pollution. Chemistry & Bioengineering, 2013, 30(8): 1-4.
(in Chinese) 肖春文, 罗秀云, 田云, 卢向阳. 重金属镉污染生物修复的研究进展. 化学与生物工程, 2013, 30(8): 1-4. DOI:10.3969/j.issn.1672-5425.2013.08.001 |
| [10] |
Lin XY, Mou RX, Cao ZY, Zhu ZW, Chen MX. Isolation and cadmium adsorption mechanisms of cadmium-resistant bacteria strains. Journal of Agro-Environment Science, 2015, 34(9): 1700-1706.
(in Chinese) 林晓燕, 牟仁祥, 曹赵云, 朱智伟, 陈铭学. 耐镉细菌菌株的分离及其吸附镉机理研究. 农业环境科学学报, 2015, 34(9): 1700-1706. |
| [11] |
Wang JL, Chen C. Research advances in heavy metal removal by biosorption. Acta Scientiae Circumstantiae, 2010, 30(4): 673-701.
(in Chinese) 王建龙, 陈灿. 生物吸附法去除重金属离子的研究进展. 环境科学学报, 2010, 30(4): 673-701. |
| [12] |
Xiao W, Zhang SY, Zhao Q, Wang YX, Lai YH, Li ZY, Cui XL. Diversity and heavy-metal tolerance of bacteria isolated from Gejiu tin mining area of Yunnan. Acta Microbiologica Sinica, 2013, 53(11): 1158-1165.
(in Chinese) 肖炜, 张仕颖, 赵琴, 王永霞, 赖泳红, 李治滢, 崔晓龙. 云南个旧锡矿区可培养细菌多样性及其重金属抗性. 微生物学报, 2013, 53(11): 1158-1165. |
| [13] | Igwe JC, Abia AA. A bioseparation process for removing heavy metals from waste water using biosorbents. African Journal of Biotechnology, 2006, 5(12): 1167-1179. |
| [14] | Loukidou MX, Karapantsios TD, Zouboulis AI, Matis KA. Diffusion kinetic study of cadmium(Ⅱ) biosorption by Aeromonas caviae. Journal of Chemical Technology & Biotechnology, 2004, 79(7): 711-719. |
| [15] | Ziagova M, Dimitriadis G, Aslanidou D, Papaioannou X, Litopoulou E, Liakopoulou-Kyriakides M. Comparative study of Cd(Ⅱ) and Cr(Ⅵ) biosorption on Staphylococcus xylosus and Pseudomonas sp. in single and binary mixtures. Bioresource Technology, 2007, 98(15): 2859-2865. DOI:10.1016/j.biortech.2006.09.043 |
| [16] | Flouty R, Estephane G. Bioaccumulation and biosorption of copper and lead by a unicellular algae Chlamydomonas reinhardtii in single and binary metal systems:a comparative study. Journal of Environmental Management, 2012, 111: 106-114. |
| [17] | Kaduková J, Virčíková E. Comparison of differences between copper bioaccumulation and biosorption. Environment International, 2005, 31(2): 227-232. DOI:10.1016/j.envint.2004.09.020 |
| [18] | 黄飞.蜡状芽孢杆菌对水体中镉的吸附特性与机理研究.华南理工大学博士学位论文, 2013. |
| [19] | Li HF, Lin YB, Guan WM, Chang JL, Xu L, Guo JK, Wei GH. Biosorption of Zn(Ⅱ) by live and dead cells of Streptomyces ciscaucasicus strain CCNWHX 72-14. Journal of Hazardous Materials, 2010, 179(1/3): 151-159. |
| [20] | Limcharoensuk T, Sooksawat N, Sumarnrote A, Awutpet T, Kruatrachue M, Pokethitiyook P, Auesukaree C. Bioaccumulation and biosorption of Cd2+ and Zn2+ by bacteria isolated from a zinc mine in Thailand. Ecotoxicology and Environmental Safety, 2015, 122: 322-330. DOI:10.1016/j.ecoenv.2015.08.013 |
| [21] |
Tang KX, Niu ZX, Sun CX, Pang X. Research on growth characteristics of Bacillus cereus. Shandong Journal of Animal Science and Veterinary Medicine, 2000(1): 6-7.
(in Chinese) 唐珂心, 牛钟相, 孙存孝, 庞昕. 蜡样芽胞杆菌生长特性的研究. 山东畜牧兽医, 2000(1): 6-7. |
| [22] | Meseguer VF, Ortu o JF, Aguilar MI, Pinzón-Bedoya ML, Lloréns M, Sáez J, Pérez-Marín AB. Biosorption of cadmium(Ⅱ) from aqueous solutions by natural and modified non-living leaves of Posidonia oceanica. Environmental Science and Pollution Research, 2016, 23(23): 24032-24046. DOI:10.1007/s11356-016-7625-x |
| [23] | Zheng HS, Guo WQ, Li S, Wu QL, Yin RL, Feng XC, Du JS, Ren NQ, Chang JS. Biosorption of cadmium by a lipid extraction residue of lipid-rich microalgae. RSC Advances, 2016, 6(24): 20051-20057. DOI:10.1039/C5RA27264E |
| [24] |
Jin Y, Qu JJ, Li Y, Gu HD, Yan LL, Sun XB. Isolation, identification and Pb(Ⅱ) biosorption characterization of a lead-resistant strain. Acta Scientiae Circumstantiae, 2013, 33(8): 2248-2255.
(in Chinese) 金羽, 曲娟娟, 李影, 顾海东, 闫立龙, 孙兴滨. 一株耐铅细菌的分离鉴定及其吸附特性研究. 环境科学学报, 2013, 33(8): 2248-2255. |
| [25] |
Chen MB, Guo JH, Yao Q, Duan JM, Feng GD, Cai ZP, Zhu HH. Isolation and identification, and biological characteristics of cadmium-tolerant bacteria from the Dabao Mine. Microbiology China, 2012, 39(12): 1720-1733.
(in Chinese) 陈美标, 郭建华, 姚青, 段锦梅, 冯广达, 蔡卓平, 朱红惠. 大宝山矿区耐Cd2+细菌的分离鉴定及其生物学特性. 微生物学通报, 2012, 39(12): 1720-1733. |
| [26] |
Geng YY, Wang XM, Wang HQ, Tong XC. Screening and identification of cadmium-tolerant bacteria in polluted soil and characteristics. Journal of Northeast Agricultural University, 2010, 41(11): 59-65.
(in Chinese) 耿印印, 王旭梅, 王红旗, 佟秀春. 污染土壤中耐镉菌株的筛选、鉴定及吸附试验研究. 东北农业大学学报, 2010, 41(11): 59-65. DOI:10.3969/j.issn.1005-9369.2010.11.011 |
| [27] |
Liu Y, Dang Z, Liu Y, Yi XY, Guo CL, Lu GN, Zhou XQ. Isolation and identification of a sulfate-reducing bacteria DSRBa and its characterization. Journal of Agro-Environment Science, 2011, 30(1): 176-182.
(in Chinese) 刘艳, 党志, 刘云, 易筱筠, 郭楚玲, 卢桂宁, 周兴求. 一株硫酸盐还原菌DSRBa的分离鉴定及特性分析. 农业环境科学学报, 2011, 30(1): 176-182. |
| [28] | Huang F, Dang Z, Guo CL, Lu GN, Gu RR, Liu HJ, Zhang H. Biosorption of Cd(Ⅱ) by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil. Colloids & Surfaces B:Biointerfaces, 2013, 107: 11-18. |
| [29] | 周赓.耐镉放线菌的筛选及特性研究.湖南农业大学硕士毕业论文, 2016. |
| [30] |
Sun YL, Li X, Wang J, Wang JF, Li WJ, Wang YB. Screening of a Cd2+-resistant bacterium and its biosorption. Chinese Journal of Environmental Engineering, 2014, 8(3): 1235-1242.
(in Chinese) 孙永亮, 李欣, 王洁, 王菊芳, 李文建, 王弋博. 一株抗Cd2+菌株的筛选及其吸附性能. 环境工程学报, 2014, 8(3): 1235-1242. |
| [31] | Hokkanen S, Bhatnagar A, Sillanp M. A review on modification methods to cellulose-based adsorbents to improve adsorption capacity. Water Research, 2016, 91: 156-173. DOI:10.1016/j.watres.2016.01.008 |
| [32] | Goswami S, Syiem MB, Pakshirajan K. Cadmium removal by Anabaena doliolum Ind1 isolated from a coal mining area in Meghalaya, India:associated structural and physiological alterations. Environmental Engineering Research, 2015, 20(1): 41-50. |
 2019, Vol. 59
2019, Vol. 59