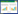中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王辑, 房晓彬, 吴彤. 2018
- Ji Wang, Xiaobin Fang, Tong Wu. 2018
- 植物乳杆菌JLK0142胞外多糖对RAW264.7巨噬细胞和免疫抑制小鼠的免疫调节作用
- Immunoregulatory effect of exopolysaccharide from Lactobacillus plantarum JLK0142 on RAW264.7 macrophages and immunosuppressed mice
- 微生物学报, 58(9): 1614-1624
- Acta Microbiologica Sinica, 58(9): 1614-1624
-
文章历史
- 收稿日期:2017-11-24
- 修回日期:2018-01-25
- 网络出版日期:2018-02-09
乳杆菌胞外多糖(exopolysaccharide,EPS)是乳杆菌在生长代谢过程中分泌到细胞壁外的黏液多糖或荚膜多糖的总称[1]。乳杆菌EPS具有多种生理功能,如增强人体免疫力、抑制有害菌、降血压、抗氧化、抗肿瘤、抗溃疡、抗病毒和改善肠道微生态环境等,其中免疫调节是乳杆菌EPS最重要的生物学活性,随着细胞生物学和分子生物学的发展,人们对免疫系统的认识越来越深入[2-10]。免疫系统的紊乱不仅会产生多种疾病,而且与人类的衰老有关[11]。研究表明,乳杆菌EPS在一般情况下对机体的免疫器官、特异性和非特异性免疫、细胞和体液免疫都有一定影响,能够在一定程度上增强机体的免疫调节能力[12-15]。然而,由于乳杆菌EPS结构的复杂性和来源的广泛性,迄今为止,在机理上对口服乳杆菌EPS后如何发挥免疫调节作用依然不清楚,导致学术界和消费者对该类产品的质量和功效心存疑虑,严重制约了多糖类保健食品市场的发展。
本研究为进一步探究乳杆菌EPS在细胞水平和动物水平上对免疫调节功能的影响及其可能相关的作用机制,将实验室筛选到的植物乳杆菌JLK0142进行发酵,从发酵产物中分离纯化EPS,分别以RAW264.7巨噬细胞和环磷酰胺致免疫抑制小鼠作为研究模型,考察L. plantarum JLK0142 EPS的免疫调节作用。
1 材料和方法 1.1 材料和试剂小鼠RAW264.7巨噬细胞株,中国科学院细胞库;植物乳杆菌(Lactobacillus plantarum) JLK0142,本实验室筛选并保存;细菌脂多糖(LPS),美国Sigma公司;BALB/C小鼠,购自长春生物制品研究所有限责任公司,许可证号:scXK(吉)2011-0003。
ELISA试剂盒,北京达科为生物技术公司;环磷酰胺,江苏恒瑞医药股份有限公司;胎牛血清、RPMI-1640培养基,美国HyClone公司;DEAE-Sepharose Fast Flow,英国Waterman公司;Sepharose CL-6B,Amersham Bioscience公司;透析袋(截流分子质量为8000–14000 Da),北京鼎国生物技术有限公司。
SDM培养基:胰蛋白胨10.0 g、YNB (酵母氮源) 6.7 g、K2HPO4 2.0 g、无水乙酸钠5.0 g、柠檬酸钠5.0 g、MgSO4·7H2O 0.2 g、MnSO4·H2O 0.05 g、葡萄糖20.0 g、吐温80 1.0 mL,加蒸馏水至1000 mL,1 mol/L乙酸调pH 6.6,121 ℃灭菌15 min。
1.2 仪器和设备高速冷冻离心机,德国HERMLE公司;酶标仪,美谷分子仪器有限公司;数显pH计,奥豪斯仪器(上海)有限公司;CO2培养箱,德国BINDER公司;真空冷冻干燥机,北京博医康仪器有限公司;高压蒸汽灭菌锅,日本ALP公司;全自动部分收集器,上海嘉鹏科技有限公司;恒流泵,上海琪特分析仪器有限公司。
1.3 胞外多糖的制备 1.3.1 粗多糖的制备: 将活化好的L. plantarum JLK0142按3% (V/V)的接种量接种到液体SDM培养基中,37 ℃培养24 h,将发酵液于100 ℃下灭酶15 min,加入80% (M/V)的三氯乙酸(TCA)至终浓度为4%,室温下搅拌2 h后离心(10000×g,4 ℃,45 min),去除多余菌体和蛋白。取上清液加入其2倍体积的无水乙醇,4 ℃冷藏过夜,离心后取沉淀溶解于蒸馏水中,装入8000–14000 Da的透析袋中48 h (每8 h换水)。最后浓缩、冷冻干燥即得粗多糖。 1.3.2 粗多糖的纯化: 将提取的粗多糖充分溶解于水中,经DEAE-Sepharose Fast Flow离子交换层析柱(2.6 cm×40 cm),依次用蒸馏水(1–30管)、0.2 mol/L NaCl (31–60管)、0.5 mol/L NaCl (61–90管)线性梯度洗脱,洗脱速度为1 mL/min,每管收集5 mL。分离得到的组分再经Sepharose CL-6B琼脂糖凝胶层析柱(2.5 cm×50 cm),选用0.9% (M/V) NaCl作为洗脱液,洗脱速度为0.5 mL/min,每管收集5 mL。纯化后的多糖用于体外细胞试验。 1.3.3 胞外多糖分子量的测定: 利用凝胶渗透色谱(GPC)联用多角度激光光散射仪(MALLS)法(GPC-MALLS-RI)测定纯化EPS的重均分子量(Mw)。测试条件:色谱柱(SB-806m-HQ 13 μm,300 mm×8.0 mm);折光率检测器(RI);柱温:40 ℃;流动相:0.1 mol/L NaNO3;流速:0.5 mL/min;进样量:200 μL;折光率指数(dn/dc):0.146。 1.4 细胞培养及试验分组RAW264.7细胞用DMEM完全培养基(100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清)于37 ℃、5% CO2培养箱中培养,待细胞长至80%–90%融合时使用胰酶消化后进行传代并分为8组,每组设5个复孔。空白对照组:只加完全培养基;阳性对照组:加入终浓度为1 μg/mL的LPS;EPS处理组:分别加入浓度为50、100、250、500、800、1000 μg/mL的纯化EPS。
1.5 EPS对巨噬细胞增殖的影响调整细胞浓度至1×105 cells/mL,培养2 h贴壁后,按照试验分组加入不同处理样品继续培养24 h,每孔加入5 mg/mL的噻唑蓝(MTT) 20 μL,继续培养4 h。弃掉上清液,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min,用酶标仪测定吸光度值(570 nm)。

|
调整细胞浓度至1×105 cells/mL,培养2 h贴壁后,按照试验分组加入不同处理样品继续培养24 h,弃掉上清液,每孔加入200 μL 0.075%中性红溶液,继续培养2 h;再吸弃培养液,用预温的D-Hanks液洗涤3次,每孔加200 μL裂解液(冰醋酸:无水乙醇体积为1:1),4 ℃静置过夜,用酶标仪测定吸光度值(570 nm)。
1.7 EPS对巨噬细胞分泌NO的影响调整细胞浓度至1×105 cells/mL,培养2 h贴壁后,按照试验分组加入不同处理样品继续培养24 h后,每孔吸取50 μL上清液至96孔板中,按照一氧化氮检测试剂盒说明书进行操作。根据标准曲线来计算样品中的NO含量。
1.8 实验动物及分组BALB/C小鼠48只,雌性,体质量18–22 g。将小鼠适应性喂养3 d后随机分为6组,每组8只,分别为空白对照组、模型对照组、阳性对照组及EPS高、中、低剂量组。除空白对照组外,各组小鼠在第1、2、3天腹腔注射80 mg/kg体重的环磷酰胺,建立免疫抑制小鼠模型。造模后阳性对照组灌胃盐酸左旋咪唑(40 mg/kg),高、中、低剂量组分别灌胃100、50、25 mg/kg体重的粗EPS,连续灌胃7 d,空白对照组和模型对照组给予等体积的生理盐水。实验期间,各组小鼠自由采食、饮水。
1.9 小鼠脾脏指数测定将小鼠眼球取血后颈椎脱臼处死,取脾脏,用滤纸吸干脏器表面血污,称重。按下列公式计算脾脏指数。

|
无菌条件下取脾脏制成细胞悬液。台盼蓝染色计数(活细胞数大于95%),调整细胞浓度为5×106个/mL。无菌条件下将脾细胞悬液加入含有ConA (2 μg/mL)的96孔培养板中,每孔200 μL,设空白对照组(只加细胞悬液),37 ℃、5% CO2恒湿培养箱中孵育72 h。取出培养板,每孔中加入10 μL MTT溶液(5 mg/mL),继续培养4 h后,每孔中加入100 μL DMSO,振摇10 min,待紫色结晶完全溶解后,酶标仪读取570 nm波长处OD值。

|
摘小鼠眼球取血,将血液室温自然凝固10–20 min,3000×g离心10 min。仔细收集上清液,待用。采用ELLSA法测定小鼠血清中IL-2和TNF-α含量。
1.12 统计分析采用SPSS16.0软件进行数据统计处理,实验数据用3次实验的平均值和标准偏差表示,即x±SD。用组间ANOVA进行统计分析,Turkey检验方法用于实验中比较各给药组与对照组之间差异的显著性。P > 0.05表示差异不显著,P < 0.05表示差异显著。
2 结果和分析 2.1 粗多糖的制备及分离纯化L. plantarum JLK0142的SDM发酵液经离心除蛋白菌体、三氯乙酸除蛋白、乙醇沉淀、透析、冻干,最终得到蓬松、白色的粗多糖样品。粗多糖经DEAE-Sepharose Fast Flow离子交换层析,只得到1个组分(图 1-A)。该组分再经Sepharose CL-6B琼脂糖凝胶层析,得到单一对称峰(图 1-B)。通过凝胶渗透色谱联用多角度激光光散射仪法测定该纯化组分的分子量为1.34×105 Da (图 2)。收集该纯化组分出峰管,经浓缩、透析、冷冻干燥获得纯化样品进行免疫活性研究。
|
| 图 1 L. plantarum JLK0142 EPS经DEAE-Sepharose Fast Flow (A)和Sepharose CL-6B (B)色谱柱的洗脱曲线 Figure 1 Elution profile of EPS from L. plantarum JLK0142 on DEAE-Sepharose Fast Flow (A) and Sepharose CL-6B column (B). |

|
| 图 2 L. plantarum JLK0142 EPS的GPC-MALLS-RI色谱图 Figure 2 GPC-MALLS-RI chromatogram of EPS from L. plantarum JLK0142. |
2.2 EPS对巨噬细胞增殖的影响
配制不同浓度的L. plantarum JLK0142 EPS,测定其对RAW264.7巨噬细胞增殖活性的影响。结果如图 3所示,与对照组相比,LPS处理组巨噬细胞的相对增值率显著升高(P < 0.01)。随着L. plantarum JLK0142 EPS浓度的增加,巨噬细胞的相对增殖率呈先上升后下降的趋势。EPS浓度为50–800 μg/mL时巨噬细胞的相对增长率呈正增长,并在浓度500 μg/mL时达到最大值为128.75%,显著高于对照组(P < 0.05),而在浓度1000 μg/mL时呈负增长。表明L. plantarum JLK0142 EPS在一定范围能促进RAW264.7巨噬细胞的增殖。

|
| 图 3 L. plantarum JLK0142 EPS对巨噬细胞增殖的影响(x±SD,n=5) Figure 3 Effect of EPS from L. plantarum JLK0142 on macrophages proliferation (x±SD, n=5). *P < 0.05, **P < 0.01 compared with control group; #P < 0.05, ##P < 0.01 compared with positive control (LPS) group. |
2.3 EPS对巨噬细胞吞噬能力的影响
配制不同浓度的L. plantarum JLK0142 EPS,测定其对RAW264.7巨噬细胞吞噬活性的影响。结果如图 4所示,与对照组相比,LPS处理组巨噬细胞的吞噬活性显著升高(P < 0.01)。与对照组相比,L. plantarum EPS在浓度50–250 μg/mL范围内,巨噬细胞吞噬的活性增加不显著。然而,当EPS浓度在500 μg/mL和800 μg/mL时,巨噬细胞的吞噬活性均显著高于对照组(P < 0.05),并在浓度800 μg/mL时达到最大值为0.89。表明L. plantarum JLK0142 EPS在一定浓度范围内能显著提高RAW264.7巨噬细胞的吞噬活性。

|
| 图 4 L. plantarum JLK0142 EPS对巨噬细胞吞噬活性的影响(x±SD,n=5) Figure 4 Effect of EPS from L. plantarum JLK0142 on macrophage phagocytosis (x±SD, n=5). *P < 0.05, **P < 0.01 compared with control group; #P < 0.05 compared with positive control (LPS) group. |
2.4 EPS对巨噬细胞分泌NO的影响
配制不同浓度的L. plantarum JLK0142 EPS,测定其对RAW264.7巨噬细胞NO分泌的影响。结果如图 5所示,与对照组相比,体外培养的巨噬细胞经LPS刺激后,NO的分泌量显著增加(P < 0.01)。与对照组相比,EPS在低浓度50–500 μg/mL范围内,巨噬细胞NO的分泌量增加不显著。然而,当EPS浓度为800 μg/mL和1000 μg/mL时,NO分泌量均显著高于对照组(P < 0.01),并在浓度800 μg/mL时达到最大值为27.56 μmol/L。表明高浓度的L. plantarum JLK0142 EPS能显著提高RAW264.7巨噬细胞NO的分泌量,具有作为免疫刺激剂的潜能。

|
| 图 5 L. plantarum JLK0142 EPS对巨噬细胞分泌NO的影响(x±SD,n=5) Figure 5 Effect of EPS form L. plantarum JLK0142 on NO production of macrophage (x±SD, n=5). **P < 0.01 compared with control group; ##P < 0.01 compared with positive control (LPS) group. |
2.5 EPS对小鼠脾脏指数的影响
由图 6可知,与空白对照组相比,模型对照组小鼠脾脏指数明显下降,说明环磷酰胺能使小鼠免疫功能受到抑制,免疫抑制模型构建成功。与模型对照组相比,阳性对照组、EPS中剂量组和高剂量组小鼠脾脏指数均显著提高(P < 0.01),而EPS低剂量组小鼠脾脏指数没有显著性差异。

|
| 图 6 L. plantarum JLK0142 EPS对免疫抑制小鼠脾脏指数的影响(x±SD,n=8) Figure 6 Effect of EPS form L. plantarum JLK0142 on spleen index in immunosuppressed mice (x±SD, n=8). *P < 0.05, **P < 0.01 compared with normal control group; ##P < 0.01 compared with model control group. |
2.6 EPS对小鼠T淋巴细胞增殖的影响
由图 7可知,与空白对照组相比,模型对照组小鼠T淋巴细胞增殖率显著下降(P < 0.01)。与模型对照组相比,阳性对照组、EPS中剂量组和高剂量组小鼠T淋巴细胞增殖率均显著提高(P < 0.01),而EPS低剂量组小鼠T淋巴细胞增殖率没有显著性差异。

|
| 图 7 L. plantarum JLK0142 EPS对免疫抑制小鼠脾淋巴细胞增殖的影响(x±SD,n=8) Figure 7 Effect of EPS from L. plantarum JLK0142 on spleen lymphocytes proliferation in immunosuppressed mice (x±SD, n=8). *P < 0.05, **P < 0.01 compared with normal control group; ##P < 0.01 compared with model control group. |
2.7 EPS对小鼠血清细胞因子的影响
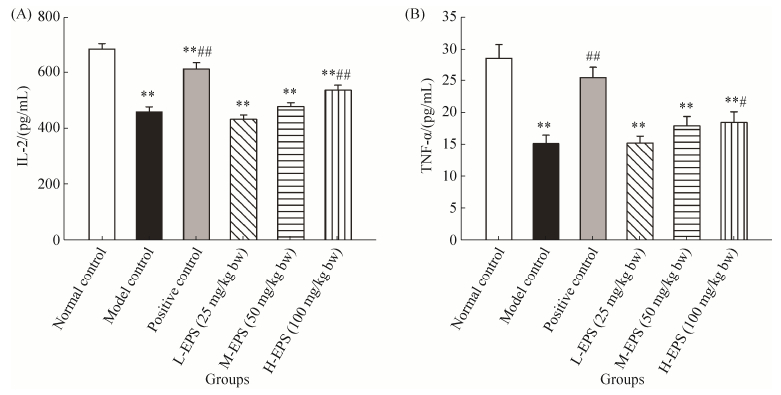
如图 8可知,与空白对照组相比,模型对照组小鼠血清细胞因子IL-2和TNF-α水平显著下降(P < 0.01)。与模型对照组相比,阳性对照组和EPS高剂量组小鼠血清细胞因子IL-2和TNF-α水平显著提高(P < 0.01,P < 0.05),而EPS低、中剂量组没有显著性差异。
|
| 图 8 L. plantarum JLK0142 EPS对免疫抑制小鼠血清细胞因子IL-2(A)和TNF-α(B)影响(x±SD,n=8) Figure 8 Effect of EPS form L. plantarum JLK0142 on serum cytokines IL-2 and TNF-α levels in immunosuppressed mice (x±SD, n=8); **P < 0.01 compared with normal control group; #P < 0.05, ##P < 0.01 compared with model control group. |
3 讨论
随着细胞生物学和分子生物学的发展,人们对免疫系统的认识越来越深。免疫系统的紊乱不仅会产生多种疾病,而且与人类的衰老有关。研究发现,一些植物源多糖具有很好的免疫调节作用[16-17]。作为天然安全无公害的食品级添加剂,植物乳杆菌EPS具有多种生理功能,其中免疫调节是植物乳杆菌EPS最重要的生物学活性。然而,目前有关植物乳杆菌EPS的免疫调节活性及作用机制的研究较少。本文主要对由本实验室分离纯化的L. plantarum JLK0142 EPS作用于RAW264.7巨噬细胞和免疫抑制小鼠的免疫调节活性展开研究。
离子交换柱层析分离方法不但可以保存被分离物的活性,而且分辨率较高。从DEAE-Sepharose Fast Flow色谱柱的梯度洗脱曲线可看出,植物乳杆菌JLK0142胞外多糖直接用去离子水洗脱下来,表明该多糖不带电荷,是中性多糖。通过凝胶渗透色谱联用多角度激光光散射仪法测定植物乳杆菌JLK0142 EPS的分子量为1.34×105 Da,符合植物乳杆菌EPS的分子量范围(105–106 Da)[18-19]。EPS的生物活性与分子量大小存在一定关系,分子量的大小可影响EPS的生物活性。例如,Bifidobacterium animalis RH产生的低分子量EPS (2.31×104 Da)的抗氧化活性要显著高于其他高分子量的EPS[19-20];而高分子量的EPS要比低分子量的EPS对肿瘤的抑制作用更强[21]。Ren等研究发现S. thermophiles产生的低分子量EPS (332 kDa)在1000 g/mL浓度下对RAW 264.7巨噬细胞NO的分泌量最大[22],略低于本研究中L. plantarum JLK0142 EPS在同等浓度下对RAW 264.7巨噬细胞NO的分泌量,推断可能是由于其分子量较大的原因,但有关EPS的免疫调节活性与分子量之间的关系还需要进一步深入的研究。
巨噬细胞是炎症反应的重要效应细胞,RAW264.7细胞作为巨噬细胞的一种,当病原体入侵或自身组织出现病理性改变时,它能激活机体的免疫系统,通过细胞内杀伤作用消灭抗原[23]。根据MTT实验结果,本研究中的L. plantarum JLK0142 EPS在50–800 μg/mL浓度范围内能提高巨噬细胞的相对增殖率,表明L. plantarum JLK0142 EPS对正常状态的巨噬细胞无毒性。同时,L. plantarum JLK0142 EPS能够显著增强巨噬细胞的吞噬活性来提高免疫作用。巨噬细胞受到刺激活化时会释放大量NO,NO是一种重要的活性气体分子,有细胞毒作用,可杀伤入侵的细菌、真菌等微生物和肿瘤细胞等,同时,在炎症损伤方面起着十分重要的作用[24]。本研究中,L. plantarum JLK0142 EPS能够促进巨噬细胞分泌NO,且呈一定的剂量依赖关系。由此可见,L. plantarum JLK0142 EPS可通过刺激巨噬细胞分泌NO从而对细菌等病原体产生杀伤和细胞毒作用,但这种促进作用弱于LPS,不会引起过度炎症反应。
脾脏是重要的免疫器官,它们可通过参与免疫反应、调节细胞免疫以及促进肿瘤细胞凋亡等途径抑制肿瘤细胞的生长。因此,脾脏的重量可直接反应机体的免疫水平[25]。环磷酰胺是一种烷化类的免疫抑制剂,能抑制免疫反应,引起肝脏和抗氧化酶的损害。本文通过腹腔注射环磷酰胺,建立免疫抑制小鼠模型。研究结果发现,模型对照组小鼠脾脏指数显著低于正常对照组小鼠,说明环磷酰胺使小鼠免疫功能受到抑制,当灌胃L. plantarum JLK0142 EPS后,各剂量组小鼠脾脏指数均有所增加,尤其是中剂量组和高剂量组小鼠脾脏指数均显著高于模型对照组(P < 0.01),表明L. plantarum JLK0142 EPS可在一定程度上改善免疫抑制小鼠脾脏的萎缩。这与Bleau等[26]的研究结果相似,Bleau等给免疫抑制小鼠灌胃L. rhamnosus RW-9595M胞外多糖,测定血清中溶血素抗体水平,同时测定小鼠免疫器官与体重的比值,最终证明,这株乳杆菌产生的EPS能够增加脾、胸腺指数和抗体积数,同时能显著促进IL-10的分泌。T淋巴细胞是参与机体细胞免疫反应,并在免疫应答中起调节作用的免疫细胞[27]。因此,T淋巴细胞的增殖能力是反应免疫能力的重要指标。本研究中,与模型对照组相比,EPS中剂量组和高剂量组小鼠T淋巴细胞增殖率均显著增强(P < 0.01),表明L. plantarum JLK0142 EPS能提高脾淋巴细胞转化能力。这与Shao等的研究结果相似。Shao等[28]研究浓度分别为10、100、1000 μg/mL的L. rhamnosus KF5胞外多糖对脾淋巴细胞增殖的影响,结果发现,脾细胞的增殖速度与EPS浓度呈现良好的剂量依赖关系,当EPS浓度为1000 μg/mL时获得了最高的增殖活性。
免疫细胞产生的许多细胞因子参与免疫系统的调节,而多糖对细胞因子以及受体表达的影响是其发挥抗炎作用的重要分子机制[29]。IL-2具有辅助抗体生成、促进淋巴细胞有丝分裂和增强对杀伤细胞的杀伤功能等生物学作用,是细胞因子的重要成员[30-31]。而TNF-α是巨噬细胞在炎症反应中产生的主要促炎细胞因子,可调节细胞的生长分化、增殖,调节免疫应答,以正反馈调控的形式参与许多炎症反应,具有重要的生物功能[32]。IL-2和TNF-α能够相互协调发挥一系列的免疫功能[33]。本研究结果发现,高剂量组小鼠血清中IL-2和TNF-α含量与模型对照组相比均显著提高(P < 0.01,P < 0.05),而低、中剂量组则差异不显著,表明高剂量组的L. plantarum JLK0142 EPS能增加IL-2和TNF-α的分泌量来调节机体免疫功能,低、中剂量组的EPS则作用不明显。
综上所述,L. plantarum JLK0142 EPS不仅能在体外细胞实验中提高RAW264.7巨噬细胞的增殖率、吞噬活性和NO分泌量,还可在体内动物实验中通过增加小鼠脾脏指数、促进T淋巴细胞增殖、释放细胞因子IL-2和TNF-α等途径全面发挥对免疫抑制小鼠的免疫调节作用。今后还需要对L. plantarum JLK0142 EPS的结构和理化特性进行深入研究,并从L. plantarum JLK0142 EPS对巨噬细胞免疫相关蛋白表达水平入手,探索其构效关系及可能作用机理,为进一步开发具有潜在免疫调节功能的保健食品奠定理论基础。
| [1] | Sjögren YM, Tomicic S, Lundberg A, Böttcher MF, Björkstén B, Sverremark-Ekström E, Jenmalm MC. Influence of early gut microbiota on the maturation of childhood mucosal and systemic immune responses. Clinical and Experimental Allergy, 2009, 39(12): 1842-1851. DOI:10.1111/j.1365-2222.2009.03326.x |
| [2] | Hidalgo-Cantabrana C, Nikolic M, López P, Suárez A, Miljkovic M, Kojic M, Margolles A, Golic N, Ruas-Madiedo P. Exopolysaccharide-producing Bifidobacterium animalis subsp. lactis strains and their polymers elicit different responses on immune cells from blood and gut associated lymphoid tissue. Anaerobe, 2014, 26: 24-30. DOI:10.1016/j.anaerobe.2014.01.003 |
| [3] | Liu CF, Tseng KC, Chiang SS, Lee BH, Hsu WH, Pan TM. Immunomodulatory and antioxidant potential of Lactobacillus exopolysaccharides. Journal of the Science of Food and Agriculture, 2011, 91(12): 2284-2291. |
| [4] | Kšonžeková P, Bystrický P, Vlčková S, Pätoprstý V, Pulzová L, Mudroňová D, Kubašková T, Csank T, Tkáčiková L. Exopolysaccharides of Lactobacillus reuteri:Their influence on adherence of E. coli to epithelial cells and inflammatory response. Carbohydrate Polymers, 2016, 141: 10-19. DOI:10.1016/j.carbpol.2015.12.037 |
| [5] | Ai LZ, Zhang H, Guo BH, Chen W, Wu ZJ, Wu Y. Preparation, partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W. Carbohydrate Polymers, 2008, 74(3): 353-357. DOI:10.1016/j.carbpol.2008.03.004 |
| [6] | Zheng LP, Zou T, Ma YJ, Wang JW, Zhang YQ. Antioxidant and DNA damage protecting activity of exopolysaccharides from the endophytic bacterium Bacillus cereus SZ1. Molecules, 2016, 21: 174. DOI:10.3390/molecules21020174 |
| [7] | Wang K, Li W, Rui X, Chen XH, Jiang M, Dong MS. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810. International Journal of Biological Macromolecules, 2014, 63: 133-139. DOI:10.1016/j.ijbiomac.2013.10.036 |
| [8] | Masood MI, Qadir MI, Shirazi JH, Khan IU. Beneficial effects of lactic acid bacteria on human beings. Critical Reviews in Microbiology, 2011, 37(1): 91-98. DOI:10.3109/1040841X.2010.536522 |
| [9] | Arena A, Maugeri TL, Pavone B, Iannello D, Gugliandolo C, Bisignano G. Antiviral and immunoregulatory effect of a novel exopolysaccharide from a marine thermotolerant Bacillus licheniformis. International Immunopharmacology, 2006, 6(1): 8-13. DOI:10.1016/j.intimp.2005.07.004 |
| [10] | Salazar N, Binetti A, Gueimonde M, Alonso A, Garrido P, González del Rey C, González C, Ruas-Madiedo P, de los Reyes-Gavilán CG. Safety and intestinal microbiota modulation by the exopolysaccharide-producing strains Bifidobacterium animalis IPLA R1 and Bifidobacterium longum IPLA E44 orally administered to Wistar rats. International Journal of Food Microbiology, 2011, 144(3): 342-351. DOI:10.1016/j.ijfoodmicro.2010.10.016 |
| [11] | Nikinmaa M, Alam SA, Raulio M, Katina K, Kajala I, Nordlund E, Sozer N. Bioprocessing of bran with exopolysaccharide producing microorganisms as a tool to improve expansion and textural properties of extruded cereal foams with high dietary fibre content. LWT-Food Science and Technology, 2017, 77: 170-177. DOI:10.1016/j.lwt.2016.11.041 |
| [12] | Petry S, Furlan S, Waghorne E, Saulnier L, Cerning J, Maguin E. Comparison of the thickening properties of four Lactobacillus delbrueckii subsp. bulgaricus strains and physicochemical characterization of their exopolysaccharides. FEMS Microbiology Letters, 2003, 221(2): 285-291. DOI:10.1016/S0378-1097(03)00214-3 |
| [13] | Hess SJ, Roberts RF, Ziegler GR. Rheological properties of nonfat yogurt stabilized using Lactobacillus delbrueckii ssp. bulgaricus producing exopolysaccharide or using commercial stabilizer systems. Journal of Dairy Science, 1997, 80(2): 252-263. DOI:10.3168/jds.S0022-0302(97)75933-2 |
| [14] | Prasanna PHP, Grandison AS, Charalampopoulos D. Microbiological, chemical and rheological properties of low fat set yoghurt produced with exopolysaccharide (EPS) producing Bifidobacterium strains. Food Research International, 2013, 51(1): 15-22. DOI:10.1016/j.foodres.2012.11.016 |
| [15] | Behare PV, Singh R, Nagpal R, Rao KH. Exopolysaccharides producing Lactobacillus fermentum strain for enhancing rheological and sensory attributes of low-fat dahi. Journal of Food Science and Technology, 2013, 50(6): 1228-1232. DOI:10.1007/s13197-013-0999-6 |
| [16] |
Shang QH, Xie YH, Zhang GG, Jiang SZ, Yang ZB, Yang WR, Zhang CY. Immune regulation roles of phytogenic polysaccharides and its mechanisms. Chinese Journal of Animal Nutrition, 2015, 27(1): 49-58.
(in Chinese) 尚庆辉, 解玉怀, 张桂国, 姜淑贞, 杨在宾, 杨维仁, 张崇玉. 植物多糖的免疫调节作用及其机制研究进展. 动物营养学报, 2015, 27(1): 49-58. DOI:10.3969/j.issn.1006-267x.2015.01.008 |
| [17] |
Chen JL, Zhang YQ, Yuan Y, Wu SR, Ming J. Progress in research on immune-regulatory effects of plant polysaccharides on macrophages through NF-κB signaling pathway. Food Science, 2015, 36(23): 288-294.
(in Chinese) 陈金龙, 张月巧, 袁娅, 吴素蕊, 明建. 植物多糖通过NF-κB信号通路对巨噬细胞的免疫调节作用研究进展. 食品科学, 2015, 36(23): 288-294. DOI:10.7506/spkx1002-6630-201523053 |
| [18] | Zhang L, Liu CH, Li D, Zhao YJ, Xue Z, Zeng XP, Yang ZN, Li SY. Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88. International Journal of Biological Macromolecules, 2013, 54: 270-275. DOI:10.1016/j.ijbiomac.2012.12.037 |
| [19] | Wang J, Zhao X, Yang YW, Zhao AM, Yang ZN. Characterization and bioactivities of an exopolysaccharide produced by Lactobacillus plantarum YW32. International Journal of Biological Macromolecules, 2015, 74: 119-126. DOI:10.1016/j.ijbiomac.2014.12.006 |
| [20] | Xu RH, Shen Q, Ding XL, Gao WG, Li PL. Chemical characterization and antioxidant activity of an exopolysaccharide fraction isolated from Bifidobacterium animalis RH. European Food Research and Technology, 2011, 232(2): 231-240. DOI:10.1007/s00217-010-1382-8 |
| [21] | Rajoka MSR, Jin ML, Zhao HB, Li Q, Shao DY, Jiang CM, Huang QS, Yang H, Shi JL, Hussain N. Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk. LWT-Food Science and Technology, 2018, 89: 638-647. DOI:10.1016/j.lwt.2017.11.034 |
| [22] | Ren W, Xia YJ, Wang GQ, Zhang H, Zhu S, Ai LZ. Bioactive exopolysaccharides from a S. thermophilus strain:Screening, purification and characterization. International Journal of Biological Macromolecules, 2016, 86: 402-407. DOI:10.1016/j.ijbiomac.2016.01.085 |
| [23] |
Li RJ. The effect of Lactobacillus LC2W cell fraction on macrophage activity and cytokine secretion. Master Dissertation of Shanghai Ocean University, 2010. (in Chinese) 李瑞君. 干酪乳杆菌LC2W细胞组分对巨噬细胞活性及细胞因子分泌的影响. 上海海洋大学硕士学位论文, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10264-1011304812.htm |
| [24] |
Xie YX, An LG, Yang GW. Immunomodulatory activity of botanical polysaccharides on macrophage. Chinese Journal of Biochemistry and Molecular Biology, 2008, 24(4): 307-314.
(in Chinese) 谢燕霞, 安利国, 杨桂文. 植物多糖对巨噬细胞的免疫调节作用. 中国生物化学与分子生物学报, 2008, 24(4): 307-314. DOI:10.3969/j.issn.1007-7626.2008.04.004 |
| [25] |
Wang J. Separation, screening, molecular characterization and application of exopolysaccharide-producing Lactobacillus plantarum strains. Doctor Dissertation of Jilin University, 2015. (in Chinese) 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究. 吉林大学博士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10183-1015590881.htm |
| [26] | Bleau C, Monges A, Rashidan K, Laverdure JP, Lacroix M, van Calsteren MR, Millette M, Savard R, Lamontagne L. Intermediate chains of exopolysaccharides from Lactobacillus rhamnosus RW-9595M increase IL-10 production by macrophages. Journal of Applied Microbiology, 2010, 108(2): 666-675. DOI:10.1111/jam.2009.108.issue-2 |
| [27] |
Wang MS, Min WH, Shen MH, Liu W, Miao XY, Mao J, Liu JS. Effect of enzymatic hydrolysates of hazelnut (Corylus heterophylla Fisch.) from Changbai mountain on the immune function in mice. Modern Food Science & Technology, 2016, 32(2): 1-7.
(in Chinese) 王明爽, 闵伟红, 沈明浩, 刘威, 苗欣宇, 毛晶, 刘景圣. 长白山榛仁(Corylus heterophylla Fisch.)蛋白酶解物对小鼠免疫功能的影响. 现代食品科技, 2016, 32(2): 1-7. |
| [28] | Shao L, Wu ZJ, Zhang H, Chen W, Ai LZ, Guo BH. Partial characterization and immunostimulatory activity of exopolysaccharides from Lactobacillus rhamnosus KF5. Carbohydrate Polymers, 2014, 107: 51-56. DOI:10.1016/j.carbpol.2014.02.037 |
| [29] |
Li FF, Huang DF, Jiang LM, Xie MY. Immunoregulatory effect of polysaccharide from the seeds of Plantago asiatica L. on RAW264.7 cells stimulated with lipopolysaccharide. Food Science, 2014, 35(23): 249-252.
(in Chinese) 李芬芬, 黄丹菲, 江乐明, 谢明勇. 大粒车前子多糖对脂多糖刺激RAW264.7巨噬细胞的免疫调节作用. 食品科学, 2014, 35(23): 249-252. DOI:10.7506/spkx1002-6630-201423048 |
| [30] | Ohri CM, Shikotra A, Green RH, Waller DA, Bradding P. Tumour necrosis factor-alpha expression in tumour islets confers a survival advantage in non-small cell lung cancer. BMC Cancer, 2010, 10: 323. DOI:10.1186/1471-2407-10-323 |
| [31] | Rosenberg SA. IL-2:The first effective immunotherapy for human cancer. IThe Journal of Immunology, 2014, 192(12): 5451-5458. DOI:10.4049/jimmunol.1490019 |
| [32] |
Li WJ, Nie SP, Yu Q, Li JE, Xie MY. Immune modulation of polysaccharides from Ganoderma atrum on immunosuppressed mice. Food Science, 2009, 30(19): 297-299.
(in Chinese) 李文娟, 聂少平, 余强, 李景恩, 谢明勇. 黑灵芝多糖对免疫抑制小鼠的免疫调节作用. 食品科学, 2009, 30(19): 297-299. DOI:10.3321/j.issn:1002-6630.2009.19.070 |
| [33] | Habijanic J, Berovic M, Boh B, Plankl M, Wraber B. Submerged cultivation of Ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-α, IL-12, IFN-γ, IL-2, IL-4, IL-10 and IL-17. New Biotechnology, 2015, 32(1): 85-95. DOI:10.1016/j.nbt.2014.07.007 |
 2018, Vol. 58
2018, Vol. 58