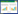中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 鲁芳, 张蓓, 刘永, 宋迎, 郭刚兴, 杨培龙, 姚斌, 郭素娟, 高伟. 2018
- Fang Lu, Bei Zhang, Yong Liu, Ying Song, Gangxing Guo, Peilong Yang, Bin Yao, Sujuan Guo, Wei Gao. 2018
- 双功能域β-折叠桶碱性植酸酶蛋白序列分析与酶学特性
- Sequencing and characterization of dual-domain β-propeller alkaline phytase
- 微生物学报, 58(9): 1582-1592
- Acta Microbiologica Sinica, 58(9): 1582-1592
-
文章历史
- 收稿日期:2017-11-01
- 修回日期:2017-12-26
- 网络出版日期:2018-03-20
2. 北京林业大学理学院, 北京 100083;
3. 中国农业科学院饲料研究所, 农业部饲料生物技术重点实验室, 北京 100081
2. School of Sciences, Beijing Forestry University, Beijing 100083, China;
3. Key Laboratory for Feed Biotechnology of the Ministry of Agriculture, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Wei Gao, Tel:+86-10-62338136, E-mail:w_gao@bjfu.edu.cn
磷是生命体维持生命活动的六大必需元素之一,地球表面上的磷元素的储量较少[1]。一些专家预测,世界的磷矿石到2050年可能会被耗尽[2]。自然界中,有相当大的一部分磷是以植酸的形式存在的,植酸和它的衍生物中所含有的有机磷可占到总磷的一半以上。植酸非常稳定,加热、强酸均很难使其分解,植酸中的磷元素不能被直接吸收和利用[3],这就限制了磷的循环利用。目前降解植酸的一个有效的方法为酶解法,即采用植酸酶降解植酸。植酸酶可以分解植酸,释放出难以被利用的植酸形式的磷,从而增加了磷的有效性。
植酸酶,全称为肌醇六磷酸磷酸水解酶,是催化植酸及植酸盐类水解生成肌醇或肌醇衍生物以及相应的磷酸一类酶的统称[4]。人们对植酸酶的研究已经持续了近百年,但是直到最近二三十年内植酸酶的研究才飞速发展起来[5],现在对于植酸酶的研究仍然是当前研究的热点。
根据结构和催化机理,植酸酶可分为组氨酸酸性磷酸酶(HAP)、β-折叠桶植酸酶(BPP)、半胱氨酸磷酸酶植酸酶(CP)和紫色酸性磷酸酶植酸酶(PAP)[6]。BPP的分子结构中有一特殊的折叠桶结构,故因此而得名。这类植酸酶最早在芽孢杆菌中发现[7],目前发现的BPP大多数仍然来源于芽孢杆菌[8-10],是已发现植酸酶中唯一中性偏碱的植酸酶(pH 6.0–8.0)。相对于已经市场化的HAP,BPP有较高的热稳定性,更易降解植酸,更适于中性偏碱性环境的应用。一些研究表明,BPP在陆地和水体环境分布最为广泛[6, 10],因此,BPP具有更大的社会需求和市场推广前景。但是,由于BPP的比活不高,分离纯化困难,限制了其工业化的进程。获得较高酶活性的BPP是其进行商业化生产的当务之急。
研究者前期报道了双功能域β-折叠桶植酸酶(phyH)的2个功能域(N端功能域和C端功能域)之间关系以及对酶活性的影响[11],该酶具有两个协同作用的功能域,并且与目前已经发现的一些其他种类BPP植酸酶相比,其酶活性较高[12]。之后,我们对PhyH进行了重新构建,截去前端的40氨基酸的信号肽,重组蛋白(PhyHT)大量表达,以包涵体的形式存在于沉淀中,经过变复性以及分离纯化后得到了具有催化活性的蛋白溶液,得到的植酸酶比活力显著提高[13-14]。另外,我们对phyHT进行了初步晶体学研究[13],有希望解析出其三维晶体结构,明确其功能机制。phyHT的2个功能域之间具有协同作用,使得植酸酶的催化活性大大提高,这可能是微生物应对自然界植酸难以水解的一种重要机制。本研究对双功能域β-折叠桶植酸酶蛋白序列进行了生物信息学分析及预测,为后期揭示该酶的催化机制提供线索。同时,对phyHT进行表达纯化以及酶学特性的研究,为将来广泛的应用提供理论依据。
1 材料和方法 1.1 菌株及质粒含有双功能域β-折叠桶植酸酶全长phyHT(菌株Bacillus sp. HJB17,菌株登记为ACCC 05550)基因的载体重组质粒(pET-28b-phyHT)为实验室前期构建获得[13, 15];表达菌株Escherichia coli BL21 (DE3)购自宝日医生物技术(北京)有限公司。
1.2 培养基和溶液LB液体培养基:蛋白胨10 g;酵母提取物5 g;氯化钠10 g;加去离子水至1000 mL,分装,125 ℃灭菌20 min。
植酸钠底物溶液:50 mmol/L Tris-HCl,2 mmol/L植酸钠,1 mmol/L氯化钙,pH校准到实验所对应的范围。
显色剂(钼酸铵-硫酸亚铁):50 mmol/L Tris-HCl,5.5%硫酸,1.5%钼酸铵,2.7%硫酸亚铁。
终止液:10%TCA。
1.3 phyHT蛋白序列分析将实验室保存的含有pET-28b-phyHT重组质粒进行测序。氨基酸序列使用蛋白质数据库(Protein databank,PDB)搜索,从相似性较高的蛋白质序列中,选取2个与phyHT蛋白同源性最高的蛋白进行序列对比。应用蛋白专家分析系统,对得到的phyHT蛋白的分子量、等电点(Compute pI/MW)、基本理化性质(ProtParam)、二级结构(CFSSP)、亲疏水性(ProtScale)等进行分析与预测。SMART对蛋白的二级结构和蛋白结构域进行预测。GlobPlot工具预测PhyHT的球型结构域。SWISS-MODEL工具对phyHT的三级结构进行预测。
1.4 phyHT蛋白的制备根据前期研究[13-15]中表述的方法对phyHT蛋白进行诱导表达、变复性、分离纯化,获得具有活性的phyHT蛋白溶液。具体操作为:将实验室保存的含有pET-28b-phyHT重组质粒[15]的菌液接种到5 mL LB培养基(含100µg/mL卡那霉素)进行活化,提取质粒。将重组质粒转入表达菌株Escherichia coli BL21(DE3)中,37 ℃培养至OD600值达到0.6–0.8时,加入IPTG至终浓度0.2 mmol/L,诱导4–6 h。离心,收集菌体,超声波破碎,12% SDS-PAGE检测到目的蛋白在沉淀中以包涵体的形式存在。利用梯度透析的方法进行变复性[13-14],得到phyHT粗蛋白溶液。应用镍柱亲和层析以及分子筛的方法对复性后phyHT蛋白进行分离纯化,得到具有一定催化活性的纯度高、稳定性好的蛋白溶液。12% SDS-PAGE检测蛋白的分子量以及纯度,考马斯亮蓝法测定蛋白浓度。
1.5 phyHT蛋白酶学特性研究 1.5.1 植酸酶酶活测定: 植酸酶酶活性测定方法采用硫酸亚铁-钼蓝显色法[15-16]:取100 µL植酸酶溶液,在37 ℃水浴中孵育5 min,加入400 µL的底物溶液,37 ℃水浴反应15 min。加入500 µL的终止液对反应进行终止。加入500 µL显色剂,在室温静置10 min,使其充分显色,低速离心10 min,除去部分不可见的沉淀杂质,在700 nm波长下测定溶液的OD值。设置对照实验,对照组为:100 µL植酸酶液先加入500 µL终止液使酶失活,再以同样的方法进行后续测定。 1.5.2 phyHT主要酶学特性研究: (1) 最适反应温度测定:将phyHT蛋白溶液在pH为8.0的缓冲体系及不同温度(10–65 ℃)下,按1.5.1的方法,进行酶促反应,测定phyHT的酶活性。(2)最适pH测定:在最适温度下,将phyHT蛋白溶液于pH为3.0–9.0的条件下,按1.5.1的方法,进行酶促反应,测定phyHT的酶活性。(3)温度耐受性测定:将phyHT分别在不同的温度(20–65 ℃)下,孵育不同的时间,之后立即置于冰中冷却,按1.5.1的方法,最适反应条件下,测定phyHT的酶活性。(4) pH稳定性:将phyHT在一系列不同pH缓冲液中处理30 min后,在最适温度与pH条件下,按1.5.1的方法,测定phyHT的酶活性。(5)米氏常数与最大反应速率测定(Km值,Vmax):配置不同浓度(0.1 mmol/L–10.0 mmol/L)的底物溶液,在最适反应条件下,按1.5.1的方法,测定phyHT的酶活性。通过LineweaveBurk双倒数曲线法[17],计算出表观Km、Vmax。(6)金属离子对酶活性的影响:在酶促反应体系中,添加不同浓度的不同的金属离子。按1.5.1的方法,最适反应条件下,测定phyHT的酶活性。(7)贮存稳定性测定:将phyHT在最适反应缓冲液中保持,置于4 ℃冰箱中,每隔7 d测定phyHT的酶活性。 2 结果和分析 2.1 生物信息学分析 2.1.1 phyHT蛋白序列比对及基本理化性质分析: phyHT蛋白序列由phyH (ADZ99372.1)截去了N端信号肽的40个氨基酸后加上pET-28b(+)载体的表达标签,共633个氨基酸组成。在已知结构的BPP中,phyHT与来自Bacillus amyloliquefaciens的热稳定植酸酶(TS-Phy,PDB编号为1cvm)[18]以及来自于Bacillus subtilis的3-植酸酶(3-phytase,PDB编号为3amr)[19],结构相似性较高,其部分序列比对结果如图 1。
|
| 图 1 phyHT的部分序列的对比分析 Figure 1 Partial amino acid sequence alignment of phyHT. |
phyHT的理论等电点(pI)为5.37,相对分子量(MW)为69321.68 Da。分子式:C3045H4792N884O945S13。其中Leu、Ala、Gln含量较高分别为12.2%、10.0%,8.7%。正电荷(Arg+Lys)和负电荷(Asp+Glu)氨基酸分别为45和71个。总平均亲水性:–0.263,为亲水性蛋白。
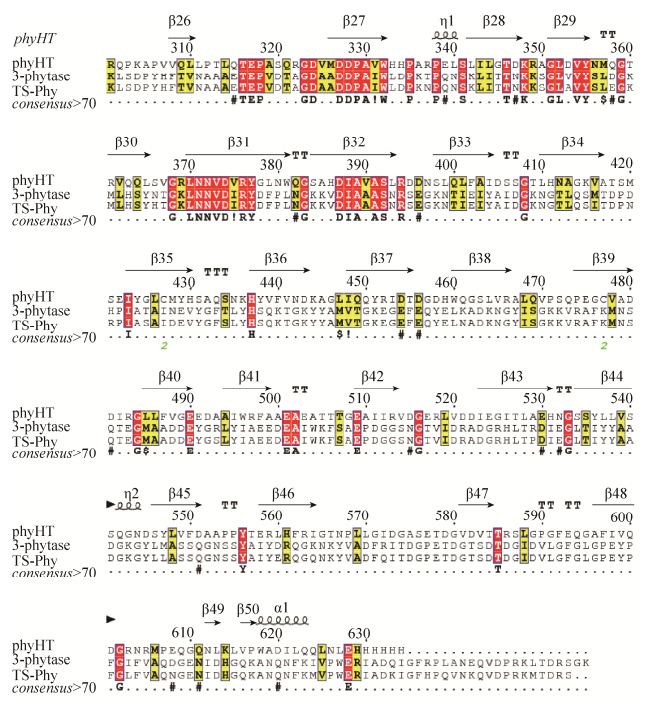
2.1.2 phyHT的二级结构及亲疏水性预测: 通过蛋白质专家分析系统(ExPASy)的CFSSP工具对phyHT的二级结构进行预测。如图 2-A可知,二级结构的phyHT中螺旋(helix)、片层(sheet)、转角(turn)比例分别为67.9%、63.7%、12.6%。该蛋白主要由α-螺旋以及β-转角组成,这与phyHT属于β-折叠桶植酸酶的结构相符合。采用ProtScale工具进行亲疏水性分析,如图 2-B所示,氨基酸预测值大部分为负值,同时根据上述预测的蛋白总平均亲水性值–0.263,进一步说明phyHT是一种亲水性蛋白。
|
| 图 2 phyHT蛋白分析 Figure 2 PhyHT protein analysis. A: Prediction of secondary structure for phyHT; B: Predicted hydrophobicity/hydrophilicity of the phyHT; C: Disorder globularity domain predictor of phyHT; D: The domain structure analyzed of phyHT by SMART. |
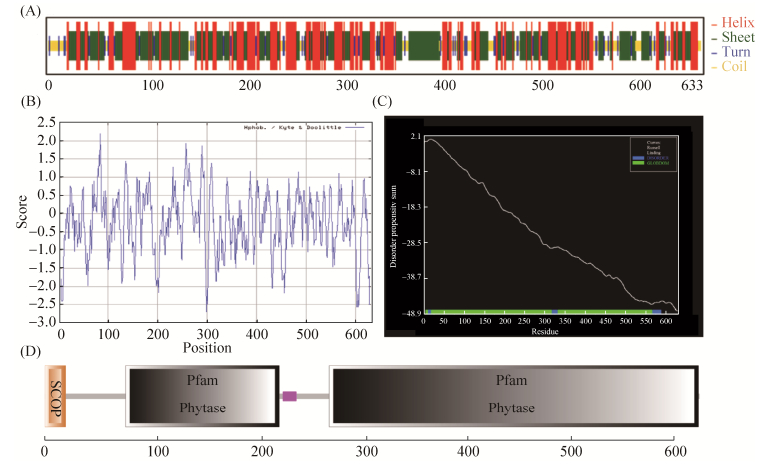
2.1.3 phyHT蛋白固有无序化区、球蛋白区预测: 利用GlobPlot version 2.3软件预测氨基酸序列中的紊乱区、球蛋白区,结果显示phyHT氨基酸序列中存在3个固有无序化区,分别位于11–18、318–331、567–588氨基酸位置。由于蛋白质紊乱区氨基酸具有可变性,该区域很可能与phyHT的酶活性发挥或蛋白相互作用相关,在探寻蛋白功能机制时应当重点关注。该蛋白存在2个潜在的球蛋白区,位于4–317、332–566氨基酸位置(图 2-C),球形蛋白区的氨基酸相对稳定。 2.1.4 phyHT跨膜区及功能结构域分析: SMART软件分析phyHT氨基酸序列结果如图 2-D,该蛋白在氨基酸序列含有2个植酸酶结构域区域(80–228,276–632氨基酸),属于典型的植酸酶蛋白,在232–243氨基酸处有一个低复杂度区,没有推测出有跨膜区域的存在。 2.1.5 phyHT蛋白三级结构预测: 应用SWISS-MODEL在线工具对蛋白进行三级结构预测,找到序列相似性在25%以上的较优模板50个,应用SWISS-MODEL上的build model功能,进行三级结构的预测,分别以5wyj.16.A、5gje.1.A、3s2k.1.B为模板,构建三级结构的模型,得到3个phyHT的模型,其结构模型如图 3。预测的三级结构以β片层为主,占主要的比例,其次是α螺旋和无规则卷曲,这与该蛋白二级结构的预测结果相一致。
|
| 图 3 phyHT蛋白的三级结构 Figure 3 The tertiary structure of phyHT. A: templates, 5wyj.16.A; B: templates, 5gje.1.A; C: templates, 3s2k.1.B. |
2.2 phyHT的表达纯化
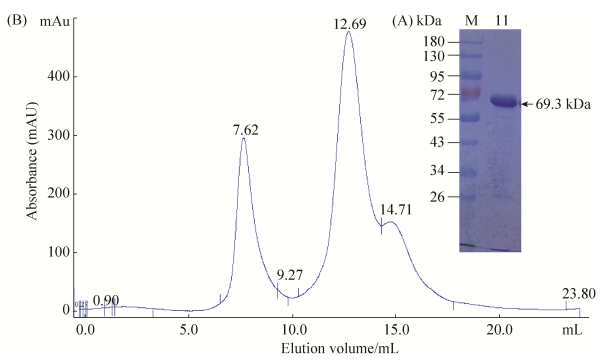
phyHT在Escherichia coli原核表达体系中进行了诱导表达,phyHT蛋白以无活性的包涵体形式存在,通过变复性的方法得到目的蛋白phyHT。经过镍柱亲和层析收集峰值,再经分子筛层析进一步分离纯化,得到纯度较高的目的蛋白样品。由分子筛图谱可以看出,PhyHT单体蛋白在12.69 mL处出现峰值,如图 4-B所示。对分离纯化的蛋白进行12%的SDS-PAGE检测,如图 4-A所示:获得高纯度的phyHT,其分子量为69.3 kDa,与目的蛋白相符合,且蛋白的纯度较高,几乎没有杂蛋白的存在。
|
| 图 4 phyHT分子筛与SDS-PAGE电泳图 Figure 4 Purification of phyHT monomer on gel filtration column and SDS polyacrylamide gradient gel analysis. A: 12% SDS-PAGE of stained with Coomassie Brilliant Blue. Lane M: Protein marker; lane 1: phyHT which corresponding the peak 2 on the gel filtration profile. B: Purification profile of phyHT, which eluted as a symmetrical peak from the SEC Superdex G200 column (blue peak). The vertical coordinate is the absorbency value (mAU) and the horizontal coordinate is the volume of solution (mL). |
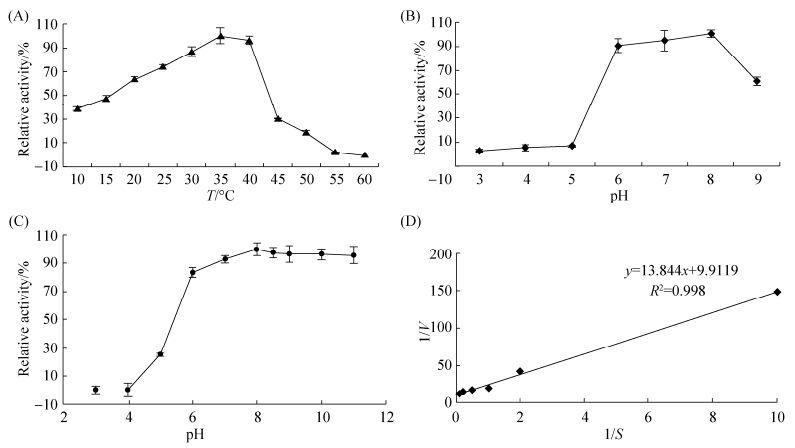
2.3 phyHT主要酶学特性 2.3.1 phyHT的最适反应温度: 在不同温度下测定phyHT的结果表明(图 5-A),该酶的最适反应温度为35 ℃,10–45 ℃下,酶的催化活性保持在30%以上,说明phyHT可以在较宽的温度范围内发挥其催化活性。
|
| 图 5 phyHT酶学性质分析 Figure 5 Analysis of enzymatic properties of phyHT. A: The optimal temperature of phyHT; B: The optimal pH of phyHT; C: pH stability of phyHT; D: Kinetic parameters of enzymatic reaction. Error bars represents the standard deviations. |
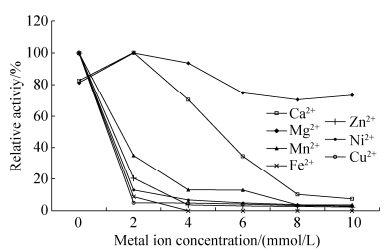
2.3.2 phyHT的最适反应pH: phyHT在pH 5–9内保持较好的催化活性,随着pH值的增加,酶活性增强,在pH值8.0达到高峰,然后随着pH值上升,酶活开始下降,其最适的pH为8.0,偏碱性,说明其属于碱性植酸酶。当pH小于5时,酶的催化活性降低到10%以下(图 5-B),该酶不适宜在酸性较强的环境下发挥作用。 2.3.3 phyHT的温度稳定性: 60 ℃下孵育15 min,phyHT的酶活力下降到15%以下,说明植酸酶在温度大于60 ℃的条件下,不能很好地保持酶活性。当温度在45 ℃时,孵育2 h后,植酸酶仍能保持80%的酶活性。当温度小于37 ℃时,孵育5 h以内植酸酶的活力几乎不变。说明在低温状态下,phyHT稳定性好。 2.3.4 phyHT的pH稳定性: 37℃时,phyHT在一系列不同pH缓冲液中处理30 min后,pH为6–12时,剩余酶活性维持在95%以上。当pH低于6时,酶活性迅速下降,到pH低于4时,几乎没有酶活性(图 5-C),说明该酶有很好的耐碱性,但耐酸性较差。 2.3.5 phyHT反应动力学参数: 如图 5-D所示,通过LineweaveBurk双倒数曲线作图[17],以植酸钠为底物的条件下,计算出表观Km、Vmax分别为1.397 mmol/L和100.89 µmol/(mg·min)。 2.3.6 金属离子对phyHT催化活性的影响: 如图 6所示,低浓度的Ca2+以及Mg2+对phyHT的催化效率有促进作用,浓度升高,酶活性受到抑制。phyHT属于β-折叠桶植酸酶,其催化活性的发挥具有钙离子依赖性,在一定的范围内具有促进催化效果的功能[20],Ca2+的浓度对phyHT催化活性的影响与前人研究的结果一致[11]。Fe2+、Mn2+、Zn2+、Cu2+、Ni2+等金属离子对酶活性有抑制作用,随着浓度的升高,植酸酶酶活性迅速降低。当金属离子浓度在2 mmol/L时,植酸酶的酶活性均降低到极低的水平。
|
| 图 6 金属离子对phyHT活性的影响 Figure 6 Effect of metal ions on phyHT activity. |
2.3.7 phyHT的储存稳定性: 在4 ℃冰箱中,放置60 d后,最适条件下测定phyHT的活性,酶活性仍保持70%左右,说明其具有很好的存储效果,稳定性较强。 3 讨论
BPP普遍存在于陆地和水生生态系统中,是自然界中分布最为广泛的一类植酸酶。基因组序列数据库调查显示,BPP主要分布于微生物中,而微生物来源的植酸酶,被广泛地应用于商业生产中[12, 20]。与目前生产上常用的HAP和PAP相比,BPP在中性偏碱性的pH范围内发挥催化活性,热稳定性高,底物专一性强[20]。这些特性预示着该类植酸酶将有广泛的应用前景。BPP是一类碱性植酸酶,大部分水生动物的胃肠道是碱性的,因此,碱性植酸酶制剂在水产养殖领域受到了研究者的关注。另外,BPP在常温下表现出较好的稳定性,所以在生产操作时有较大的优势,在土壤的改良、饲料的加工等诸多方面都有良好的应用前景。
双功能域BPP区别于单功能域的BPP,具有两个功能域以及相对较高的催化活性。一些双功能域BPP在NCBI数据库的微生物基因组被发现,并且以2个功能域为其分类的一个特性,具有2个保守的半胱氨酸残基。这一类植酸酶广泛存在于γ-Proteobacteria中如Shewanella sp.,Pseudomonas sp.和Idiomarina sp.[6]。
本研究所涉及到的双功能域β-折叠桶植酸酶(phyHT),由氮末端一个不完整的植酸酶功能域以及一个碳末端的完整的植酸酶结构域构成。是在Bacillus sp. HJB17中发现的第一个有报道的芽孢杆菌属的双功能域BPP[11],其催化活性高于单功能域植酸酶。研究发现,其N末端功能域不能直接发挥催化功能,但是它的存在提高了单功能域植酸酶的整体酶活性。将其基因与其他单功能域BPP基因以及其他类型的单功能域植酸酶(HAP和CP)基因构建连接,表达纯化蛋白后,酶活性提高了1.0–2.5倍。C末端功能域为典型的BPP结构域,具有催化植酸的功能。当2个功能域协同作用时,可以显著提高1.17–2.49倍的催化活性[11]。
因此,我们推测2个功能域的协同作用是其发挥较高催化活性的关键,双功能域植酸酶可能是由单功能域的基因复制进化而来的,具有高的催化活性,有着非常重要的研究意义。双功能域β-折叠桶植酸酶的研究,为整体碱性植酸酶活性的提高,以及将来的工业化生产提供良好的依据。
我们对phyHT蛋白序列进行生物信息学分析,结果显示,phyHT其含有2个典型的植酸酶结构域,二级结构中,phyHT中α-螺旋(Helix)、β-片层(Sheet)占主要的比例,高级结构以β-片层形成的桶状结构为主,是典型的双功能域β-折叠桶植酸酶。研究发现BPP具有保守的2个序列D-A-[A/T/E]-D-D-P-A-[I/L/V]-W(钙离子的结合位点)和N-N-[V/I]-D-[I/L/V]-R-[Y/D/Q](催化活性中心)[10],序列对比结果显示phyHT在324–332氨基酸残基的位置为钙离子的结合位点(图 1),酶学性质研究表明,Ca2+对酶活性有促进作用,说明phyHT的催化活性对钙离子有依赖作用,推测可能是钙离子结合位点在催化反应中发挥了作用。另外,对phyHT三维结构进行模拟,得到了3个三维结构预测图(图 3),结果显示phyHT的2个功能域PhyH-DI与PhyH-DII均由β-折叠桶状结构构成,三维结构中钙离子与活性中心的结合可以促进phyHT催化活性的发挥。
本研究以phyHT为研究对象[13, 15],进行了生物信息学分析及结构的预测,明确了phyHT基本特性,并通过模拟了解其主要的结构特点,为phyHT结构的深入研究以及功能与结构关系的阐释奠定基础。经过表达纯化,得到了植酸酶的蛋白,进行酶学特性的研究,阐释了phyHT主要的催化特性,为将来广泛的应用提供理论依据。
| [1] | Gilbert N. Environment: The disappearing nutrient. Nature, 2009, 461(7265): 716-718. DOI:10.1038/461716a |
| [2] | Vance CP, Uhde-Stone C, Allan DL. Phosphorus acquisition and use: Critical adaptations by plants for securing a nonrenewable resource. New Phytologist, 2003, 157(3): 423-447. DOI:10.1046/j.1469-8137.2003.00695.x |
| [3] | Lung SC, Lim BL. Assimilation of phytate-phosphorus by the extracellular phytase activity of tobacco (Nicotiana tabacum) is affected by the availability of soluble phytate. Plant and Soil, 2006, 279(1/2): 187-199. |
| [4] | 崔富昌. 米曲霉植酸酶的分离纯化、性质研究及其基因的克隆. 山东大学硕士学位论文, 2006. |
| [5] |
Li XL, Yang HT, Hu JD, Wu YZ, Li JS, Ren Y. Diversity and classification of phytases. Microbiology China, 2010, 37(5): 738-747.
(in Chinese) 李晓龙, 杨合同, 扈进冬, 吴远征, 李纪顺, 任艳. 植酸酶的多样性及其分类. 微生物学通报, 2010, 37(5): 738-747. |
| [6] | Lim BL, Yeung P, Cheng CW, Hill JE. Distribution and diversity of phytate-mineralizing bacteria. The ISME Journal, 2007, 1(4): 321-330. DOI:10.1038/ismej.2007.40 |
| [7] | Kerovuo J, Lauraeus M, Nurminen P, Kalkkinen N, Apajalahti J. Isolation, characterization, molecular gene cloning, and sequencing of a novel phytase from Bacillus subtilis. Applied and Environmental Microbiology, 1998, 64(6): 2079-2085. |
| [8] | Gulati HK, Chadha BS, Saini HS. Production and characterization of thermostable alkaline phytase from Bacillus laevolacticus isolated from rhizosphere soil. Journal of Industrial Microbiology & Biotechnology, 2007, 34(1): 91-98. |
| [9] | Zhang R, Yang PL, Huang HQ, Yuan TZ, Shi PJ, Meng K, Yao B. Molecular and biochemical characterization of a new alkaline β-propeller phytase from the insect symbiotic bacterium Janthinobacterium sp.TN115. Applied Microbiology and Biotechnology, 2011, 92(2): 317-325. DOI:10.1007/s00253-011-3309-0 |
| [10] | Huang HQ, Shi PJ, Wang Y, Luo HY, Shao N, Wang GZ, Yang PL, Yao B. Diversity of beta-propeller phytase genes in the intestinal contents of grass carp provides insight into the release of major phosphorus from phytate in nature. Applied and Environmental Microbiology, 2009, 75(6): 1508-1516. DOI:10.1128/AEM.02188-08 |
| [11] | Li ZY, Huang HQ, Yang PL, Yuan TZ, Shi PJ, Zhao JQ, Meng K, Yao B. The tandemly repeated domains of a β-propeller phytase act synergistically to increase catalytic efficiency. The FEBS Journal, 2011, 278(17): 3032-3040. DOI:10.1111/j.1742-4658.2011.08223.x |
| [12] | Jain J, Sapna, Singh B. Characteristics and biotechnological applications of bacterial phytases. Process Biochemistry, 2016, 51(2): 159-169. DOI:10.1016/j.procbio.2015.12.004 |
| [13] | Lu F, Guo GG, Li QQ, Feng D, Liu Y, Huang HQ, Yang PL, Gao W, Yao B. Preparation, purification, crystallization and preliminary crystallographic analysis of dual-domain β-propeller phytase from Bacillus sp.HJB17. Acta Crystallographica Section F, 2014, 70(12): 1671-1674. |
| [14] |
Li QQ, Li ZY, Feng D, Huang HQ, Han CX, Yang PL, Yao B, Gao W. Optimizing soluble expression and inclusion body renature research of β-propeller phytase of Bacillus sp.HJB17 in E. coli. China Biotechnology, 2012, 32(8): 49-55.
(in Chinese) 李倩倩, 李中媛, 冯舵, 黄火清, 韩翠晓, 杨培龙, 姚斌, 高伟. 芽孢杆菌β-折叠桶植酸酶的原核可溶性表达优化及包涵体复性研究. 中国生物工程杂志, 2012, 32(8): 49-55. |
| [15] |
Gao W, Lu F, Li QQ, Guo GX. Method for preparing dual-functional-domain β-propellar phytase (BPP) disomes in quantity: China, CN103740672B. 2017-07-14. (in Chinese) 高伟, 鲁芳, 李倩倩, 郭刚兴. 一种大量制备双功能域β-折叠桶植酸酶二体的方法: 中国, CN103740672B. 2017-07-14. |
| [16] | Choi YM, Suh HJ, Kim JM. Purification and properties of extracellular phytase from Bacillus sp. KHU-10. Journal of Protein Chemistry, 2001, 2(4): 287-292. |
| [17] | Lineweaver H, Burk D. The determination of enzyme dissociation constants. Journal of the American Chemical Society, 1934, 56(3): 658-666. DOI:10.1021/ja01318a036 |
| [18] | Ha NC, Oh BC, Shin S, Kim HJ, Oh TK, Kim YO, Choi KY, Oh BH. Crystal structures of a novel, thermostable phytase in partially and fully calcium-loaded states. Nature Structural Biology, 2000, 7(2): 147-153. DOI:10.1038/72421 |
| [19] | Zhang R, Yang PL, Huang HQ, Shi PJ, Yuan TZ, Yao B. Two types of phytases (histidine acid phytase and β-propeller phytase) in Serratia sp.TN49 from the gut of Batocera horsfieldi (Coleoptera) Larvae. Current Microbiology, 2011, 63(5): 408-415. DOI:10.1007/s00284-011-9995-0 |
| [20] | Kumar V, Yadav AN, Verma P, Sangwan P, Saxena A, Kumar K, Singh B. β-Propeller phytases: Diversity, catalytic attributes, current developments and potential biotechnological applications. International Journal of Biological Macromolecules, 2017, 98: 595-609. DOI:10.1016/j.ijbiomac.2017.01.134 |
 2018, Vol. 58
2018, Vol. 58