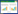中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 沈日敏, 刘卫, 孙雨, 李润植, 解志红. 2018
- Rimin Shen, Wei Liu, Yu Sun, Runzhi Li, Zhihong Xie. 2018
- 茎瘤固氮根瘤菌ORS571鞭毛马达基因fliN与fliM的功能分析
- Function analysis of flagellar genes fliN and fliM in Azorhizobium caulinodans ORS571
- 微生物学报, 58(5): 882-892
- Acta Microbiologica Sinica, 58(5): 882-892
-
文章历史
- 收稿日期:2017-09-27
- 修回日期:2017-11-09
- 网络出版日期:2017-11-28
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, Shandong Province, China
Zhihong Xie, Tel: +86-535-2109183, Fax: +86-535-2109000, E-mail: zhxie@yic.ac.cn
茎瘤固氮根瘤菌(Azorhizobium caulinodans) ORS571属于α-变形菌,最初由Dreyfus等从热带豆科植物毛萼田菁(Sesbania rostrata)的茎瘤中分离得到。其寄主植物非常有限,尽管能与多种田菁属植物共生结瘤,但只在S. rostrata和S. punctata上形成有效瘤[1]。与其他根瘤菌一样,ORS571通过固定大气中的游离氮为寄主提供氮素养料,从而减少寄主对土壤中氮肥的依赖。区别于其他根瘤菌的是,ORS571能够同时在植物的根和茎上结瘤,既能与其天然宿主共生固氮,又能自生或作为内生菌在其他植物体内固氮[2]。基于ORS571既具有根瘤菌的共性又有自身固氮的特性,使其比其他根瘤菌更具有研究价值。
鞭毛是广泛存在于细菌体表的一种特殊结构,通常呈细长弯曲的波浪状。它是细菌在进化过程中长期适应的结果,使细菌能更好地适应环境以利于自身生存[3]。鞭毛由鞭毛丝(filament)、鞭毛钩(hook)和基底部(basal body) 3部分组成。每根鞭毛在位于基底部的鞭毛马达(flagellar motor)的驱动下旋转,从而推动细胞运动。鞭毛马达主要由包含FliG、FliM、FliN、MotA和MotB等约20种蛋白构成,其中MotAB复合体构成非旋转部分——定子(stator),FliG、FliM和FliN构成的切换复合体(C环)作为马达的转子(rotor)。细菌通过调节鞭毛的旋转方向和频率来改变其运动状态及运动方向[4]。长期以来鞭毛仅被简单地当做细菌的运动器官。但近些年,随着对鞭毛结构及功能的不断深入研究,发现在许多细菌中鞭毛已被证实具有除运动外其他重要的生物学功能,如在细菌的致病性、粘附定居、生物膜的形成等方面起重要作用[5-7]。此外,鞭毛也因其独特的免疫学效应而被越来越多地应用于新型免疫佐剂的研发中[8]。
一直以来研究者们对于鞭毛马达蛋白的研究主要集中于MotA和MotB蛋白[9-12]。为了丰富对FliN和FliM的认识,明确其作为鞭毛马达的一部分在细菌运动中所起到的具体作用,初步探究茎瘤固氮根瘤菌ORS571中fliM和fliN基因的生物学功能,以期为今后从分子水平探究ORS571趋化信号转导机制提供依据,本研究从ORS571基因组中克隆这2个基因,利用同源重组的方法分别构建了ORS571的基因缺失突变体ΔfliM和ΔfliN,将它们与野生型菌株WT比较,分析了fliM和fliN这两种基因的缺失分别对ORS571的趋化、胞外多糖的分泌以及生物膜的形成等表型的影响。
1 材料和方法 1.1 材料 1.1.1 供试菌株和质粒:本实验中使用的菌株和质粒详见表 1。
| Strains and plasmids | Relevant characteristics | Source and reference |
| Strains | ||
| A. caulinodans ORS571 | Wild type strain, NaI and Amp | [13] |
| Mutant strains | ORS571 derivative, Gen | This study |
| Escherichia coli DH5α | General cloning strain | This study |
| Plasmids | ||
| pEASY blunt simple | The vector cloning PCR products, Kan | TransGen |
| pCM351 | The construction of mutant, Gen, TC | [14] |
| pRK2013 | Helper plasmid, carries tra genes, Kan | [15] |
| NaI: nalidixic acid; Amp: ampicillin; Gen: gentamicin; TC: tetracycline; Kan: kanamycin. | ||
1.1.2 引物:
本实验中使用的各引物详见表 2。
| Primers | Sequences (5′→3′) | Restriction sites |
| fliN-up-F | GGTACCTCTTGTTGATGATGTCGGC | Kpn Ⅰ |
| fliN-up-R | CATATGAGACAACTCCCGTTTCGGC | Nde Ⅰ |
| fliN-down-F | ACCGGTATGGTCTCTTCCTTGCCGT | Age Ⅰ |
| fliN-down-R | GAGCTCACGCTCGTGAAGCTGGAAA | Sac Ⅰ |
| fliM-up-F | GGTACCCGACCGAGCTTCATGAGAT | Kpn Ⅰ |
| fliM-up-R | CATATGGCGGGTCGAAGAGCAGATC | Nde Ⅰ |
| fliM-down-F | ACCGGTCATCGAGCAGCATGTCT | Age Ⅰ |
| fliM-down-R | GAGCTCGACGCAGTATATCTGCGAC | Sac Ⅰ |
1.1.3 培养条件:
TY[16]和L3[17]培养基用于茎瘤固氮根瘤菌ORS571,37 ℃培养。LB培养基用于大肠杆菌,37 ℃培养。抗生素的工作浓度为NaI (萘啶酮酸) 25 μg/mL,Kan (卡那霉素) 50 μg/mL,Gen (庆大霉素) 30 ℃μg/mL,TC(四环素) 10 μg/mL,Amp (氨苄青霉素) 100 μg/mL。
1.1.4 主要试剂和仪器:切胶回收试剂盒和T4连接酶购自全式金生物技术有限公司,质粒小提试剂盒购自天根生物科技有限公司,限制性内切酶购自NEB公司。引物合成由华大基因完成,测序由北京奥克鼎盛生物科技有限公司完成。JEM-1400透射电子显微镜由滨州医学院提供,PCR扩增仪和凝胶成像系统购自Bio-Rad。
1.2 基因片段的克隆和重组载体的构建重组载体的构建过程如图 1所示,以ORS571基因组DNA为模板,用fliN-up-F/R与fliN-down-F/R两对引物扩增得到大小为714、667 bp的上下游片段fliN-up与fliN-down,同样用fliM-up-F/R与fliM-down-F/R两对引物扩增得到大小为694、579 bp的上下游片段fliM-up与fliM-down。将得到的片段分别连接到pEAST载体上并测序验证。验证正确的上游片段和pCM351载体都用Kpn Ⅰ和Nde Ⅰ酶切,将回收的酶切片段与pCM351载体用T4连接酶16 ℃过夜连接,得到pCM351::fliNup和pCM351:: fliMup质粒。将以上得到的两种质粒分别转入大肠杆菌感受态中,菌落PCR验证,挑选出验证正确的阳性克隆子进行质粒提取并酶切验证。用同样的方法将测序正确的下游片段fliN-down与fliM-down连接到对应的pCM351::fliNup与pCM351:: fliMup质粒上,从而得到构建好的pCM351::fliNup-down和pCM351:: fliMup-down质粒。
|
| 图 1 敲除载体pCM351的构建 Figure 1 Construction of knock-out vector pCM351. |
1.3 茎瘤固氮根瘤菌ΔfliN与ΔfliM缺失突变株的构建
利用三亲结合的方法[18]将野生型菌株ORS571、含有pCM351::fliNup-down质粒的大肠杆菌DH5α、含有辅助质粒pRK2013的大肠杆菌DH5α按照10:3:2的比例混合,根据同源重组交换的原理,野生型ORS571中fliN基因片段就会与pCM351载体上的Gen基因片段互换。用TY+NaI+Amp+Gen的平板筛选突变株,并用fliN-up-F、fliN-down-R这对引物对筛选出的克隆子进行PCR验证,同时用ORS571的野生型WT作为阳性对照,根据扩增条带的大小差异筛选出阳性克隆子并送测序验证,测序结果正确的即为构建成功的ΔfliN突变株。按照同样的方法构建ΔfliM突变株。
1.4 生长曲线的测定将待测菌株WT在TY+NaI+Amp的固体平板上活化,ΔfliN与ΔfliM分别在TY+NaI+Amp+Gen的固体平板上活化,挑取单菌落接种于TY+NaI+ Amp的液体培养基中再次活化,37 ℃、200 r/min培养至OD600为0.6-0.8,取适量菌液转接至50 mL的TY液体培养基中,设置起始OD600为0.05,每隔2 h取样测定OD600。
1.5 趋化实验趋化实验采用Bible[19]的半固体平板法。将野生型菌株WT、突变株ΔfliN、ΔfliM接种至TY+NaI+Amp的液体培养基中,37 ℃、200 r/min培养过夜,调OD600值为0.8,各取5 μL滴在0.3%的L3 (乳酸钠为碳源)半固体培养基上,37 ℃培养2 d左右,观察各菌株趋化圈的大小。
1.6 细菌形态学观察细菌鞭毛的形态采用负染后在投射电镜下观察。将50 μL菌液滴加到铜网上,10 min后用滤纸轻轻吸取菌液,滴加一滴磷钨酸(2%,pH 7.4)负染1 min,立即用滤纸吸取磷钨酸,将铜网放置在65烘箱内烘干后于透射电镜下观察。
1.7 胞外多糖的观察与测定分别配制以乳酸钠、甘油和苹果酸为碳源的L3无氮固体培养基,其中碳源浓度为10 mmol/L,琼脂浓度为8 g/L。将OD600均为0.8的WT、ΔfliN和ΔfliM三种菌液悬滴到上述平板上,每种碳源3个重复,37 ℃度恒温培养4-5 d。观察每种菌株胞外多糖(EPS)的分泌情况,并利用蒽酮-浓硫酸氧化法定量测定。
1.8 生物膜的形成与测定参照Barnard介绍的方法[20]进行生物膜的形成及测定。配制以琥珀酸(10 mmol/L)为碳源的含氮和无氮L3液体培养基。调节待测各菌株OD600为2,取150 μL接种于1.5 mL的上述培养基中,3个平行实验,30 ℃静置培养3-5 d后弃培养液,加入0.1%结晶紫2 mL染色20 min,小心移除染色液,再用蒸馏水洗3-5次,观察各菌株生物膜的形成情况。对于生物膜的定量测定,取15 μL待测菌液接种至加入150 μL上述培养基的96孔板中,3个平行实验,30 ℃静置培养3-5 d后弃培养液,加入0.1%结晶紫200 μL染色20 min,小心移除染色液,再用蒸馏水洗3-5次,放入培养箱中烘干后加入30%的乙酸溶解,利用酶标仪测定OD590处的吸光度。
1.9 絮凝实验待测菌株接种至TY+NaI+Amp的液体培养基中,37 ℃、200 r/min培养过夜,调OD600值为1.0。50 mL锥形管中加入10 mL L3+1/2 N的液体培养基(乳酸钠为碳源),并接入200 μL待测菌液,37 ℃、180 r/min分别培养24 h、48 h。取出锥形管静置30 ℃min,取上清菌液测OD600,吸光值定义为ODS。用组织研磨器将沉淀与上清研磨混匀后测OD600,吸光值定义为ODt。细胞絮凝百分比按公式(1)计算。flocculation(%)=[(ODt-ODS)/ODt]×100。
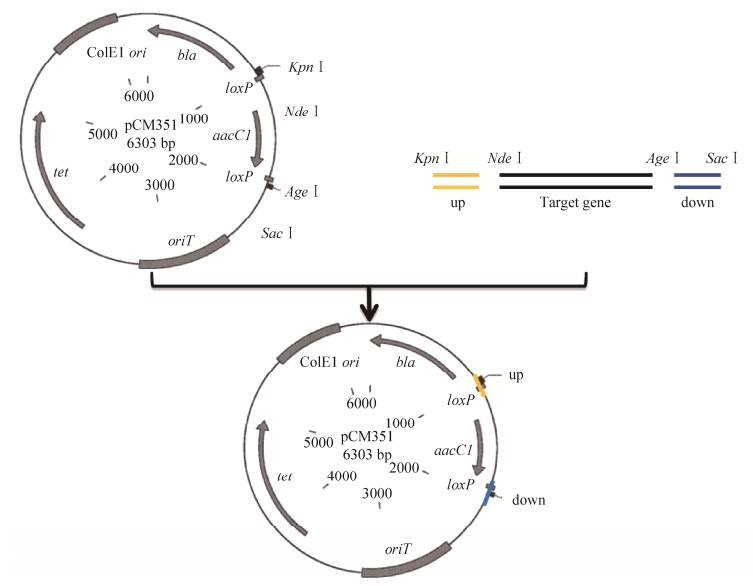
2 结果和分析 2.1 ΔfliN与ΔfliM突变株的构建三亲本结合后,能够在含有NaI和Gen抗性的TY平板上生长,但不能在含有NaI、Gen和Tc抗性的TY平板上生长的结合子可能为潜在突变株。利用fliN-up-F/fliN-down-R、fliM-up-F/fliM-down-R这两对引物做菌落PCR验证的结果表明,在野生型WT中扩增出的片段大小与在潜在突变株中扩增出的大小不同,如图 2所示。此外,测序结果也显示潜在突变株中上下游片段间的目的基因fliN、fliM均被载体上的庆大霉素抗性基因Gen替换。上述结果表明,突变株ΔfliN、ΔfliM构建成功。
|
| 图 2 突变株的PCR验证 Figure 2 PCR confirmation of the mutant strains. M: marker. Primers fliN-up-F/fliN-down-R: 1: The genomic DNA of ΔfliN mutant strain; 2: The genomic DNA of wild-type strain. Primers fliM-up-F/fliM-down-R: 3: The genomic DNA of ΔfliM mutant strain; 4: The genomic DNA of wild-type strain. |
2.2 生长曲线测定结果
在TY液体培养基中测定野生型WT、突变株ΔfliN和ΔfliM不同时期的OD600值,结果如图 3。从图中可以看出,突变株的生长曲线几乎与野生型一致,说明鞭毛马达基因fliN、fliM单个缺失后并不影响菌株的生长状况。

|
| 图 3 野生型WT、突变株ΔfliN和ΔfliM生长曲线的测定 Figure 3 The growth curve of wild type WT, mutants ΔfliN and ΔfliM. |
2.3 趋化能力的测定及鞭毛形态观察结果
在fliN和fliM分别缺失后不影响其生长的前提下,进行了趋化能力的测定。如图 4所示,从图中可看出在0.3% L3半固体平板上ΔfliN和ΔfliM的趋化圈明显小于野生型WT,说明鞭毛马达基因fliN、fliM能够影响ORS571对外源化学吸引剂的趋化能力。

|
| 图 4 3株菌株对乳酸钠的趋化能力 Figure 4 The chemotaxis ability to sodium lactate of the three different strains. |
2.4 鞭毛形态观察结果
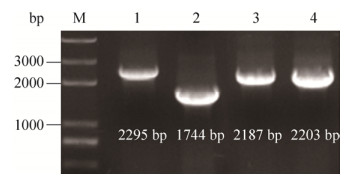
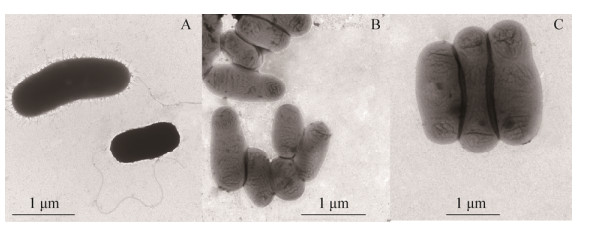
如图 5所示,野生型菌株WT具有完整的鞭毛结构,而突变株ΔfliN和ΔfliM均丧失鞭毛,说明鞭毛马达基因fliN、fliM分别缺失后会影响ORS571鞭毛的构建。
|
| 图 5 菌株的形态观察 Figure 5 Morphological examinations of the three strains under electron microscope. A: Wide-type strain of ORS571 with flagellar; B: Mutant strain ΔfliN without flagellar; C: Mutant strain ΔfliM without flagellar. |
2.5 胞外多糖的观察与测定结果
在以乳酸钠、苹果酸和甘油三种物质为碳源的L3无氮固体平板上培养4 d后,野生型菌株和ΔfliN、ΔfliM突变株的菌落形态和分泌的胞外多糖均有明显差异,结果如图 6-A。其中野生型菌株分泌的胞外多糖最多,除乳酸钠平板外,在其他碳源的平板上整个菌落都被胞外多糖包裹,菌落表面湿润光滑。从图中可看出ΔfliN突变株的胞外多糖最少,而ΔfliM介于两者之间且菌落边缘不平滑。
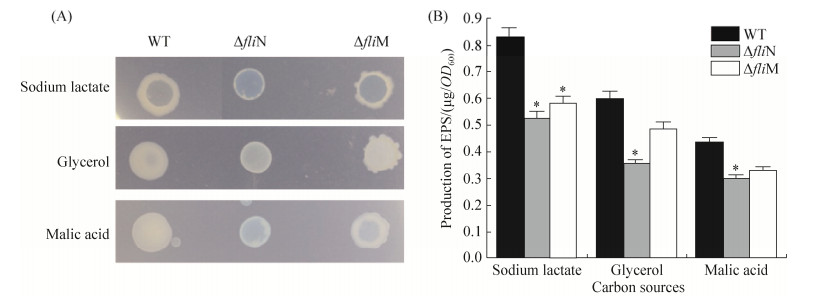
|
| 图 6 菌株的胞外多糖表型与定量分析 Figure 6 Colony morphologies and quantitative analysis of the EPS. A: Colony morphologies of the three different strains spotted on the L3-N plates with three different carbon sources (sodium lactate, glycerol and malic acid). Photographs were taken after 4 days of incubation. There were distinct differences between the wide-type strain (WT) and the mutant strains (ΔfliN and ΔfliM); B: Quantitative analysis of the EPS. The error bars represent SE of means from three independent experiments. Asterisks indicate statistically significant differences (*: P < 0.05). |
利用蒽酮-浓硫酸氧化法测定各菌株胞外多糖含量,结果如图 6-B所示。在无氮培养情况下,当以乳酸钠为碳源时,三种菌株分泌胞外多糖均比其他两种碳源多,且野生型的胞外多糖产量远高于两种突变株。当以乳酸钠为碳源时,ΔfliN和ΔfliM的胞外多糖含量相比野生型WT分别下降36%和30%;以甘油为碳源时分别下降40%和20%;以苹果酸为碳源时分别下降31%和24%。
2.6 生物膜的形成与测定结果鞭毛对生物膜的形成具有重要作用。为了探究鞭毛马达基因fliN和fliM对ORS571生物膜形成的影响,我们利用L3液体培养基,分别在有氮与无氮的情况下对野生型和突变株的生物膜产生量进行了定性与定量分析,结果如图 7所示。经过4 d的培养后,在有氮与无氮的情况下,突变株ΔfliN和ΔfliM的生物膜形成能力都明显低于野生型WT,并且在有氮培养条件下生物膜的产量要明显高于无氮培养情况下,如图 7-A。定量分析发现,较野生型菌株WT,有氮时ΔfliN和ΔfliM的生物膜形成能力分别下降43%和51%,无氮时分别下降40%和54%,且差异均显著。
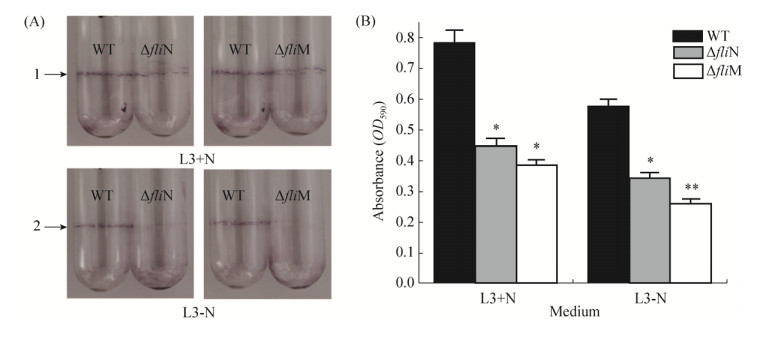
|
| 图 7 菌株的生物膜形成与定量 Figure 7 Biofilm formation and quantification of ethanol-solubilized CV from PVC plates biofilms. A: Biofilm morphologies upon crystal violet staining of the WT, ΔfliN and ΔfliM. Lane 1: Strains were inoculated with L3+N liquid medium; line 2: Strains were inoculated with L3-N liquid medium; B: Biofilm formation was quantified by crystal violet staining method. The error bars represent SE of means from three independent experiments. Asterisks indicate statistically significant differences (*: P < 0.05 and **: P < 0.01). |
2.7 絮凝实验结果
A. caulinadans ORS571在高度氧化的情况下,利用寡营养培养基培养时可产生凝结沉淀。为了研究鞭毛马达基因fliN和fliM是否影响到这一过程,我们按照1.8的方法比较了野生型与突变株的细胞凝结能力。结果表明(图 8),突变株ΔfliN和ΔfliM的凝结能力均高于野生型,说明fliN、fliM对ORS571的凝结过程具有调节作用。且随着培养时间的延长,由于生物量的增加,三者在48 h的凝结量均高于24 h。

|
| 图 8 野生型与突变株的絮凝比较 Figure 8 Flocculation of wild-type and mutant strains. A: Flocculation morphologies of the WT, ΔfliN and ΔfliM. Strains were inoculated with L3+1/2N liquid medium, and photographs were taken after 48 hours of incubation; B: Quantitative analysis of the flocculation cell mass. The error bars represent SE of means from three independent experiments. Asterisks indicate statistically significant differences (*: P < 0.05 and **: P < 0.01). |
3 讨论
细菌的运动依赖于鞭毛,对鞭毛的长期研究表明鞭毛不仅影响细菌的运动性,在细菌粘附、侵染、生物膜的形成等过程中也起重要作用。本研究采用分子生物学和生物化学等手段,对茎瘤固氮根瘤菌ORS571的鞭毛马达基因fliN和fliM分别进行了缺失突变,探究了这两种基因对ORS571趋化、絮凝、生物膜形成以及胞外多糖产生等方面的影响。结果表明,fliN、fliM的单独缺失,都会使A. caulinadans ORS571丧失鞭毛和趋化能力,同时发现突变株分泌的胞外多糖含量和生物膜的形成量相对野生型都减少。相反,细胞的凝结能力增强。
在复杂多变的自然环境中,细菌需要感知环境中的变化并及时作出反应。有运动能力的细菌通过受体感应环境中的有益或有害物质后,通过信号转导途径将胞外信号传递给鞭毛马达,促使转子的旋转方向发生改变,从而驱动细菌向着对自身有利的方向运动。因此,将鞭毛马达中转子的重要组成部分FliN或FliM缺失后势必会对菌株的运动能力造成损害,进而也影响到其趋化作用。此外,我们在显微镜下观察到这两种突变株的运动状态与野生型菌株相比的确表现出明显的运动缺陷,大多数突变株的状态都是左右摆动或原地打转,很少出现前进或者转弯的运动轨迹(未发表)。
有人已经研究过胞外多糖(EPS)对细菌运动的影响,但不同菌株结果不同,甚至是有争议的。在苜蓿中华根瘤菌RMB7201中,运动缺失突变体合成的EPS较少,而将EPS过表达后菌株则会表现出不同程度的运动缺失[21]。运动能力增强的铜绿假单胞菌突变体产EPS的能力会减弱[22],相反EPS合成受损的枯草芽孢杆菌其运动能力也大大减弱[23]。Liu[24]等的实验结果表明,产EPS量少的突变体菌株在泳动板上的运动能力也会减弱。进一步的分析推测,菌体自身分泌的EPS可能会通过增加菌落表面的湿度并且减少菌体与基质间的表面张力来促进菌体运动。而对交替假单胞菌SM9913的研究表明,SM9913泳动不会诱导EPS的产生,反之菌体自身分泌的EPS会促进菌体的泳动。细菌的运动除鞭毛的旋转驱动外,菌体表面的类黏蛋白层也会促进运动,EPS产量的减少会影响类黏蛋白层的形成,作者解释这也许是EPS合成能力丧失会减弱细菌泳动的主要原因。关于EPS能够促进细胞泳动的研究报道少之又少。有研究表明,大肠杆菌泳动时胞外脂多糖可能会作为一种渗透物质促进平板中的水分渗出,这有利于细菌的泳动。细菌胞外的荚膜胞外多糖(CPS)也能够通过协助菌落水合促进细菌在固体表面的移动同时也能为鞭毛提供一个水环境,利于鞭毛更好地发挥作用[25-26]。基于不同菌株间EPS和运动的关系存在很大差异,因此进一步从机理上深入探索细菌自身分泌的EPS对其运动的影响是非常必要的。除运动外,适当的EPS对细菌的粘附、成熟生物膜结构的形成、细菌毒力以及在木质部的扩散是必不可少的[27-29]。对荧光假单胞菌来说,它分泌的EPS在菌体与植物和菌体与丛植真菌的互作中也起重要作用[30]。胞外多糖琥珀酰聚糖(SCG)对苜蓿中华根瘤菌的有效共生是必需的,并且它的表达水平会影响菌株在植物表面的定殖状况[31]。
生物膜是细菌为适应生存环境而形成的一种特殊的生存方式。细菌运动与生物膜的形成息息相关,本实验中,突变株ΔfliN和ΔfliM的生物膜形成能力相对野生型明显下降,我们推测由于A. caulinodans是需氧微生物,但只有在微好氧的情况下才能固氮。马达蛋白缺失的突变体由于运动缺陷很可能无法到达培养基与空气接触处最佳的氧气浓度位置,从而难以形成生物膜结构。另外,胞外多糖如纤维素和藻酸盐也参与到了生物膜结构的形成[32-33]。Berleman等[34]的研究发现,粘球菌细胞组织形成生物膜依赖于EPS形成的微孔道。细胞被高度地集中在由EPS微孔道三维结构中,这种结构有助于细胞的排列和在物质表面的运动,缺少EPS的突变体则表现出细胞组织和运动的减弱。胞外多糖通过影响生物膜中细菌密度、水通道、离子分布等因素,进而影响生物膜整体结构以及细菌在其中的生存状态。以此推测,ΔfliN和ΔfliM胞外多糖的减少可能也是生物膜形成下降的重要原因之一。细胞凝结是由提升的氧气浓度和氮源的限制所诱导的,因此我们推测突变株为了补偿功能上的一些缺失,在低氮状态下相对野生型过早产生凝结来对抗这种胁迫。
| [1] | Boivin C, Ndoye I, Lortet G, Ndiaye A, de Lajudie P, Dreyfus B. The Sesbania root symbionts Sinorhizobium saheli and S. teranga bv. sesbaniae can form stem nodules on Sesbania rostrata, although they are less adapted to stem nodulation than Azorhizobium caulinodans. Applied and Environmental Microbiology, 1997, 63(3): 1040-1047. |
| [2] | Tsukada S, Aono T, Akiba N, Lee KB, Liu CT, Toyazaki H, Oyaizu H. Comparative genome-wide transcriptional profiling of Azorhizobium caulinodans ORS571 grown under free-living and symbiotic conditions. Applied and Environmental Microbiology, 2009, 75(15): 5037-5046. DOI:10.1128/AEM.00398-09 |
| [3] |
Li RF, He QG, Zhou R, Chen HC. The research advances on the bacterial flagella. Microbiology China, 2005, 32(6): 124-127.
(in Chinese) 李任峰, 何启盖, 周锐, 陈焕春. 细菌鞭毛研究概况及进展. 微生物学通报, 2005, 32(6): 124-127. |
| [4] | Xue RD, Ma Q, Baker MAB, Bai F. A delicate nanoscale motor made by nature-The bacterial flagellar motor. Advanced Science, 2015, 2(9): 1500126. |
| [5] | Barnich N, Boudeau J, Clare L, Darfeuille-Michaud A. Regulatory and functional co-operation of flagella and type 1 pili in adhesive and invasive abilities of AIEC strain LF82 isolated from a patient with Crohn's disease. Molecular Microbiology, 2003, 48(3): 781-794. DOI:10.1046/j.1365-2958.2003.03468.x |
| [6] | Roy K, Hilliard GM, Hamilton DJ, Luo JW, Ostmann MM, Fleckenstein JM. Enterotoxigenic Escherichia coli EtpA mediates adhesion between flagella and host cells. Nature, 2009, 457(7229): 594-598. DOI:10.1038/nature07568 |
| [7] | Wood TK, González Barrios AF, Herzberg M, Lee J. Motility influences biofilm architecture in Escherichia coli. Applied Microbiology and Biotechnology, 2006, 72(2): 361-367. DOI:10.1007/s00253-005-0263-8 |
| [8] |
Guo ZY, Zhou MX, Duan QD, Zhu GQ. Advance on the pathogenicity and immunological application of bacterial flagella-A review. Acta Microbiologica Sinica, 2014, 54(3): 251-260.
(in Chinese) 郭志燕, 周明旭, 段强德, 朱国强. 细菌鞭毛的致病性及其免疫学应用的研究进展. 微生物学报, 2014, 54(3): 251-260. |
| [9] | Hosking ER, Vogt C, Bakker EP, Manson MD. The Escherichia coli MotAB proton channel unplugged. Journal of Molecular Biology, 2006, 364(5): 921-937. DOI:10.1016/j.jmb.2006.09.035 |
| [10] | Lane MC, Lockatell V, Monterosso G, Lamphier D, Weinert J, Hebel JR, Johnson DE, Mobley HLT. Role of motility in the colonization of uropathogenic Escherichia coli in the urinary tract. Infection and Immunity, 2005, 73(11): 7644-7656. DOI:10.1128/IAI.73.11.7644-7656.2005 |
| [11] | Ryu WS, Berry RM, Berg HC. Torque-generating units of the flagellar motor of Escherichia coli have a high duty ratio. Nature, 2000, 403(6768): 444-447. DOI:10.1038/35000233 |
| [12] | Zhou J, Lloyd SA, Blair DF. Electrostatic interactions between rotor and stator in the bacterial flagellar motor. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(11): 6436-6441. DOI:10.1073/pnas.95.11.6436 |
| [13] | Dreyfus B, Garcia JL, Gillis M. Characterization of Azorhizobium caulinodans gen. nov., sp. nov., a stem-nodulating nitrogen-fixing bacterium isolated from Sesbania rostrata. International Journal of Systematic Bacteriology, 1988, 38(1): 89-98. DOI:10.1099/00207713-38-1-89 |
| [14] | Marx CJ, Lidstrom ME. Broad-host-range cre-lox system for antibiotic marker recycling in gram-negative bacteria. Biotechniques, 2002, 33(5): 1062-1067. |
| [15] | Figurski DH, Helinski DR. Replication of an origin-containing derivative of plasmid RK2 dependent on a plasmid function provided in trans. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(4): 1648-1652. DOI:10.1073/pnas.76.4.1648 |
| [16] | Beringer JE. R factor transfer in Rhizobium leguminosarum. Journal of General Microbiology, 1947, 84(1): 188-198. |
| [17] | Nakajima A, Aono T, Tsukada S, Siarot L, Ogawa T, Oyaizu H. Lon protease of Azorhizobium caulinodans ORS571 is required for suppression of reb gene expression. Applied and Environmental Microbiology, 2012, 78(17): 6251-6261. DOI:10.1128/AEM.01039-12 |
| [18] |
Li Y. The mechanism underlying broad-host-range adaptation of Sinorhizobium sp. NGR234. Doctor Dissertation of China Agricultural University, 2013. (in Chinese) 李岩. Sinorhizobium sp. NGR234的广宿主适应机制研究. 中国农业大学博士学位论文, 2013. |
| [19] | Bible AN, Stephens BB, Ortega DR, Xie ZH, Alexandre G. Function of a chemotaxis-like signal transduction pathway in modulating motility, cell clumping, and cell length in the alphaproteobacterium Azospirillum brasilense. Journal of Bacteriology, 2008, 190(19): 6365-6375. DOI:10.1128/JB.00734-08 |
| [20] | Barnard AM, Simpson NJ, Lilley KS, Salmond GP. Mutations in rpsL that confer streptomycin resistance show pleiotropic effects on virulence and the production of a carbapenem antibiotic in Erwinia carotovora. Microbiology, 2010, 156(Pt 4): 1030-1039. |
| [21] | Wei XM, Bauer WD. Tn5-induced and spontaneous switching of Sinorhizobium meliloti to faster-swarming behavior. Applied and Environmental Microbiology, 1999, 65(3): 1228-1235. |
| [22] | Ashraf M, Hasnain S, Berge O, Mahmood T. Inoculating wheat seedlings with exopolysaccharide-producing bacteria restricts sodium uptake and stimulates plant growth under salt stress. Biology and Fertility of Soils, 2004, 40(3): 157-162. |
| [23] | Nagórska K, Ostrowski A, Hinc K, Holland IB, Obuchowski M. Importance of eps genes from Bacillus subtilis in biofilm formation and swarming. Journal of Applied Genetics, 2010, 51(3): 369-381. DOI:10.1007/BF03208867 |
| [24] | Liu A, Mi ZH, Zheng XY, Yang Y, Su HN, Chen XL, Xie BB, Zhou BC, Zhang YZ, Qin QL. xopolysaccharides play a role in the swarming of the benthic bacterium Pseudoalteromonas sp. SM9913. Frontiers in Microbiology, 2016, 7: 473. |
| [25] | Gygi D, Rahman MM, Lai HC, Carlson R, Guard-Petter J, Hughes C. A cell-surface polysaccharide that facilitates rapid population migration by differentiated swarm cells of Proteus mirabilis. Molecular Microbiology, 1995, 17(6): 1167-1175. DOI:10.1111/mmi.1995.17.issue-6 |
| [26] | Rahman MM, Guard-Petter J, Asokan K, Hughes C, Carlson RW. The structure of the colony migration factor from pathogenic Proteus mirabilis. A capsular polysaccharide that facilitates swarming. Journal of Biological Chemistry, 1999, 274(33): 22993-22998. DOI:10.1074/jbc.274.33.22993 |
| [27] | Koutsoudis MD, Tsaltas D, Minogue TD, von Bodman SB. Quorum-sensing regulation governs bacterial adhesion, biofilm development, and host colonization in Pantoea stewartii subspecies stewartii. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(15): 5983-5988. DOI:10.1073/pnas.0509860103 |
| [28] | Qui iones B, Dulla G, Lindow SE. Quorum sensing regulates exopolysaccharide production, motility, and virulence in Pseudomonas syringae. Molecular Plant-Microbe Interactions, 2005, 18(7): 682-693. DOI:10.1094/MPMI-18-0682 |
| [29] | Romanenko AS, Lomovatskaya LA, Shafikova TN, Borovskii GB, Krivolapova NV. Potato cell plasma membrane receptors to ring rot pathogen extracellular polysaccharides. Journal of Phytopathology, 2003, 151(1): 1-6. DOI:10.1046/j.1439-0434.2003.00667.x |
| [30] | Bianciotto V, Andreotti S, Balestrini R, Bonfante P, Perotto S. Mucoid mutants of the biocontrol strain Pseudomonas fluorescens CHA0 show increased ability in biofilm formation on mycorrhizal and nonmycorrhizal carrot roots. Molecular Plant-Microbe Interactions, 2001, 14(2): 255-260. DOI:10.1094/MPMI.2001.14.2.255 |
| [31] | Fujishige NA, Kapadia NN, de Hoff PL, Hirsch AM. Investigations of Rhizobium biofilm formation. FEMS Microbiology Ecology, 2006, 56(2): 195-206. DOI:10.1111/fem.2006.56.issue-2 |
| [32] | Danhorn T, Fuqua C. Biofilm formation by plant-associated bacteria. Annual Review of Microbiology, 2007, 61(1): 401-422. DOI:10.1146/annurev.micro.61.080706.093316 |
| [33] | Russo DM, Williams A, Edwards A, Posadas DM, Finnie C, Dankert M, Downie JA, Zorreguieta A. Proteins exported via the PrsD-PrsE type Ⅰ secretion system and the acidic exopolysaccharide are involved in biofilm formation by Rhizobium leguminosarum. Journal of Bacteriology, 2006, 188(12): 4474-4486. DOI:10.1128/JB.00246-06 |
| [34] | Berleman JE, Zemla M, Remis JP, Liu H, Davis AE, Worth AN, West Z, Zhang A, Park H, Bosneaga E, van Leer B, Tsai W, Zusman DR, Auer M. Exopolysaccharide microchannels direct bacterial motility and organize multicellular behavior. ISME Journal, 2016, 10(11): 2620-2632. DOI:10.1038/ismej.2016.60 |
 2018, Vol. 58
2018, Vol. 58