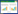中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 江红梅, 殷中伟, 史发超, 刘彩月, 范丙全. 2018
- Hongmei Jiang, Zhongwei Yin, Fachao Shi, Caiyue Liu, Bingquan Fan. 2018
- 一株耐盐日本曲霉的筛选及其溶磷促生作用
- Isolation, identification of a salt-tolerant, phosphate-solubilizing and crop-growth promoting Aspergillus japonicus
- 微生物学报, 58(5): 862-881
- Acta Microbiologica Sinica, 58(5): 862-881
-
文章历史
- 收稿日期:2017-07-04
- 修回日期:2017-09-28
- 网络出版日期:2017-11-21
磷素是植物生长必需的三大营养元素之一,磷肥使用是粮食增产的重要措施。施入土壤的磷肥90%以上转化为难溶磷,不易被植物吸收利用,是磷肥利用效率低的主要成因[1-2]。迄今,世界各国依靠大量消费磷肥确保作物增产,保障粮食安全,从而导致磷矿资源的消费量逐年增加。我国90%以上的磷矿为中低品位,按现有的年消费量,我国的磷矿使用年限将不足20年[3]。今后,提高磷肥和磷矿资源的使用效率、提高土壤磷库的有效性,延长磷矿资源的使用寿命,对世界各国农业可持续发展具有重要意义[4-5]。
溶磷微生物能有效转化土壤难溶磷、提高磷肥利用率、促进作物增产、提高作物吸磷量,从而减少磷肥投入量[6]。因此,溶磷生物肥料是一种高效、经济、环境友好的活化土壤难溶磷的生物措施,具有巨大应用潜力。溶磷微生物依靠自身产生有机酸[7-8]、分泌H+质子[9-10],将难溶磷转化为有效磷,同时通过自身产生植物促生物质[11],在磷素的生物有效性和作物增产中起着重要作用。自1903年Staltrom[12]从土壤中成功分离到溶磷细菌以来,溶磷微生物一直受到科学家的高度重视,国内外相继开展了溶磷微生物的大量筛选研究[13-15],期望通过接种溶磷微生物制剂提高土壤难溶磷的有效性和磷肥利用效率[7, 16]。由于不同种类的溶磷菌或不同菌株之间的溶磷能力和接种效果差异悬殊,所以,高效溶磷菌株的筛选显得尤为重要。已有报道显示,真菌的溶磷能力大于细菌[12],世界各国科学家分离了大量溶磷真菌,其中,青霉菌(Penicillium sp.)、曲霉菌(Aspergillus sp.)、木霉菌(Trichoderma sp.)、链格孢菌(Alternaria sp.)、镰刀菌(Fusarium sp.)和踝节菌(Talaromyces sp.) 6个属都具有溶磷能力。溶磷曲霉菌是一类重要的溶磷微生物资源,迄今已经报道的溶磷曲霉菌有黑曲霉(A. niger)[14]、棘孢曲霉(A. aculeatus)[17]、烟曲霉(A. fumigatus)[18]、泡盛曲霉(A. awamori)[18]、棒曲霉(A. clavatus)[19]、焦曲霉(A. ustus)[19]、构巢曲霉(A. nidulans)[19]、黄曲霉(A. flavus)[20]、臭曲霉(A. foetidus)[21]、灰绿曲霉(A. glaucus)[22]、聚多曲霉(A. sydowii)[22]、蜂蜜曲霉(A. melleus)[23]、土曲霉(A. terreus)[24]和塔宾曲霉(A. tubingensis)[25]14个种。
众所周知,绝大多数溶磷菌株是从作物根际土壤中获得,但有些溶磷菌是从特殊环境中分离,以便利用此类菌株具有溶磷功能和兼具适应土著环境的特性。Chatli等[26]从低温沙漠地区分离了溶磷青霉菌株FC28、FC39,溶磷黑曲霉菌株AF;Naveenkumar等[24]从槟榔壳废弃物中获得了溶磷黑曲霉菌株Strain-1;Bhattacharya等[27]从蚯蚓粪便中分离到溶磷构巢曲霉菌株Ⅴ1;李海云等[28]从猪粪堆肥中筛选到溶磷产黄青霉菌株PSM-1;Nath等[29]从茶树叶中分离出溶磷青霉菌(AF014929)。
我国耕地仅有18亿亩,盐碱地面积占10%,充分利用耐盐溶磷增产的微生物资源及其生物肥料对于提高粮食产量十分重要。世界各国科学家开展了大量筛选耐盐溶磷菌的工作,其中,溶磷草酸青霉菌(Penicillium oxalicum) QL1501[30]、红酵母菌(Rhodotorula sp.) PS4[31]、木霉菌TRC3[32]和疣孢蓝状菌(Talaromyces verruculosus) P10[33]等菌株的耐盐能力尤为突出。
迄今为止,溶磷微生物研究取得了丰硕成果,揭示了溶磷微生物及其生物肥料的可利用价值。大量研究证明,溶磷微生物具有增加土壤有效磷[34-35]、促进磷素吸收和减少磷肥用量[4, 36]、促进磷矿石的生物有效性[34, 37],以及促进作物生长和提高作物产量的作用[38-39]。毋容置疑,溶磷微生物及其生物肥料在溶解难溶磷、减少磷肥投入和提高作物产量方面潜力巨大。因此,在溶磷微生物筛选和应用研究过程中,应该注重选择既能高效溶解难溶磷、又能显著提高作物产量的溶磷菌株。
本研究旨在筛选耐盐的高效溶磷真菌,并对其溶磷耐盐能力、促生增产效果及其机理进行研究,为开发耐盐溶磷生物肥料提供高效真菌资源。
1 材料和方法 1.1 材料 1.1.1 土壤来源:采自内蒙古五原县轻中度盐碱农田的向日葵根围土壤样品共150个。盆栽土壤来自北京市石灰性潮土、安徽省阜阳黏性潮土、安徽水稻土和山东沿海盐潮土。土壤理化性状见表 1。
| Code | Soil types | Organic matter/(g/kg) | Total N/ (g/kg) |
Total P/ (g/kg) |
Total K/ (g/kg) |
Available nutrients/(mg/kg) | |
| P | K | ||||||
| 1 | Paddy soils | 17.46 | 1.55 | 0.63 | 21.28 | 5.58 | 185.99 |
| 2 | Viscous fluvo-aquic soils | 10.96 | 1.03 | 0.44 | 13.84 | 6.01 | 219.81 |
| 3 | Salinized fluvo-aquic soils | 21.61 | 0.43 | 0.76 | 22.17 | 5.94 | 318.43 |
| 4 | Calcareous fluvo-aqui soils | 31.22 | 1.03 | 0.82 | 19.74 | 8.26 | 129.63 |
1.1.2 培养基:
(1)菌株筛选与培养:无机磷培养基,PDA培养基,牛肉膏蛋白胨培养基等[10]。(2)Pikovskaya改良培养基(g/L):葡萄糖10.0,(NH4)2SO4 0.5,酵母抽提物0.5,KCl 0.2,FeSO4ˑ7H2O 0.001,MnSO4·4H2O 0.001,Ca3(PO4)2 5.0,MgSO4·7H2O 0.1,pH 7.0,115 ℃,灭菌30 min[40]。(3)PDY培养基:土豆200 g与1 L蒸馏水混合煮沸20 min过滤,滤液补水至1 L,加入蔗糖10 g、酵母粉1 g。(4)PDYA培养基:PDY加琼脂18 g/L。(5)耐盐培养基:PDYA加NaCl。分别配制NaCl含量为0、5.0%、7.5%、10.0%和12.5%的培养基。
1.1.3 供试磷源:(1)分析纯磷酸三钙[Ca3(PO4)2 (P2O5 45.78%)]、分析纯磷酸铝[AlPO4 (P2O5 58.18%)],购于天津科密欧试剂公司。(2)磷矿粉:贵州开阳磷矿粉(Kaiyang rock phosphate,Kaiyang RP,P2O5 33.87%)、江苏锦屏磷矿粉(Jinping rock phosphate,JPRP,P2O5 34.37%)、云南晋宁磷矿粉(Jinning rock phosphate,JNRP,P2O5 33.79%)、河北钒山磷矿粉(Fanshan rock phosphate,FSRP,P2O5 33.91%)和云南昆阳磷矿粉(Kunyang rock phosphate,Kunyang RP,P2O5 34.13%),磷矿石均粉碎过100目(149 μm)筛。(3)钒钼黄比色法测定磷矿粉全磷含量,钼锑抗比色法测定有效磷含量。Kaiyang RP、JPRP、JNRP、FSRP和Kunyang RP有效磷含量(P2O5)分别为0.37%、0.31%、0.29%、0.38%和0.34%。
1.1.4 液质联用(Liquid chromatograph-mass spectrometer,LC-MS)试剂:(1)有机酸标准品:酒石酸(DL-Tartaric acid)、草酸(Oxalic acid)、柠檬酸(Citric acid)、苹果酸(DL-Malic acid)、乳酸(L(+)-Lactic acid)、琥珀酸(Succinic acid)和延胡索酸(Fumaric acid),购自德国Dr. Ehrenstorfer公司。(2)植物激素标准品:生长素(Auxin)、玉米素(Zeatin),购于德国Dr. Ehrenstorfer公司。磷酸二氢钾和磷酸为国产优级纯,甲酸铵、丙酸和甲醇(Methyl alcohol)为色谱纯(美国Tedia公司)。实验用水为超纯水(电阻率为18.20 MΩ·cm)。
1.1.5 Hoagland培养液配方(mol/L):K2SO4 8×10-4,MgSO4 6.5×10-4,KCl 1×10-4,Ca(NO3)2 2×10-3,CuSO4 1×10-7,MnSO4 1×10-6,EDTA-Fe 1×10-7,H3BO3 1×10-5,ZnSO4 1×10-6,(NH4)6Mo7O4 5×10-9。用0.01 mol/L NaOH溶液和0.01 mol/L HNO3溶液调节pH至5.8[41]。
1.1.6 供试菌株:日本曲霉(Aspergillus japonicus)菌株M1为本试验筛选菌株;黑曲霉(Aspergillus niger)菌株DSM 821(ATCC 9142),购自德国Leibniz研究所DSMZ微生物保藏和细胞培养中心(德国不伦瑞克)。黑曲霉菌DSM 821作为对照菌株。
1.1.7 主要试剂和仪器:真菌总DNA提取试剂盒、Taq酶和dNTP购自天根生化科技有限公司;引物为ITS1和ITS4由生工生物工程(上海)股份有限公司合成;其他试剂为国产分析纯购自国药集团化学试剂有限公司。培养箱为DHP-9162型购自上海一恒科技有限公司;PCR仪为GeneAmp PCR System 9700;高速离心机为Heraeus公司的Sorvall Biofuge Stratos;光学显微镜为OLYMPUS BH-2;扫描电子显微镜为FEI-QUANTA200;紫外分光光度仪为天美科技有限公司UV-7501。三重串联四极杆液质联用仪器(美国Agilent):主机Agilent LC 1290 Infinity2,Agilent QQQ 6470;工作站:Agilent Masshunter。
1.2 溶磷菌株的分离鉴定采用梯度稀释法获得系列稀释倍数的土壤菌悬液。称取1 g保藏于4 ℃冰箱的新鲜土壤,用0.85%灭菌的生理盐水将土壤样品稀释至10-2-10-5倍,分别吸取0.1 mL土壤悬液涂布于无机磷培养基平板上,每个浓度土壤悬液重复涂布3个平板。置于培养箱中28 ℃倒置培养,选择溶磷圈较大的菌株,转接到PDA固体培养基平板上,纯化后接入PDA斜面保藏。
扫描电镜观察菌体形态在清华大学医学测试中心进行。主要步骤为:离心后的菌体用2.5%戊二醛固定过夜,0.1 mol/L的PBS缓冲液漂洗3次,每次14 min;依次用浓度为50%、70%、80%和90%的乙醇梯度脱水14 min,再用100%的乙醇脱水3次,每次14 min;最后用叔丁醇:乙醇=1:1和纯叔丁醇各洗1次,每次14 min。样品经冷冻干燥后做喷金处理,固定于电导胶上置于FEI-QUANTA200型扫描电镜下观察。
1.3 供试菌株对难溶磷源的溶解效果研究将100 mL含5 g/L难溶磷的Pikovskaya培养液盛入三角瓶中,难溶磷磷源分别为磷酸三钙、磷酸铝、开阳磷矿粉(Kaiyang RP)、锦屏磷矿粉(JPRP)、晋宁磷矿粉(JNRP)、钒山磷矿粉(FSRP)和昆阳磷矿粉(Kunyang RP)。于121 ℃、1.01×105 Pa高压灭菌30 min,接种1 mL溶磷菌悬液于无菌培养基中。试验处理包括:(1)对照(CK):不接菌;(2)黑曲霉菌DSM 821:第二对照;(3)日本曲霉菌M1。每个处理3次重复。置于28 ℃、160 r/min摇床培养,分别于3、6、9 d取菌液5 mL,12000 r/min、4 ℃离心5 min,取上清液测定有效磷含量。
1.4 供试菌株在磷酸三钙、磷酸铝和磷矿粉中溶磷过程的pH值变化试验设置同1.2.2的方法,分别测定在磷酸三钙、磷酸铝和5种磷矿粉中接种菌株M1、DSM 821时溶液pH值的变化。
1.5 供试菌株耐盐性测定用无菌接种环从长满菌丝体的PDY培养液中挑取一个较大的小球体接入固体耐盐培养基中央,置于28 ℃恒温培养箱中,从3 d开始每日观察并记录菌丝在不同含量NaCl的PDYA平板中的生长状况。
1.6 溶磷菌剂的制备将若干草炭置于5 L三角瓶中,121 ℃、1.01×103 Pa,高压灭菌30 min。供试溶磷菌株M1、DSM 821分别接种于PDY液体培养基中,28 ℃、170 r/min摇床培养,每日进行平板计数,当菌液浓度达到108 CFU/mL时,供试菌株与灭菌草炭混合均匀,菌剂的干湿度为手攥成团、一碰即散。置于28 ℃培养,待菌数达5×108 CFU/g菌剂,用于盆栽试验。
1.7 液质联用(LC-MS)测定日本曲霉菌M1溶磷过程中产生的有机酸在200 mL三角瓶中装入100 mL的Pikovskaya液体培养基,磷源分别为磷酸三钙、磷酸铝和开阳磷矿粉三种。灭菌后接种1 mL 106 CFU溶磷真菌M1的孢子悬液,28 ℃、170 r/min摇床振荡培养6 d。将菌液12000 r/min离心2 min取上清,加入2滴0.05%百里酚以抑制微生物活动并防止有机酸分解。将菌液过水相0.22 μm滤膜后上机测试。
1.7.1 有机酸标准液配制:分别精确称取酒石酸(Tartaric acid)、草酸(Oxalic acid)、苹果酸(Malic acid)、柠檬酸(Citric acid)、乳酸(Lactic acid)、延胡索酸(Fumaric acid)和琥珀酸(Succinic acid) 7种有机酸的标准品(精确至0.0001 g),用流动相A溶解稀释,用孔径0.22 μm的微孔滤膜过滤,定容于50 mL容量瓶中,配制质量浓度为100 mg/L的储备液,4 ℃冷藏。
1.7.2 标准曲线绘制:根据文献及实际操作中紫外吸收灵敏度,将草酸、酒石酸、苹果酸、乳酸、柠檬酸、延胡索酸、琥珀酸按照2.5:5.0:5.0:5.0:5.0:0.5:15.0的比例配制混标,逐级稀释成5、10、20倍分别为a、b、c和d级别的标准液,现配现用。其中a级别标准溶液的质量浓度为56.0、120.0、140.0、103.0、150.0、10.8、300.0 mg/L。
(1) 高效液相条件:流动相A配制:精准称量KH2PO4 (精确至0.0001 g),用超纯水溶解配制浓度为0.01 mol/L,加入适量H3PO4调节pH值至2.73,经水系孔径为0.22 μm的微孔滤膜过滤,超声脱气后备用。动相B为0.1%丙酸水:甲醇=80:20,经超声脱气后备用。色谱柱为ZORBAX SB C18 (5 μm,250 mm×4.6 mm),流速为0.5 mL/min,柱温为25 ℃,进样量10 μL,运行时间10 min。
(2) 质谱条件:负离子扫描,SIM模式,干燥气温度300 ℃,鞘气温度250 ℃,毛细管电压3500 V,喷嘴电压500 V。
1.8 液质联用(LC-MS)测定日本曲霉菌M1溶磷过程中分泌的植物激素试验设计同1.2.6的方法。植物激素标准液配制:分别精确称取生长素(Auxin)和玉米素(Zeatin)标准品(精确至0.0001 g),以甲醇溶解稀释,用孔径0.22 μm的微孔滤膜过滤,定容于50 mL容量瓶中,配制质量浓度为100 mg/L的储备液,4 ℃冷藏。
(1) 高效液相条件:流动相为5 mmol甲酸铵水:甲醇=70:30。色谱柱为Eclipse XDB C18 (3.5 μm,2.1 mm×150 mm),流速为0.3 mL/min,柱温为25 ℃,进样量10 μL,运行时间6 min。
(2) 质谱条件:正离子扫描,MRM模式,干燥气温度300 ℃,鞘气温度250 ℃,毛细管电压3500 V,喷嘴电压500 V。
1.9 不同类型土壤与溶磷菌株匹配性盆栽试验玉米种子0.4%的次氯酸钠表面灭菌,灭菌蒸馏水冲洗4次除去次氯酸钠, 再用55 ℃灭菌蒸馏水浸种,在30 ℃温箱培养过夜后将种子转入灭菌纱布上催芽。试验使用塑料盆(18 cm×15 cm×15 cm),每盆装土壤750 g。菌剂处理为:(1)对照(CK)。不接菌,施用难溶磷;(2)溶磷菌DSM 821。接菌,施用难溶磷;(3)溶磷菌M1。接菌,施用难溶磷。供试磷源为3种,分别是Ca3(PO4)2、AlPO4和开阳磷矿粉(KYRP),每种磷源用量为1.0 g/kg土壤。菌剂使用量为5 g/kg土壤,菌剂与土壤混合均匀。试验采用完全随机设计方案,在水稻土(1)、黏性潮土(2)、盐潮土(3)和石灰性潮土(4),添加难溶磷磷酸三钙、磷酸铝和开阳磷矿粉(KYRP),分别接入溶磷菌M1、DSM 821,以不接菌为对照CK。每个处理重复4次,共计144盆。温室种植(2014年3月28日种植,5月4日收获,北京白天平均28 ℃,夜间平均18 ℃),每盆播种2粒发芽的玉米种子。生长期间每10 d浇灌植物营养液100 mL/盆。采集玉米根际土壤样品和收获玉米植株,测定植株鲜重、干重和土壤有效磷含量。玉米品种为郑单958。
1.10 溶磷菌株小区试验2014年5月在北京市唐家岭布置了田间小区试验。供试菌株为M1、DSM 821和ATCC20851为对照菌株,小区试验地面积为10 m×4 m,将其划分为1.8 m×0.8 m的小区,每个小区接种菌剂300 g,菌剂处理为:(1)对照(CK)、不接种溶磷菌剂;(2)接种ATCC20851溶磷菌剂:(3)接种DSM 821溶磷菌剂;(4)接种M3溶磷菌剂;(5)接种M1溶磷菌剂。每个处理重复4次,溶磷菌剂与表层15 cm土壤混合均匀后培垄(200 cm×20 cm×20 cm),每个垄种植花生16棵,155 d收获。测定花生植株鲜重和干重、花生果实鲜重和干重。将小区产量折合为每公顷的产量,收获时采集花生根部土壤测定土壤有效磷含量。
1.11 数据统计分析方法采用SAS 9.2统计软件对数据进行统计分析(SAS Institute Inc.,Cary,NC,USA)。
利用SPSS 19.0软件中的一般线性模型(General Lineral Model for Univariate,GLM-Univariate)进行多因素方差分析。
2 结果和分析 2.1 溶磷菌的筛选、鉴定从向日葵根围土壤样品中共分离到5株溶磷真菌,其中真菌M1在无机磷培养基上生长良好(图 1-A),5 d能够将9 cm培养皿内的无机磷全部溶解,说明该菌具有较强的溶磷能力,故选择菌株M1作为本试验的供试菌株。菌株M1在PDA培养基中28 ℃培养(图 1-B),菌落生长迅速,菌丝为白色,2 d后出现棕色分生孢子,5 d时分生孢子多且易脱落,颜色变深为棕褐色,有少量渗出液,无明显气味,背面为浅黄色。扫描电镜观察菌株M1的孢子为椭圆形(图 1-C),直径约5 μm,脱水过程中孢子大量脱落,菌丝无隔断。
|
| 图 1 日本曲霉菌M1形态特征 Figure 1 Characteristics of Aspergillus japonicus isolate M1. A: colony grew of strain M1 on PDA medium; B: a phosphate solubilization clear halo of isolate M1 on PVK plate; C: observed the hyphae and conidial heads of isolate M1 under Scanning Electron Microscope. |
利用ITS rDNA特异引物对菌株进行PCR扩增得到538 bp的目的DNA片段,提交到GenBank (登录号MF073328)。利用BLAST软件与GenBank的序列进行同源性比较,结果显示菌株M1与日本曲霉(Aspergillus japonicus)的同源性达到99%。利用MEGA 6.0的Neighbor-Joining软件进行系统发育树的构建(图 2),菌株M1与Aspergillus japonicus处于相同的发育地位,说明菌株M1与Aspergillus japonicus在ITS rDNA序列上具有高度的相似性,即为某一共同祖先经过趋异进化而形成的不同序列。因此,形态学和ITS序列鉴定结果一致,菌株M1为日本曲霉。

|
| 图 2 菌株M1基于ITS rDNA序列同源性构建的系统发育树 Figure 2 Phylogenetic tree of M1 and reference Aspergillus species. Evolutionary distances showed in the figure 1 were calculated by MEGA 6.0; Bootstrap=1000. Bar, 0.05 substitution per nucleotide. Numbers in parentheses represent the sequences accession number in GenBank. The number at each branch points is the percentage supported by bootstrap. |
2.2 溶磷菌株M1的溶磷效果研究 2.2.1 溶磷菌株对不同难溶磷酸盐的作用效果:
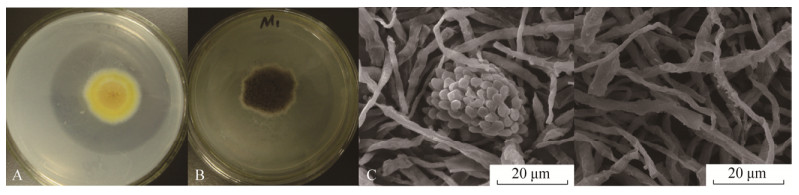
接种溶磷菌株的溶磷量明显高于对照(图 3,图 4)。以磷酸三钙为磷源的处理中,接种溶磷菌株摇瓶中培养3 d,菌株M1处理下溶液有效磷含量为579.37 mg/L,DSM 821菌株处理的溶液有效磷含量为341.75 mg/L;摇瓶中接种菌株6 d,菌株M1处理的溶液有效磷达到1020.89 mg/L,DSM 821处理的培养液中有效磷含量达到696.18 mg/L,与3 d相比分别增加441.49 mg/L和354.43 mg/L,CK处理有效磷含量仅为24.05 mg/L;摇瓶培养9 d时,接种菌株M1的处理有效磷达到980.89 mg/L,比DSM 821的有效磷增加294.16 mg/L,磷酸三钙的溶解率为60.82%,菌株DSM 821对磷酸钙的溶解率仅为42.58%。以磷酸铝为磷源的液体培养试验中,接种菌株摇瓶培养3 d时,菌株M1比DSM 821的有效磷增加106.15 mg/L;接种菌株摇瓶培养6 d时,菌株M1处理的溶液有效磷含量达到995.69 mg/L (比3 d增加633.13 mg/L),DSM 821处理的有效磷含量达到772.86 mg/L (比3 d增加516.45 mg/L),CK有效磷含量仅为21.28 mg/L;摇瓶接种菌株9 d时,菌株M1有效磷含量达到976.49 mg/L,比菌株DSM82的有效磷增加260.59 mg/L,M1对磷酸铝的溶解率为47.65%,菌株DSM 821对磷酸铝的溶解率为34.93%。可见菌株M1对磷酸三钙和磷酸铝的溶解能力大于菌株DSM 821,更显著高于对照。

|
| 图 3 菌株M1和DSM 821对Ca3(PO4)2的溶解量 Figure 3 Soluble phosphorus content in Ca3(PO4)2 broth medium by strain M1 and DSM 821. |
|
| 图 4 菌株M1和DSM 821对AlPO4的溶解量 Figure 4 The soluble phosphorus content in AlPO4 by strain M1 and DSM 821. |
2.2.2 溶磷菌株对不同磷矿粉的作用效果:
液体摇床培养条件下,以我国5种磷矿粉为磷源,接种菌株M1与菌株DSM 821,结果显示,2株溶磷菌株的溶磷能力显著高于对照,菌株M1的溶磷量显著大于菌株DSM 821 (表 2),摇床培养6 d时,菌株M1对开阳、昆阳和晋宁磷矿粉中溶磷量分别达到236.98、220.33、363.64 mg/L,比对照分别增加233.57、216.37、359.59 mg/L,锦屏和钒山磷矿粉中溶磷量与对照之间没有差异;菌株DSM 821对磷矿粉的溶磷能力略低于菌株M1,比对照增加113.94-359.59 mg/L,而DSM 821对锦屏和钒山磷矿粉的溶磷量分别为18.62 mg/L和20.12 mg/L,比对照增加15.24 mg/L和16.07 mg/L,差异达到显著水平。与菌株DSM 821相比,菌株M1接种开阳磷矿粉处理的溶液有效磷增加119.53 mg/L,接种昆阳磷矿粉处理的溶液有效磷增加14 mg/L,接种晋宁磷矿粉处理的溶液有效磷增加82 mg/L。由此说明,菌株M1对于开阳、昆阳和晋宁磷矿粉的溶磷能力高于对照菌株DSM 821。
| Strains | Soluble phosphate content/(mg/L) | ||||
| Kaiyang RP | JPRP | FSRP | Kunyang RP | JNRP | |
| CK | 3.51c | 3.39 b | 4.05 b | 3.86 c | 4.05 c |
| DSM 821 | 117.45 b | 18.62 a | 20.12 a | 206.33 b | 281.64 b |
| M1 | 236.98 a | 5.92 b | 4.78 b | 220.33 a | 363.64 a |
| Signif (P) |
0.05 | 0.05 | 0.05 | 0.05 | 0.05 |
| The letters indicate the significant difference at 5% level. | |||||
综上所述,菌株M1在磷酸三钙、磷酸铝开阳磷矿粉、昆阳磷矿粉、晋宁磷矿粉的溶解能力大于菌株DSM 821;对磷酸三钙的溶解能力大于磷酸铝和磷矿粉。
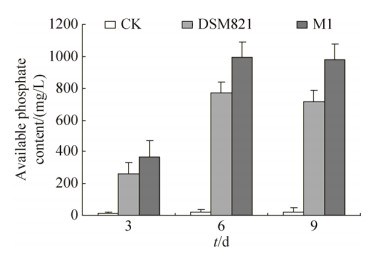
2.3 磷菌株对难溶磷培养液pH值的影响 2.3.1 无机难溶磷液体培养基中pH值变化:在起始pH值为7.0的磷酸三钙和磷酸铝培养液中(图 5),菌株M1、DSM 821与CK相比,溶液pH值明显下降且差异显著。磷酸三钙培养液中,菌株M1培养7 d时溶液pH值降至最低为3.36,降幅大于菌株DSM 821,差异达显著水平。磷酸铝培养液中,菌株M1培养7 d时溶液pH值降至最低为2.98,降幅小于菌株DSM 821,差异不显著。
|
| 图 5 Pikovskaya培养液[难溶磷分别为Ca3(PO4)2 (A)、AlPO4 (B)]接种菌株M1后pH值的变化 Figure 5 pH value change in Ca3(PO4)2 (A) and AlPO4 (B) mediated PVK broth inoculated with isolate M1. |
2.3.2 溶磷菌株对磷矿粉液体培养基pH值的影响:
溶磷菌M1和DSM 821接种于分别使用5种磷矿粉的液体培养基中,结果显示,所有接种处理的溶液pH值均比CK显著下降(表 3)。菌株M1在开阳磷矿粉中pH值下降至最低(3.97),菌株DSM 821在晋宁磷矿粉中pH值最低(4.18)。菌株M1使得5种磷矿粉的溶液pH值均低于菌株DSM 821,差异显著。
| Strains | Insoluble rock phosphate | ||||
| Kaiyang RP | JPRP | FSRP | Kunyang RP | JNRP | |
| CK | 7.69 a | 7.84 a | 7.85 a | 7.91 a | 6.94 a |
| M1 | 3.97 c | 4.03 c | 4.17 c | 4.34 c | 3.99 c |
| DSM 821 | 4.21 b | 4.38 b | 4.32 b | 4.54 b | 4.18 b |
| The letters indicate the significant difference at 5% level. | |||||
2.4 溶磷菌株耐盐性能力测定
溶磷菌株M1、DSM 821分别接入耐盐培养基中(表 4),与CK (NaCl含量为0)相比,在盐含量为5%的培养基中菌株DSM 821的生长受抑制,而菌株M1的生长状况与CK中相似;在盐含量为7.5%时,菌株DSM 821的生长严重被抑制,菌株M1的抑制程度低于DSM 821;在盐含量为10%时,菌株DSM 821无生长,菌株M1被严重抑制。可见,溶磷真菌M1耐盐胁迫能力较好,最高可耐受10%的盐浓度。
| Strains | NaCl content/% | ||||
| 0 | 5.0 | 7.5 | 10.0 | 12.5 | |
| M1 | +++ | +++ | ++ | + | - |
| DSM 821 | +++ | ++ | + | - | - |
| -, +, ++, +++ represent no colony, colonies inhibited severely, colonies inhibited slightly, colonies thriving, respectively. | |||||
2.5 不同难溶磷对溶磷菌产酸的影响
菌株M1接入分别含磷酸三钙、磷酸铝或开阳磷矿粉的Pikovskaya培养液中,利用LC-MS法测定溶液中有机酸的种类和浓度(图 6)。结果显示,菌株在不同难溶磷培养液中,产生有机酸的种类相同,但浓度有差异。菌株M1在3种难溶磷的培养液中,以分泌草酸和柠檬酸为主,其次为苹果酸、乳酸和琥珀酸,微量的酒石酸和延胡索酸。菌株M1在不同难溶磷培养条件下,总有机酸分泌量Ca3(PO4)2>AlPO4>磷矿粉,分别为1161.63、984.10、940.77 mg/L。
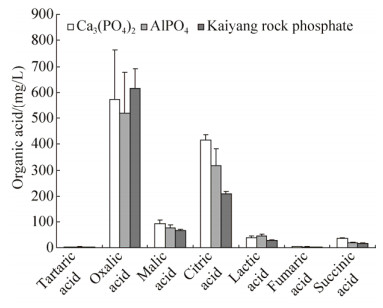
|
| 图 6 Ca3(PO4)2、AlPO4、开阳磷矿粉对溶磷真菌M1产生有机酸(6 d)的影响 Figure 6 Effects of organic acids produced by isolate M1 in in different phosphate sources (6 d). |
2.6 不同难溶磷对溶磷菌分泌植物激素的影响
菌株M1接入分别含磷酸三钙、磷酸铝和开阳磷矿粉的Pikovskaya培养液中,利用LC-MS法测定溶液中生长素和玉米素(表 5)。结果表明,菌株M1在不同难溶磷中分泌生长素的含量差异显著,而分泌玉米素含量无明显差异。菌株M1生长素分泌量Ca3(PO4)2>磷矿粉>AlPO4,分别为77.58、32.29、18.45 mg/L;分泌玉米素含量磷矿粉>Ca3(PO4)2>AlPO4,分别为0.11、0.07、0.06 mg/L。
| Treatment | c(phytohormone)/(mg/L) | |
| Auxin | Zeatin | |
| Ca3(PO4)2 | 77.58 a | 0.07 a |
| AlPO4 | 18.45 b | 0.06 a |
| KYRP | 32.29 b | 0.11 a |
| Signif (P) | 0.05 | 0.05 |
| The letters indicate the significant difference at 5% level. | ||
2.7 溶磷真菌与难溶磷及不同土壤适配性研究 2.7.1 溶磷菌株对玉米盆栽土壤难溶磷的溶解效果:
接种菌剂M1和DSM 821明显提高土壤中有效磷含量,与CK相比,差异均达显著性水平(表 6)。菌剂M1分别接种于4种土壤,结果显示,所有4种土壤的有效磷含量皆高于对照和DSM821,而菌剂DSM821有效磷含量高于对照。以土壤种类为主要因素,对所有接种菌剂和不同磷源处理下的数据进行平均,结果显示,4种土壤中以1号水稻土有效磷含量最高,平均为33.08 mg/kg,表明溶磷菌剂M1和DSM821在水稻土活化难溶磷的能力最强;4号石灰性潮土中有效磷含量最低,为31.40 mg/kg,说明菌剂M1和DSM821在该土壤中溶磷效果较差,表明菌剂M1和DSM821在水稻土中溶解难溶磷的能力高于其他3种土壤。接种菌剂和不接菌(CK)处理下,接种菌剂M1土壤有效磷含量最高(33.22 mg/kg),CK土壤有效磷含量最低(9.59 mg/kg),接种菌剂M1比对照增加23.61 mg/kg;接种菌剂DSM 821土壤有效磷含量为30.91 mg/kg,比对照增加21.32 mg/kg。不同磷源处理下,以磷酸铝为磷源的土壤有效磷含量最高,为32.31 mg/kg;以开阳磷矿粉为磷源的土壤有效磷含量最低,为31.58 mg/kg,表明菌剂M1和DSM821在土壤中活化磷酸铝的能力最强,优于磷酸三钙和磷矿粉。
| Soil No. | Strains | Treatment | Available phosphorus/(mg/kg) | Mean/(mg/kg) | Increase rate/% |
| 1 | M1 | Ca3(PO4)2 | 32.40 g | 33.73 | 298.52 |
| AlPO4 | 37.13 a | 287.98 | |||
| KYRP | 31.66 i | 272.91 | |||
| DSM 821 | Ca3(PO4)2 | 31.77 hi | 32.45 | 290.77 | |
| AlPO4 | 35.74 c | 273.46 | |||
| KYRP | 29.83 n | 251.35 | |||
| CK | Ca3(PO4)2 | 8.13 w | 8.73 | - | |
| AlPO4 | 9.57 s | - | |||
| KYRP | 8.49 v | - | |||
| 2 | M1 | Ca3(PO4)2 | 36.42 b | 34.49 | 243.58 |
| AlPO4 | 35.03 d | 229.85 | |||
| KYRP | 32.02 h | 258.97 | |||
| DSM 821 | Ca3(PO4)2 | 31.75 i | 29.94 | 199.53 | |
| AlPO4 | 27.81 p | 161.86 | |||
| KYRP | 30.25 m | 239.13 | |||
| CK | Ca3(PO4)2 | 10.60 q | 10.05 | - | |
| AlPO4 | 10.62 q | - | |||
| KYRP | 8.92 u | - | |||
| 3 | M1 | Ca3(PO4)2 | 31.35 j | 32.51 | 235.29 |
| AlPO4 | 32.87 f | 223.84 | |||
| KYRP | 33.31 e | 228.50 | |||
| DSM 821 | Ca3(PO4)2 | 30.53 l | 30.60 | 226.52 | |
| AlPO4 | 29.42 o | 189.85 | |||
| KYRP | 31.84 hi | 214.00 | |||
| CK | Ca3(PO4)2 | 9.35 st | 9.88 | - | |
| AlPO4 | 10.15 r | - | |||
| KYRP | 10.14 r | - | |||
| 4 | M1 | Ca3(PO4)2 | 33.01 f | 32.17 | 260.77 |
| AlPO4 | 31.02 k | 232.12 | |||
| KYRP | 32.47 g | 204.60 | |||
| DSM 821 | Ca3(PO4)2 | 31.32 j | 30.66 | 242.30 | |
| AlPO4 | 29.42 o | 214.99 | |||
| KYRP | 31.23 jk | 192.96 | |||
| CK | Ca3(PO4)2 | 9.15 tu | 9.72 | - | |
| AlPO4 | 9.34 st | - | |||
| KYRP | 10.66 q | - | |||
| The letters indicate the significant difference at 5% level. | |||||
4种土壤、2种菌剂和3种难溶磷源共36个处理中,以磷酸铝为磷源的水稻土接种菌剂M1的处理,土壤有效磷含量最高(37.13 mg/kg),与CK、DSM 821相比差异显著,比CK增加27.56 mg/kg,增长率为287.98%;而黏性潮土则以开阳磷矿粉为磷源的CK处理的土壤有效磷含量最低,仅8.92 mg/kg,表明磷矿粉在不接菌剂的条件下,土壤自身对磷矿粉的活化能力较弱。
对玉米盆栽试验中土壤有效磷含量进行多因素方差分析,结果表明溶磷菌株、土壤类型、难溶磷及其交互作用,差异显著。在统计中由于偏Eta方(Partial Eta Squared,η2)值表示主效应或交互效应的大小,上述因素及其交互作用对土壤有效磷含量效应的大小次序为溶磷菌剂(η2=0.966)>难溶磷(η2=0.880)>溶磷菌剂×难溶磷(η2=0.825)>溶磷菌剂×土壤×难溶磷(η2=0.712)>土壤(η2=0.485)>土壤×难溶磷(η2=0.357)>溶磷菌剂×土壤(η2=0.353)。溶磷菌剂、难溶磷单因素及两者互作效应值分别为0.966、0.880和0.825,土壤类型单因素效应值仅为0.485。因此,溶磷菌剂、难溶磷及其交互作用是影响土壤有效磷含量的决定性因素。
综上说明,菌剂M1比菌剂DSM 821对提高土壤有效磷的含量具有显著优势,菌剂M1与水稻土适配性最佳,菌剂DSM 821与黏性潮土适配性较差,菌剂M1与4种土壤的适配性均高于菌剂DSM 821,具有较强应用潜力。
2.7.2 溶磷菌株对玉米盆栽植株的促生效果:对玉米生物量的影响与土壤有效磷含量相同,接种菌剂M1和DSM 821能提高玉米生物量(表 7)。同种土壤中,接种菌剂M1的玉米生物量均高于菌剂DSM 821。4种土壤中接种菌剂和不同磷源处理下,1号水稻土中玉米生物量最高,鲜重、干重分别为31.29 g和5.18 g,表明菌剂M1和DSM 821在水稻土中对玉米的促生效果最好;4号石灰性潮土中玉米生物量最低,鲜重、干重分别为11.61 g和1.27 g,说明菌剂M1和DSM821在石灰性潮土中促生效果较差。接种菌剂和不接菌(CK)处理下,接种菌剂M1的玉米生物量最高,鲜重、干重分别为23.08 g和3.79 g;CK处理的玉米生物量最低,鲜重、干重分别为15.61 g和1.50 g。
| Soil No. | Strains | Treatment | Shoot fresh weight/g | Increase rate/% | Shoot dry weight/g | Increase rate/% |
| 1 | M1 | Ca3(PO4)2 | 35.17 a | 90.91 | 6.27 a | 268.28 |
| AlPO4 | 35.06 ab | 90.27 | 6.10 a | 255.69 | ||
| KYRP | 29.93 bcde | 48.95 | 5.93 a | 232.82 | ||
| DSM 821 | Ca3(PO4)2 | 29.72 cde | 61.31 | 4.37 bc | 156.83 | |
| AlPO4 | 31.15 abcd | 69.05 | 4.65 b | 170.85 | ||
| KYRP | 26.72 cdef | 32.96 | 3.78 c | 112.20 | ||
| CK | Ca3(PO4)2 | 18.42 hijk | - | 1.70 def | - | |
| AlPO4 | 18.43 hijk | - | 1.72 def | - | ||
| KYRP | 20.10 hij | - | 1.78 def | - | ||
| 2 | M1 | Ca3(PO4)2 | 31.26 abc | 45.03 | 6.01 a | 214.66 |
| AlPO4 | 31.12 abcd | 44.44 | 5.94 a | 205.13 | ||
| KYRP | 30.07 abcde | 33.89 | 5.91 a | 207.55 | ||
| DSM 821 | Ca3(PO4)2 | 26.11 defg | 21.15 | 3.92 bc | 105.24 | |
| AlPO4 | 26.83 cdef | 24.54 | 4.28 bc | 119.77 | ||
| KYRP | 25.25 efg | 12.42 | 3.59 c | 86.98 | ||
| CK | Ca3(PO4)2 | 21.55 ghi | - | 1.91 de | - | |
| AlPO4 | 21.55 ghi | - | 1.95 d | - | ||
| KYRP | 22.46 fgh | - | 1.92 de | - | ||
| 3 | M1 | Ca3(PO4)2 | 16.67 ijklm | 53.53 | 1.82 def | 46.28 |
| AlPO4 | 16.98 ijkl | 48.87 | 1.80 def | 39.34 | ||
| KYRP | 15.62 jklmn | 48.64 | 1.69 def | 30.81 | ||
| DSM 821 | Ca3(PO4)2 | 14.39 klmno | 32.49 | 1.71 def | 37.83 | |
| AlPO4 | 11.94 lmno | 4.67 | 1.45 def | 12.40 | ||
| KYRP | 11.49 no | 9.32 | 1.42 def | 10.27 | ||
| CK | Ca3(PO4)2 | 10.86 no | - | 1.24 def | - | |
| AlPO4 | 11.40 no | - | 1.29 def | - | ||
| KYRP | 10.51 no | - | 1.29 def | - | ||
| 4 | M1 | Ca3(PO4)2 | 11.72 mno | 21.68 | 1.29 def | 27.16 |
| AlPO4 | 12.53 lmno | 5.45 | 1.39 def | 22.15 | ||
| KYRP | 10.85 no | 2.14 | 1.31 def | 26.88 | ||
| DSM 821 | Ca3(PO4)2 | 11.67 mno | 21.13 | 1.29 def | 27.16 | |
| AlPO4 | 12.16 lmno | 2.34 | 1.21 def | 5.70 | ||
| KYRP | 10.74 no | 1.11 | 1.13 ef | 9.20 | ||
| CK | Ca3(PO4)2 | 9.63 o | - | 1.01 f | - | |
| AlPO4 | 11.88 lmno | - | 1.14 def | - | ||
| KYRP | 10.62 no | - | 1.03 f | - | ||
| The letters indicate the significant difference at 5% level. | ||||||
水稻土中使用磷酸三钙的同时接种菌剂M1处理,植株干重增长率最大,为268.28%;石灰性潮土中接种菌剂DSM 821以开阳磷矿粉为磷源的处理中,植株鲜重增长率最小,为1.11%。接入菌剂M1与DSM821相比,M1的植株干重和鲜重都有增加。表明菌剂M1在4种土壤中对玉米生物量的促生效果好于菌剂DSM 821。
对盆栽试验中玉米生物量进行统计,结果表明溶磷菌株、土壤类型、难溶磷及其交互作用,差异达显著性水平(图 7)。其对玉米生物量最大效应值为:菌剂(鲜重η2=0.952、干重η2=0.960)、难溶磷(鲜重η2=0.774、干重η2=0.922),而土壤效应值较低(鲜重η2=0.110、干重η2=0.078)。可见,溶磷菌剂、难溶磷及其交互作用是影响玉米生物量的决定性因素。

|
| 图 7 溶磷菌株对玉米促生效果的盆栽试验(37 d) Figure 7 Inoculated with soluble phosphate fungi for crop growth promotion in pot experiment (37 d). A: the period of seeding emergence; B: jointing stage. |
综上表明,菌剂M1对玉米生物量的作用效果优于菌剂DSM821,菌剂M1与4种土壤的适配性均高于菌剂DSM 821。
2.8 溶磷菌剂对小区试验花生产量的影响接种菌剂对花生的生长有明显促生效果,施加菌剂花生植株的鲜重和干重比对照增加显著,对花生产量的促生效果为菌剂M1>DSM 821>ATCC20851>CK (图 8)。
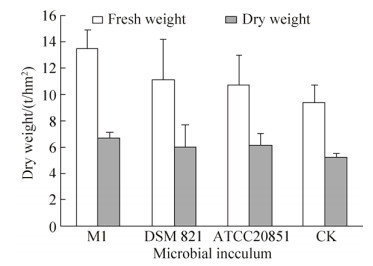
|
| 图 8 不同菌株处理下的花生植株鲜干重 Figure 8 The shoot fresh and dry weight of peanut with different strains. |

|
| 图 9 溶磷菌株对花生的促生效果 Figure 9 Inoculated with soluble phosphate strains for peanut growth promotion in field experiment. |
添加菌剂M1对花生的干重、鲜重促生作用最好,与CK相比,菌剂M1处理的植株鲜重、干重分别增加43.92%和27.67%,达13.50 t/hm2和6.69 t/hm2;施加菌剂ATCC20851,植株鲜重、干重比CK分别增加13.96%和16.60%,达到10.69 t/hm2和6.11 t/hm2;菌剂DSM 821处理的植株鲜重、干重比CK分别增加18.87%和14.31%,达11.15 t/hm2和5.99 t/hm2。添加不同的菌剂对花生植株的促生效果不同,菌剂M1与ATCC 20851相比,植株鲜重提高2.81 t/hm2,干重提高0.58 t/hm2;菌剂M1与菌剂DSM 821相比,植株的鲜重、干重分别增加2.35 t/hm2和0.70 t/hm2。综上表明,添加菌剂M1对小区试验花生生物量的促生效果最好。
2.9 小区试验供试菌株对花生果实产量及土壤有效磷的影响研究结果表明(表 8),施加菌剂与CK相比,花生果实鲜重与干重差异显著。对花生果实的促生效果为菌剂M1>ATCC20851>DSM 821>CK。对花生果实产量影响最大的为菌剂M1,比CK花生果实鲜重、干重增产1.39 t/hm2和0.81 t/hm2,达5.35 t/hm2和3.65 t/hm2;菌剂ATCC20851处理下的花生果实鲜重、干重,比CK增产0.80 t/hm2和0.50 t/hm2,达6.15 t/hm2和4.15 t/hm2。菌剂M1比菌剂ATCC20851处理的花生果实鲜重、干重增加9.59%和7.47%。
| Treatment | Fresh weight/ (t/hm2) |
Dry weight/ (t/hm2) |
Dry weight growth rate/% | Soil available phosphorus/(mg/kg) | Increased rate/% |
| CK | 5.35 d | 3.65 c | - | 18.56 d | - |
| ATCC 20851 | 6.15 b | 4.15 b | 13.70 | 26.36 c | 42.02 |
| DSM 821 | 5.75 c | 4.05 b | 10.96 | 28.14 c | 51.56 |
| M1 | 6.74 a | 4.46 a | 22.19 | 35.58 a | 91.67 |
| The letters indicate the significant difference at 5% level. | |||||
添加菌剂能显著提高土壤中有效磷含量(表 8),与对照相比差异显著。对土壤中有效磷含量影响最大的为菌剂M1,与CK比增加91.67%达35.58 mg/kg;菌剂DSM 821与CK比土壤有效磷含量增加9.58 mg/kg,达到28.14 mg/kg;菌剂ATCC 20851与CK比,土壤有效磷含量增加42.02%,达26.36 mg/kg。菌剂处理之间土壤有效磷含量差异显著,菌剂M1与ATCC20851相比,土壤有效磷含量增加34.98%。综上可见,菌剂M1在小区试验中对花生产量以及土壤磷养分促进效果最好。
3 讨论溶磷微生物具有提高土壤有效磷含量、促进作物生长的作用,已报道的溶磷微生物有36个属、89种,以及数以万计的溶磷菌株[42]。目前,溶磷真菌筛选报道的主要是曲霉菌(Aspergillus)、青霉菌(Penicillium)、木霉菌(trichoderma)、酵母菌(Saccharomyces)、正青霉菌(Eupenicillium)、篮状菌(Talaromyces)、根霉菌(Rhizopus)、镰刀菌(Fusarium)、小菌核菌(Sclerotium)和轮枝菌(Verticillium)等,其中绝大部分为青霉菌和曲霉菌。研究人员已从世界各地不同类型土壤中分离到大量高效溶磷曲霉,研究人员从美国哥伦比亚和墨西哥种植咖啡的酸性红壤和热带氧化土壤中筛选到曲霉菌O1-12和O1-40[43]、在夏威夷火山灰土中分离到黑曲霉[44];从锡金农田土壤中筛选到烟曲霉[45];从中国北方石灰性土壤中分离到黑曲霉P85[14],印度、伊拉克、加拿大、埃及等国科学家从石灰性土壤中分离到塔宾曲霉[25]、黑曲霉[11]、泡盛曲霉菌[18]和臭曲霉[46]等高效溶磷菌。本研究获得的具有耐盐、溶磷特性的真菌M1,鉴定为日本曲霉,迄今未见溶磷耐盐功能的报道。
溶磷菌株对难溶磷源具有特异性选择,但能溶解的磷源种类越多,能力越强,应用前景越好。日本曲霉菌M1在液体摇瓶培养和土壤条件下,对多种难溶磷都表现出较强的溶解能力。现已报道的溶解磷酸三钙较强的曲霉菌株有P85 (A. niger)[14]、S36 (A. niger)[47]和FS1 (A. niger)[48],换算成培养基中加入磷酸三钙5 g/L,培养液中最大可溶性磷含量分别为706.85、312、537.5 mg/L。菌株M1在加入5 g/L磷酸三钙培养液中,有效磷最大浓度为1020.89 mg/L,在溶解磷酸三钙上要优于上述菌株。以往研究表明,多数溶磷菌株对磷酸三钙的溶解能力高于磷酸铝和磷矿粉[47-48]。溶解磷酸铝较好的溶磷真菌菌株已有较多报道,其中,菌株B1-A (A. niger)[49]、菌株FS1 (A. niger)[48]和菌株Z60 (A. niger)[50]对磷酸铝溶解能力较强,水溶性磷最大浓度分别为942.3、713.0、624.1 mg/L,其他能溶解磷酸铝的曲霉菌株,可溶性磷含量大多约100 mg/L[48-49],日本曲霉M1对磷酸铝的溶解量为995.69 mg/L,菌株M1对磷酸铝的溶解能力优于菌株B1-A、FS1和Z60。一般而言,液体培养条件下溶磷曲霉菌溶解磷矿粉的能力为28-266 mg/L[10, 14, 51],菌株M1在晋宁磷矿粉中可溶性磷最高含量为363.64 mg/L。显而易见,日本曲霉M1对磷矿粉的溶解能力显著高于大多数已报道的溶磷菌株,略低于黑曲霉An2[8]。黑曲霉An2溶解磷酸铝(培养液中折合成5 g/L的加入量)的有效磷达1178 mg/L,高于菌株M1,但对磷酸三钙和磷矿粉的溶解能力明显低于菌株M1,An2的最大溶解量分别为861 mg/L和89.5 mg/L;同时菌株M1对NaCl的最大耐受力为10%,而菌株An2仅能耐受5%的NaCl。耐盐能力较好的菌株P. oxalicum[30]、Saccharomyces[31]和Trichoderma[32]当培养液中NaCl浓度为0.4%-1.5%时,菌落生长明显受抑制。比较而言,菌株M1不仅表现出高效的溶磷能力,而且耐盐能力皆高于目前已报道的溶磷曲霉菌菌株。
我们对筛选获得的日本曲霉M1与4种典型土壤的适配性进行了研究,结果显示了菌剂M1将土壤难溶磷转化为有效磷的高效性。4种土壤接种菌剂M1对玉米生物量最大增加率达268.28%,凸显了菌剂M1优良的促生效果。大量报道显示,溶磷曲霉菌在土壤中转化难溶磷具有良好的效果,能促进植株的生长[34-35],然而,溶磷微生物与不同难溶磷、多种土壤的适配性的研究未见报道。Yin等[14]在盆栽试验土壤中添加磷矿粉、接种菌剂P85 (A. niger),与对照相比土壤有效磷含量增加98.01%、玉米植株生物量增加9.31%。Xiao等[51]接种菌剂WHAK1 (A. niger)并施加磷矿粉于土壤中,与对照相比有效磷含量增加37.04%,小麦植株干重增加36.8%。Mittal等[38]在盆栽土壤中添加磷酸三钙并接入混合菌剂VH1 (A. awamori)+ VQ2 (A. awamori),有效磷含量增加26%,鹰嘴豆种子和植株总生物量增加61.11%。接种剂M1于4种土壤中,所有接菌M1处理的土壤有效磷均显著增加,增加率最大值为287.98% (表 7),我们的研究表明菌株M1与我国黏性潮土配合时生物量和有效磷含量最高,其次是与水稻土配合,因此,M1在上述2种土壤中都能够高效溶解土壤磷和外源加入的难溶磷,为未来生产中高效使用M1生物肥料提供了重要依据。
目前,关于溶磷菌的溶磷过程一般被认为是菌株在生长过程中产生低分子量有机酸,这些有机酸通过羟基或羧基与难溶性磷酸盐上的钙、铁、铝、镁、锌等金属离子螯合,从而将难溶磷转化成可溶性磷[7, 42]。溶磷真菌产生的有机酸种类主要有:葡萄糖酸、柠檬酸、乳酸、苹果酸、乙酸、丙酸和琥珀酸等[8, 14-15]。Schneider等[52]检测到黑曲霉ATCC 9142在溶解磷矿粉时主要分泌葡萄糖酸(36.9 mg/L)。范丙全等[15]研究表明菌株P8在溶解磷矿粉时主要分泌苹果酸(56.6 mg/L)、乙酸(69.3 mg/L)和丙酸(42 mg/L);Yin等[14]研究结果与之相似,其还检测到大量柠檬酸(98.24 mg/L)和其他7种少量有机酸,如甲酸(29.19 mg/L)、乙酸(67.97 mg/L)、酒石酸(56.37 mg/L)、乳酸(37.48 mg/L)、延胡索酸(0.33 mg/L)、琥珀酸(33.99 mg/L)、草酸(11.27 mg/L)。Li等[8]测定黑曲霉An2在难溶磷源磷酸钙、磷酸镁、磷酸铝、磷酸铁和磷矿粉中主要分泌的有机酸为草酸、酒石酸和琥珀酸,菌株在不同磷源中产生有机酸的含量差异较大。日本曲霉M1在磷酸钙、磷酸铝和磷矿粉培养液中检测到7种有机酸,其中含量最高的为草酸(616.16 mg/L)和柠檬酸(413.69 mg/L),难溶磷种类影响菌株M1分泌总有机酸的含量,M1分泌有机酸的总含量为940.77-1161.63 mg/L。已有报道显示,曲霉菌菌株分泌有机酸的含量为12-1620 mg/L[8, 14, 52]。溶磷菌黑曲霉An2产生酒石酸的含量为880 mg/L,酒石酸为二羧酸,有机酸对难溶磷的溶解是依靠羧基来螯合磷源中的金属离子而释放有效磷,有机酸中含有羧基愈多则螯合能力愈强[53]。而本研究中菌株M1分泌的大量柠檬酸为三羧酸,此酸能大量螯合难溶磷中的金属离子,从而有效释放水溶性磷,可能是导致菌株M1高效溶磷能力的主要因素。
研究表明,溶磷微生物作为促生菌的一类,同样能够分泌一定量的植物激素(主要为IAA、赤霉素GA和细胞分裂素),促进作物生长[54]。目前植物激素的测定方法主要有生物鉴定法、免疫分析法和色谱分析法三大类。质谱法较前三类方法具有确定物质分子量、灵敏度更高的优点。本研究利用LC-MS法测定菌株M1在磷酸三钙、磷酸铝和磷矿粉供应条件下分泌生长素和玉米素的含量最大值分别为77.58 mg/L和0.11 mg/L。已报道的溶磷菌株分泌IAA含量较高的菌种包括Penicillium、Aspergillus、Pseudomonas、Rhizopu和Trichoderma等,其中溶磷曲霉菌分泌生长素的含量为2.50-42.53 mg/L[32, 55-56],且大多研究中仅测定溶磷菌株接入一种难溶磷培养液中吲哚乙酸(IAA)的分泌量,菌株M1分泌生长素的能力高于已报道的溶磷菌株。目前,还未见溶磷曲霉菌分泌玉米素的研究报道。溶磷菌株M1具有高效的溶磷效果和分泌促生物质生长素、玉米素,从而表现出对玉米和花生良好的促生增产效果。因此,集溶磷、促生和耐盐多功能于一体的日本曲霉M1作为有潜力的菌种资源,有望在农业生产中发挥重要的增产节肥作用。
| [1] | Raychaudhuri M, Ngachan SV, Raychaudhuri S, Singh AL. Yield response of groundnut (Arachis hypogaea) to dual inoculation and liming of an acid hill Ultisol of Manipur. Indian Journal of Agricultural Science, 2003, 73(2): 86-88. |
| [2] | Wang H, Appan A, Gulliver JS. Modeling of phosphorus dynamics in aquatic sediments: Ⅱ-examination of model performance. Water Research, 2003, 37(16): 3939-3953. DOI:10.1016/S0043-1354(03)00305-1 |
| [3] |
Wu PF, Zhang DM, Hao LH, Qi ZP. Status quo and prospects of phosphate-soluble microorganisms. Journal of Agricultural Science and Technology, 2008, 10(3): 40-46.
(in Chinese) 吴鹏飞, 张冬明, 郝丽虹, 漆智平. 解磷微生物研究现状及展望. 中国农业科技导报, 2008, 10(3): 40-46. |
| [4] | Singh H, Reddy MS. Effect of inoculation with phosphate solubilizing fungus on growth and nutrient uptake of wheat and maize plants fertilized with rock phosphate in alkaline soils. European Journal of Soil Biology, 2011, 47(1): 30-34. DOI:10.1016/j.ejsobi.2010.10.005 |
| [5] | Son H-J, Park G-T, Cha M-S, Heo M-S. Solubilization of insoluble inorganic phosphates by a novel salt- and pH-tolerant Pantoea agglomerans R-42 isolated from soybean rhizosphere. Bioresource Technology, 2006, 97(2): 204-210. DOI:10.1016/j.biortech.2005.02.021 |
| [6] | Yao Q, Li XL, Feng G. Mobilization of sparingly soluble inorganic phosphates by the external mycelium of an abuscular mycorrhizal fungus. Plant and Soil, 2001, 230(2): 279-285. DOI:10.1023/A:1010367501363 |
| [7] | de Oliveira Mendes G, de Freitas ALM, Pereira OL, da Silva IR, Vassilev NB, Costa MD. Mechanisms of phosphate solubilization by fungal isolates when exposed to different P sources. Annals of Microbiology, 2014, 64(1): 239-249. DOI:10.1007/s13213-013-0656-3 |
| [8] | Li XL, Luo LJ, Yang JS, Li BZ, Yuan HL. Mechanisms for solubilization of various insoluble phosphates and activation of immobilized phosphates in different soils by an efficient and salinity-tolerant Aspergillus niger strain An2. Applied Biochemistry and Biotechnology, 2015, 175(5): 2755-2768. DOI:10.1007/s12010-014-1465-2 |
| [9] | Illmer P., Schinner F. Solubilization of inorganic calcium phosphates-solubilization mechanisms. Soil Biology and Biochemistry, 1995, 27(3): 257-263. DOI:10.1016/0038-0717(94)00190-C |
| [10] | Xu RK, Zhu YG, Chittleborough D. Phosphorus release from phosphate rock and iron phosphate by low-molecular-weight organic acids. Journal of Environmental Sciences, 2004, 16(1): 5-8. |
| [11] | Hussein KA, Joo JH. Isolation and characterization of rhizomicrobial isolatesfor phosphate solubilization and indole acetic acid production. Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(6): 847-855. DOI:10.1007/s13765-015-0114-y |
| [12] | Stalstrom VA. Beitrag Zur Kenntrusder einwinsking sterilizer and in garung befindlieher striffe any dil loslieshkeit der phosphorus are destrical cum phosphours. Zbt Bakt Abt Ⅱ, 1903, 11: 724-732. |
| [13] |
Zhao XR, Lin QM. A review of phosphate-dissolving microorganisms. Soil and Fertilizer, 2001(3): 7-11.
(in Chinese) 赵小蓉, 林启美. 微生物解磷的研究进展. 土壤肥料, 2001(3): 7-11. |
| [14] | Yin ZW, Shi FC, Jiang HM, Roberts DP, Chen SF, Fan BQ. Phosphate solubilization and promotion of maize growth by Penicillium oxalicum P4 and Aspergillus niger P85 in a calcareous soil. Canadian Journal of Microbiology, 2015, 61(12): 913-923. DOI:10.1139/cjm-2015-0358 |
| [15] |
Fan BQ, Jin JY, Ge C. Isolation of Penicillium oxalicum oxalicum and its effect on solubilization of insoluble phosphate under different conditions. Scientia Agricultura Sinica, 2002, 35(5): 525-530.
(in Chinese) 范丙全, 金继运, 葛诚. 溶磷草酸青霉菌筛选及其溶磷效果的初步研究. 中国农业科学, 2002, 35(5): 525-530. |
| [16] | Kanse OS, Whitelaw-Weckert M, Kadam TA, Bhosale HJ. Phosphate solubilization by stress-tolerant soil fungus Talaromyces funiculosus SLS8 isolated from the Neem rhizosphere. Annals of Microbiology, 2015, 65(1): 85-93. DOI:10.1007/s13213-014-0839-6 |
| [17] | Narsian V, Patel HH. Aspergillus aculeatus as a rock phosphate solubilizer. Soil Biology and Biochemistry, 2000, 32(4): 559-565. DOI:10.1016/S0038-0717(99)00184-4 |
| [18] | Mahamuni SV, Wani PV, Patil AS. Isolation of phosphate solubilizing fungi from rhizosphere of sugarcane & sugar beet using Tcp and Rp solubilization. Asian Journal of Biochemical and Pharmaceutical Research, 2012, 2(1): 237-244. |
| [19] | Singh R, Algh GS, Singh S. Screening of phosphorus solubilizing Aspergilli from unusual habitats of Agra region. Indian Journal of Life Sciences, 2012, 2: 165-168. |
| [20] | Priya S, Panneerselvam T, Sivakumar T. Evaluation of indole-3-acetic acid in phosphate solubilizing microbes isolated from Rhizosphere soil. International Journal of Current Microbiology and Applied Sciences, 2013, 2(3): 29-36. |
| [21] | Singal R, Gupta R, Saxena RK. Rock phosphate solubilization under alkaline conditions by Aspergillus japonicus and A. Foetidus. Folia Microbiologica, 1994, 39(1): 33-36. DOI:10.1007/BF02814526 |
| [22] | Rinu K, Malviya MK, Sati P, Tiwari SC, Pandey A. Response of cold-tolerant Aspergillus spp. to solubilization of Fe and Al phosphate in presence of different nutritional sources. ISRN Soil Sci, 2013, 2013: Article ID 598541. |
| [23] | Chakraborty BN, Chakraborty U, Saha A, Sunar K, Dey PL. Evaluation of phosphate solubilizers from soils of North Bengal and their diversity analysis. World Journal of Agricultural Sciences, 2010, 6(2): 195-200. |
| [24] | Naveenkumar KJ, Thippeswamy B, Shivakumar PB, Thirumalesh BV. Lignolytic and phosphate solubilizing efficiency of fungal species isolated from Arecanut husk waste. Journal Research Biology, 2012, 2: 143-151. |
| [25] | Relwani L, Krishna P, Sudhakara RM. Effect of carbon and nitrogen sources on phosphate solubilization by a wild-type strain and UV-induced mutants of Aspergillus tubingensis. Current Microbiology, 2008, 57(5): 401-406. DOI:10.1007/s00284-008-9212-y |
| [26] | Chatli A, Beri V, Sidhu BS. Isolation and characterisation of phosphate solubilising microorganisms from the cold desert habitat of Salix alba Linn. in trans Himalayan region of Himachal Pradesh. Indian Journal of Microbiology, 2008, 48(2): 267-273. DOI:10.1007/s12088-008-0037-y |
| [27] | Bhattacharya S S, Barman S, Ghosh R, Duary RK, Goswami L, Mandal NC. Phosphate solubilizing ability of Emericella nidulans strain Ⅴ1 isolated from vermicompost. Indian Journal of Experimental Biology, 2013, 51(10): 840-848. |
| [28] |
Li HY, Niu SQ, Kong WB, Da WY, Geng H, Han CH, Yan WR. Screening and identification of a phosphate solubilizing strain isolated from pig manure compost and determination of its phosphate solubilizing capacity. Acta Scientiae Circumstantiae, 2015, 35(5): 1464-1470.
(in Chinese) 李海云, 牛世全, 孔维宝, 达文燕, 耿晖, 韩彩虹, 阎薇如. 猪粪堆肥中一株溶磷菌的筛选鉴定及溶磷能力初步测定. 环境科学学报, 2015, 35(5): 1464-1470. |
| [29] | Nath R, Sharma G, Barooah M. Efficiency of tricalcium phosphate solubilization by two different endophytic Penicillium sp. isolated from tea (Camellia sinensis L.). European Journal of Experimental Biology, 2012, 2(4): 1354-1358. |
| [30] |
Li XP, Ren JY, Zou ML. Phosphate-solubilizing ability of a saline-alkali fungus strain and effects on the growth of corn in sensitive period. Research of Soil and Water Conservation, 2015, 22(5): 276-278.
(in Chinese) 李学平, 任加云, 邹美玲. 一株耐盐解磷菌的解磷能力及对玉米敏感期生长的影响. 水土保持研究, 2015, 22(5): 276-278. |
| [31] | Mundra S, Arora R, Stobdan T. Solubilization of insoluble inorganic phosphates by a novel temperature-, pH-, and salt-tolerant yeast, Rhodotorula sp. PS4, isolated from seabuckthorn rhizosphere, growing in cold desert of Ladakh, India. World Journal of Micribiology and Biotechnology, 2011, 27: 2387-2396. DOI:10.1007/s11274-011-0708-4 |
| [32] | Kumar K, Manigundan K, Amaresan N. Amaresan N. Influence of salt tolerant Trichoderma spp. on growth of maize (Zea mays) under different salinity conditions. Journal of Basic Microbiology, 2017, 57(2): 141-150. DOI:10.1002/jobm.201600369 |
| [33] | New MT, Yu SS, Latt ZK. Study on phosphate solubilization of salt tolerant soil yeast isolates and effects on maize germination and growth. International Journal of Innovation and Applied Studies, 2013, 4(3): 524-533. |
| [34] | Kucey RMN, Janzen HH, Leggett ME. Microbially mediated increases in plant-available phosphorus. Advances in Agronomy, 1989, 42: 199-228. DOI:10.1016/S0065-2113(08)60525-8 |
| [35] |
Shi FC, Yin ZW, Jiang HM, Fan BQ. Screening, identification of P-dissolving fungus P83 strain and its effects on phosphate solubilization and plant growth promotion. Acta Microbiologica Sinica, 2014, 54(11): 1333-1343.
(in Chinese) 史发超, 殷中伟, 江红梅, 范丙全. 一株溶磷真菌筛选鉴定及其溶磷促生效果. 微生物学报, 2014, 54(11): 1333-1343. |
| [36] | Nakayan P, Hameed A, Singh S, Young L-S, Hung M-H, Young C-C. Phosphate-solubilizing soil yeast Meyerozyma guilliermondii CC1 improves maize (Zea mays L.) productivity and minimizes requisite chemical fertilization. Plant and Soil, 2013, 373(1/2): 301-315. |
| [37] | Kaur G, Reddy MS. Effects of phosphate-solubilizing bacteria, rock phosphate and chemical fertilizers on maize-wheat cropping cycle and economics. Pedosphere, 2015, 25(3): 428-437. DOI:10.1016/S1002-0160(15)30010-2 |
| [38] | Mittal V, Singh O, Nayyar H, Kaur J, Tewari R. Stimulatory effect of phosphate-solubilizing fungal strains (Aspergillus awamori and Penicillium citrinum) on the yield of chickpea (Cicer arietinum L. cv. GPF2). Soil Biological and Biochemistry, 2008, 40(3): 718-727. DOI:10.1016/j.soilbio.2007.10.008 |
| [39] | Ghosh P, Rathinasabapathi B, Ma LQ. Phosphorus solubilization and plant growth enhancement by arsenic-resistant bacteria. Chemosphere, 2015, 134: 1-6. DOI:10.1016/j.chemosphere.2015.03.048 |
| [40] | Gupta R, Singal R, Shankar A, Kuhad RC, Saxena RK. A modified plate assay for screening phosphate solubilizing microorganisms. Journal of General and Applied Microbiology, 1994, 40(3): 255-260. DOI:10.2323/jgam.40.255 |
| [41] | Hoagland DR, Arnon DI. The water-culture method for growing plants without soil. California Agricultural Experiment Station, Circular, 1950, 347(2): 2-32. |
| [42] | Rivas R, Trujillo ME, Sanchez M, Mateos PF, Martínez-Molina E, Velázquez E. Microbacterium ulmi sp. nov., a xylanolytic, phosphate-solubilizing bacterium isolated from sawdust of Ulmus nigra. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(2): 513-517. DOI:10.1099/ijs.0.02724-0 |
| [43] | Posada RH, Heredia-Abarca G, Sieverding E, Prager MS. Solubilization of iron and calcium phosphates by soil fungi isolated from coffee plantations. Archives of Agronomy and Soil Science, 2013, 59(2): 185-196. DOI:10.1080/03650340.2011.610030 |
| [44] | Habte M, Osorio NW. Effect of nitrogen form on the effectiveness of a phosphate-solubilizing fungus to dissolve rock phosphate. Journal of Biofertilizers and Biopesticides, 2012, 3: 127. |
| [45] | Sharma K. Inorganic phosphate solubilization by fungi isolated from agriculture soil. Journal of Phytology, 2011, 3(4): 11-12. |
| [46] | Salih HM, Yahya AI, Abdul-Rahem AM, Munam BH. Availability of phosphorus in a calcareous soil treated with rock phosphate or superphosphate as affected by phosphate-dissolving fungi. Plant and Soil, 1989, 120(2): 181-185. DOI:10.1007/BF02377067 |
| [47] | Jain R, Saxena J, Sharma V. Differential effects of immobilized and free forms of phosphate-solubilizing fungal strains on the growth and phosphorus uptake of mung bean plants. Annals of Microbiology, 2014, 64(4): 1523-1534. DOI:10.1007/s13213-013-0795-6 |
| [48] | de Oliveira Mendes G, de Freitas ALM, Pereira OL, da Silva IR, Vassilev NB, Costa MD. Mechanisms of phosphate solubilization by fungal isolates when exposed to different P sources. Annals of Microbiology, 2014, 64(1): 239-249. DOI:10.1007/s13213-013-0656-3 |
| [49] |
Liu WG, He YQ, Zhang K, Fan JB, Cao H. Isolation, identification and characterization of a strain of phosphate-solubilizing bacteria from red soil. Acta Microbiologica Sinica, 2012, 52(3): 326-333.
(in Chinese) 刘文干, 何园球, 张坤, 樊建波, 曹慧. 一株红壤溶磷菌的分离、鉴定及溶磷特性. 微生物学报, 2012, 52(3): 326-333. |
| [50] |
Qiao ZW, Gong JP, Xie YH, Li LX, Ren ZX. Screening, identification and dissolving characteristics of a strong phosphorus solubilizing fungi in calcareous soil. Chinese Journal of Applied Environmental Biology, 2013, 19(5): 873-877.
(in Chinese) 乔志伟, 洪坚平, 谢英荷, 李林轩, 任振兴. 一株石灰性土壤强溶磷真菌的分离鉴定及溶磷特性. 应用与环境生物学报, 2013, 19(5): 873-877. |
| [51] | Xiao CQ, Zhang HX, Fang YJ, Chi R. Evaluation for rock phosphate solubilization in fermentation and soil-plant system using a stress-tolerant phosphate-solubilizing Aspergillus niger WHAK1. Applied and Biochemistry and Biotechnology, 2013, 169(1): 123-133. DOI:10.1007/s12010-012-9967-2 |
| [52] | Schneider KD, Van Straaten P, De Orduña RM, Glasauer S, Trevors J, Fallow D, Smith PS. Comparing phosphorus mobilization strategies using Aspergillus niger for the mineral dissolution of three phosphate rocks. Journal of Applied Microbiology, 2010, 108(1): 366-374. DOI:10.1111/jam.2009.108.issue-1 |
| [53] | Sperber J. The incidence of apatite-solubilizing organisms in the rhizosphere and soil. Australian Journal of Agricultural Research, 1958, 9(6): 778-781. DOI:10.1071/AR9580778 |
| [54] |
Xue XY, Feng RH, Guan DW, Li J, Cao FM. Screening and analysis for efficient co-inoculation system of soybean rhizobia and plant growth-promoting rhizobacteria. Soybean Science, 2011, 30(4): 613-620.
(in Chinese) 薛晓昀, 冯瑞华, 关大伟, 李俊, 曹凤明. 大豆根瘤菌与促生菌复合系筛选及机理研究. 大豆科学, 2011, 30(4): 613-620. |
| [55] | Banic S, Dey BK. Available phosphate content of an alluvial soil as influenced by inoculation of some isolated phosphate-solubilizing micro-organisms. Plant and Soil, 1982, 69(3): 353-364. DOI:10.1007/BF02372456 |
| [56] | Resende MP, Jakoby ICMC, dos Santos LCR, Soares MA, Pereira FD, Souchie EL, Silva FG. Phosphate solubilization and phytohormone production by endophytic and rhizosphere Trichoderma isolates of guanandi (Calophyllum brasiliense Cambess). African Journal of Microbiology Research, 2014, 8(27): 2616-2623. DOI:10.5897/AJMR |
 2018, Vol. 58
2018, Vol. 58