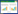中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王聪, 凌娟, 张燕英, 林丽云, 曾思泉, 周卫国, 林显程, 尹浩, 董俊德. 2018
- Cong Wang, Juan Ling, Yanying Zhang, Liyun Lin, Siquan Zeng, Weiguo Zhou, Xiancheng Lin, Hao Yin, Junde Dong. 2018
- 海洋固氮菌和解磷菌的分离鉴定及发酵条件优化
- Isolation, characterization and culture optimization of nitrogen-fixing and phosphate-solubilizing bacteria from rhizosphere sediments of Halophila ovalis
- 微生物学报, 58(5): 817-829
- Acta Microbiologica Sinica, 58(5): 817-829
-
文章历史
- 收稿日期:2017-06-12
- 修回日期:2017-08-31
- 网络出版日期:2017-11-14
2. 中国科学院大学, 北京 100049;
3. 中国科学院海南热带海洋生物重点实验站, 海南 三亚 572000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Tropical Marine Biological Research Station in Hainan, Chinese Academy of Sciences, Sanya 572000, Hainan Province, China
海草床生态系统不仅生长着大量的动植物,也附寄生许多微生物[1]。海洋固氮原核生物能够转化大气中的N元素为铵化合物,进入海洋生态系统[2]。生物固氮可以直接将空气中的氮气直接转化为植物可利用的氨,供植物生长之需。据估计,每年地球陆地生态系统由生物固氮作用固定的氮量约为90×106-130×106 t纯氮[3],而在贫营养的海洋生态系统,由原核生物主导的生物固氮是海洋氮元素的主要来源。生物固氮酶由铁蛋白(固氮酶还原酶)和钼铁蛋白(固氮酶)组成[4]。其中由nifH基因编码的铁蛋白是目前唯一已知的具有钼铁蛋白还原功能的蛋白[5]。因此nifH已经被广泛应用于从功能基因水平对固氮菌的鉴定。在具有固氮酶活性的浮游植物、蓝藻、原核生物等均能扩增出nifH基因[6-8]。解磷微生物能够降解环境中难溶解的矿物,从而帮助植物更好地吸收营养元素,对磷元素的代谢利用和在生态系统中循环有促进作用。这些植物促生菌在植物吸收N、P、K等营养元素过程中起着重要的作用,减少了化学肥料在农业中的使用[9]。因此可以利用功能微生物制成微生物菌肥和功能缓释剂帮助海草的生长发育。
目前国内外对利用PGPB发酵生产微生物菌剂并运用于陆地农作物的研究趋于成熟。Suarez等在生长在高盐浓度下的大麦接种PGPB-E19T发现,E19T可以促进大麦在高盐土壤中生长[10]。德国研究者Egamberdiyeva在玉米上接种产碱假单胞菌(Pseudomonas alcaligenes)、芽孢杆菌(Bacillus),在钙质土壤中以未接种作对照,发现能够显著提高玉米芽和根的N、P含量16%-85%[11]。然而,国内外对PGPB应用于海洋生态系统的研究还在起步阶段。Kathiresan等比较了芽孢杆菌(Bacillus)和固氮菌(Azotobacter)施用于红树林幼苗,根的增长率分别为171.6%和123.9%[12]。张晓君等优化了红树林促生菌剂,并应用于木榄和秋茄幼苗,对茎高、茎径、根干重、叶干重、茎干重、总干重都有不同程度的增加[13]。
发酵条件优化主要有发酵培养基的优化和发酵培养因素的优化两方面。陈凯等用正交实验优化了巨大芽孢杆菌的发酵培养基,显著提高了菌种数[14]。本文从西沙海域岛屿喜盐草的根际沉积物中,通过Ashby无氮培养基和改良PSM解磷培养基培养,筛选分离到具有高效固氮能力的菌株AZ16以及高效降解有机磷植酸钠的菌株XT37,在生理生化水平,利用16S rDNA及固氮nifH基因分析,进行鉴定。通过单因素实验和响应面实验(response surface methods,RSM)优化发酵条件,并制成固、液型混合菌剂进行保存、定期检测,用于后期生态效应实验。
1 材料和方法 1.1 沉积物样品采集、前处理喜盐草根际沉积物采集于西沙永兴岛近海岸(16°50'32"N,112°20'41"E)。取0.2 g土壤样品于18 mL的无菌海水中,稀释10-2、10-3倍平板涂布于选择性固氮培养基和改良PSM有机磷培养基中,培养6 d后放4 ℃冰箱保存。
1.2 培养基LB培养基(g/L):用于菌种活化和保藏。蛋白胨10,酵母提取物5,NaCl 25,固体培养基加入16 g琼脂。
选择性海草固氮培养基(g/L):用于固氮菌的初筛。FeSO4·7H2O 0.001,KCl 0.56,MgCl2·6H2O 4.00,NaCl 25.00,MgSO4·7H2O 4.80,K2HPO4 0.01,Tris 0.48,蛋白胨4.00,酵母提取物2.00,甘油2.00,pH 8.10,固体培养基加入16.00 g琼脂[15]。
无氮培养基(Ashby, g/L):用于固氮菌株的复筛,CaCO3 5.0,甘露醇5.0,KH2PO4 0.2,MgSO4·7H2O 0.2,NaCl 5.0,CaSO4 0.1,陈海水0.5,去离子0.5,pH 7.0[16]。
改良选择性解磷培养基(PSM, g/L):用于解磷菌株的筛选,D-葡萄糖15.00,NH4NO3 5.00,CaCl2 2.00,KCl 0.50,MgSO4·7H2O 0.50,FeSO4·7H2O 0.01,MnSO4·7H2O 0.01,植酸钠4.00 (单独灭菌),NaCl 25.00,pH 8.15,固体培养基加入16.00 g琼脂[16]。
初始发酵培养基(g/L):玉米粉10,黄豆粉5,NaCl 25。
1.3 菌种的筛选、纯化及生理生化鉴定将选择性培养基生长的单菌落和PSM培养基中出现透明菌落的单菌落,分别在Ashby培养基和PSM培养基上平板划线,培养1周后,再次平板划线,直至获得纯培养物。最后接种到LB固体培养基上进行保存。对得到的固氮菌株AZ16和溶解有机磷菌株XT37革兰氏染色,通过试剂盒进行生理生化鉴定。
1.4 菌株DNA提取、PCR扩增16S rDNA和nifH基因用OMEGA Bacterial DNA Kit提取纯化后菌株DNA,PCR扩增16S rDNA。25 μL PCR反应体系:rTaq酶12.5 μL,Primer 1492R (5′-AGA GTTTGATCCTGGCTCAG-3′)/27F (5′-TACGGCTA CCTTGTTACGACTT-3′)各0.5 μL,DNA 1.0 μL,无菌水10.0 μL,BSA 0.5 μL。使用型号S100 PCR仪,全序列扩增条件为:95 ℃ 2 min;95 ℃ 15 s,56 ℃ 30 s,72 ℃ 1.5 min,32个循环;72 ℃ 10 min,16 ℃。25 μL nifH基因扩增体系为:Ex Taq酶12.5 μL,Primer F/R各0.5 μL,DNA 1.0 μL,无菌水10.5 μL。序列扩增条件:95 ℃ 2 min,1个循环;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,1个循环;4 ℃。PCR扩增产物进行琼脂糖凝胶电泳检测,将扩增产物送华大基因测序,所得测序结果在NCBI进行BLAST对比。在序列对比的基础上使用MEGA 4.1软件的邻接法构建系统进化树。
1.5 固氮活性检测和植酸酶活性检测根据Dong等的乙炔还原法对菌株固氮酶活性进行测定[17]。28 ℃培养8 h后,取50 μL瓶内空气在GC112A气相色谱仪检测乙烯峰的面积,根据标准曲线计算得到菌株的固氮能力。
钼蓝比色法测定菌株植酸酶的活性[18]。装有100 mL PSM培养基的250 mL三角瓶中接种1 mL活化24 h后的AZ16菌液,28 ℃、180 r/min下培养5 d,对照为接种1%无菌水的PSM培养基,检测植酸酶的酶活性。
1.6 菌株生长曲线的测定将活化后的AZ16、XT37菌液分别按1%接种量接种于装有100 mL选择性海草固氮培养基的250 mL三角瓶中,隔4 h取200 μL菌液测量OD600,重复3次。
1.7 单因素菌株培养条件研究 1.7.1 初始pH对菌株生长的影响:配制100 mL pH为5、6、7、8、9 (±0.02)的选择性海草固氮培养基于250 mL三角瓶中,按1%接种量分别接种活化24 h后的AZ16和XT37菌液,28 ℃、180 r/min下振荡培养48 h,3个重复,Gen5酶标仪测量OD600。
1.7.2 温度对菌株生长的影响:配制100 mL、pH 7 (±0.02)的选择性海草固氮培养基于250 mL三角瓶中,分别接种1%活化24 h后的AZ16和XT37菌液,在转数180 r/min,温度分别为20、24、28、32、36、40 ℃下振荡培养48 h,3个重复,测量OD600。
1.7.3 NaCl浓度对菌株生长的影响:配制pH 7 (±0.02) NaCl浓度分别1‰、5‰、15‰、25‰、35‰的选择性海草固氮培养基100 mL于250 mL三角瓶中,分别接种1%活化24 h后的AZ16和XT37菌液,3个重复,在180 r/min、28 ℃下振荡培养48 h,测量OD600。
1.7.4 不同无机盐对菌株生长的影响:在装有pH 7 (±0.02)初始发酵培养基100 mL的250 mL三角瓶中,分别加入CaCO3、KH2PO4、MgSO4·7H2O、KCl、MgCl2·6H2O、MgSO4·7H2O、K2HPO4各0.200 g、FeSO4·7H2O 0.005 g,按1%接种量分别接种活化24 h后的AZ16和XT37菌液,180 r/min、28 ℃下振荡培养48 h,取100 μL无菌水稀释10-9后,平板涂布,28 ℃恒温培养箱培养3 d后计数。以不加无机盐为对照,重复3次。
1.7.5 接种量对菌株生长的影响:配制pH 7 (±0.02)的选择性海草固氮培养基100 mL于250 mL三角瓶中,按1%、3%、5%、7%、9%接种量分别接种活化24 h的后AZ16和XT37菌液,3个重复,在180 r/min、28 ℃下振荡培养48 h,测量OD600。
1.8 响应面实验优化菌株培养条件根据单因素实验,利用Design-Expert8.0.6软件中Box-Behnken Design方法对pH、温度、接种量进行优化。利用优化后的发酵培养基配方进行验证实验,重复3次,数据处理软件使用SPSS19。
1.9 菌种安全性评价委托广东省微生物分析检测中心,根据《食品安全国家标准急性经口毒性试验》(GB 15193.3-2014),对菌株进行急性毒性实验,其中给予小鼠最大使用浓度和最大灌胃体积,剂量设计为19.3 g/kg·BW。根据《微生物肥料生物安全通用技术准则》(NY/T 1109-2006)对菌株进行溶血实验。
2 结果和分析 2.1 菌株的形态学特征与生理生化鉴定通过选择培养基分离纯化四代后,得到具有高效固氮能力的单菌落AZ16及高效降解植酸酶活性的单菌落XT37。AZ16形态学特征描述为:球状菌、乳白色、菌落圆形且小、表面光滑、粘稠、革兰氏阴性菌。XT37形态学特征描述为:杆状菌、灰白色、菌落圆形且大、表面褶皱、干燥、革兰氏阳性菌。根据《常见细菌鉴定手册》[19]革兰氏阳性好养和兼性厌氧球菌及产芽孢杆菌鉴定方法,选取一些特征性生理生化指标鉴定,结果如表 1。
| Characteristics | AZ16 | XT37 |
| Indole production | - | - |
| Oxidases | + | + |
| Amylase | - | + |
| Voges-Proskauer reaction | + | - |
| Gelatin liquefaction | - | - |
| Lysopine dehydrogenase | + | + |
| Ornithine decarboxylase | + | + |
| D-glucose | + | + |
| D-mannitol | - | + |
| Maltose | + | + |
| Sucrose | - | + |
| Galactose | + | + |
| Acetamide | + | + |
| Carbamide | + | - |
| Nitrate reduction | - | - |
| Nitrate gas production | - | - |
| +: indicates that the strain reaction is positive; -: indicates that the strain reaction is negative. | ||
菌株AZ16能够利用D-葡萄糖、麦芽糖、半乳糖,不能利用蔗糖、D-甘露醇,无淀粉酶。能利用乙酰胺和尿素,氧化酶活性高,V-P反应为阳性。菌株XT37能利用D-葡萄糖、甘露醇、麦芽糖、蔗糖、半乳糖、淀粉,对糖类无选择特异性。两株菌均能产生赖氨酸脱羧酶和鸟氨酸脱羧酶,且不能产生吲哚及利用硝酸盐产气。
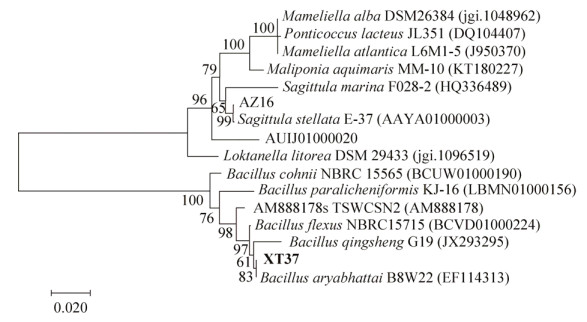
2.2 菌株16S rDNA系统发育分析及nifH功能基因扩增通过生理生化鉴定和BLAST在线比对,AZ16属于箭头菌属(Sagittula),与一株珊瑚礁来源的Sagittula stellate E-37T相似度达99.04%[20]。XT37属于芽孢杆菌属(Bacillus),与Bacillus aryabhattai B8W22相似度达100%。选取与AZ16和XT37菌株同源性相近菌株的16S rDNA序列构建系统发育进化树(图 1)。所得固氮菌AZ16的nifH功能基因序列长为359 bp (图 2),与固氮螺菌(Azospirillum sp. TSH81w)的nifH基因相似度为89%。
|
| 图 1 菌株16S rDNA系统发育进化树 Figure 1 Phylogenetic tree based on 16S rDNA gene sequences of AZ16 and XT37. Numbers above branches indicate bootstrap support (> 50%) from 1000 replicates and are given in the following order: neighbor joining parsimony. Scale represents the expected number of substitutions per site. The objective strains are in bold font. |
|
| 图 2 菌株AZ16的nifH基因电泳图 Figure 2 Gel-electrophoresis of nifH gene in strain AZ16. |
2.3 固氮酶活性、解磷酶活性检测
注入50 μL乙炔气体后得到峰面积为382.6 μV/s,计算后得到固氮能力为34.63 nmol C2H2/(mL·h)。PSM培养基振荡培养5 d后测得培养基中的无机磷含量是239.49 μg/L。
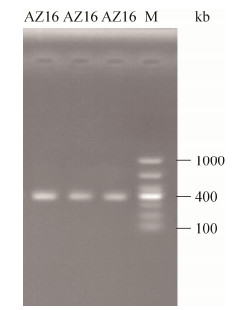
2.4 不同培养基中菌株生长曲线测定图 3-A和图 3-B表示AZ16和XT37在选择性海草固氮培养基中的生长曲线。其中,XT37在接种后8 h开始进入生长对数期,接种24 h后达到稳定,菌种浓度缓慢的下降最终趋于稳定。AZ16在接种10 h之后进入生长对数期,同样在24 h之后达到稳定。在LB培养基中,XT37在8 h之后进入生长对数期,26 h后进入稳定期,与在选择性海草固氮培养基中差异不大。AZ16在LB培养基中,接种20 h之后进入对数期,28 h之后达到稳定期,开始进入衰亡期。相比在LB培养基中的生长,AZ16在选择性海草固氮培养基中进入对数期快,且达到稳定后的菌浓度高。XT37在两种培养基中生长情况差异不大。
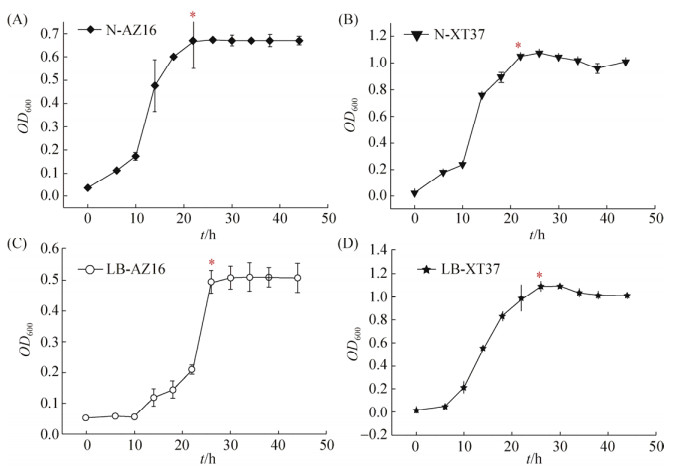
|
| 图 3 海草固氮培养基和LB培养基中菌株的生长曲线 Figure 3 The growth curve of two strains in different mediums. A and B showed the growth cure of AZ16 and XT37 in seawater nitrogen fixing medium respectively; C and D represents the growth curve of AZ16 and XT37 in LB medium respectively. *: The beginning of stationary phase. |
2.5 单因素实验研究因子对菌株生长的影响 2.5.1 培养条件对菌株生长的影响:
图 4-A表示初始pH对菌株浓度的影响。左侧坐标轴表示AZ16的OD600,右侧坐标轴表示XT37的OD600。其中XT37在偏酸性的环境中生长较好,当pH为5时,在同等条件下,XT37菌浓度最高。当pH高于8或者小于5时,XT37的菌液浓度开始急剧下降。AZ16在pH为7时,菌液的浓度达到最大。当pH高于8或者小于7时,AZ16的菌浓度开始急剧下降。由于海洋特殊的弱碱性环境,AZ16在海洋中的适应能力可能更强。温度对菌株生长的影响如图 4-B所示,两种菌对温度的响应都类似服从于二次方的模型。AZ16和XT37分别在28 ℃、32 ℃达到最大活菌浓度。当温度高于36 ℃或低于24 ℃,AZ16生长趋于停滞,而XT37保持一定的菌种活性。图 4-C表示NaCl浓度对菌株生长的影响,在NaCl浓度为1‰时,AZ16和XT37生长状况影响较大,其中XT37几乎不生长,这与菌株筛选于海草根际沉积物相吻合。分别用LSD法对AZ16与XT37进行嵌套设计方差分析发现,AZ16模型P=0.000<0.05有效,两两比较后,盐度25‰与其他盐度均具有显著差异性(P<0.05),且对菌株生长效果最好。XT37模型(P=0.000<0.05)有效,浓度为25‰与35‰之间P=0.069>0.05,无显著差异,但与其他各组均具有显著差异性,且NaCl浓度为5‰时,效果最佳。考虑到海洋具有高盐浓度的特殊性,因此培养基最终的NaCl浓度选取25‰。接种量对菌株生长的影响如图 4-D所示,当接种量为5%时,AZ16的菌液浓度OD600达到最高0.855,与其他各接种量差异显著(P<0.05),且效果最佳。当接种量超过3%时,XT37的菌液浓度无显著差异性。因此,接种5%对AZ16生长最好,接种3%对XT37的发酵培养最佳。
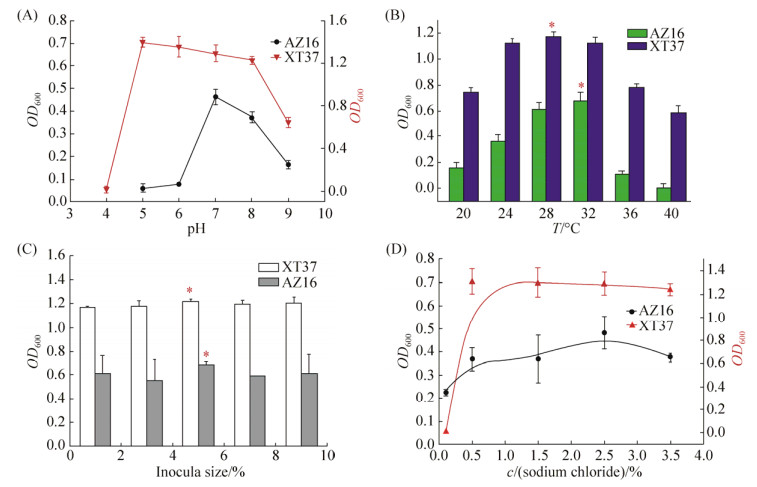
|
| 图 4 培养条件对菌株生长的影响 Figure 4 Effects of culture conditions on the growth of strains. A: Effects of pH on the growth of strains; B: Effect of fermentation temperature on the growth of strains; C: Effects of inocula size on the growth of strains; D: Effects of concentration of sodium chloride on the growth of strains. |
2.5.2 不同无机盐对菌株生长的影响:
不同种类的无机盐对AZ16与XT37菌株生长的影响如图 5所示。其中,在相同条件下加入CaCO3后,AZ16的活菌数量增长12倍。可能的原因是加入CaCO3后,缓冲了菌株生长过程中所产生的酸,因此有利于AZ16生长。XT37更适合酸性的环境下生长,因此加入同量的CaCO3降低了XT37活菌数量。低浓度的FeSO4·7H2O能促进AZ16的生长。XT37在不加无机盐的情况下生长最好,也间接说明XT37抗逆能力强,适应范围广。因此,加入0.2%的CaCO3能促进AZ16生长,而在培养XT37的过程中不需要添加其他无机盐。

|
| 图 5 不同无机盐对菌株生长的影响 Figure 5 Effects of different kinds of inorganic salts on the growth of strains. |
2.6 响应面实验优化菌株培养条件
根据单因素实验结果,选取对菌株生长影响较大的pH、温度(T)、接种量(IS)对AZ16和XT37发酵培养条件进行优化,共设计17组实验,重复3次,实验结果如下。方差分析结果表明,AZ16模型有效(P=0.0052<0.05):
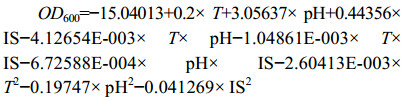
|
根据回归方程作出了AZ16与XT37相同数据的响应面立体分析图,即3D曲面图与等高线图,分别如图 6、7所示。
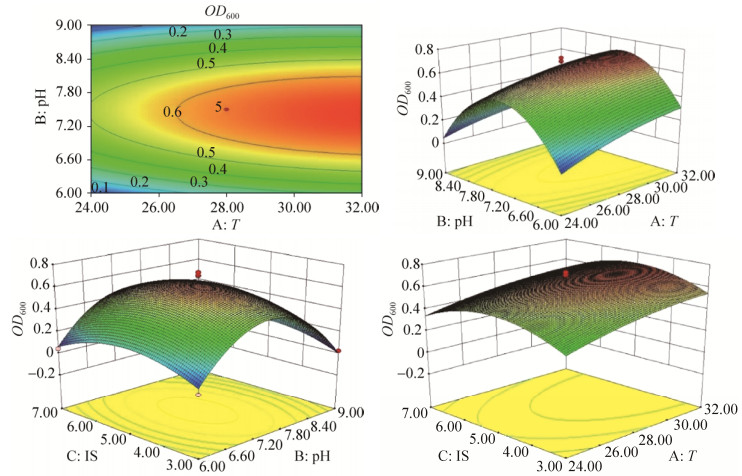
|
| 图 6 优化AZ16等高线图和响应面立体分析图 Figure 6 Contour map and response surface analysis map of AZ16 strain. |

|
| 图 7 优化XT37等高线图和响应面立体分析图 Figure 7 Contour map and response surface analysis map of XT37 strain. |
根据模型推测,当初始pH 7.49、温度(T) 32.65 ℃、接种量4.90%时,AZ16菌液的OD600可达到0.6876。以此培养条件,接入活化24 h后的AZ16菌液,培养48 h后测得菌液的OD600为0.724,略高于预测值。
方差分析结果表明,XT37模型差异显著(P=0.0193<0.05):
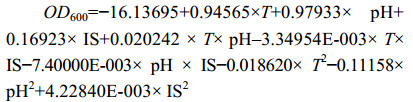
|
根据模型推测,当初始pH 6.82、温度(T) 28.65 ℃、接种量5%时,XT37菌液的OD600可达到1.33615,实际OD600为1.2876,略小于预测值。
2.7 菌株的安全性评价结果急性毒性实验16 d后,实验小鼠未见明显中毒体征,无动物死亡。因此根据急性毒性剂量分级标准判定,AZ16与XT37属实际无毒级别。溶血实验也表明,AZ16与XT37均不能引起溶血反应。
3 讨论目前,国内外学者报道的植物根际的PGPR菌主要有14个属:无色杆菌属(Achromobacter)、节杆菌属(Arthrobacter)、固氮螺旋菌属(Azospirillum)、芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)、伯克氏菌属(Burkholderia)、金黄杆菌属(Chry-seobacterium)、肠杆菌属(Enterobacter)、柠檬酸杆菌属(Citrobacter)、克雷伯氏杆菌属(Klebsiella)、草螺旋菌属(Herbaspirillum)、泛生菌属(Pantoea)、假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)等[21]。张丽红等[22]在中国南海底泥中分离得到了一株固氮类芽孢杆菌,证明了可培养芽孢杆菌在海洋中确实存在。本实验从海洋喜盐草的根际沉积物中,筛选、分离得到一株具有高效固氮能力的菌株AZ16,生理生化特征及16S rDNA初步鉴定为星箭头菌(Sagittula stellate),与陆地生态系统PGPR菌种类不一致。其生理生化检测结果与从珊瑚礁分离得到的Sagittula stellate E-37T也存在一些差异[20],AZ16能在厌氧的条件下生长,且不能利用甘露醇,这可能是培养基的成分不同造成。陆地生态系统中,产植酸酶细菌研究最多的是芽孢杆菌属(Bacillus)[23]。黄达明等从土壤作物根际筛选分离出的一株解无机磷能力较强的溶磷菌株,通过优化后其解磷能力达到791.84 μg/mL[24]。本实验从海洋沉积物中分离筛选的降解植酸芽孢杆菌XT37,降解植酸的能力达到239.49 μg/L,抗逆性强,不产生溶血反应,具有良好的海草微生物菌剂应用前景。菌株XT37较其他真菌解植酸能力低的原因可能是在生长的过程中产生的酸或其他代谢物或与其他生物共同导致了植酸的降解。因此海洋细菌降解植酸机理仍需进一步研究。尽管PGPR能显著促进一些农作物、蔬菜、经济作物等的生长[25-26],但自生固氮菌AZ16与解植酸芽孢杆菌XT37是否对海草具有实际的生态效应,需要进一步的实验证明。
优化微生物培养条件,不仅可以了解微生物培养过程中的特性,还能够提高微生物的活菌率和功能酶活性。侯佳奇等通过响应曲面法建立了耐高温功能复合菌剂解磷条件的二次多项数学模型,对复合菌剂培养的5个因素进行优化,证明接种量影响最大[27]。Khoshayand通过响应面实验发现温度、葡萄糖和烟酸对Lactobacillus case菌的生长具有显著影响[28]。本实验以选择性海草固氮培养基为基础,单因素实验优化AZ16和XT37的培养pH、温度、盐浓度、接种量,利用Design-Expert 8.0.6软件中Box-Behnken Design方法,对菌株培养过程的初始pH、温度、接种量进行响应面优化。结果得到AZ16与XT37数学模型显著(P<0.05),并推测对AZ16与XT37影响最大的是温度和pH。其中单因素实验表明,培养基中加入CaCO3对固氮菌AZ16影响显著,其有效活菌数较未加入CaCO3增加24.5倍,与Pera研究钙对真菌的影响不一致[29]。目前的研究结果表明钙离子参与了细菌对温度、盐、渗透压的早期感应,以及运动性、趋化性、细胞分裂、基因表达和细胞分化等多种生命过程[30]。然而,CaCO3对AZ16的影响机制以及不同浓度的无机盐对细菌的影响仍需要进一步的研究。
海草床生态系统对海岸带区域具有重要作用,不仅可以为海洋生物提供重要的栖息地和食物来源,而且在全球C、N、P循环中具有重要作用[31]。据2006年的一项调查研究显示,过去20年内,由于自然因素和人为因素的威胁,世界上有记录的海草床中,大约18% (33000 km2)已消失[32]。因此探索一种安全有效的方法促进海草的生长显得十分紧迫。尽管在农业上,微生物菌肥对植物生长促进的研究很多,但利用功能菌株促进海洋植物生长的研究并不多见。本文从海草根际沉积物中筛选分离到具有固氮和解磷功能的菌株,具有抗逆能力强、生态安全性好等特征,有潜力应用于生产海洋微生物菌肥。由于海洋环境的特殊性,利用微生物菌肥促进海草的生长也存在一定的困难。但是利用有益微生物帮助海草的生长和恢复,为保护海草床生态系统提供新的思路和途径。
致谢:感谢中国科学院南海海洋研究所仪器设备公共服务中心(Equipment Public Service Center,SCSIO)高永利老师在发酵培养过程中提供的技术帮助。
| [1] | Wear RJ. Recent advances in research into seagrass restoration. Prepared for the Coastal Protection Branch, Department for Environment and Heritage. SARDI Aquatic Sciences Publication No. RD0410038-4. SARDI Aquatic Sciences. Adelaide, 2006. |
| [2] | Dyhrman ST, Ammerman JW, van Mooy BAS. Microbes and the marine phosphorus cycle. Oceanography, 2007, 20(2): 110-116. DOI:10.5670/oceanog |
| [3] | Galloway JN, Schlesinger WH, Levy Ⅱ H, Michaels A, Schnoor JL. Nitrogen fixation: anthropogenic enhancement environmental response. Global Biogeochemical Cycles, 1995, 9(2): 235-252. DOI:10.1029/95GB00158 |
| [4] | Hoffman BM, Lukoyanov D, Yang ZY, Dean DR, Seefeldt LC. Mechanism of nitrogen fixation by nitrogenase: the next stage. Chemical Reviews, 2014, 114(8): 4041-4062. DOI:10.1021/cr400641x |
| [5] | Georgiadis MM, Komiya H, Chakrabarti P, Woo D, Kornuc JJ, Rees DC. Crystallographic structure of the nitrogenase iron protein from Azotobacter vinelandii. Science, 1992, 257(5077): 1653-1659. DOI:10.1126/science.1529353 |
| [6] | Mishra AK, Singh PK, Singh P, Singh A, Singh SS, Srivastava A, Srivastava AK, Sarma HK. Phylogeny and evolutionary genetics of Frankia strains based on 16S rRNA and nif D-K gene sequences. Journal of Basic Microbiology, 2015, 55(8): 1013-1020. DOI:10.1002/jobm.v55.8 |
| [7] | Braun ST, Proctor LM, Zani S, Mellon MT, Zehr JP. Molecular evidence for zooplankton-associated nitrogen-fixing anaerobes based on amplification of the nifH gene. FEMS Microbiology Ecology, 1999, 28(3): 273-279. DOI:10.1111/fem.1999.28.issue-3 |
| [8] | Dedysh SN, Ricke P, Liesack W. NifH and NifD phylogenies: an evolutionary basis for understanding nitrogen fixation capabilities of methanotrophic bacteria. Microbiology, 2004, 150(5): 1301-1313. DOI:10.1099/mic.0.26585-0 |
| [9] | Lugtenberg BJJ, Chin-A-Woeng TFC, Bloemberg GV. Microbe-plant interactions: principles and mechanisms. Antonie van Leeuwenhoek, 2002, 81(1): 373-383. DOI:10.1023/A:1020596903142 |
| [10] | Suarez C, Cardinale M, Ratering S, Steffens D, Jung S, Montoya AMZ, Geissler-Plaum R, Schnell S. lant growth-promoting effects of Hartmannibacter diazotrophicus, on summer barley (Hordeum vulgare, L.) under salt stress. Applied Soil Ecology, 2015, 95: 23-30. DOI:10.1016/j.apsoil.2015.04.017 |
| [11] | Egamberdiyeva D. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Applied Soil Ecology, 2007, 36(2/3): 184-189. |
| [12] |
Li R. Isolation of Plant Growth-Promoting Rhizobacteria of Cunninghamia lancceolata and Compound Microbial bacterial fertilizer Producing. Master's Thesis of Central South University of Forestry & Technology, 2012. (in Chinese) 李蓉. 杉木PGPR菌分离筛选及其微生物复合菌肥研制. 中南林业科技大学硕士学位论文, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10538-1012398047.htm |
| [13] | 张晓君. 红树林促生菌(PGPB)菌剂优化及应用技术研究. 中南林业科技大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10538-1014353958.htm |
| [14] |
Chen K, Li JS, Yang HT, Zhang XJ, Wei YL, Huang YJ. Phosphate solubilizing abilities of Bacillus megaterium strain P1 and its fermentation conditions. Soils and Fertilizers Sciences in China, 2010(4): 73-76.
(in Chinese) 陈凯, 李纪顺, 杨合同, 张新建, 魏艳丽, 黄玉杰. 巨大芽孢杆菌P1的解磷效果与发酵条件研究. 中国土壤与肥料, 2010(4): 73-76. |
| [15] |
Ling J, Dong JD, Zhang YY, Cai CH, Wang YS, Zhang S. Isolation and characterization of a N2-fixing bacterium from coral reef-seagrass ecosystem. Microbiology China, 2010, 37(7): 962-968.
(in Chinese) 凌娟, 董俊德, 张燕英, 蔡创华, 王友绍, 张偲. 一株珊瑚礁-海草床复合生态系统固氮菌的分离与鉴定. 微生物学通报, 2010, 37(7): 962-968. |
| [16] | Zhang SP, Liao SA, Yu XY, Lu HW, Xian JA, Guo H, Wang AL, Xie J. Microbial diversity of mangrove sediment in Shenzhen Bay and gene cloning, characterization of an isolated phytase-producing strain of SPC09 B. cereus. Applied Microbiology and Biotechnology, 2015, 99(12): 5339-5350. DOI:10.1007/s00253-015-6405-8 |
| [17] | Dong JD, Wang YS, Zhang YY. Spatial and seasonal variations of Cyanobacteria and their nitrogen fixation rates in Sanya Bay, South China Sea. Scientia Marina, 2008, 72(2): 239-251. |
| [18] | 李丽娟. 一株产植酸酶菌株的选育. 华中农业大学硕士学位论文, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10504-2007209854.htm |
| [19] |
Dong XZ, Cai MY. Common Bacterial System Identification Manual. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001. |
| [20] | Gonzalez JM, Mayer F, Moran MA, Hodson RE, Whitman WB. Sagittula stellata gen. nov., sp. nov., a lignin-transforming bacterium from a coastal environment. International Journal of Systematic Bacteriology, 1997, 47(3): 773-780. DOI:10.1099/00207713-47-3-773 |
| [21] | 王国基. 根际促生专用菌肥研制及其对玉米促生作用的研究. 甘肃农业大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10733-1015021470.htm |
| [22] |
Zhang LH, Liu YF, Hu QP. Isolation and identification of a Paenibacillus sp. producing nitrogenase activity from South China Sea. Marine Sciences, 2015, 39(3): 100-105.
(in Chinese) 张丽红, 刘艳芳, 胡青平. 中国南海一株固氮类芽孢杆菌的筛选和分离鉴定. 海洋科学, 2015, 39(3): 100-105. |
| [23] | Konietzny U, Greiner R. Bacterial phytase: potential application, in vivo function and regulation of its synthesis. Brazilian Journal of Microbiology, 2004, 35(1/2): 12-18. |
| [24] |
Huang DM, Li Q, Guan GQ, Zhang ZC, Qian JY, Song QC. Selection, identification and medium optimization of a phosphate-solubilizing bacterium. Biotechnology Bulletin, 2015, 31(2): 173-178.
(in Chinese) 黄达明, 李倩, 管国强, 张志才, 钱静亚, 宋庆春. 一株解磷细菌的筛选、鉴定及其溶磷培养条件的优化. 生物技术通报, 2015, 31(2): 173-178. |
| [25] | Basak BB, Biswas DR. Co-inoculation of potassium solubilizing and nitrogen fixing bacteria on solubilization of waste mica and their effect on growth promotion and nutrient acquisition by a forage crop. Biology and Fertility of Soils, 2010, 46(6): 641-648. DOI:10.1007/s00374-010-0456-x |
| [26] | Zaidi A, Ahmad E, Khan MS, Saif S, Rizvi A. Role of plant growth promoting rhizobacteria in sustainable production of vegetables: current perspective. Scientia Horticulturae, 2015, 193: 231-239. DOI:10.1016/j.scienta.2015.07.020 |
| [27] |
Hou JQ, Li MX, Jia X, Xi BD, Wei ZM, Dang QL, Song CH, Zhao GP. Optimizing the phosphorus-solubilizing condition of multiple species inoculants. Journal of Agro-Environment Science, 2013, 32(2): 385-392.
(in Chinese) 侯佳奇, 李鸣晓, 贾璇, 席北斗, 魏自民, 党秋玲, 宋彩红, 赵国鹏. 复合菌剂解无机磷条件优化研究. 农业环境科学学报, 2013, 32(2): 385-392. |
| [28] | Khoshayand F, Goodarzi S, Shahverdi AR, Khoshayand MR. Optimization of culture conditions for fermentation of soymilk using Lactobacillus casei by response surface methodology. Probiotics & Antimicrobial Proteins, 2011, 3(3/4): 159-167. |
| [29] | Pear LM, Callieri DA. Influence of calcium on fungal growth, hyphal morphology and citric acid production in Aspergillus niger. Folia Microbiologica, 1997, 42(6): 551-556. DOI:10.1007/BF02815463 |
| [30] |
Ren XH, Wang SL, Wen Y, Yang KQ. An update of calcium signaling in bacteria - A review. Acta Microbiologica Sinica, 2009, 49(12): 1564-1570.
(in Chinese) 任晓慧, 王胜兰, 文莹, 杨克迁. 细菌中钙信号的作用. 微生物学报, 2009, 49(12): 1564-1570. |
| [31] |
Han QY, Shi P. Progress in the study of seagrass ecology. Acta Ecologica Sinica, 2008, 28(11): 5561-5570.
(in Chinese) 韩秋影, 施平. 海草生态学研究进展. 生态学报, 2008, 28(11): 5561-5570. |
| [32] | Walker DI, Kendrick GA, McComb AJ. Decline and recovery of seagrass ecosystems-the dynamics of change//Larkum A, Orth RJ, Duarte C. Seagrasses: Biology, Ecology, and Conservation. Dordrecht: Springer, 2007: 551-565. |
 2018, Vol. 58
2018, Vol. 58