中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 刘进超, 王欧美, 李佳佳, 刘芳华. 2018
- Jinchao Liu, Oumei Wang, Jiajia Li, Fanghua Liu. 2018
- 生物地球化学锰循环中的微生物胞外电子传递机制
- Mechanisms of extracellular electron transfer in the biogeochemical manganese cycle
- 微生物学报, 58(4): 546-559
- Acta Microbiologica Sinica, 58(4): 546-559
-
文章历史
- 收稿日期:2017-11-21
- 修回日期:2018-03-15
- 网络出版日期:2018-03-22
2. 中国科学院大学, 北京 100049;
3. 滨州医学院, 山东 烟台 264003
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Binzhou Medical University, Yantai 264003, Shandong Province, China
Fanghua Liu, Tel/Fax: +86-535-2109268, E-mail:fhliu@yic.ac.cn
碳、氮等元素的生物地球化学循环可能早已引起人们足够的关注,其实锰的循环也对地球化学有着极大的影响。锰在土壤矿物、水体及其沉淀物中均有分布,其在地壳中的含量位居第十,是丰度仅次于铁的第二大过渡重金属元素[1];也是一种重要的生命元素。微生物促进和推动锰存在形态的改变。
1 锰的生物地球化学循环及其意义锰,是一种对所有生命形式都十分必需的微量元素。锰可作为一些具有抗氧化和代谢功能酶的辅因子。在植物和一些光合微生物中,锰存在于光捕获复合物反应中心的核心,在氧化水生成O2的过程中发挥重要作用[2]。
地壳岩石中锰的含量约为0.1%[1]。锰在自然界中以+2、+3、+4等3种价态出现,Mn(Ⅱ)和Mn(Ⅳ)氧化物通常分别以可溶和不溶的形式存在,Mn(Ⅲ)通常与一些配体(如焦磷酸盐、铁载体)络合,或存在于Mn(Ⅲ/Ⅳ)氧化物中。在这些价态不断地循环转化的过程中,微生物起着重要的促进和推动作用。其推动锰的生物地球化学循环的方式主要包括锰氧化和锰还原2个过程;循环过程中会受温度、pH、水压等环境因素的影响,在多因素作用下实现锰氧化和锰还原平衡[3]。
微生物因有相关的酶或特异性的代谢途径,可高效催化Mn(Ⅱ)氧化,使高价锰的生成速率相比化学氧化要快103–105倍[4]。过去,因Mn(Ⅲ)性质不稳定,且难以检测,其在锰循环中的角色被忽视。近几年,Mn(Ⅲ)成为锰循环研究的前沿领域,已经发现络合Mn(Ⅲ)在沉积物好氧/厌氧交界处[5]、海底孔隙水[6]、含氧水[7]中占总溶解锰池的86%甚至100%,含量惊人。由于Mn(Ⅲ)既可作为电子受体又可作为电子供体,故Mn(Ⅲ)在锰循环中有着举足轻重的地位。
微生物在厌氧条件下以有机物为电子供体(electron donor,ED),锰氧化物作为电子受体(terminal electron acceptor,TEA),将高价态锰还原为Mn(Ⅱ),同时获得能量的过程称为异化锰还原(dissimilatory manganese reduction)。异化锰还原与微生物胞外电子传递(microbial extracellular electron transfer,MEET)紧密关联。MEET是一种自然界普遍存在的能量代谢方式,该过程的理论研究为我们理解元素循环、有机废物厌氧降解等重要生物地球化学过程提供了全新的科学视角,增加了人们对于微生物能量获取方式多样性的认识。与传统的胞内电子传递不同,胞外电子传递过程中电子怎样穿过细胞膜壁,在胞内和胞外矿物(例如锰)之间建立“电”的联系,是生物地球化学、地质微生物学等许多基础学科的热点课题。
锰的生物地球化学循环不是孤立存在的,而是与多种元素循环相互伴随、偶联和相互影响。且由于锰氧化矿物自身具有较强的氧化性和吸附能力,所以锰循环活动与自然界很多物质的形态、迁移与转化过程相关联,在生物地球化学元素循环中发挥着重要作用[8],并直接影响到人类和生态系统的健康。
2 参与锰循环的微生物多样性参与锰循环的微生物广泛分布于陆地、淡水和海水等环境中。近几年,因分离技术提高和高通量测序技术发展,促进了新锰氧化和锰还原微生物的发现,其中细菌是锰循环微生物的主体。
目前已经发现微生物利用多种胞外电子传递机制还原锰;而关于微生物通过胞外电子传递氧化锰的研究较少,更多是因为其分泌酶催化锰氧化,因此本综述对这部分没有展开讨论。下面主要从微生物胞外电子传递机制、微生物介导锰氧化、微生物介导锰还原等3个方面来综述这一部分。
2.1 微生物胞外电子传递的机制微生物胞外电子传递是指微生物将胞内电子导出胞外或从胞外捕获电子的过程。目前微生物胞外电子传递的机制主要有纳米导线机制、直接接触机制、电子穿梭体机制、螯合促溶机制、应电运动,这5种胞外电子传递机制与锰还原都有关联(图 1)。
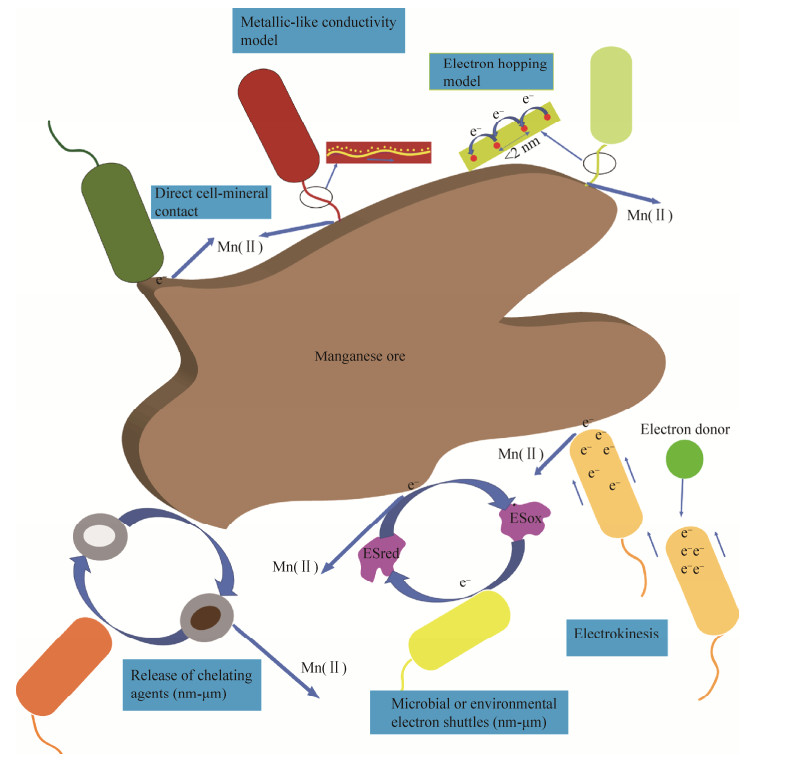
|
| 图 1 锰矿与微生物之间的相互作用 Figure 1 The interaction between microorganisms and manganese ore. |
不同于O2、NO3–和SO42–等可溶性电子受体,Mn(Ⅳ)氧化物在大多数环境下高度不溶,所以不能通过扩散进入胞内被还原。从细胞中心代谢的电子是如何跨过细胞膜壁并最终传递到胞外难溶的电子受体上是研究者关注的一个重要问题。电子跨膜得以实现,关键在于细胞质膜、外膜结构,尤其是周质空间上分布着高浓度的蛋白质[主要是细胞色素c (Cyt c)],它们作为电子传递载体或末端还原酶,构成贯穿内外的电子传递链,实现电子向胞外传输。在完整的Cyt c中,亚铁血红素常通过半胱氨酸的巯基与蛋白质部分结合。其中,铁是亚铁血红素的中心元素,其价态变化决定了Cyt c的氧化还原电位[9]。参与Mn(Ⅳ)和Fe(Ⅲ)还原的电子传递蛋白在地杆菌(Geobacter)和希瓦氏菌(Shewanella)中研究最为深入。
地杆菌是第一类被发现可以进行异化锰还原和铁还原的微生物。目前,已经超过110个Cyt c基因在硫还原地杆菌(Geobacter sulfurreducens)中被发现[10],但其中大部分基因还未知其功能。目前已知参与胞外电子传递的蛋白主要有MacA、PpcA、OmaB/C、OmbB/C、OmcB/C、OmcE、OmcZ、OmcS等。据此,G. sulfurreducens电子跨膜传递机制被提出(图 2)[11-12]。
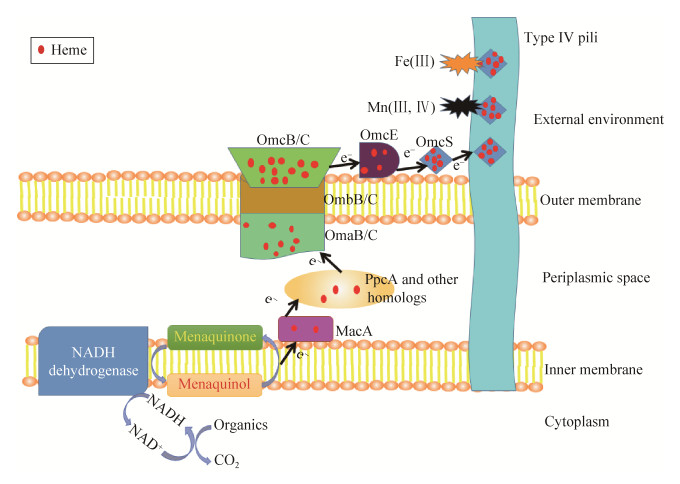
|
| 图 2 G. sulfurreducens中电子跨膜传递的可能途径示意图 Figure 2 Diagram of proposed transmembrane electron transfer pathway in G. sulfurreducens. |
有机物在胞内被氧化过程中生成还原力(NADH),在NADH脱氢酶的作用下,电子从NADH转移到内膜上的电子载体——醌类物质。内膜上的MacA蛋白可从载体中获得电子,并发挥氧化还原中心的作用,将电子分配给周质空间中的PpcA及其同源蛋白PpcB、PpcC、PpcD、PpcE。这其中PpcA的电子传递贡献最大[13],电子经PpcA家族蛋白转移到外膜的跨膜蛋白组合(OmaC-OmbC-OmcC和OmaB-OmbB-OmcB)上,从而实现跨膜传递。OmcS和OmcE是松散结合在G. sulfurreducens膜外的2种主要Cyt c[14]。OmcE在电子从OmcB/C传递到Ⅳ型菌毛(type Ⅳ pili,TFP)过程中可能主要起中介作用,然而G. sulfurreducens生长在含Mn(Ⅳ)氧化物的环境下omcE转录本丰度并不会提升[15]。尽管敲除omcE基因使得Mn(Ⅳ)还原有所延迟,但G. sulfurreducens最终能够适应omcE基因缺失所造成的影响[14]。OmcS是Geobacter还原Mn(Ⅳ)和Fe(Ⅲ)氧化物过程中十分重要的Cyt c。生长在含Mn(Ⅳ)氧化物的环境下,Geobacter的omcS转录本丰度提升了13.8倍[15],而omcS突变株还原Mn(Ⅳ)氧化物会受到抑制。电子经由外膜Cyt c传递到TFP上,并沿着TFP传递到远处,实现了Mn(Ⅳ)和Fe(Ⅲ)等不溶性胞外电子受体的远距离还原。
(1) 纳米导线机制。当生长在只含有不溶性Mn(Ⅳ)和Fe(Ⅲ)氧化物的环境中时,Geobacter会特异性地表达菌毛或鞭毛,这表明当感知不到可溶性的电子受体时,它会合成适当的附属物与不溶性的电子受体建立联系[16]。Geobacter利用这种“纳米导线”(microbial nanowires,MNWs)还原Mn(Ⅳ)氧化物非常普遍,即便锰矿存在于细菌无法进入的孔隙中,也能发生还原[17]。电子沿MNWs传递的模型,现主要有2种,一种是类金属导电模型(metallic-like conductivity model),另一种是电子跃迁模型(electron hopping model)。
对于G. sulfurreducens,其纳米导线的实质是锚定在外膜上的菌毛[18],菌毛拥有离域的电子态,以类似金属导电的蛋白“电线”起作用[19]。从X射线分析的菌毛结构来看,这种类似金属的导电性,主要因为PilA (G. sulfurreducens菌毛蛋白亚基)上芳香族氨基酸紧密重叠的π键有助于完成电子的运输与传递[20]。Vargas等[21]通过使用丙氨酸来替换PilA的5个芳香族氨基酸,发现Geobacter还原Fe(Ⅲ)氧化物的能力大大降低,而且菌毛拥有越多的芳香族氨基酸导电性就越好[22],这表明了芳香族氨基酸对于G. sulfurreducens胞外电子传递的重要性。而对于Shewanella oneidensis MR-1的纳米导线,电子传递可能是通过电子跃迁方式。目前认为MR-1的MNWs是周质和外膜向外延伸的形式[23],因其上面布满了Cyt c[24],电子在Cyt c之间跃迁使得电子沿着导线传递。G. sulfurreducens的MNWs也分布着丰富的Cyt c——OmcS[25],然而通过原子力显微镜观察揭示了OmcS之间的距离超过了100 nm,远大于2 nm以下的Cyt c之间电子跃迁要求的距离[19],所以OmcS在菌毛上的排布对于长距离的电子传输并无帮助,它更可能是介导导线和矿物之间的电子传递。
Geobacter spp.可以利用MNWs形成错综复杂的网络,借此与其他种微生物形成导电性团聚体,发生种间直接电子传递(direct interspecies electron transfer,DIET),建立起共生关系。G. metallireducens可以与G. sulfurreducens在乙醇互营氧化体系中形成团聚体实现DIET[26]。地杆菌也可直接将电子传递给产甲烷菌用于产生甲烷,如Methanosaeta harundinacea[27]、巴氏甲烷八叠球菌(Methanosarcina barkeri)[28]、马氏甲烷八叠球菌(Methanosarcina mazei)[29]。产甲烷菌参与DIET增加了大气甲烷的排放量,这在全球的碳循环中有潜在的重要影响。另外,纳米磁铁矿(Fe3O4)具有促进微生物胞外电子传递的作用,Liu等[30]从分子层面揭示了纳米磁铁矿能够补偿关键的OmcS的电子传递能力。本课题组最近发现纳米磁铁矿可在“小时”级别上显著提高湿地甲烷产生速率。进一步实验证实Geobacter与Methanosarcina可以通过偶联互营乙酸氧化和电子还原二氧化碳产甲烷,而纳米磁铁矿能够加速二者之间的电子传递进而增加湿地甲烷的生成[31]。自然界土壤中的磁铁矿常被腐殖酸和二氧化硅(SiO2)包被,我们研究发现,由于供体菌代谢的电子会通过表面修饰的腐殖酸选择性地转移到受体菌,而被包覆的磁铁矿核心几乎没有起作用,所以磁铁矿的表面经腐殖酸修饰后会显著降低原有的促进作用。与腐殖酸类似,非导电性SiO2层阻碍磁铁矿核与细菌之间的电子传递,因而削弱磁铁矿的促进作用。结果表明,对磁铁矿表面进行修饰,不仅可以显著改变其促进微生物种间直接电子传递的效率,而且可以改变电子传递的途径。研究结果证实了磁铁矿表面特征在促进微生物种间直接电子传递中的重要性,为全面评估导电矿物在土壤生态系统中促进微生物种间直接电子传递的效应提供了理论依据和实践基础[32]。
(2) 直接接触机制。直接接触实现了矿物的短距离还原。MtrC和MtrF是MR-1外膜Cyt c,在还原水钠锰矿[(Na, K)0.6(Mn4+, Mn3+)2O4·1.5H2O]过程中扮演末端还原酶的角色[33],可通过暴露在其表面的血红素将电子传递给氧化物。近几年也有Geobacter和Shewanella利用黄素类物质结合外膜Cyt c,并作为Cyt c的辅因子,提高Cyt c氧化还原电势,进而提高电子传递速率的发现[34-35]。
(3) 电子穿梭机制。电子穿梭体(electron shuttles,ES)主要在胞外发挥作用,ES介导微生物胞外电子传递的大致过程为:氧化态ES接受胞内的电子成为还原态,还原态ES传递电子给胞外电子受体,自身再次成为氧化态,从而往复循环[36]。根据ES是由微生物自身分泌还是外来供给,分别称之为内生ES和外生ES[36]。
MR-1在有氧条件下可分泌黄素类物质作为电子穿梭体,厌氧条件下用于异化Mn(Ⅳ)还原[37]。定量测得MR-1的这种电子传递方式贡献了总胞外电子传递的75%[38]。Marsili等[39]计算合成核黄素消耗ATP的速率大约为6.7×10–3 μmol ATP/mg蛋白质/h,然而在35 μA的电流下,希瓦氏菌产生ATP的速率大约是9.6 μmol ATP/mg蛋白质/h,这意味着合成穿梭体是低能耗的过程。除了黄素类物质,黑色素、吩嗪衍生物等也属于内生ES。
AQDS (蒽醌-2, 6-二磺酸)、AQS (9, 10-蒽醌-2-磺酸)和AQC (9, 10-蒽醌-2-羧酸)等是常见的外生ES。Zhang等在Dietzia DQ12-45-1还原水钠锰矿[(Na, K)0.6(Mn4+, Mn3+)2O4·1.5H2O]的实验中添加了AQDS,发现其不仅加速了Mn(Ⅳ)的还原,且增加了Mn(Ⅳ)还原程度[40]。一些腐殖质可以通过直接接触外膜层带电子的Cyt c,而另一些分子比较小,可穿过外膜,甚至穿过细胞质膜进入细胞内,从呼吸链上直接捕获电子。穿梭体氧化还原电位不同,其在呼吸链中截获电子的位点也有所不同[41]。对腐殖质进行醌基修饰以增强腐殖质的电子转移能力,从而加速反应速率是腐殖质方面一个较新的研究方向。
(4) 螯合促溶机制。一些分子或离子可以与金属离子发生络合反应形成稳定的新离子。螯合剂的存在一方面增加了溶液中可溶性金属离子的浓度,同时也增大了菌体与金属离子接触面积,更有利于金属还原[42]。例如铁载体是由微生物分泌的与铁具有高亲和性的螯合剂,铁载体对于MR-1还原MnO2也很重要。因为在铁受限和MnO2被还原的条件下,Cyt c转录受到抑制,在铁载体表达缺陷的细胞中尤其明显。铁载体的存在增加了胞内可溶性铁含量,缓解Cyt c受抑制的情况[43]。铁载体与锰的元素循环也存在直接联系,如desferrioxamine B,在不同的pH下,与锰矿发生还原或非还原的反应[44]。可见,螯合剂改变了金属的存在状态,促进了金属及其他元素的循环,继而影响整个生物地球化学系统。然而螯合物可能会受到环境中微生物或其他物质的作用,影响对不溶性金属的溶解[42]。
(5) 应电运动。2009年,Harris等[45]在对Shewanella的研究中首次发现了一种胞外电子传递所伴随的细菌行为响应——应电运动(Electrokinesis)。基本过程是,最靠近胞外受体(MnO2颗粒或电极)的微生物细胞亚居群将氧化有机物产生的电子储存在细胞表面形成“生物电容器”,然后通过“Touch-and-go”的方式,即细菌快速运动撞击受体,短时间内释放电子以还原受体,并在瞬间接触后脱离受体表面,参与下一个循环。应电运动的发生需要合适的胞外电子受体来激发,接触受体的细胞游动更加迅速,并在受体周围聚集。这种聚集与胞外电子传递的趋化性和趋能性相关[46]。
在微生物胞外电子传递过程中,五种机制并非独立发挥作用,而是几种方式协同作用,利用不同的策略来应对不同的环境最终实现异化锰还原,以利于更好地生存。多种电子传递方式是如何配合、哪种电子传递方式占主导是未来针对胞外电子传递机制的一个重要研究方向。
2.2 微生物介导锰氧化经系统发育分析锰氧化菌从门水平上主要属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),如图 3所示。其中变形菌门的Pseudomonas putida MnB1、Aurantimonas manganoxydans SI85-9A1、Leptothrix discophora SS-1、Erythrobacter sp. SD-21、Pedomicrobium sp. ACM3067、Rosebacter sp. AzwK-3b以及厚壁菌门的Bacillus sp. SG1是研究锰氧化的模式细菌。科学家在研究不同环境时发现,锰氧化细菌数量占细菌总数的比例大致如下:海底锰结核中可以高达50.0%,而一般海底沉积物中最多占10.0%;海水中的比例为1.0%–10.0%,土壤中这一比例则只有0.1%[47]。

|
| 图 3 部分锰氧化细菌系统发育关系 Figure 3 Phylogenetic relationship of part Mn(Ⅱ)-oxidizing bacteria. |
微生物介导的锰氧化过程可分为直接氧化和间接氧化。
直接氧化过程主要是微生物通过分泌酶催化Mn(Ⅱ)氧化,最常见的是以O2作为电子受体[反应式(1)],也有少部分是H2O2为电子受体[主要由真菌的锰过氧化物酶(manganese peroxidase,MnP)催化]。以O2作为电子受体参与氧化的酶主要分为2大类:多铜氧化酶(multicopper oxidases,MCOs)和动物血红素过氧化物酶(animal heme peroxidases,AHPs)。Mn(Ⅱ)不能直接氧化为Mn(Ⅳ),所以会出现Mn(Ⅲ)中间物[反应式(2)][48]。
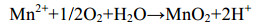
|
公式(1) |
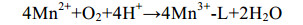
|
公式(2) |
反应式(2)是反应(1)的限速步骤[48]。反应式(1)发生后,Mn(Ⅲ)通过歧化作用生成Mn(Ⅳ)[49],即发生反应式(3)。
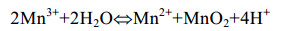
|
公式(3) |
Mn(Ⅱ)除了被微生物直接氧化,还存在间接氧化方式。间接氧化的发生是因为微生物生长发育过程中会产生一种或几种代谢产物,与Mn(Ⅱ)发生化学反应;或者微生物的存在一定程度上改变了周边环境,更有利于Mn(Ⅱ)的氧化。细菌产生超氧化物(O2–)氧化Mn(Ⅱ)是近几年间接锰氧化的热门研究方向,Learman等[50]证实玫瑰杆菌属菌株AzwK-3b (Roseobacter sp. AzwK-3b)可以通过产生超氧化物,间接将Mn(Ⅱ)氧化,这也体现了锰的抗氧化特性。AzwK-3b产生超氧化物与AHPs有关[51],说明间接氧化仍会有酶的参与,只是酶不直接作用于Mn(Ⅱ)。其他分泌AHPs的细菌是否也是通过产生超氧化物间接氧化锰有待证实。在海洋表面等环境中Mn(Ⅱ)是与O2–发生反应的主要物质之一[52],该反应[反应式(4)]会生成溶解态Mn(Ⅲ),是溶解态Mn(Ⅲ)的重要来源[53]。
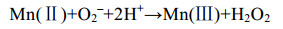
|
公式(4) |
根据热力学推导,pH在0–13,反应(4)都易于进行。然而,由于产物H2O2对反应本身有抑制作用[反应式(5)],因此要把Mn(Ⅲ)氧化生成高价态锰氧化物必须清除H2O2。
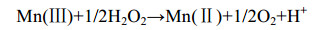
|
公式(5) |
异化锰还原菌大多是革兰氏阴性菌,主要分布在变形杆菌门、厚壁菌门等(表 1)。这些锰还原菌广泛存在于锰结核、采油污水、淡水沉积物、海相盆地、热液环境、泥土等多种环境中。
| Microorganisms | Phylum | Morphology | Growth Temperature/℃ |
| Bacillus infernus | Firmicutes | rod | 60 |
| Desulfitobacterium hafniense | Firmicutes | rod | 37 |
| Desulfolomaculum reducers | Firmicutes | rod | 37 |
| Desulfuromonas acetoxidans | Proteobacteria | rod | 30 |
| Thermovenabulum ferriorganovorum | Firmicutes | rod | 60 |
| Geabacter metallireducens | Proteobacteria | rod | 30 |
| Geobacter sulfurreducens | Proteobacteria | rod | 35 |
| Geothrix fermentans | Actinobacteria | rod | 30 |
| Pyrobaculum islandicum | Crenarchaeota | rod | 100 |
| Rhodoferax ferrireducens | Proteobacteria | rod | 25 |
| Shewanella oneidensis | Proteobacteria | rod | 30 |
| Shewanella putrefaciens | Proteobacteria | rod | 30 |
| Sulfurospirillum barnesii | Proteobacteria | vibrio | 30 |
| Thermanoerobacter siderophilus | Firmicutes | rod | 70 |
细菌介导的异化Mn(Ⅳ)还原耦合乙酸氧化反应式式(6)是最早被报道的[55]。
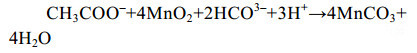
|
公式(6) |
Lovley等以严格厌氧的G. metallireducens GS-15为研究对象,第一次证明了微生物可以把Mn(Ⅳ)或Fe(Ⅲ)作为唯一电子受体,并使有机物完全氧化来产生能量供给微生物生长。Szeinbaum等[56]发现Shewanella在厌氧条件下以可溶的Mn(Ⅲ)为电子受体氧化乙酸,说明Mn(Ⅲ)也能参与微生物的代谢活动,这在锰循环和碳循环间建立了新的生物地球化学循环联系。另外,海洋微生物介导的甲烷厌氧氧化(anaerobic oxidation of methane,AOM)过去多被认为是依赖硫酸盐还原的过程,近期发现该过程也可以借助铁、锰元素进行。由于海洋沉积物中由河流输入的铁、锰元素在最终沉积前会反复氧化和还原100–300次,所以即使只有一小部分用于AOM,但仍有相当可观的甲烷氧化潜力[57]。据估算,每年约有1900万t锰和7.3亿t铁从江河入海[58],暗示这种潜力巨大。
微生物也可利用甲酸盐、乳酸盐[59]等碳源还原锰(反应式7、8),在一些海底沉积物的浅层,异化锰还原更是最重要的有机碳矿化和厌氧降解方式之一[57-60]。
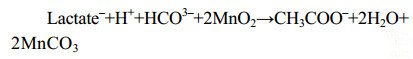
|
公式(7) |
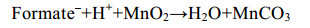
|
公式(8) |
研究发现,腐败希瓦氏菌(Shewanella putrefaciens)[59]和冰岛热棒菌(Pyrobaculum islandicum)[61]可以利用氢气作为电子供体(ED);某些硫酸盐还原菌、氧化硫硫杆菌(Thiobacillus thiooxidans)和氧化亚铁硫杆菌(Thiobacillus ferrooxidans)能够以单质硫作为ED还原Mn(Ⅳ)[62-63];MR-1可以以H2、甲酸、乳酸等作为ED还原Mn(Ⅲ)[64],其中利用甲酸、乳酸还原Mn(Ⅲ)的速率比用H2还原Mn(Ⅲ)要快4–5倍(反应式9、10)[65]。
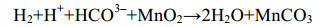
|
公式(9) |
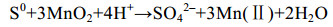
|
公式(10) |
近年研究表明,Mn(Ⅳ)还原生成Mn(Ⅱ)并非一步反应,是有Mn(Ⅲ)出现的2步反应。该反应第一步并未偶联有机物氧化,可能是细菌释放了能与Mn(Ⅳ)化学反应的物质来生成可溶性的Mn(Ⅲ),目的是增加锰的生物利用率;第二步反应耦合总无机碳(total inorganic carbon,TIC)氧化和能量产生[66]。以乳酸和甲酸作为ED还原Mn(Ⅲ)要比还原Mn(Ⅳ)快5–10倍,这在一定程度上说明Mn(Ⅳ)的还原增溶是Mn(Ⅳ)还原的限速步骤[65]。
3 微生物地球化学锰循环的环境意义Mn(Ⅱ)在自然界中的稳定性较高,当其在饮用水中的浓度超过0.4 mg/L (世界卫生组织标准),即成为污染物质。基于锰氧化菌氧化Mn(Ⅱ)生成Mn(Ⅳ)从而降低可溶性锰的浓度这一原理而发展的生物除锰法,具有工艺流程简单、运行费用低等优点,是目前水处理方面研究的热点。然而生物除锰系统启动时间长、易受环境因素影响,这是生物除锰过程需要解决的问题。因此,分离高效的锰氧化菌并培养固化仍是生物除锰需要做的工作。而作为生物氧化锰的核心,锰氧化酶的作用机理也需要进一步解释清楚[67]。
Mn(Ⅲ/Ⅳ)氧化物,在自然界的氧化能力仅次于O2,因而可以与众多物质直接发生化学反应,如药物磺胺甲嘧啶[68]等,含铬、钴、砷、锑、铈、硒、铀、钚等元素的无机物质、硫化物、Fe(Ⅱ)、NO2–等。锰氧化物自身具有高度反应活性、电荷零点低以及高负电荷量,需要一些可交换的阳离子来平衡,使得它对多种金属离子[69](包括镍、锌、铜、钴、锰、铅、镉、银、锡、钙、铁、镭、汞、铀、钋、钍等)具有吸附性。此前认为Mn(Ⅳ)可能在其中发挥主要作用,然而随着近几年对Mn(Ⅲ)研究技术的提升,Mn(Ⅲ)在其中的作用也不能忽略,这使得我们更准确预估不同组分的锰氧化物的氧化潜力。另外,被锰氧化的反应产物毒性如何、是否造成二次污染也是值得注意的问题。
利用异化锰还原是实现锰矿物生物冶金的一种技术,具有无污染、流程简单、能耗低的优点,已被广泛研究替代传统的火法冶金。近几年,化妆品和药物污染困扰人们,而微生物可以通过异化还原锰、铁元素氧化有机物,科学家试图从这一点出发找出处理此类污染物的新途径,这也成为一项研究热点。
4 总结和展望锰是自然界物质循环的重要组成元素。参与锰循环的微生物呈多样性丰富、空间分布广泛的特点,它们在锰元素的生物地球化学循环中起到重要作用。但微生物参与锰循环的研究还存在一些亟待解决的问题。如:(1)获得能氧化、还原锰的古菌。目前,尚未有古菌域微生物进行氧化锰的报道,且能还原锰的古菌也较为稀少。因此,若能从极端环境下发现新的能氧化锰、还原锰的古菌,不仅有利于揭示极端环境下微生物参与锰元素生物地球化学循环的发生机理,也会在锰循环的研究领域迈出重要一步。(2)非络合Mn(Ⅲ)在环境中的角色。非络合态Mn(Ⅲ)在一些地区被发现广泛存在,颠覆了人们对Mn(Ⅲ)的认识。在某些特殊环境中非络合Mn(Ⅲ)是否广泛存在、在锰循环中扮演了怎样的角色是值得思考的。(3)微生物酶催化锰氧化的机理和生理原因。Mn(Ⅲ)的发现使得自然界锰氧化过程进一步清晰,而微生物如何促使电子在酶内转移是一个核心问题。另外,微生物为什么分泌酶催化锰氧化,目前虽然有多种猜测,但都还未有直接证据。(4)锰化合物是否能促进电子传递。纳米磁铁矿具有促进胞外电子传递的作用,作为元素周期表上铁的近邻、性质相似的锰及其矿物,是否也存在类似纳米磁铁矿的导电性,从而影响微生物的胞外电子传递,亟待深入研究。(5) Cyt c的功能和定位。微生物胞外电子传递过程中,Cyt c的功能和定位是关键,也一直是胞外电子传递的研究热点。微生物在面对不同的电子受体时,各种Cyt c的重要性不同,细菌是如何通过调节其中的分子结构来改变其参与电子传递的蛋白组分,这一问题还不清楚。
致谢:感谢中国科学院烟台海岸带研究所肖雷雷老师,张洪霞、郝钦钦、张月超、王炳臣等对文章撰写所提出的宝贵意见及建议。
| [1] | Post JE. Manganese oxide minerals:crystal structures and economic and environmental significance. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3447-3454. DOI:10.1073/pnas.96.7.3447 |
| [2] | Grundmeier A, Dau H. Structural models of the manganese complex of photosystem Ⅱ and mechanistic implications. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2012, 1817(1): 88-105. DOI:10.1016/j.bbabio.2011.07.004 |
| [3] | Sparrow LA, Uren NC. Manganese oxidation and reduction in soils:effects of temperature, water potential, pH and their interactions. Soil Research, 2014, 52(5): 483-494. DOI:10.1071/SR13159 |
| [4] | Soldatova AV, Butterfield C, Oyerinde OF, Tebo BM, Spiro TG. Multicopper oxidase involvement in both Mn(Ⅱ) and Mn(Ⅲ) oxidation during bacterial formation of MnO2. JBIC Journal of Biological Inorganic Chemistry, 2012, 17(8): 1151-1158. DOI:10.1007/s00775-012-0928-6 |
| [5] | Trouwborst RE, Clement BG, Tebo BM, Glazer BT, Luther Ⅲ GW. Soluble Mn(Ⅲ) in suboxic zones. Science, 2006, 313(5795): 1955-1957. DOI:10.1126/science.1132876 |
| [6] | Madison AS, Tebo BM, Mucci A, Sundby B, Luther Ⅲ GW. Abundant porewater Mn(Ⅲ) is a major component of the sedimentary redox system. Science, 2013, 341(6148): 875-878. DOI:10.1126/science.1241396 |
| [7] | Oldham VE, Mucci A, Tebo BM, Luther Ⅲ GW. Soluble Mn(Ⅲ)-L complexes are abundant in oxygenated waters and stabilized by humic ligands. Geochimica et Cosmochimica Acta, 2017, 199: 238-246. DOI:10.1016/j.gca.2016.11.043 |
| [8] |
Zhang Z, Li L, Liu F. Molecular mechanism of bacterial manganese(Ⅱ) oxidation-A review. Acta Microbiologica Sinica, 2011, 51(2): 170-177.
(in Chinese) 张震, 李林, 刘凡. 细菌氧化锰的分子机制. 微生物学报, 2011, 51(2): 170-177. |
| [9] |
Ma C, Zhou SG, Zhuang L, Wu CY. Electron transfer mechanism of extracellular respiration:a review. Acta Ecologica Sinica, 2011, 31(7): 2008-2018.
(in Chinese) 马晨, 周顺桂, 庄莉, 武春媛. 微生物胞外呼吸电子传递机制研究进展. 生态学报, 2011, 31(7): 2008-2018. |
| [10] | Methé BA, Nelson KE, Eisen JA, Paulsen IT, Nelson W, Heidelberg JF, Wu D, Wu M, Ward N, Beanan MJ, Dodson RJ, Madupu R, Brinkac LM, Daugherty SC, DeBoy RT, Durkin AS, Gwinn M, Kolonay JF, Sullivan SA, Haft DH, Selengut J, Davidsen TM, Zafar N, White O, Tran B, Romero C, Forberger HA, Weidman J, Khouri H, Feldblyum TV, Utterback TR, Van Aken SE, Lovley DR, Fraser CM. Genome of Geobacter sulfurreducens:Metal reduction in subsurface environments. Science, 2003, 302(5652): 1967-1969. DOI:10.1126/science.1088727 |
| [11] | Lovley DR. Bug juice:harvesting electricity with microorganisms. Nature Reviews Microbiology, 2006, 4(7): 497-508. DOI:10.1038/nrmicro1442 |
| [12] | Santos TC, Silva MA, Morgado L, Dantas JM, Salgueiro CA. Diving into the redox properties of Geobacter sulfurreducens cytochromes:a model for extracellular electron transfer. Dalton Transactions, 2015, 44(20): 9335-9344. DOI:10.1039/C5DT00556F |
| [13] | Ueki T, DiDonato LN, Lovley DR. Toward establishing minimum requirements for extracellular electron transfer in Geobacter sulfurreducens. FEMS Microbiology Letters, 2017, 364(9). DOI:10.1093/femsle/fnx093 |
| [14] | Mehta T, Coppi MV, Childers SE, Lovley DR. Outer membrane c-type cytochromes required for Fe(Ⅲ) and Mn(Ⅳ) oxide reduction in Geobacter sulfurreducens. Applied and Environmental Microbiology, 2005, 71(12): 8634-8641. DOI:10.1128/AEM.71.12.8634-8641.2005 |
| [15] | Aklujkar M, Coppi MV, Leang C, Kim BC, Chavan MA, Perpetua LA, Giloteaux L, Liu A, Holmes DE. Proteins involved in electron transfer to Fe(Ⅲ) and Mn(Ⅳ) oxides by Geobacter sulfurreducens and Geobacter uraniireducens. Microbiology, 2013, 159(3): 515-535. |
| [16] | Childers SE, Ciufo S, Lovley DR. Geobacter metallireducens accesses insoluble Fe(Ⅲ) oxide by chemotaxis. Nature, 2002, 416(6882): 767-769. DOI:10.1038/416767a |
| [17] | Michelson K, Sanford RA, Valocchi AJ, Werth CJ. Nanowires of Geobacter sulfurreducens require redox cofactors to reduce metals in pore spaces too small for cell passage. Environmental Science & Technology, 2017, 51(20): 11660-11668. |
| [18] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [19] | Malvankar NS, Tuominen MT, Lovley DR. Lack of cytochrome involvement in long-range electron transport through conductive biofilms and nanowires of Geobacter sulfurreducens. Energy & Environmental Science, 2012, 5(9): 8651-8659. |
| [20] | Malvankar NS, Vargas M, Nevin K, Tremblay PL, Evans-Lutterodt K, Nykypanchuk D, Martz E, Tuominen MT, Lovley DR. Structural basis for metallic-like conductivity in microbial nanowires. mBio, 2015, 6(2): e00084-15. |
| [21] | Vargas M, Malvankar NS, Tremblay PL, Leang C, Smith JA, Patel P, Snoeyenbos-West O, Nevin KP, Lovley DR. Aromatic amino acids required for pili conductivity and long-range extracellular electron transport in Geobacter sulfurreducens. mBio, 2013, 4(2): e00105-13. |
| [22] | Tan Y, Adhikari RY, Malvankar NS, Ward JE, Woodard TL, Nevin KP, Lovley DR. Expressing the Geobacter metallireducens pilA in Geobacter sulfurreducens yields pili with exceptional conductivity. mBio, 2017, 8(1): e02203-16. |
| [23] | Pirbadian S, Barchinger SE, Leung KM, Byun HS, Jangir Y, Bouhenni RA, Reed SB, Romine MF, Saffarini DA, Shi L, Gorby YA, Golbeck JH, El-Naggar MY. Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(35): 12883-12888. DOI:10.1073/pnas.1410551111 |
| [24] | Sure S, Ackland ML, Torriero AAJ, Adholeya A, Kochar M. Microbial nanowires:an electrifying tale. Microbiology, 2016, 162(12): 2017-2028. DOI:10.1099/mic.0.000382 |
| [25] | Leang C, Qian XL, Mester T, Lovley DR. Alignment of the c-type cytochrome OmcS along pili of Geobacter sulfurreducens. Applied and Environmental Microbiology, 2010, 76(12): 4080-4084. DOI:10.1128/AEM.00023-10 |
| [26] | Summers ZM, Fogarty HE, Leang C, Franks AE, Malvankar NS, Lovley DR. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [27] | Rotaru AE, Shrestha PM, Liu FH, Shrestha M, Shrestha D, Embree M, Zengler K, Wardman C, Nevin KP, Lovley DR. A new model for electron flow during anaerobic digestion:direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane. Energy & Environmental Science, 2014, 7(1): 408-415. |
| [28] | Rotaru AE, Shrestha PM, Liu FH, Markovaite B, Chen SS, Nevin KP, Lovley DR. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. Applied and Environmental Microbiology, 2014, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
| [29] | Zheng SL, Zhang HX, Li Y, Zhang H, Wang OM, Zhang J, Liu FH. Co-occurrence of Methanosarcina mazei and Geobacteraceae in an iron(Ⅲ)-reducing enrichment culture. Frontiers in Microbiology, 2015, 6: 941. |
| [30] | Liu F, Rotaru AE, Shrestha PM, Malvankar NS, Nevin KP, Lovley DR. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange. Environmental Microbiology, 2015, 17(3): 648-655. DOI:10.1111/emi.2015.17.issue-3 |
| [31] | Xiao LL, Liu FH, Liu JC, Li JJ, Zhang YC, Yu JF, Wang OM. Nano-Fe3O4 particles accelerating electromethanogenesis on an hour-long timescale in wetland soil. Environmental Science:Nano, 2018, 5(2): 436-445. DOI:10.1039/C7EN00577F |
| [32] | You YS, Zheng SL, Zang HM, Liu F, Liu FH, Liu J. Stimulatory effect of magnetite on the syntrophic metabolism of Geobacter co-cultures:influences of surface coating. Geochimica et Cosmochimica Acta, 2018. DOI:10.1016/j.gca.2018.02.009 |
| [33] | Bücking C, Popp F, Kerzenmacher S, Gescher J. Involvement and specificity of Shewanella oneidensis outer membrane cytochromes in the reduction of soluble and solid-phase terminal electron acceptors. FEMS Microbiology Letters, 2010, 306(2): 144-151. DOI:10.1111/fml.2010.306.issue-2 |
| [34] | Okamoto A, Hashimoto K, Nealson KH, Nakamura R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(19): 7856-7861. DOI:10.1073/pnas.1220823110 |
| [35] | Okamoto A, Saito K, Inoue K, Nealson KH, Hashimoto K, Nakamura R. Uptake of self-secreted flavins as bound cofactors for extracellular electron transfer in Geobacter species. Energy & Environmental Science, 2014, 7(4): 1357-1361. |
| [36] |
Ma JL, Ma C, Tang J, Zhou SG, Zhuang L. Mechanisms and applications of electron shuttle-mediated extracellular electron transfer. Progress in Chemistry, 2015, 27(12): 1833-1840.
(in Chinese) 马金莲, 马晨, 汤佳, 周顺桂, 庄莉. 电子穿梭体介导的微生物胞外电子传递:机制及应用. 化学进展, 2015, 27(12): 1833-1840. DOI:10.7536/PC150533 |
| [37] | von Canstein H, Ogawa J, Shimizu S, Lloyd JR. Secretion of flavins by Shewanella species and their role in extracellular electron transfer. Applied and Environmental Microbiology, 2008, 74(3): 615-623. DOI:10.1128/AEM.01387-07 |
| [38] | Kotloski NJ, Gralnick JA. Flavin electron shuttles dominate extracellular electron transfer by Shewanella oneidensis. mBio, 2013, 4(1): e00553-12. |
| [39] | Marsili E, Baron DB, Shikhare ID, Coursolle D, Gralnick JA, Bond DR. Shewanella Secretes flavins that mediate extracellular electron transfer. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(10): 3968-3973. DOI:10.1073/pnas.0710525105 |
| [40] | Zhang HQ, Li Y, Wang X, Lu AH, Ding HR, Zeng CP, Wang X, Wu XL, Nie Y, Wang CQ. Aerobic and anaerobic reduction of birnessite by a novel Dietzia strain. Geochemical Transactions, 2015, 16: 11. DOI:10.1186/s12932-015-0026-0 |
| [41] |
Xie ZF, Zheng P, Zhang JQ, Cai J. The electricigens and their physiological and biochemical characteristics. Bulletin of Science and Technology, 2013, 27(3): 32-39.
(in Chinese) 谢作甫, 郑平, 张吉强, 蔡靖. 产电微生物及其生理生化特性. 科技通报, 2013, 27(3): 32-39. |
| [42] |
Xu W, Hu P, Li YH, Li XM, Zhou SG. Mechanisms of microbial Fe(Ⅲ) respiration:A review. Chinese Journal of Ecology, 2008, 27(6): 1037-1042.
(in Chinese) 许伟, 胡佩, 李艳红, 李晓敏, 周顺桂. 微生物铁呼吸机制研究进展. 生态学杂志, 2008, 27(6): 1037-1042. |
| [43] | Kouzuma A, Hashimoto K, Watanabe K. Roles of siderophore in manganese-oxide reduction by Shewanella oneidensis MR-1. FEMS Microbiology Letters, 2012, 326(1): 91-98. DOI:10.1111/j.1574-6968.2011.02444.x |
| [44] | Duckworth OW, Sposito G. Siderophore-promoted dissolution of synthetic and biogenic layer-type Mn oxides. Chemical Geology, 2007, 242(3/4): 497-508. |
| [45] | Harris HW, El-Naggar MY, Bretschger O, Ward MJ, Romine MF, Obraztsova AY, Nealson KH. Electrokinesis is a microbial behavior that requires extracellular electron transport. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(1): 326-331. DOI:10.1073/pnas.0907468107 |
| [46] | Harris HW, El-Naggar MY, Nealson KH. Shewanella oneidensis MR-1 chemotaxis proteins and electron-transport chain components essential for congregation near insoluble electron acceptors. Biochemical Society Transactions, 2012, 40(6): 1167-1177. DOI:10.1042/BST20120232 |
| [47] |
Yang H, Zhong J, Ji J, Zhang J. Advance in microbiological studies of Mn(Ⅱ)-oxidizing bacteria. Chinese Journal of Applied & Environmental Biology, 2008, 14(1): 143-146.
(in Chinese) 杨宏, 钟洁, 纪娟, 张杰. Mn(Ⅱ)氧化细菌的微生物学研究进展. 应用与环境生物学报, 2008, 14(1): 143-146. |
| [48] | Webb SM, Dick GJ, Bargar JR, Tebo BM. Evidence for the presence of Mn(Ⅲ) intermediates in the bacterial oxidation of Mn(Ⅱ). Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(15): 5558-5563. DOI:10.1073/pnas.0409119102 |
| [49] | Soldatova AV, Romano CA, Tao LZ, Stich TA, Casey WH, Britt RD, Tebo BM, Spiro TG. Mn(Ⅱ) oxidation by the multicopper oxidase complex Mnx:A coordinated two-stage Mn(Ⅱ)/(Ⅲ) and Mn(Ⅲ)/(Ⅳ) mechanism. Journal of the American Chemical Society, 2017, 139(33): 11381-11391. DOI:10.1021/jacs.7b02772 |
| [50] | Learman DR, Voelker BM, Vazquez-Rodriguez AI, Hansel CM. Formation of manganese oxides by bacterially generated superoxide. Nature Geoscience, 2011, 4(2): 95-98. DOI:10.1038/ngeo1055 |
| [51] | Andeer PF, Learman DR, McIlvin M, Dunn JA, Hansel CM. Extracellular haem peroxidases mediate Mn(Ⅱ) oxidation in a marine Roseobacter bacterium via superoxide production. Environmental Microbiology, 2015, 17(10): 3925-3936. DOI:10.1111/1462-2920.12893 |
| [52] | Wuttig K, Heller MI, Croot PL. Pathways of superoxide (O2-) decay in the Eastern Tropical North Atlantic. Environmental Science & Technology, 2013, 47(18): 10249-10256. |
| [53] | Hansard SP, Easter HD, Voelker BM. Rapid Reaction of nanomolar Mn(Ⅱ) with superoxide radical in seawater and simulated freshwater. Environmental Science & Technology, 2011, 45(7): 2811-2817. |
| [54] | Lovley DR, Holmes DE, Nevin KP. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction. Advances in Microbial Physiology, 2004, 49: 219-286. DOI:10.1016/S0065-2911(04)49005-5 |
| [55] | Lovley DR, Phillips EJP. Novel mode of microbial energy metabolism:organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Applied and Environmental Microbiology, 1988, 54(6): 1472-1480. |
| [56] | Szeinbaum N, Lin H, Brandes JA, Taillefert M, Glass JB, DiChristina TJ. Microbial manganese(Ⅲ) reduction fuelled by anaerobic acetate oxidation. Environmental Microbiology, 2017, 19(9): 3475-3486. DOI:10.1111/emi.2017.19.issue-9 |
| [57] | Canfield DE, Thamdrup B, Hansen JW. The anaerobic degradation of organic matter in Danish coastal sediments:iron reduction, manganese reduction, and sulfate reduction. Geochimica et Cosmochimica Acta, 1993, 57(16): 3867-3883. DOI:10.1016/0016-7037(93)90340-3 |
| [58] | Beal EJ, House CH, Orphan VJ. Manganese-and iron-dependent marine methane oxidation. Science, 2009, 325(5937): 184-187. DOI:10.1126/science.1169984 |
| [59] | Lovley DR, Phillips EJP, Lonergan DJ. Hydrogen and formate oxidation coupled to dissimilatory reduction of iron or manganese by Alteromonas putrefaciens. Applied and Environmental Microbiology, 1989, 55(3): 700-706. |
| [60] | Thamdrup B, Rosselló-Mora R, Amann R. Microbial manganese and sulfate reduction in Black Sea shelf sediments. Applied and Environmental Microbiology, 2000, 66(7): 2888-2897. DOI:10.1128/AEM.66.7.2888-2897.2000 |
| [61] | Lovley DR. Potential role of dissimilatory iron reduction in the early evolution of microbial respiration[M]//Seckbach J. Origins. Netherlands: Springer, 2004: 299-313. |
| [62] | Lovley DR. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction. Microbiological Reviews, 1991, 55(2): 259-287. |
| [63] | Lovley DR, Phillips EJP. Novel processes for anaerobic sulfate production from elemental sulfur by sulfate-reducing bacteria. Applied and Environmental Microbiology, 1994, 60(7): 2394-2399. |
| [64] | Kostka JE, Luther Ⅲ GW, Nealson KH. Chemical and biological reduction of Mn(Ⅲ)-pyrophosphate complexes:potential importance of dissolved Mn(Ⅲ) as an environmental oxidant. Geochimica et Cosmochimica Acta, 1995, 59(5): 885-894. |
| [65] | Szeinbaum N, Burns JL, DiChristina TJ. Electron transport and protein secretion pathways involved in Mn(Ⅲ) reduction by Shewanella oneidensis. Environmental Microbiology Reports, 2014, 6(5): 490-500. DOI:10.1111/emi4.2014.6.issue-5 |
| [66] | Lin H, Szeinbaum NH, DiChristina TJ, Taillefert M. Microbial Mn(Ⅳ) reduction requires an initial one-electron reductive solubilization step. Geochimica et Cosmochimica Acta, 2012, 99: 179-192. DOI:10.1016/j.gca.2012.09.020 |
| [67] |
Yuan S, Liu SY, Zheng C, Lin HJ, Liu WL, Zhang XR. Review of manganese removal technology in drinking water. Journal of Taizhou University, 2015, 37(3): 52-59.
(in Chinese) 袁烁, 刘树元, 郑晨, 林宏剑, 刘文莉, 张曦冉. 饮用水中除锰技术的研究进展. 台州学院学报, 2015, 37(3): 52-59. |
| [68] | Gao J, Hedman C, Liu C, Guo T, Pedersen JA. Transformation of sulfamethazine by manganese oxide in aqueous solution. Environmental Science & Technology, 2012, 46(5): 2642-2651. |
| [69] | Tebo BM, Bargar JR, Clement BG, Dick GJ, Murray KJ, Parker D, Verity R, Webb SM. Biogenic manganese oxides:Properties and mechanisms of formation. Annual Review of Earth and Planetary Sciences, 2004, 32: 287-328. DOI:10.1146/annurev.earth.32.101802.120213 |
 2018, Vol. 58
2018, Vol. 58




