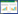中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 白雪瑞, 王权, 凌娇, 万莹, 陈永军, 方维焕, 孙卫东, 蒋蔚. 2018
- Xuerui Bai, Quan Wang, Jiao Ling, Ying Wan, Yongjun Chen, Weihuan Fang, Weidong Sun, Wei Jiang. 2018
- T3SS1和T3SS2影响副溶血弧菌生物学特性及细胞致病性的比较
- Comparison of biological characteristics and cytopathogenicities between T3SS1 and T3SS2 in Vibrio parahaemolyticus
- 微生物学报, 58(3): 455-466
- Acta Microbiologica Sinica, 58(3): 455-466
-
文章历史
- 收稿日期:2017-05-08
- 修回日期:2017-07-09
- 网络出版日期:2017-07-17
2. 南京农业大学动物医学院, 江苏 南京 210095;
3. 浙江农林大学动物科技学院, 浙江 临安 311300
2. College of Animal Medical, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China;
3. College of Animal Science and Technology, Zhejiang Agriculture & Forestry University, Lin'an 311300, Zhejiang Province, China
副溶血弧菌(Vibrio parahaemolyticus)作为革兰氏阴性嗜盐短杆菌,普遍存在于鱼类、虾贝类等水产品中,能引发细菌食源性疾病,对人和动物的健康构成严重威胁[1-2]。副溶血弧菌主要利用毒力因子在宿主中发挥致病作用,包括耐热直接溶血毒素(Thermostable direct hemolysin,TDH)、TDH相关溶血毒素(TDH-related hemolysin,TRH)、Ⅲ型分泌系统(The type Ⅲ secretion systems,T3SSs)及Ⅵ型分泌系统(The type Ⅵ secretion systems,T6SS)等[3]。TDH是一种淀粉样蛋白毒素,是公认的重要致病因子,主要通过破坏红细胞或宿主细胞的脂质微区,增大细胞膜通透性,进而发挥溶血活性和细胞毒性[4]。TRH被证实类似于TDH,能通过激活氯离子通道,改变离子通量而导致细胞溶血[5-6]。
T3SSs作为与致病性密切相关的毒力因子,主要由蛋白复合物形成跨膜分泌管道,似针状结构,刺入宿主细胞内,将效应蛋白直接注入细胞质中,从而发挥细胞毒性作用[7]。副溶血弧菌T3SSs在两条染色体上各有一套,分别命名为T3SS1和T3SS2。T3SS1系统由结构蛋白(如VscA1-VscY1、VcrD1、VcrG1、VcrR1和VcrV1)和效应蛋白(VopQ、VopR、VopS和VPA0450等)构成,主要发挥对宿主细胞的细胞毒性,介导宿主细胞自噬凋亡等作用[8-10]。T3SS2位于染色体Ⅱ的毒力岛上,由类似T3SS1的结构蛋白和7个效应蛋白(VopA/P、VopL、VopC、VopT、VopV、VopZ和VPA1380)构成,主要引起细菌肠毒性和一定的细胞毒性作用[11-14]。通过建立动物模型试验,证实T3SS1对小鼠具有一定的致死性,而T3SS2能致使兔回肠肠液聚集,引发其腹泻[14-15]。
VcrD1和vcrD2基因是T3SS1和T3SS2中具有代表性的结构基因,然而,两者在临床分离株和环境分离株的分布不同。VcrD1基因存在于所有菌株中,vcrD2基因在临床分离株中的阳性率高于环境分离株[16]。推测T3SS1在副溶血弧菌的环境生存性或是生物特性中起主要作用,而最近的研究表明,vcrD1缺失株会导致鞭毛蛋白表达量下调而显著降低副溶血弧菌的运动性[17],证实T3SS1在生物学特性中的作用,但T3SS2是否有类似的作用尚无明确报道。同时,Ⅲ型分泌系统T3SS1和T3SS2在副溶血弧菌生物特性中是否存在一定关联,研究甚少。
本文在已有的研究基础上,进一步系统性地研究T3SS1和T3SS2在细菌生物学特性和细胞致病性的差异和相关关系,为副溶血弧菌的致病机制的研究和疫苗开发等提供重要资料。
1 材料和方法 1.1 菌种、质粒和试剂副溶血弧菌临床分离株SH112 (tdh+,血清型O3:K6),同源重组质粒pYAK1及互补质粒pMMB207、大肠杆菌HB101 (pRK2013)和CC118λpir,均由本实验室保存。细菌基因组提取试剂盒和质粒提取试剂盒购自上海天根生化公司。限制性内切酶、DNA Taq聚合酶、T4连接酶,以及PrimeScript®反转录试剂盒和SYBR® Premix Ex TaqTM П购自大连TaKaRa公司。Trizol®试剂购自Invitrogen公司,CytoTox 96®非放射性细胞毒性检测试剂盒购自Promega公司,DMEM细胞培养基和胎牛血清均购自Gibco公司,硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)购自广东环凯微生物公司,其他生化试剂均为进口或国产分析纯。细胞计数仪购自Bio-Rad公司,紫外分光光度计购自Thermo公司,普通PCR仪和高速低温离心机购自Eppendorf公司,Biosystems® 7500荧光定量PCR仪购自ABI公司。
1.2 引物设计根据GenBank上副溶血弧菌RIMD2210633标准株的vcrD1和vcrD2基因序列,用Primer 5软件设计以下引物,见表 1。
| Primer | Nucleotide sequence (5′→3′) a | Restriction site |
| vcrD1-A | CAGGGATCCTTTTCAGTGGGCGATAGT | BamH Ⅰ |
| vcrD1-B | TGAACGCAGCACTTGTACAATCGTTTGAAC | |
| vcrD1-C | CAAGTGCTGCGTTCATATGTAAAGATTGCAGATAG | |
| vcrD1-D | ACAGCATGCGCGAAGCCAAAACTGAACCA | Sph Ⅰ |
| vcrD1-E | TTTCTTTCATCCGCATTTC | |
| vcrD1-F | GTGACGCTTCCGACACTC | |
| vcrD1-pMMB-F | AAAGGATCCATTACATCCCTACCCGTCCAAG | BamH Ⅰ |
| vcrD1-pMMB-R | CCAGAGCTCGTGAATCTCATGAATAAGTTGA | Sac Ⅰ |
| vcrD2-A | TTAGCATGCCTGACTAACTTTAAGAGTG | Sph Ⅰ |
| vcrD2-B | ATGACTTTTAGGAGGATATGATGGCAGAAGAAT | |
| vcrD2-C | CCTCCTAAAAGTCATATCGAGTCTAATCCTCTTTT | |
| vcrD2-D | TTTGGATCCTGAGGAACAAGTGCTC | BamH Ⅰ |
| vcrD2-E | ACTGACTACCCAATACATCC | |
| vcrD2-F | ATCAACCAGACTAAACGAAA | |
| vcrD2-pMMB-F | TCTGAATTCATGATGGCGAAGTTACGT | EcoR Ⅰ |
| vcrD2-pMMB-R | GGGGGATCCTTAAATATGAATTGTATCTGT | BamH Ⅰ |
| sacB-F | ACGGCACTGTCGCAAACTAT | |
| sacB-R | TTCCGTCACCGTCAAAGAT | |
| a Restriction enzyme sites are underlined. | ||
1.3 缺失株及互补株的构建 1.3.1 ΔvcrD1构建以及ΔvcrD1互补株的构建: ΔvcrD1缺失株的构建:以副溶血弧菌SH112为野生株(Wide type strain,WT),待细菌长至生长对数期时,利用细菌基因提取试剂盒提取其DNA,用两对引物vcrD1-A/B、vcrD1-C/D分别扩增vcrD1基因的上下游同源臂片段AB和CD,再以vcrD1-A/D为引物,利用融合PCR扩增片段AB和CD,获得vcrD1-AD片段。将vcrD1-AD片段与pYAK-CC118质粒同时进行双酶切,经T4连接酶连接后转入到CC118λpir感受态细胞中,在10 μg/mL氯霉素的LB平板上培养,挑取疑似阳性的单菌落进行PCR鉴定,扩增产物送至上海英骏生物技术公司测序,命名阳性重组质粒为pYAK1-vcrD1。以含有同源重组质粒的CC118λpir为供体菌,副溶血弧菌SH112株为受体菌进行接合转移。通过10 μg/mL氯霉素的TCBS平板和20%蔗糖LB平板进行传代筛选,挑取在氯霉素抗性平板中无法生长的单菌落进行培养鉴定,若用vcrD1-E/F引物进行检测,只获得缺失片段,同时用引物sacB-F/R扩增,无目的条带,则获得基因缺失株ΔvcrD1。
ΔvcrD1互补株的构建:以野生株DNA为模板,用引物vcrD1-pMMB-F/R扩增获得vcrD1整个ORF片段,并与pMMB207质粒同时进行双酶切,经连接后再转入CC118λpir感受态细胞中,同样于10 μg/mL氯霉素的LB平板上培养,挑取单克隆菌培养,经PCR和测序鉴定后的阳性互补质粒,称为pMMB-vcrD1。分别以含互补质粒pMMB-vcrD1的CC118λpir为供体菌,ΔvcrD1缺失株为受体菌,pRK2013-HB101为辅助菌进行接合转移试验,利用引物vcrD1-pMMB-F/R进行PCR鉴定,其阳性株命名为互补株CΔvcrD1。
1.3.2 ΔvcrD2缺失株的构建与ΔvcrD2互补株的构建: ΔvcrD2缺失株和CΔvcrD2互补株的构建方法同于1.3.1中的构建方法。 1.3.3 ΔvcrD1-vcrD2双缺失株的构建: 以ΔvcrD2缺失株为亲本菌,将1.3.1中构建成功的含有pYAK1-vcrD1的CC118λpir为供体菌,进行接合转移,同源重组后,获得双缺失株ΔvcrD1-vcrD2。 1.4 各缺失株生长曲线的测定挑取野生株、各缺失株ΔvcrD1、ΔvcrD2、ΔvcrD1-vcrD2及互补株CΔvcrD1、CΔvcrD2的单菌落分别接种到3% NaCl-LB (pH 7.2)液体培养基中,37 ℃培养至OD600=0.20 (±0.02),将各菌液的100 μL接种于新鲜5 mL 3% NaCl-LB液体培养基中混悬,取100 μL加于96孔的酶标板孔中,重复3个孔,空白孔为3% NaCl-LB液体培养基,将酶标板放置37 ℃温箱温育,每隔1 h测其OD600,连续监测12 h,并绘制各菌株的生长曲线。试验重复3次。
1.5 生物被膜的测定同1.4方法中,将各菌液调其浓度至OD600=0.20 (±0.02),并稀释于3% NaCl-LB液体培养基中。在酶标板中,各实验孔加200 μL的菌液,空白孔加培养基,然后放置37 ℃温箱内静置培养48 h。随后,弃去菌液上清,用1× PBS (pH 7.4)洗3次,加200 μL纯甲醇固定10 min,再用200 μL的1%结晶紫染色15 min,弃去结晶紫后用1× PBS洗涤3次,空气干燥。最后,加入200 μL 95%乙醇作用10 min,用酶标仪测量595 nm处的吸光值(OD595)。每株细菌重复10个孔,重复3次实验,取平均值。
1.6 运动性测定先配制含0.3%琼脂的LB平板培养基(运动培养基),室温放置,过夜待用。同1.4方法中,将单菌落培养好的各菌株培养至浓度为OD600=0.20 (±0.02),取1.5 μL的菌液轻轻垂直点在运动培养基的表面,放置37 ℃温箱内培养5 h。每小时观察1次,测量细菌圆形运动直径的大小并记录。将4.5 h运动培养基的运动情况进行拍照。实验重复3次,取其平均值。
1.7 细胞毒性检测用10%胎牛血清的DMEM培养液将RAW264.7巨噬细胞培养于96孔细胞板上,待单层细胞布满,吸去培养上清,用PBS洗1遍备用。将野生株、缺失株和互补株培养至对数生长期,测定其OD600=0.20 (±0.02),用无酚红DMEM洗1次,按感染率(Multiplicity of infection,MOI)=10:1 (细菌数:细胞数)感染RAW264.7细胞,每孔对应加入100 μL的菌液作为实验孔,重复4个孔;加入100 μL无酚红DMEM作为细胞自发对照孔;加入90 μL的DMEM为最大释放孔;加90 μL的DMEM和10 μL裂解液(无细胞孔)为体积对照孔,分别置于37 ℃、5% CO2的细胞培养箱中孵育1、2、3 h。利用CytoTox96试剂盒检测细胞上清中乳酸脱氢酶(LDH)的释放,在收集细胞上清前45 min,在最大释放孔中加入10 μL裂解液。到收集上清时,从每孔取出50 μL转移到96孔酶标板中,避光加入50 μL配好的底物,用锡箔纸盖住平板,室温孵育30 min,然后快速向每孔加入50 μL终止液,参照说明书计算各细菌感染RAW264.7细胞后LDH释放的百分比。
同样方法,用含20%胎牛血清的DMEM培养液将Caco-2细胞培养至90%左右,将各细菌按感染率MOI=1:1感染Caco-2细胞,同样的条件作用1、2、3 h,检测各细菌感染Caco-2细胞后LDH释放的百分比。
1.8 RNA水平检测细胞因子转录水平将RAW264.7巨噬细胞(10%胎牛血清的DMEM培养液)在24孔细胞板上培养至90%时,弃上清培养基,加入200 μL的完全培养基,待用。将培养好的野生株、各缺失株的OD600调整到一致(OD600=0.20±0.02),用完全培养基洗2遍,按MOI=10:1分别将各菌加到RAW264.7细胞孔和Caco-2细胞孔中,每实验孔加500 μL,重复3个实验孔,并设立阴性对照孔(不加细菌),置于37 ℃、5% CO2的细胞培养箱孵育。分别在作用1 h和2 h时,将每孔上清离心后的细胞沉淀和孔底细胞用1 mL的Trizol完全裂解细胞混合。根据Trizol法提取每孔细胞的mRNA,按照PrimeScript® RT试剂盒反转录成cDNA。最后根据试剂盒SYBR® Premix Ex TaqTM П,利用荧光定量PCR法检测细胞炎性因子IL-6和IL-1β转录水平的表达情况。荧光定量所用的引物[18]如表 2所示。
| Primer | Sequence (5′→3′) | Function |
| IL-1β-F | TCCAGGATGAGGACATGAGCAC | Fragment for mouse IL-1β gene |
| IL-1β-R | GAACGTCACACACCAGCAGGTTA | |
| IL-6-F | CCACTTCACAAGTCGGAGGCTTA | Fragment for mouse IL-6 gene |
| IL-6-R | GCAAGTGCATCATCGTTGTTCATAC | |
| β-actin-F | TGACAGGATGCAGAAGGAGA | Fragment for mouse β-actin gene |
| β-actin-R | GCTGGAAGGTGGACAGTGAG |
2 结果和分析 2.1 基因缺失株ΔvcrD1、ΔvcrD2、ΔvcrD1-vcrD2及互补株CΔvcrD1、CΔvcrD2的鉴定
以疑似阳性单菌落的基因组DNA为模板,分别用引物vcrD1-E/F (3447-1320 bp)、vcrD2-E/F (3252-1365 bp)对缺失株中相应的缺失基因进行鉴定,用引物sacB-F/R鉴定缺失菌株中重组质粒的消失情况。ΔvcrD1缺失株的鉴定结果如图 1-A,用引物vcrD1-E/F扩增后,在1320 bp处有明显短条带(图 1-A泳道1),用引物vcrD2-E/F扩增得3252 bp的完整片段(图 1-A泳道2),用vcrD1-pMMB-F/R (2146 bp)扩不出来目的片段(图 1-A泳道3),用vcrD2-pMMB-F/R(1902 bp)能扩增vcrD2的整个ORF片段(图 1-A泳道4),且用引物sacB-F/R没有扩增任何条带(图 1-A泳道5),证明已成功缺失vcrD1基因,且抗性质粒已凋亡;同理,用vcrD2-E/F引物扩增ΔvcrD2缺失株的vcrD2基因能得到缺失片段1365 bp,用引物vcrD2-pMMB-F/R未能扩增出片段,且用引物sacB-F/R没有任何条带,证明ΔvcrD2缺失株已成功缺失vcrD2基因;ΔvcrD1-vcrD2双缺失中vcrD1基因和vcrD2基因的扩增片段均为小片段,且未扩增出互补pMMB-FR片段和sacB片段,证明vcrD1-vcrD2双基因缺失成功。

|
| 图 1 副溶血弧菌ΔvcrD1、ΔvcrD2、ΔvcrD1-vcrD2基因缺失株及CΔvcrD1、CΔvcrD2互补株的鉴定 Figure 1 PCR identification of mutant and complement strains of V. parahaemolyticus. A1: ΔvcrD1, A2: ΔvcrD2, A3: ΔvcrD1-vcrD2. M: DL2000; lane 1–5: Primers of vcrD1-E/F, vcrD2-E/F, vcrD1-pMMB-F/R, vcrD2-pMMB-F/R, sacB-F/R. B1: CΔvcrD1, B2: CΔvcrD2. M: DL2000; lane 1–4: Primers of vcrD1-E/F, vcrD2-E/F, vcrD1-pMMB-F/R, vcrD2-pMMB-F/R. |
用引物vcrD1-pMMB-F/R、vcrD2-pMMB-F/R对CΔvcrD1、CΔvcrD2互补株进行鉴定,结果如图 1B。CΔvcrD1互补株能扩增出vcrD1-EF的缺失片段1320 bp (图 1-B泳道1)和vcrD1-pMMB-FR互补片段(图 1-B泳道3),同时也能扩增出vcrD2-EF (图 1-B泳道2)和vcrD2-pMMB-FR (图 1-B泳道4)的完整片段,说明在ΔvcrD1缺失株中vcrD1基因质粒已互补成功。同理,CΔvcrD2互补株的鉴定结果表明vcrD2基因互补成功。
各缺失株和互补株经连续培养20代后,通过以上PCR方法同样可扩增出相应片段,证明构建成功的缺失株和互补株具有较好的遗传稳定性。
2.2 生长曲线测定对缺失株ΔvcrD1、ΔvcrD2、ΔvcrD1-vcrD2和野生株WT以及互补株CΔvcrD1、CΔvcrD2的生长曲线分析表明(图 2),各缺失株的生长特性基本一致,无明显差异(P > 0.05)。

|
| 图 2 副溶血弧菌野生株、各缺失株及互补株的生长曲线图 Figure 2 The growth curve of the wild-type (WT) mutant strains (ΔvcrD1, ΔvcrD2, ΔvcrD1-vcrD2) and complement strains (CΔvcrD1, CΔvcrD2). The graph shows means standard errors of values originated from three independent assays. |
2.3 运动性测定
通过监测各菌株在运动培养基上的运动情况,结果显示,菌株在2 h开始从接种点向周围扩展运动,在4-5 h有明显的运动现象(图 3-A)。在4.5 h时,野生株、ΔvcrD2缺失株以及2个互补株均表现出明显的运动性,呈半透明圆形运动轨迹(图 3-B);同时,菌株圆形运动半径测量统计结果(图 3-C)表示,缺失株ΔvcrD1的运动能力明显降低(**,P≤0.01),为野生株的0.75倍,缺失株ΔvcrD2无显著性差异(P > 0.05),而双缺失株ΔvcrD1-vcrD2的运动性表现极显著抑制,仅为野生株的0.21倍(***,P≤0.001)。互补株CΔvcrD1和CΔvcrD2均恢复到野生株的运动能力。结果表明,vcrD1基因对副溶血弧菌的运动性起重要作用;vcrD2基因单独在副溶血弧菌的运动过程中无显著作用,但与vcrD1基因一起可对其运动性发挥协同作用。

|
| 图 3 各细菌株在0.3%琼脂LB平板的运动情况 Figure 3 The results of motilities of the strains in 0.3% agar-LB plates. A: Dynamic monitoring quantification of the motorial ability from 1 to 5 hours by measuring motility zone diameter (cm) made by the strains; B: The swimming patterns of various strains was exhibited in 0.3% agar-LB plates for 4.5 h; C: Motility zone diameter (cm) was used to compare the differences in the movement of the strains for 4.5 h. |
2.4 生物被膜测定
将各菌株经48 h温箱孵育,用结晶法检测生物被膜形成能力,结果显示(图 4),与野生株相比,缺失株ΔvcrD1和双缺失株ΔvcrD1-vcrD2生物被膜形成能力均显著下降(**,P≤0.01;***,P≤0.001),而缺失株ΔvcrD2的生物被膜形成能力则无显著差异(P > 0.05)。互补株CΔvcrD1、CΔvcrD2均恢复了细菌的生物被膜形成能力(P > 0.05)。此外,与缺失株ΔvcrD1相比,双缺失株ΔvcrD1-vcrD2的生物被膜形成能力进一步显著下降(*,P≤0.05)。结果表明,vcrD1基因在副溶血弧菌的生物被膜形成能力起重要作用,而vcrD2基因单独对细菌生物被膜无明显影响,但可协同增强vcrD1基因对副溶血弧菌在生物被膜形成方面的作用。

|
| 图 4 各菌株的生物被膜形成 Figure 4 Biofilm formation of the strains grown in 3% NaCl-LB at 48 hours by crystal violet staining. Data are analysed using two-way ANOVA and showed as the means±standard deviation from three independent experiments, meanwhile, differences in values between the wild-type and mutant strains, single gene deletion strains and double gene deletion strain were indicated with asterisks (*, P≤0.05; **, P≤0.01; ***, P≤0.001). |
2.5 细胞毒性测定
细胞毒性结果显示(图 5-A),以MOI=10:1感染Caco-2细胞1-3 h,缺失株ΔvcrD1和双缺失株ΔvcrD1-vcrD2较野生株均有显著降低(***,P≤0.001),在2 h时,仅为野生株的细胞毒性的0.27倍和0.17倍,而ΔvcrD2是野生株的0.91倍(*,P≤0.05)。在感染3 h时,ΔvcrD1和ΔvcrD2缺失株之间,以及ΔvcrD1缺失株和ΔvcrD1-vcrD2双缺失株之间均出现显著差异(**,P≤0.01;*,P≤0.05)。互补株CΔvcrD1、CΔvcrD2细胞毒性作用均恢复到野生株的水平(P > 0.05)。各菌株对RAW264.7巨噬细胞的细胞毒性的结果见图 5-B,与对Caco-2细胞细胞毒性的结果相似。研究表明,vcrD1和vcrD2基因对副溶血弧菌在细胞毒性方面均有显著影响,且具有协同作用,其中vcrD1基因为主导作用。
|
| 图 5 各细菌株细胞毒性的比较 Figure 5 Comparison of cytotoxic effects of the strains. With Caco-2 cells (A) and RAW264.7 macrophages (B) attacked by the strains at an MOI (1:10) for 1–3 h, the cytoplasmic LDH release were collected and measured with the CytoTox 96 Non-Radioactive Cytotoxicity Assay. Statistically significant differences were indicated with asterisks (*, P≤0.05; **, P≤0.01; ***, P≤0.001). |
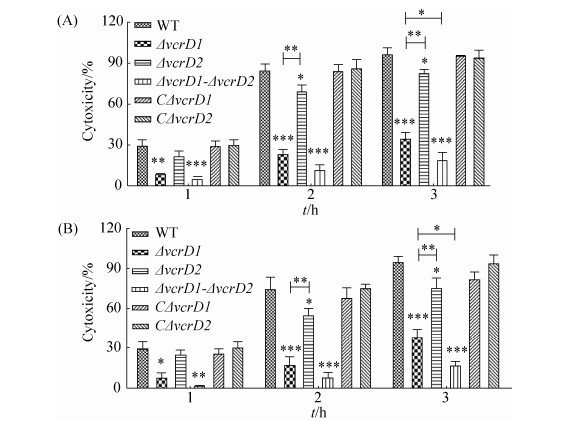
2.6 细胞因子mRNA水平转录情况
各菌株对RAW264.7巨噬细胞炎性因子IL-1β和IL-6的mRNA转录水平分析显示(图 6),与野生株相比,缺失株ΔvcrD2的IL-1β和IL-6炎性因子的转录表达水平显著性增强(***,P≤0.001);而缺失株ΔvcrD1和双缺失株ΔvcrD1-vcrD2引起炎性因子的转录水平均无明显变化(P > 0.05);互补株CΔvcrD1、CΔvcrD2均恢复到野生株水平(P > 0.05)。结果表明,缺失vcrD2基因能显著上调副溶血弧菌对靶细胞炎性因子IL-1β、IL-6的表达,缺失vcrD1基因则无显著作用,同时缺失vcrD2和vcrD1基因对宿主细胞炎性因子的表达水平也无显著影响,提示T3SS2在抑制宿主细胞免疫应答水平上起主导作用。
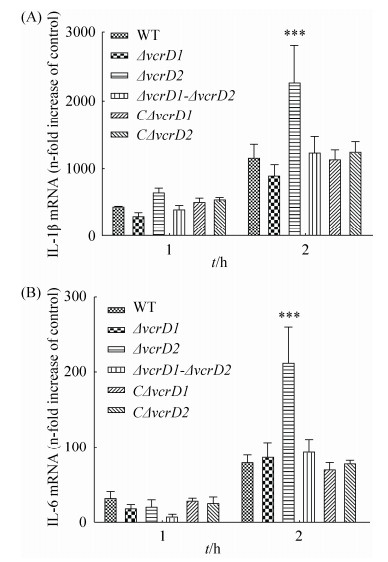
|
| 图 6 各缺失株诱导RAW264.7巨噬细胞炎性因子相对表达的差异 Figure 6 Differences of V. parahaemolyticus-induced cytokine expressions in RAW264.7 macrophages. Infected with the strains at an MOI of 10:1, RAW264.7 macrophages were harvested at 1 h and 2 h, and the cytokine expression of IL-1β (A) and IL-6 (B) were measured by Real-time PCR. Data analyses were performed using two-way ANOVA to evaluate the statistical significance of the results (***, P≤0.001). |
3 讨论
自2002年Tagomori K[19]等发现副溶血弧菌有两套Ⅲ型分泌系统以来,研究表明T3SS1系统主要发挥对宿主细胞的细胞毒性,介导宿主细胞自噬凋亡等作用[9],而T3SS2系统可增加细菌感染的组织受损程度和回肠积液量,具有肠毒性作用[15, 20]。然而,关于这两个系统在细菌运动性、生物被膜形成等生物学特性和致炎作用中的差异和相关性的研究报道甚少。本文选用副溶血弧菌T3SSs分泌系统内膜蛋白基因vcrD1和vcrD2作为研究对象,分析单基因和双基因缺失株的生物学特性和细胞致病性,进而深入探究T3SS1和T3SS2之间的功能关系。
生物被膜是细菌为适应环境而聚集形成的一种膜样物,被黏性基质包裹的菌体对抗生素及宿主免疫等不利因素有较强的抵抗能力,从而有利于细菌的生存及致病性[21]。弧菌的运动性主要与鞭毛系统有关,在细菌感染宿主的粘附、侵入及扩散过程中起至关重要的作用[22-23]。本文研究结果显示,vcrD1基因缺失能够显著降低副溶血弧菌的运动性和生物被膜形成能力,vcrD2基因缺失则对运动性和生物被膜形成能力无显著影响。结果提示,在副溶血弧菌环境存活中起主要作用的是T3SS1。我们在vcrD2基因缺失的基础上进一步缺失vcrD1基因,结果发现双基因缺失株的运动和生物被膜形成能力均表现为极显著降低,且显著低于ΔvcrD1缺失株,研究结果表明,T3SS2可协同增强T3SS1在生物特性中的功能,发挥间接作用。
副溶血弧菌感染宿主后,主要引起组织细胞裂解受损等细胞毒性作用,进而有利于细菌在体内繁殖扩散。我们通过细胞毒性试验发现,vcrD1和vcrD2基因的缺失均可影响副溶血弧菌对Caco-2细胞和RAW264.7巨噬细胞的细胞毒性作用,但T3SS1和T3SS2对细胞产生毒性的能力不同,且有显著差异,其中T3SS1对宿主细胞产生显著的细胞毒性作用,而T3SS2起较弱的毒性作用,结果表明在副溶血弧菌对细胞产生毒性作用的过程中,T3SS1起主要作用,与已有研究报道结果相似[14, 20]。我们进一步研究发现,vcrD1和vcrD2双基因缺失株的细胞毒性作用在单基因缺失株的基础上进一步降低,提示在细胞毒性作用中T3SS1起主要作用,且T3SS2与T3SS1可能存在协同作用。
巨噬细胞主要通过IL-1、IL-6、IL-12、TNF-α等炎性因子发挥免疫细胞募集、共刺激分子调控和B/T细胞亚群分化中的作用,进而调节宿主炎症反应和免疫反应[24]。本研究利用RAW264.7巨噬细胞来检测不同菌株诱导宿主细胞因子的转录水平的情况。结果发现,vcrD2能显著抑制巨噬细胞炎性因子IL-1β和IL-6的表达水平,提示T3SS2能够抑制宿主的炎性反应及免疫应答反应,从而利于细菌在宿主体内的免疫逃避及生存,进而产生致病作用[25]。vcrD1并未影响宿主细胞因子的表达水平,然而,双基因缺失株ΔvcrD1-vcrD2并没有同单基因缺失株ΔvcrD2一样表现为抑制宿主细胞因子的转录水平,表明T3SS1虽不直接参与宿主免疫反应,但可能影响T3SS2发挥免疫逃避作用。以上研究进一步提示尽管副溶血性弧菌T3SS1和T3SS2在引起宿主炎症反应中发挥不同的作用,然而两者之间存在着紧密的联系。
本研究通过对T3SSs中vcrD1和vcrD2的单基因缺失株及双基因缺失株进行生物学分析,表明T3SS1和T3SS2在环境适应性和细胞致病中扮演不同的角色,但两者之间存在一定的协同关系。另有研究表明某些副溶血弧菌菌株T3SS1和T3SS2的基因在不同温度条件下表达量存在一定的差异,副溶血弧菌ATCC17802菌株的vcrD1基因在16 ℃表达量最高,vcrD2β基因在25 ℃表达量最高;而副溶血弧菌JA21菌株的vcrD1基因和vcrD2β基因均在25 ℃表达量最高[26]。本文试验对副溶血弧菌的培养温度均为37 ℃ (模拟人体温度),vcrD1基因和vcrD2基因对副溶血弧菌生物学特性和细胞致病性中的不同作用是否与温度有关,有待进一步研究。值得注意的是,有报道显示T3SS1存在于副溶血性弧菌所有的分离株中,而T3SS2仅在致病性临床株(KP阳性)中[27],并有研究推测T3SS1单独不足以引起人类发病,但可协同其他毒力因子产生致病作用[9]。结合本研究结果推测,副溶血弧菌可通过T3SS1和T3SS2之间的协助作用,增强致病菌株对环境的适应能力和细胞致病作用。本文为探明副溶血弧菌T3SS1和T3SS2分泌系统的致病机制提供重要依据,然而对副溶血弧菌T3SS1和T3SS2功能关系的研究仍然浅显,亟需深入系统地研究具体机制。
| [1] | Tran L, Nunan L, Redman RM, Mohney LL, Pantoja CR, Fitzsimmons K, Lightner DV. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 2013, 105(1): 45-55. DOI:10.3354/dao02621 |
| [2] | Wang RZ, Fang S, Wu DL, Lian JW, Fan J, Zhang YF, Wang SH, Lin WX. Screening for a single-chain variable-fragment antibody that can effectively neutralize the cytotoxicity of the Vibrio parahaemolyticus thermolabile hemolysin. Applied and Environment Microbiology, 2012, 78(14): 4967-4975. DOI:10.1128/AEM.00435-12 |
| [3] | Yu Y, Fang LH, Zhang Y, Sheng HX, Fang WH. VgrG2 of type Ⅵ secretion system 2 of Vibrio parahaemolyticus induces autophagy in macrophages. Frontiers in Microbiology, 2015, 6: 168. |
| [4] | Matsuda S, Kodama T, Okada N, Okayama K, Honda T, Iida T. Association of Vibrio parahaemolyticus thermostable direct hemolysin with lipid rafts is essential for cytotoxicity but not hemolytic activity. Infection and Immunity, 2010, 78(2): 603-610. DOI:10.1128/IAI.00946-09 |
| [5] | Takahashi A, Kenjyo N, Imura K, Myonsun Y, Honda T. Cl- secretion in colonic epithelial cells induced by the Vibrio parahaemolyticus hemolytic toxin related to thermostable direct hemolysin. Infection and Immunity, 2000, 68(9): 5435-5438. DOI:10.1128/IAI.68.9.5435-5438.2000 |
| [6] | Raghunath P. Roles of thermostable direct hemolysin (TDH) and TDH-related hemolysin (TRH) in Vibrio parahaemolyticus. Frontiers in Microbiology, 2015, 5: 805. |
| [7] | Cornelis GR. The type Ⅲ secretion injectisome. Nature Reviews Microbiology, 2006, 4(11): 811-825. DOI:10.1038/nrmicro1526 |
| [8] | Ono T, Park KS, Ueta M, Iida T, Honda T. Identification of proteins secreted via Vibrio parahaemolyticus type Ⅲ secretion system. Infection and Immunity, 2006, 74(2): 1032-1042. DOI:10.1128/IAI.74.2.1032-1042.2006 |
| [9] | Zhou XH, Konkel ME, Call DR. Type Ⅲ secretion system 1 of Vibrio parahaemolyticus induces oncosis in both epithelial and monocytic cell lines. Microbiology, 2009, 155(3): 837-851. DOI:10.1099/mic.0.024919-0 |
| [10] | Bhattacharjee RN, Park KS, Kumagai Y, Okada K, Yamamoto M, Uematsu S, Matsui K, Kumar H, Kawai T, Iida T, Honda T, Takeuchi O, Akira S. VP1686, a Vibrio type Ⅲ secretion protein, induces toll-like receptor-independent apoptosis in macrophage through NF-κB inhibition. The Journal of Biological Chemistry, 2006, 281(48): 36897-36904. DOI:10.1074/jbc.M605493200 |
| [11] | Kodama T, Hiyoshi H, Okada R, Matsuda S, Gotoh K, Iida T. Regulation of Vibrio parahaemolyticus T3SS2 gene expression and function of T3SS2 effectors that modulate actin cytoskeleton. Cellular Microbiology, 2015, 17(2): 183-190. DOI:10.1111/cmi.12408 |
| [12] | Paranjpye R, Hamel OS, Stojanovski A, Liermann M. Genetic diversity of clinical and environmental Vibrio parahaemolyticus strains from the Pacific Northwest. Applied and Environmental Microbiology, 2012, 78(24): 8631-8638. DOI:10.1128/AEM.01531-12 |
| [13] | Ham H, Orth K. The role of type Ⅲ secretion system 2 in Vibrio parahaemolyticus pathogenicity. Journal of Microbiology, 2012, 50(5): 719-725. DOI:10.1007/s12275-012-2550-2 |
| [14] | Hiyoshi H, Kodama T, Iida T, Honda T. Contribution of Vibrio parahaemolyticus virulence factors to cytotoxicity, enterotoxicity, and lethality in mice. Infection and Immunity, 2010, 78(4): 1772-1780. DOI:10.1128/IAI.01051-09 |
| [15] | Piñeyro P, Zhou XH, Orfe LH, Friel PJ, Lahmers K, Call DR. Development of two animal models to study the function of Vibrio parahaemolyticus type Ⅲ secretion systems. Infection and Immunity, 2010, 78(11): 4551-4559. DOI:10.1128/IAI.00461-10 |
| [16] | Mala W, Alam M, Angkititrakul S, Wongwajana S, Lulitanond V, Huttayananont S, Kaewkes W, Faksri K, Chomvarin C. Serogroup, virulence, and molecular traits of Vibrio parahaemolyticus isolated from clinical and cockle sources in northeastern Thailand. Infection, Genetics and Evolution, 2016, 39: 212-218. DOI:10.1016/j.meegid.2016.01.006 |
| [17] | Noh HJ, Nagami S, Kim MJ, Kim J, Lee NK, Lee KH, Park SJ. Role of vcrD1 protein in expression and secretion of flagellar components in Vibrio parahaemolyticus. Archives of Microbiology, 2015, 197(3): 397-410. DOI:10.1007/s00203-014-1069-9 |
| [18] | Wang ZF, Guo CM, Xu YN, Liu GJ, Lu CP, Liu YJ. Two novel functions of hyaluronidase from Streptococcus agalactiae are enhanced intracellular survival and inhibition of proinflammatory cytokine expression. Infection and Immunity, 2014, 82(6): 2615-2625. DOI:10.1128/IAI.00022-14 |
| [19] | Tagomori K, Iida T, Honda T. Comparison of genome structures of vibrios, bacteria possessing two chromosomes. Journal of Bacteriology, 2002, 184(16): 4351-4358. DOI:10.1128/JB.184.16.4351-4358.2002 |
| [20] | Park KS, Ono T, Rokuda M, Jang MH, Jang MH, Okada K, Iida T, Honda T. Functional characterization of two type Ⅲ secretion systems of Vibrio parahaemolyticus. Infection and Immunity, 2004, 72(11): 6659-6665. DOI:10.1128/IAI.72.11.6659-6665.2004 |
| [21] | Shafique M, Alvi IA, Abbas Z, Ur Rehman S. Assessment of biofilm removal capacity of a broad host range bacteriophage JHP against Pseudomonas aeruginosa. Acta Pathologica, Microbiologica et Iimmuologica Scandinavica, 2017, 125(6): 579-584. DOI:10.1111/apm.2017.125.issue-6 |
| [22] | Chaban B, Hughes HV, Beeby M. The flagellum in bacterial pathogens:for motility and a whole lot more. Seminars in Cell & Developmental Biology, 2015, 46: 91-103. |
| [23] | Josenhans C, Suerbaum S. The role of motility as a virulence factor in bacteria. International Journal of Medical Microbiology, 2002, 291(8): 605-614. DOI:10.1078/1438-4221-00173 |
| [24] | Martinez FO, Helming L, Gordon S. Alternative activation of macrophages:an immunologic functional perspective. Annual Review of Immunology, 2009, 27: 451-483. DOI:10.1146/annurev.immunol.021908.132532 |
| [25] | Zhu Q, Li C, Yu ZX, Zou PF, Meng QX, Yao CL. Molecular and immune response characterizations of IL-6 in large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology, 2016, 50: 263-273. |
| [26] |
Ding XY, Qu LY, Wang C, Tian XX, Sun CJ, Wang MQ. Effect of temperature on T3SS gene expression of Vibrio parahaemolyticus. Advances in Marine Science, 2016, 34(2): 250-259.
(in Chinese) 丁晓燕, 曲凌云, 王琛, 田欣欣, 孙承君, 王敏强. 温度对副溶血弧菌T3SS中相关基因表达的影响. 海洋科学进展, 2016, 34(2): 250-259. |
| [27] | Makino K, Oshima K, Kurokawa K, Yokoyama K, Uda T, Tagomori K, Iijima Y, Najima M, Nakano M, Yamashita A, Kubota Y, Kimura S, Yasunaga T, Honda T, Shinagawa H, Hattori M, Iida T. Genome sequence of Vibrio parahaemolyticus:a pathogenic mechanism distinct from that of V. cholerae. The Lancet, 2003, 361(9359): 743-749. DOI:10.1016/S0140-6736(03)12659-1 |
 2018, Vol. 58
2018, Vol. 58