中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张彤彤, 耿增超, 许晨阳, 张晓鹏, 杜璨, 王志康, 王强, 韩欢, 林云. 2018
- Tongtong Zhang, Zengchao Geng, Chenyang Xu, Xiaopeng Zhang, Can Du, Zhikang Wang, Qiang Wang, Huan Han, Yun Lin. 2018
- 秦岭辛家山林区落叶松外生菌根真菌多样性
- Diversity of ectomycorrhizal fungi associated with Larixg melinii in Xinjiashan forest region of Qinling Mountains
- 微生物学报, 58(3): 443-454
- Acta Microbiologica Sinica, 58(3): 443-454
-
文章历史
- 收稿日期:2017-05-06
- 修回日期:2017-06-17
- 网络出版日期:2017-07-21
2. 宝鸡市林业调查规划院, 陕西 宝鸡 721700
2. Baoji Institute of Forestry Investigation and Planning, Baoji 721700, Shaanxi Province, China
外生菌根真菌(Ectomycorrhizal fungi,EMF)作为森林生态系统的重要组分,在植物定殖伊始就与树木形成了共生体系。外生菌根真菌参与凋落物的酶降解过程,影响有机物的循环[1],降低根际土的pH,促进土壤矿物中速效态P、K的释放[2],增加Ca2+、Mg2+等离子的有效性[3-4]。而外生菌根的形成受土壤条件、季节变化、地理条件以及宿主植物等因子的影响[5]。外生菌根真菌具有丰富的物种多样性,是维持生态系统多样性及其功能多样性的一个重要因素[6]。有研究表明,外生菌根形成增强了华山松的抗逆性,提高单株平均干质量[7];提高了油松苗木质量[8];显著提高了湿地松成活率,增加了松苗叶绿素含量,并增加了根际细菌及放线菌数量[9]。据保守估计,全球约有20000-25000种[10],其中我国已报道40科、80属、500余种[11-12],根据已知真菌数约占自然界存在数量的5%计算,还有大量的外生菌根真菌有待发现[13]。
落叶松(Larix gmelinii)生长迅速,在各种苛刻的生境条件下具有很高的生物群落稳定性,是主要用材树种及我国北方速生造林和更新树种,具有重要的生态服务功能和经济价值[14]。我国早期对落叶松外生菌根真菌的研究主要集中于子实体的形态学鉴定,张茹琴等鉴定出秦岭火地塘地区落叶松外生菌根真菌5种[15];栾庆书等对辽宁省落叶松外生菌根真菌进行了调查[16];白淑兰等对大青山落叶松外生菌根真菌进行了研究[2]。然而,落叶松地下外生菌根真菌多样性的研究并未见报道,能产生子实体的外生菌根真菌只占菌根真菌总种类的10%左右[17],且分子标记方法被应用到菌种鉴定中,为准确描述地下外生菌根真菌多样性研究提供了良好的工具。本研究结合形态学和分子生物学方法对秦岭辛家山林区落叶松地下外生菌根真菌进行了种类鉴定,并分析其对根际土化学性质的影响以及根际土的化学性质与外生菌根侵染率之间的相互关系,比较了不同条件下(阴坡、阳坡)外生菌根真菌的多样性,补充了对落叶松外生菌根真菌资源的认识,为优良菌株筛选及其在不同环境条件下造林中的应用提供参考依据。
1 材料和方法 1.1 调查地概况调查样地位于陕西省宝鸡市秦岭辛家山的通天河国家森林公园,属于暖温带半湿润山地气候。该地区年均气温10.7 ℃,年均降雨量1097 mm,多集中于7、8、9月。土壤类型均为棕壤。该地区自然植被以天然次生林群落为主,乔木主要有云杉(Picea asperata Mast.)、冷杉(Abies fabri Craib)、油松(Pinus tabulaeformis Carr.)、红桦(Betula albosinensis Burkill)、锐齿栎(Quercus aliena var. acuteserrata)、辽东桦(Betula schmidtii Regel)、华山松(Pinus armandii Franch)、漆树(Toxicodendron vernicifluum F. A. Barkl.)、山杨(Populus davidiana Dode)、鹅耳栎(Carpinus turczaninowiiHance)等;灌木主要有悬钩子(Rubus corchorifoliusL.f.)、栓翅卫矛(Euonymus phellomanes Loes)等;草本主要有龙芽草(Agrimonia pilosa Ldb.)、异叶败酱(Patrinia heterophylla Bunge)、艾蒿(Artemisia argyi Levl.)、茜草(Rubia cordifolia Linn.)、披针叶苔草(Carex lanceolata Boott)。
1.2 样品的采集和处理2016年8月13日在调查地选择具有代表性的落叶松纯林(天然次生林),为保证研究样地阴坡和阳坡林分之间的可比性,选取林分其他条件(表 1)相似的样地1和样地2,两个样地面积均为20 m×20 m。每个样地随机选取落叶松25棵,测量每棵树胸高处周长。采根样时,首先要用小铁锹轻轻除去表层的杂物,到须根出现。然后沿着树种的根部轻轻挖到根的末级,用剪刀将根剪断,依据外生菌根真菌侵染后根的特征选取细根,取距根表小于5 mm的土壤样品作为根际土共50袋(每袋大约500 g),剪取约15 cm长3-4个根段装入塑料袋中并编号,装入一定的鲜土用以保鲜根样,共计50袋(每袋大约1000 g),采回后置于0-4 ℃冰箱保存待测。非根际土样采集(0-20 cm) 50袋,置于通风、阴凉、干燥的室内风干,以四分法取样磨细并过筛(孔径:2.00 mm、1.00 mm、0.25 mm)备用。
| Site | DBH/cm | Longitude | Latitude | Elevation/m | Aspect | Gradient | Canopy density | Soil type |
| 1 | 22.7 | 106°34'59.28" | 34°12' 50.93" | 1632 | Shady slope | 15-20° | 0.87 | Brown earth |
| 2 | 25.4 | 106°34'56.36" | 34°12' 52.07" | 1621 | Sunny slope | 20-25° | 0.78 | Brown earth |
1.3 外生菌根的鉴定 1.3.1 外生菌根形态观察: 从样品袋中轻轻取出根以免撞落菌根,置于筛子中用自来水小心地清洗表面沙土和杂物,洗净后剪成长约9 cm的根段放入培养皿中,并盛入一定的自来水,置于体视显微镜下观察,利用电脑显微照相系统拍照,记录菌根的形状、颜色、分叉、有无菌丝等情况,初步划分菌根的种类。同时选取每种菌根中新鲜、幼嫩、纯净的6-8个菌根分别装入2 mL离心管,然后放入55 ℃烘箱中干燥,最后置于0-4 ℃冰箱保存,用于分子鉴定。在观察的过程中同时用计数器记录根尖总数和每一种菌根侵染根尖的数量,计算菌根侵染率。 1.3.2 分子鉴定: 采用改进的十六烷基三甲基溴化铵(CTAB)法提取外生菌根DNA[18]。首先用高通量组织破碎仪(振荡频率为1800次/min)破碎外生菌根。在离心管中加入1个氧化锆球和50 μL CTAB溶液[2% CTAB,1 mol/L Tris-HCl (pH 8.0),0.5 mol/L EDTA (pH 8.0),1.4 mol/L NaCl,0.5% β-巯基乙醇]进行破碎,破碎后高速冷冻离心(离心力为21382×g)。再加入350 μL CTAB溶液进行二次破碎、二次离心。离心管放入65 ℃水浴锅水浴1 h,在水浴过程中每隔10 min振荡离心管1次。水浴后加入CIA溶液(氯仿:异戊醇=24:1) 400 μL猛力振荡萃取。离心后将上清液转移到1.5 mL离心管中,分别加入400 μL异丙醇沉淀DNA和500 μL 80%乙醇清洗DNA后离心,去除离心管上部溶液,倒置离心管于桌面上干燥。待离心管完全干燥后加入30 μL ddH2O溶解DNA后存储于0-4 ℃冰箱中待用。
用真菌通用引物ITS1和ITS4-B[19]进行菌根rDNA ITS的PCR扩增,反应体系15 μL:2×Taq master mix (含有TaqDNA聚合酶、dNTPs、标准Taq酶反应缓冲液、酶稳定剂和溴酚蓝染料)、前后引物、ddH2O、模板DNA。PCR反应条件为:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸2 min。取PCR扩增产物3 μL,经电泳和凝胶成像系统检测,合格的PCR扩增产物用于测序。测序均由生工生物工程(上海)股份有限公司完成。
1.4 土壤化学指标的测定土壤各项理化指标的测定均采用常规方法。土壤pH采用电位法(水:土=2.5:1.0)测定;土壤全氮含量采用半微量凯氏法测定;速效磷测定采用0.5 mol/L碳酸氢钠-钼锑抗比色法测定法;速效钾测定采用1 mol/L乙酸铵浸提-火焰光度法;有机质测定采用重铬酸钾容量法-外加热法;水溶性钠和钾测定采用火焰光度法;水溶性钙、镁测定采用原子吸收分光光度法。
1.5 数据分析 1.5.1 外生菌根真菌鉴定: 测序结果采用DNA star软件进行图谱分析,对序列进行人工校对,校正后的序列运用GenBank的序列局部相似性查询系统(BLAST)和UNITE数据库进行DNA序列对比并下载同源序列。将下载的同源序列和测定序列用Clustal X进行分析,采用MEGA 5.0软件包中的Kimura2-Parameter Distance模型进行序列匹配,用邻接法(Neighbor-Joining)构建系统发育树,自展值(Bootstrap)为1000[20]。 1.5.2 外生菌根真菌优势度及优势类群表示方法: 本实验用重要值(Important value)表示物种优势度,即相对多度(公式1)和相对频度(公式2)之和。重要值越大,优势度越高。

|
公式(1) |

|
公式(2) |
定义“优势种”为在≥80%的样本(40份样本)中被检测到的外生菌根真菌;“常见种”为在≥30%的样本(15份样本)中被检测到的外生菌根真菌;“稀有种”为在 < 30%的样本(15份样本)中被检测到的外生菌根真菌。
1.5.3 外生菌根真菌多样性表示方法: 本实验用α多样性测度方法表示落叶松外生菌根真菌多样性[21]。根据鉴定结果,对落叶松外生菌根真菌的Simpson优势度指数(D,公式3)、Shannon多样性指数(H',公式4)、Pielou均匀度指数(J,公式5)、Jaccad相似性系数(Cj,公式6)分别进行计算。

|
公式(3) |
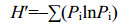
|
公式(4) |

|
公式(5) |

|
公式(6) |
其中,Pi为菌根i的相对重要值;S为每个样地检测出菌根菌种类数;j为样地1和样地2检测出的共有菌根菌种类数;a为样地1检测出菌根菌种类数;b为样地2检测出菌根菌种类数。
1.5.4 外生菌根真菌侵染率: 外生菌根真菌侵染率按照公式(7)进行计算。

|
公式(7) |
通过显微镜对被侵染根尖进行宏观形态观察发现(图 1),菌根顶端膨大粗壮,主要为单轴、二叉分支及多分支,菌根形态呈塔状、珊瑚状和鹿角状。少部分外生菌根具有外延菌丝和根状菌索,而且外延菌丝大多较细,呈绒毛状,一般为白色或黑色。不同属之间颜色、形态存在差异,如B红菇属(Russula sp.)、C乳菇属(Lactarius sp.)、D蜡蘑属(Laccaria sp.)、E丝伞盖属(Inocybe sp.)、M蜡壳耳属(Sebacina sp.)、N(Amphinema)、H丝膜菌属(Cortinarius)、P毛革菌属(Tomentella)的形态、颜色各异;同一属不同种之间颜色、形态存在差异,如E、I、G、K、O丝盖伞属(Inocybe)。

|
| 图 1 不同类型外生菌根形态学特征 Figure 1 Morphological features of different ectomycorrhizal fungi. A: Thelephorales; B: Russula sp.; C: Lactarius 1; D: Laccaria sp.; E: Inocybe 1; F: Hygrophoraceae; G: Helotiales; H: Cortinarius sp.; I: Inocybe posterula; J: Inocybe 2; K: Inocybe geophylla; L: EMF5; M: Sebacinasp.; N: Amphinemab yssoides; O: Inocybe 3; P: Tomentell asubtestacea. |
2.2 落叶松外生菌根真菌的种类组成及优势度
系统发育分析与相似性序列比较得出(表 2,图 2),落叶松外生菌根真菌与毛革菌属(Tomentella)、丝盖伞属(Inocybe)、红菇属(Russula)、Amphinema、蜡蘑属(Laccaria)、蜡壳耳属(Sebacina)、鹅膏菌属(Amanita)、牛肝菌属(Boletus)、丝膜菌属(Cortinarius)、乳菇属(Lactarius)、硬皮马勃属(Scleroderma)之间的相似性最近。其中18个样本与GenBank中已知序列的相似性≥97%,14个样本与同源序列相似性 < 97%。
| GenBank accession No. | Nearest type strain (accession No.) | Classified as (OTUs) | Similarity/% | Important value/% | No. |
| KY856777 | Amphinema byssoides (JX907809) | Amphinema byssoides | 98 | 24.86 | 15 |
| KY882556 | Amanita (AB848402) | Amanita | 97 | 4.96 | 3 |
| KY882557 | Boletus (KC422625) | Boletus 1 | 99 | 6.67 | 3 |
| KY882558 | Boletus reticulatus (AB821462) | Boletus 2 | 95 | 11.64 | 6 |
| KY882559 | Cortinarius (UDB025825) | Cortinarius sp. | 99 | 5.76 | 4 |
| KY882560 | Hygrophoraceae (KM588774) | Hygrophoraceae | 94 | 3.31 | 2 |
| KY856775 | Uncultured Inocybe (HM044545) | Inocybe 1 | 98 | 12.13 | 2 |
| KY856776 | Inocybe cincinnata var. major (HQ703020) | Inocybe cincinnata var. major | 98 | 10.61 | 3 |
| KY856787 | Inocybe geophylla (HQ604300) | Inocybe geophylla | 98 | 38.06 | 23 |
| KY856791 | 97 | ||||
| KY856790 | Inocybe posterula (HQ604298) | Inocybe posterula | 98 | 15.69 | 10 |
| KY856769 | Uncultured Inocybe (KX444427) | Inocybe 2 | 99 | 24.25 | 16 |
| KY856792 | |||||
| KY856770 | |||||
| KY856793 | Inocybe geophylla (HQ604292) | Inocybe 3 | 94 | 51.53 | 34 |
| KY856771 | |||||
| KY856772 | |||||
| KY856773 | |||||
| KY856774 | Inocybe auricoma (HQ604526) | Inocybe 4 | 94 | 34.67 | 21 |
| KY856788 | Uncultured Inocybe (KF617340) | Inocybe 5 | 99 | 4.96 | 3 |
| KY856789 | Inocybe sp. YF-2013a (KF219672) | Inocybe sp. YF-2013a | 99 | 16.55 | 10 |
| KY882561 | Laccaria negrimarginata (JX504120) | Laccaria | 90 | 26.48 | 16 |
| KY882562 | Lactarius sp. A54 (AJ534900) | Lactarius 1 | 99 | 19.11 | 10 |
| KY882563 | Uncultured Lactarius (KF617662) | Lactarius 2 | 96 | 6.62 | 4 |
| KY882564 | Scleroderma sp. (JX434679) | Scleroderma sp. | 99 | 5.87 | 2 |
| KY856781 | Uncultured Sebacina (HQ154328) | Sebacina sp. | 99 | 12.13 | 8 |
| KY856784 | Uncultured Tomentella (JQ346863) | Tomentella 1 | 98 | 17.28 | 10 |
| KY856785 | Tomentella subtestacea (JQ711878) | Tomentella subtestacea | 97 | 13.64 | 9 |
| KY856779 | Tomentella (UDB007549) | Tomentella 2 | 95 | 4.45 | 2 |
| KY856794 | Russula (KC965868) | Russula sp. | 92 | 5.20 | 2 |
| KY856798 | Russulaceae (JX630968) | EMF1 | 86 | 1.65 | 1 |
| KY882565 | Tricholomataceae (LC035207) | Tricholomataceae | 92 | 3.31 | 2 |
| KY882566 | Helotiales (EU292504) | Helotiales | 99 | 4.96 | 3 |
| KY856782 | Tomentella (UDB027167) | EMF2 | 83 | 5.26 | 3 |
| KY856778 | Uncultured Thelephoraceae (KR935496) | EMF3 | 77 | 3.03 | 2 |
| KY856780 | Uncultured Thelephoraceae (KM588815) | EMF4 | 75 | 2.22 | 1 |
| KY856783 | Tomentella (UDB007549) | EMF5 | 73 | 6.06 | 4 |

|
| 图 2 基于ITS序列构建的落叶松外生菌根真菌NJ系统发育树 Figure 2 NJ phylogenetic tree of ectomycorrhizal fungi of Larix gmelinii based on ITS sequences. The serial number in parentheses represents GenBank accession No.. The results of 1000 maximum likelihood bootstrap replicates are shown above the lines. The scale bar represents changes per sequence position. |
Inocybe3优势度最高为51.53%,在34份(< 40)样本中检测到。其他依次是Inocybe geophylla、Inocybe 4、Laccaria、Amphinema byssoides、Inocybe 2,优势度分别为38.06%、34.67%、26.48%、24.86%、24.25%,分别在23、21、16、15、16份(≥15)样本中被检测到。其余24种优势度均不高,在2.22%和19.11%之间,这24种均在 < 15份样本中被检测到(表 2)。
2.3 菌根根际土与非根际土化学性质的比较由表 3可知,两样地根际土pH、有机质、全氮、速效磷、速效钾及水溶性盐离子(Ca2+、Mg2+)与非根际土均存在差异,说明菌根真菌对其均有一定影响。其中,根际土pH均显著低于非根际土;根际土有机质含量均高于非根际,但差异不显著;样地1根际土全氮高于非根际土, 但差异并不显著;样地2根际土全氮含量显著高于非根际土;根际土速效钾和速效磷含量均显著高于非根际土;根际土水溶性钙、水溶性镁含量均高于非根际土的,但差异均不显著。
| Soil chemical properties | Site 1 (n=25) | Site 2 (n=25) | |||
| Mycorrhizosphere soil | Non-mycorrhizosphere soil | Mycorrhizosphere soil | Non-mycorrhizosphere soil | ||
| pH | 5.31±0.12a | 5.83 ±0.05b | 4.77 ±0.07a | 5.65 ±0.11b | |
| Organic matter/(g/kg) | 79.18±5.47a | 69.41±5.85a | 71.75±8.37a | 63.61±1.01a | |
| Total nitrogen/(g/kg) | 4.97±0.30a | 4.79±0.06a | 5.70±0.24a | 4.75±0.11b | |
| Available phosphorus/(mg/kg) | 7.56±0.72a | 6.22±0.88b | 7.23±0.66a | 6.09±0.75b | |
| Available potassium/(mg/kg) | 194.91±6.44a | 144.80±13.42b | 205.06±7.76a | 140.63±10.67b | |
| Soluble calcium/(g/kg) | 0.06±0.01a | 0.05±0.03a | 0.07±0.01a | 0.05±0.00a | |
| Soluble magnesium/(g/kg) | 0.03±0. 01a | 0.02±0.02a | 0.03±0.02a | 0.02±0.01a | |
| Different letters in a row for one specific site mean significant differences (P < 0.05). The numbers behind “±” mean standard errors. | |||||
2.4 落叶松外生菌根真菌的多样性
由表 4可以看出,落叶松两样地外生菌根真菌的丰富度指数、Simpson优势度指数、Shannon多样性指数和Pielou均匀指数均存在差异。除Pielou均匀指数样地1大于样地2外,丰富度指数、Simpson优势度指数、Shannon多样性指数均样地2大于样地1,说明样地2菌根真菌多样性高于样地1,但样地1外生菌根真菌分布更均匀。同时,两样地相似性系数Jaccard为0.35,相似度低,进一步说明不同坡向对外生菌根真菌多样性具有一定影响。
| Diversity indices | Site 1 | Site 2 |
| Richness index | 14.00 | 17.00 |
| Simpson index | 0.59 | 0.66 |
| Shannon index | 3.38 | 3.46 |
| Pielou evenness index | 0.24 | 0.20 |
| Infection rate | 0.14 | 0.19 |
| Jaccard index | 0.35 | 0.35 |
2.5 落叶松外生菌根侵染率及其与根际土壤化学性质相关性
样地1和样地2侵染率存在差异,且样地2侵染率高于样地1 (表 4)。对落叶松外生菌根侵染率与根际土壤化学性质的相关分析结果表明,落叶松外生菌根侵染率与土壤pH值呈显著正相关;与速效钾呈极显著正相关性;与全氮、速效磷呈显著负相关;与有机质、水溶性钙和水溶性镁无显著相关性(表 5)。
| Soil chemical properties | Correlation coefficients with infection rate |
| pH | 0.480* |
| Organic matter | 0.332 |
| Total nitrogen | –0.527* |
| Available phosphorus | –0.552* |
| Available potassium | 0.527** |
| Soluble calcium | 0.610 |
| Soluble magnesium | 0.663 |
| ** and * indicate significant differences at 0.01 and 0.05 levels, respectively. | |
3 讨论
本研究结合形态学观察和ITS序列鉴定方法,对秦岭辛家山林区落叶松外生菌根真菌多样性进行调查研究,研究结果表明,与落叶松共生的外生菌根真菌有31种,分属2门4目11科11属,分别有毛革菌属(Tomentella)、丝盖伞属(Inocybe)、红菇属(Russula)、蜡蘑属(Laccaria)、蜡壳耳属(Sebacina)、Amphinema、鹅膏菌属(Amanita)、牛肝菌属(Boletus)、丝膜菌属(Cortinarius)、乳菇属(Lactarius)、硬皮马勃属(Scleroderma)。本研究中Inocybe包含外生菌根真菌种类数(9种)最多,占总外生菌根真菌的30%,作为落叶松外生菌根真菌优势类群;Inocybe 3、Inocybe geophylla、Laccaria、Amphinema byssoides、Inocybe 2、Inocybe 4均在≥15份样本中检测到,是常见种,优势度高;其余25种均在 < 15份样本中检测到,是稀有种,优势度低。本研究中的部分样本序列与GenBank中已有序列的相似性较低,有的甚至低于90%,它们可能代表新的真菌物种。
本研究结果表明,外生菌根真菌提高了根际土中全氮含量,但样地1提高不显著,样地2提高显著,可能是因为样地1和样地2外生菌根真菌的种类和数量存在差异导致,有研究表明,不同的菌根菌对土壤的无机氮源和有机氮源的利用情况依菌种不同而不同[22]。外生菌根真菌在共生与生长过程中会产生大量的有机酸[23],降低落叶松菌根根际土pH值的同时,还能促进土壤矿物中速效态磷、钾的释放,提高了菌根根际土速效磷、速效钾的含量。张亮等研究表明,外生菌根真菌分泌的有机酸(以草酸为主)能够活化土壤无效钾[24]。耿荣等研究认为根际土全磷含量低于非根际土是外生菌根真菌活化的结果[25]。Arocena等研究发现根际土的低pH值导致菌根根际土水溶性K+和Na+、Ca2+、Mg2+的浓度高于非根际土[3]。
林木生长地的坡度、坡向、海拔高度、经纬度等立地因子的改变会引起外生菌根真菌种类及分布的改变[26-27]。本研究在海拔、坡度、林龄等有较小差异的样地比较坡向对落叶松外生菌根真菌多样性的影响。结果表明,除Pielou均匀度指数样地1高于样地2外,样地2丰富度、Shannon多样性指数、Simpson优势度指数均高于样地1,说明样地2多样性高于样地1,但样地1分布更均匀。两样地Jaccard相似性系数低,再次说明坡向对落叶松外生菌根真菌多样性具有一定影响。
本研究结果表明,不同坡向外生菌根真菌对宿主植物的侵染率不同。有研究认为,菌根真菌对宿主植物的侵染程度受多种因素制约,与根际土壤养分关系较为密切[28]。通过相关性分析得出,落叶松外生菌根侵染率与根际土全氮、速效磷呈显著负相关,与相关研究结果一致[29]。这可能是因为植物根际周围养分含量低时,促进植物根系与土壤真菌形成外生菌根,从而扩大根系的吸收面积,提高根系对养分的吸收[30],可能说明外生菌根有助于树木抵御极端环境,这对生态系统的恢复、重建有重要的意义。落叶松外生菌根侵染率与根际土水溶性钙、水溶性镁呈正相关,这与耿荣等研究结果一致[25]。
秦岭辛家山林区8月份落叶松外生菌根真菌资源丰富,外生菌根的形成提高了菌根根际土中全氮、水溶性镁和钙含量,显著降低根际土pH值,显著提高了根际土速效磷、速效钾含量。坡向对外生菌根真菌的多样性及侵染率均有一定影响。菌根侵染率与根际土pH值呈显著正相关,与全氮和速效磷呈显著负相关,与速效钾呈极显著正相关。
| [1] |
Liang Y, Guo LD, Ma KP. The role of mycorrhizal fungi in ecosystems. Acta Phytoecologica Sinica, 2002, 26(6): 739-745.
(in Chinese) 梁宇, 郭良栋, 马克平. 菌根真菌在生态系统中的作用. 植物生态学报, 2002, 26(6): 739-745. |
| [2] |
Bai SL, Liu Y, Zhou J, Dong Z, Fan R. Resources investigation and ecological study on ectomycorrhizal fungi in Daqingshan mountains, Inner Mongolia. Acta Ecologica Sinica, 2006, 26(3): 837-841.
(in Chinese) 白淑兰, 刘勇, 周晶, 董智, 樊荣. 大青山外生菌根真菌资源与生态研究. 生态学报, 2006, 26(3): 837-841. |
| [3] | Arocena JM, Glowa KR. Mineral weathering in ectomycorrhizosphere of subalpine fir (Abies lasiocarpa (Hook.) Nutt.) as revealed by soil solution composition. Forest Ecology and Management, 2000, 133(1/2): 61-70. |
| [4] | Jentschke G, Brandes B, Kuhn AJ, Schröder WH, Becker JS, Godbold DL. The mycorrhizal fungus Paxillus involutus transports magnesium to Norway spruce seedlings. Evidence from stable isotope labeling. Plant and Soil, 2000, 220(1/2): 243-246. DOI:10.1023/A:1004727331860 |
| [5] |
An L. Ectomycorrhiza of forest ecosystems in China. Shaanxi Forest Science and Technology, 2014(2): 14-21.
(in Chinese) 安丽. 我国森林生态系统的外生菌根研究进展. 陕西林业科技, 2014(2): 14-21. |
| [6] | Johnson D, Ijdo M, Genney DR, Anderson IC, Alexander IJ. How do plants regulate the function, community structure, and diversity of mycorrhizal fungi?. Journal of Experimental Botany, 2005, 56(417): 1751-1760. DOI:10.1093/jxb/eri192 |
| [7] |
Zhao XQ, Zhang XL. Application technology of ectomycorrhizal fungi in Huashan Pine seedling. Greening and Life, 2009(1): 35-36.
(in Chinese) 赵秀琴, 张小龙. 外生菌根菌剂在华山松育苗上的应用技术. 绿化与生活, 2009(1): 35-36. |
| [8] |
Yu M, Cui M, Shen H, Huang JG. Effect of inoculating with the ectotrophic mycorrhizal fungi on the growth of Pinus tabulaeformis seedlings. Journal of Sichuan Forestry Science and Technology, 2011, 32(2): 45-48.
(in Chinese) 于萌, 崔明, 申鸿, 黄建国. 外生菌根真菌对油松幼苗生长的影响. 四川林业科技, 2011, 32(2): 45-48. |
| [9] |
Zhang Y, Zeng LQ, Ye JR, Wu XQ, Zhang LP. Effects of ectomycorrhizal fungi inoculation on growth and rhizosphere microorganisms of Pinus elliottii seedlings. Journal of Nanjing Forestry University (Natural Sciences Edition), 2014, 38(5): 57-61.
(in Chinese) 张扬, 曾丽琼, 叶建仁, 吴小芹, 张林平. 接种外生菌根真菌对湿地松林促生效应及根际微生物数量的影响. 南京林业大学学报(自然科学版), 2014, 38(5): 57-61. |
| [10] | Rinaldi AC, Comandini O, Kuyper TW. Ectomycorrhizal fungal diversity:separating the wheat from the chaff. Fungal Diversity, 2008, 33: 1-45. |
| [11] | He XH, Duan YH, Chen YL, Xu MG. A 60-year journey of mycorrhizal research in China:past, present and future directions. Science China Life Sciences, 2010, 53(12): 1374-1398. DOI:10.1007/s11427-010-4096-z |
| [12] | Guo LD. Progress of microbial species diversity research in China. Biodiversity Science, 2012, 20(5): 572-580. |
| [13] |
Gao C, Guo LD. Distribution pattern and maintenance of ectomycorrhizal fungus diversity. Biodiversity Science, 2013, 21(4): 488-498.
(in Chinese) 高程, 郭良栋. 外生菌根真菌多样性的分布格局与维持机制研究进展. 生物多样性, 2013, 21(4): 488-498. |
| [14] |
Ni W, Huo CF, Wang P. Morphological plasticity of fine root traits in Larix plantations across a latitude gradient. Chinese Journal of Ecology, 2014, 33(9): 2322-2329.
(in Chinese) 倪薇, 霍常富, 王朋. 落叶松(Larix)细根形态特征沿纬度梯度的可塑性. 生态学杂志, 2014, 33(9): 2322-2329. |
| [15] |
Zhang RQ, Tang M, Zhang HH, Du XG. A preliminary investigation on ectomycorrhizal fungi in Huoditang forest region of Qinling mountains. Journal of Qingdao Agricultural University (Natural Science), 2011, 28(3): 168-173.
(in Chinese) 张茹琴, 唐明, 张海涵, 杜小刚. 秦岭火地塘林区外生菌根真菌的初步调查. 青岛农业大学学报(自然科学版), 2011, 28(3): 168-173. |
| [16] |
Luan QS, Jiao FH, Jin RZ, Yun LL, Zhao G. Surveys on habitats of major ectomycorrhizal fungi in Liaoning. Journal of Liaoning Forestry Science & Technology, 2008(4): 10-13.
(in Chinese) 栾庆书, 焦凤红, 金若忠, 云丽丽, 赵刚. 辽宁省主要外生菌根真菌生境调查及探讨. 辽宁林业科技, 2008(4): 10-13. |
| [17] |
Xu ML, Sun JD, Zhu JJ, Kang HZ. Progress in research methods of forest ectomycorrhizal fungi diversity. Chinese Journal of Soil Science, 2005, 36(6): 969-974.
(in Chinese) 许美玲, 孙军德, 朱教君, 康宏樟. 树木外生菌根真菌多样性研究方法进展. 土壤通报, 2005, 36(6): 969-974. |
| [18] | Lian CL, Zhou ZH, Hogetsu T. A simple method for developing microsatellite markers using amplified fragments of inter-simple sequence repeat (ISSR). Journal of Plant Research, 2001, 114(3): 381-385. DOI:10.1007/PL00014001 |
| [19] | White TJ, Bruns T, Lee S, Taylor JW. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics//Innis MA, Gelfand DH, Sninsky JJ, White TJ. PCR Protocols: A Guide to Methods and Applications. New York: Academic Press, 1990: 315-322. |
| [20] | Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [21] | Nagaike T, Hayashi A, Kubo M, Takahashi K, Abe M, Arai N. Changes in plant species diversity over 5 years in Larix kaempferi plantations and abandoned coppice forests in central Japan. Forest Ecology and Management, 2007, 236(2/3): 278-285. |
| [22] |
Gong MQ, Chen Y, Wang FZ. A study on environmental condition for the growth of 3 species of Eucalptus mycorrhizal fungi. Forest Research, 1997, 10(1): 1-5.
(in Chinese) 弓明钦, 陈羽, 王凤珍. 三种桉树菌根菌培养条件的研究. 林业科学研究, 1997, 10(1): 1-5. |
| [23] | Van Breemen N, Finlay R, Lundström U, Jongmans AG, Giesler R, Olsson M. Mycorrhizal weathering:a true case of mineral plant nutrition?. Biogeochemistry, 2000, 49(1): 53-67. DOI:10.1023/A:1006256231670 |
| [24] |
Geng R, Geng ZC, Huang J, He WX, Hou L, She D, Zhao J, Shang J. Diversity of ectomycorrhizal fungi associated with Picea asperata in Xinjiashan forest of Qinling mountains. Acta Microbiologica Sinica, 2015, 55(7): 905-915.
(in Chinese) 耿荣, 耿增超, 黄建, 和文祥, 侯琳, 佘雕, 赵军, 尚杰. 秦岭辛家山林区云杉外生菌根真菌多样性. 微生物学报, 2015, 55(7): 905-915. |
| [25] |
Zhang L, Wang MX, Zhang W, Huang JG, Yuan L. Mobilization of potassium from soil by ectomycorrhizal fungi. Acta Microbiologica Sinica, 2014, 54(7): 786-792.
(in Chinese) 张亮, 王明霞, 张薇, 黄建国, 袁玲. 外生菌根真菌对土壤钾的活化作用. 微生物学报, 2014, 54(7): 786-792. |
| [26] |
Geng R, Geng ZC, Huang J, He WX, Hou L, She D, Han QS, Long DF. Diversity of ectomycorrhizal fungi associated with Quercus aliena in Xinjiashan forest region of Qinling mountains. Mycosystema, 2016, 35(7): 833-847.
(in Chinese) 耿荣, 耿增超, 黄建, 和文祥, 侯琳, 佘雕, 韩其晟, 龙东风. 秦岭辛家山林区锐齿栎外生菌根真菌多样性. 菌物学报, 2016, 35(7): 833-847. |
| [27] |
Jing YB. Resource status of tree ectomycorrhizal fungi in China and study progress on its ecology. Journal of West China Forestry Science, 2007, 36(2): 135-140.
(in Chinese) 景跃波. 我国树木外生菌根菌资源状况及生态学研究进展. 西部林业科学, 2007, 36(2): 135-140. |
| [28] |
Song FQ, Tian XJ, Yang CL, He XB, Chen B, Zhu J, Hao JJ. Ectomycorrhizal infection intensity of subalpine forest ecosystems in western Sichuan, China. Acta Ecologica Sinica, 2006, 26(12): 4171-4178.
(in Chinese) 宋福强, 田兴军, 杨昌林, 何兴兵, 陈彬, 朱静, 郝杰杰. 川西亚高山带森林生态系统外生菌根的形成. 生态学报, 2006, 26(12): 4171-4178. DOI:10.3321/j.issn:1000-0933.2006.12.033 |
| [29] |
Cui L, Mu LQ. Relationship between rhizosphere soil fertility and ectomycorrhizal colonization of Tilia amurensis. Chinese Journal of Ecology, 2015, 34(1): 145-149.
(in Chinese) 崔磊, 穆立蔷. 紫椴根际土壤肥力与外生菌根侵染关系. 生态学杂志, 2015, 34(1): 145-149. |
| [30] | Pankow W, Boller T, Wiemken A. The significance of mycorrhizas for protective ecosystems. Experientia, 1991, 47(4): 391-394. DOI:10.1007/BF01972081 |
 2018, Vol. 58
2018, Vol. 58