中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 吕小龙, 胡剑刚, 陈兆国, 荆雅玮, 米荣升, 黄燕, 王少辉, 韩先干, 祁克宗. 2018
- Xiaolong Lü , Jiangang Hu , Zhaoguo Chen , Yawei Jing , Rongsheng Mi, Yan Huang, Shaohui Wang , Xiangan Han, Kezong Qi . 2018
- luxS基因缺失对禽致病性大肠杆菌O1、O2和O78三种血清型分离株的生物学特性影响
- Inactive luxS influence on biological characteristics of O1, O2 and O78 serotypes isolates in avian pathogenicity Escherichia coli
- 微生物学报, 58(2): 238-246
- Acta Microbiologica Sinica, 58(2): 238-246
-
文章历史
- 收稿日期:2017-03-06
- 修回日期:2017-05-04
- 网络出版日期:2017-06-15
2. 中国农业科学院上海兽医研究所, 上海 200241
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China
Kezong Qi, Tel: +86-551-65786835, E-mail:qkz@ahau.edu.cn
禽致病性大肠杆菌(Avian Pathogenicity Escherichia coli,APEC)临床上能够引起禽类多种疾病,包括心包炎、肝周炎、腹膜炎、气囊炎、败血症以及其他主要的肠道外疾病[1-2],APEC血清型复杂,研究表明临床上的主要血清型为O1、O2和O78等。禽大肠杆菌病常伴随其他细菌和病毒共感染,导致由其所引起的发病率和死亡率升高,严重制约养禽业的健康发展[3-5]。而抗生素的滥用,又极易造成广泛的耐药性。因此开展对APEC致病性的研究,寻求新的治疗途径,对该病的防控具有重要意义。
细菌可通过群体感应(Quorum sensing,QS)调控基因的表达来影响菌体的生理过程。而QS对细菌功能的调控是基于其信号分子的产生。LuxS/AI-2型群体感应系统广泛存在于革兰氏阴性菌和革兰氏阳性菌中,可产生通用的信号分子AI-2,AI-2作为呋喃酰硼酸二酯类分子由luxS通过催化核糖高半胱氨酸(SRH)转变为高丝半胱氨酸和4, 5-二羟基-2, 3戊二酮(DPD),DPD水化后形成AI-2[6-8]。在National Centre for Biotechnology Information (NCBI)数据库已公布的89个完整细菌基因组中,有39个包含luxS基因。含有luxS基因的细菌在该基因缺失后均消除了AI-2的产生[7]。
LuxS/AI-2型群体感应系统调控多种细胞反应,主要包括毒力因子的表达、运动性、细胞生长、生物被膜[9]等,从而使得细菌群体更加易于躲避来自宿主的免疫、抗生素以及杀菌剂等不利因素的压力,使其感染难以清除[10-13]。因此,通过调控LuxS/AI-2型群体感应系统实现对细菌病的防控,已成为微生物学研究的新热点。
本研究以APEC优势血清型APECO1 (O1血清型)、DE17 (O2血清型)、E940 (O78血清型)及其相应luxS缺失株为研究对象,研究luxS对其生物特性的影响,为进一步研究LuxS/AI-2群体感应对APEC的调控作用以及APEC的防控提供参考。
1 材料和方法 1.1 菌株与试剂APEC优势血清型APECO1 (O1血清型)、DE17 (O2血清型)、E940 (O78血清型)菌株由本实验室分离鉴定保存[14]。APECO1ΔluxS、DE17ΔluxS[15]和E940ΔluxS均由本实验室构建。96孔聚丙烯细胞培养板(美国Corning公司)。药敏纸片(杭州天和公司)。酵母粉(Yeast Extract,OXOID公司),蛋白胨(Typtone,OXOID公司),M9培养基(生工生物工程(上海)股份有限公司),葡萄糖(生工生物工程(上海)股份有限公司),刚果红(生工生物工程(上海)股份有限公司),氯化钠(生工生物工程(上海)股份有限公司)。MgSO4 (AMRESCO),Vitamin-free Casamino Acids (BD),KOU (AMRESCO),L-精氨酸(AMRESCO),反转录试剂盒(TaKaRa),QuantiNovaTM SYBR Green PCR Kit (QIAGEN)。
1.2 生长曲线将APECO1、APECO1ΔluxS、DE17、DE17ΔluxS、E940和E940ΔluxS分别接种于LB琼脂平板,37℃培养过夜,挑取单菌落接种试管中,培养至对数中期,调整OD600=1.0,按1:100稀释接种于LB培养基中,37℃、200 r/min振荡培养至平台期,间隔等量时间取样测量OD600值,记录并整理数值,绘制菌株的生长曲线。
1.3 AI-2活性检测将上述6株菌于37℃培养至OD600为2.0,用新配制的AB培养基以1:5000稀释培养物。将上述超滤液在无菌条件下用0.22μm的滤器过滤后,用于AI-2活性检测。参照文献[11]并做适当修改,具体方法如下:900μL的AB培养基,加入上述无菌的各滤液100μL,37℃培养5 h后,用多功能酶标仪的生物发光模式测定其生物发光。同时以哈维弧菌BB152培养上清为阳性对照,AB培养基为阴性对照,每组重复3次。
1.4 细菌的生物被膜细菌生物被膜形成实验根据文献[16]方法并做适当改进:将上述6株菌分别接种LB琼脂平板,37℃培养后,挑取单菌落接种试管中振荡培养至对数中期,4℃、3000×g离心10 min收集菌体。以M9洗2遍,再以M9+0.2%葡萄糖重悬菌体,调整OD600=0.03,加入到96孔聚丙烯板中,每孔200 μL,以无菌培养基作为对照组,每组6个重复,各重复3次。37 ℃培养24 h,每孔加入200μL PBS洗涤3遍,晾干后每孔加入200 μL 0.1%结晶紫溶液,37 ℃染色15 min,PBS洗涤3遍,晾干。每孔加入200μL 95%乙醇,充分溶解后,酶标仪测定每孔样本OD595的数值,并通过GraphPad Prism 6 paired t检验分析数据。
1.5 细菌的rdar形态变化将上述6株菌分别接种LB琼脂平板,挑取单菌落接种试管中振荡培养至对数中期,4℃ 3000×g离心10 min收集菌体,以无菌PBS洗涤2遍调至OD600=3,配制新鲜的rdar培养基[17](刚果红0.008 g,考马斯亮蓝0.004 g,蛋白胨2.000 g,酵母粉1.000 g,琼脂粉1.600 g),高压灭菌后的rdar固体培养基中滴加0.5μL菌体,37 ℃培养24 h后,拍照记录。
1.6 细菌的运动性将上述6株菌分别接种LB琼脂平板,挑取单菌落于玻璃试管静置培养至对数中期,4℃、3000×g离心10 min收集菌体,以无菌PBS洗涤2遍调至OD600=3,配制新鲜的运动性培养基(2.0 g蛋白胨,1.0 g氯化钠,1.6 g葡萄糖,0.5 g琼脂粉),高压灭菌后倒入平板,待冷却后在板的中央加入2 μL菌体,37 ℃培养24 h。然后测量拍照[18]。
1.7 与细菌运动性相关的基因转录水平检测参照文献[19],选取与细菌运动性相关的鞭毛基因fliG、fliI和fliM,dnaE作为内参基因,分别设计引物(表 1),进行Real-time PCR,研究缺失株与野生株鞭毛基因的转录差异。依据文献[11],并做适当改进。将上述6株菌培养至对数中前期,各取1 mL菌液提取mRNA,利用反转录试剂盒反转录为cDNA,并以相应的cDNA为模板。RT-PCR总体系为20 μL:SYBR Green PCR Master Mix 10 μL,上下游引物各1μL,cDNA模板为3μL (30 ng),QN ROX Reference Dye 0.1 μL。反应条件为:95 ℃ 2 min;95℃ 5 s,60℃ 10 s,40个循环。采用2–△△CT(Livak)法分析数据[20],计算各缺失株目的基因的转录水平。
| Gene name | Primary source | Primer | Prime Sequences (5′→3′) | Size/bp |
| dnaE | EG10238 | dnaE-F | GATTGAGCGTTATGTCGGAGGC | 80 |
| dnaE-R | GCCCCGCAGCCGTGAT | |||
| fliG | EG11654 | fliG-F | CAACTTTATGGAGCCACAGAGCG | 225 |
| fliG-R | CCGTCGAGCAAGCCATTCAGTAC | |||
| fliI | EG20266 | fliI-F | GCAACGTACACCGATTGAACATG | 381 |
| fliI-R | TAGCGGGTGAGGGAGTCCATAAT | |||
| fliM | EG10323 | fliM-F | GGCACTGGGCTGGTGGTGTTCTC | 260 |
| fliM-R | ATGTCGTTCGGCGAGGTGGTGAT | |||
1.8 细菌的耐药性
采用圆纸片扩散试验法,将上述8株菌进行头孢吡肟、庆大霉素、卡那霉素、氯霉素、头孢噻吩、环丙沙星、氨苄青霉素、四环素、甲氧苄啶、头胞曲松、丁胺卡那、头胞他啶等12种药物的药敏实验。各菌株分别划线培养于LB琼脂平板,将药敏纸片均匀贴于表面。37℃培养18 h后,测量各药敏纸片的抑菌圈直径,以mm计,参照CLSI标准,判定被检细菌对每种药物的敏感性,分别为敏感(Susceptible,S)、中(Intermediate,I)或耐药(Resistance,R)菌株。
2 结果和分析 2.1 细菌的生长曲线对APECO1、APECO1ΔluxS、DE17、DE17ΔluxS、E940和E940ΔluxS的生长曲线(图 1)检测,结果表明,各菌株的野生型与缺失型的生长趋势基本保持一致,无明显差异,表明缺失luxS并不影响细菌的生长特性。
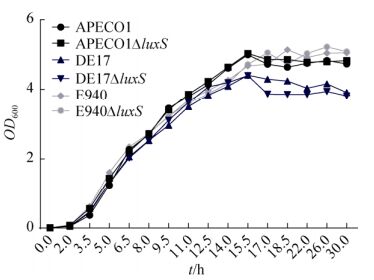
|
| 图 1 luxS缺失株与野生株的生长曲线 Figure 1 Growth curve of luxS mutants and wild strains. |
2.2 luxS基因缺失影响AI-2活性
对6株菌产生的AI-2活性检测结果表明(图 2),与阳性对照组BB152相比,luxS缺失导致APECO1ΔluxS、DE17ΔluxS和E940ΔluxS不产生AI-2。

|
| 图 2 luxS缺失株与野生株的AI-2活性检测 Figure 2 AI-2 activity of luxS mutants and wild strains. |
2.3 luxS基因缺失影响细菌的生物被膜
对6株菌的生物被膜(图 3)形成检测结果表明,luxS缺失使APECO1和E940的生物被膜形成显著下降(P<0.05),而DE17的生物被膜形成无显著变化。

|
| 图 3 luxS缺失株与野生株生物被膜形成 Figure 3 Biofilm formation of luxS mutants and wild strains. **: P < 0.01, *: P < 0.05. |
2.4 luxS基因缺失引起细菌的rdar形态变化
从对APEC的rdar形态研究结果表明(图 4),luxS基因的缺失使得APECO1的菌落颜色由白变为深红,其形态变小,且有一层透明圈。而luxS基因的缺失并不影响DE17和E940的rdar形态。

|
| 图 4 luxS缺失株与野生株的rdar形态 Figure 4 rdar morphotype of luxS mutants and wild strains. |
2.5 luxS基因缺失对细菌运动性的影响
结合本实验室以往的结果[11],从图 5中可以看出luxS基因的缺失显著降低了DE17和APECO1的泳动能力,然而并不影响BL21以及E940的运动性。
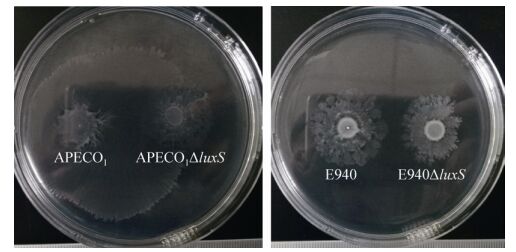
|
| 图 5 luxS缺失株与野生株运动性 Figure 5 Motility of luxS mutants and wild strains. |
2.6 luxS基因缺失影响鞭毛基因的转录水平
对各缺失株中鞭毛基因fliG、fliI及fliM的转录水平研究表明,luxS的缺失导致在APECO1ΔluxS中fliG、fliI和fliM的转录水平均显著降低(P<0.05),而在DE17ΔluxS和E940ΔluxS中,fliG和fliI的转录水平显著降低(P<0.05)(图 6)。
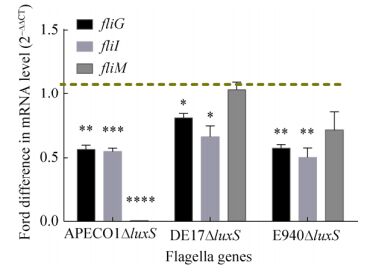
|
| 图 6 luxS缺失株鞭毛基因的转录水平 Figure 6 Transcription level of flagellin gene in luxS mutants. *: P < 0.05, **: P < 0.01, ***: P < 0.001, ****: P < 0.0001. |
2.7 luxS基因缺失引起细菌的耐药性变化
参照对8株细菌的耐药性检测结果(图 7和表 2)表明luxS基因的缺失导致APECO1对头孢吡肟和丁胺卡那由耐药变为高敏,对氯霉素都由高敏变为耐药。E940对氯霉素都由高敏变为耐药,但对DE17的耐药性无显著改变。

|
| 图 7 luxS缺失株与野生株的耐药性 Figure 7 Drug-resistance of luxS mutants and wild strains. A: Amikacin; C: Cefepime; H: Chloroamphenicol. |
| Antibiotics | Antimicrobial activity (inhibition zone diameters/cm) | |||||
| APECO1 | APECO1ΔluxS | DE17 | DE17ΔluxS | E940 | E940ΔluxS | |
| Cefuroxime | I | S | S | S | S | S |
| Cefepime | R | S | S | I | I | I |
| Amikacin | R | S | S | S | S | S |
| Ampicillin | S | S | S | S | R | R |
| Trimethoprim | S | S | S | S | R | R |
| Gentamycin | R | R | S | S | S | S |
| Kanamyin | I | R | I | I | I | S |
| Cephalothin | S | S | S | S | R | R |
| Chloroamphenicol | S | R | S | S | S | R |
| Tetracycline | R | R | I | I | R | R |
| Ciprofloxacin | S | S | I | S | R | R |
| Ceftazidime | S | S | S | S | S | S |
| R: Resistence, I: Medium sensitivity, S: Sensitivity. Compared with the wild and mutant strains, the italics indicate that the sensitization is changed from medium sensitivity to sensitivity, or from sensitivity to medium sensitivity. Underlined means that sensitivity becomes resistant, or the resistance becomes sensitivity. For resistance, or resistance to become sensitive. Bold means from medium resistance into resistance, or from resistance into medium sensitive. | ||||||
3 讨论
APEC可引起禽类大肠杆菌病,给养禽产业带来严重的经济损失。APEC血清型众多,而O1、O2和O78是其主要的致病血清型。细菌群体感应系统对细菌的致病性具有重要的调控作用,群体感应系统调控毒力因子的表达、生物被膜的形成、菌落形态改变和运动性的变化等。此外,由于生存环境和遗传背景的差异,导致细菌的致病能力及其生理特性差异显著[21-22]。
本研究结果表明,luxS基因的缺失并不影响各菌株的生长特性,luxS催化SRH生成AI-2前体,参与了细菌的甲硫氨酸(Met)代谢通路,而Met的甲基供应涉及细菌诸多重要的生化反应,对细菌的生长代谢非常重要。此外,在一些细菌中,Met代谢通路由SahH催化并不形成AI-2[23]。而本研究中缺失luxS并没有引起生长特性的改变,推测在APEC中可能存在类似SahH的替代通路参与其Met代谢,具体机制仍有待进一步研究。
细菌的“rdar” (red,dry and rough)形态是细菌的一种特殊表型,表现出细菌的一种群体行为,它以合成卷曲菌毛和纤维素等胞外基质为特征,这些胞外物质使得细菌通过相互作用抵御外界压力。根据刚果红与纤维素或卷曲菌毛结合后的吸收谱不同,可以通过菌落表型检测出这2个组分单独或混合存在。菌株产生纤维素表现出粉红、干燥和粗糙的菌落形态,而卷曲菌毛的产生会形成灰色、干燥以及粗糙的菌落形态,倘若没有胞外基质产生,则菌落表型为光滑和白色。通过对细菌rdar形态的研究,可为进一步开展纤维素和卷曲菌毛相关的调控通路提供参考。rdar形态的出现对环境中致病菌的生存和感染非常重要[24]。本研究通过对APEC的3种血清型和相应的luxS缺失株进行相关的生理学实验,发现APECO1的菌落形态由干燥的浅色变为较小规则的红色菌落,推测luxS基因的缺失可能导致其纤维素的合成增加[17],此外从其形态中可以看出其胞外基质成分和细菌的运动能力也发生改变。
此外,本研究结果表明,3种血清型都呈现一定的运动性,但是在luxS缺失的情况下,只有DE17和APECO1表现出明显的运动性下降,通过进一步研究与运动性相关的鞭毛基因的转录水平,发现在3种血清型菌株中,fliG和fliI均显著下降(P<0.05),而在APECO1中fliM基因的转录水平极显著下降(P<0.0001),表明luxS缺失导致DE17和APECO1的运动性降低,可能与其鞭毛基因的转录水平降低有关,但是对E940的运动性没有改变,推测在E940中,除了上述基因参与对其运动性的调控,也与该菌株的自身遗传背景和对环境具有依赖性有关[25]。
细菌耐药性的产生受多因素调控,研究表明,细菌的群体感应系统对细菌的耐药性具有重要的调控作用[26]。在本研究中,敲除luxS基因引起APECO1对头孢吡肟和丁胺卡那由耐药变为高敏,对氯霉素都由高敏变为耐药。E940对氯霉素都由高敏变为耐药。研究表明,头孢吡肟主要抑制细菌细胞壁的形成,而丁胺卡那和氯霉素主要抑制蛋白质的合成;耐药性结果表明,不同血清型APEC的耐药性具有菌株特异性。
本研究通过敲除APEC不同血清型的luxS,开展luxS对不同血清型APEC生物学特性的影响研究,为进一步研究APEC的防控提供参考。
| [1] | Dho-Moulin M, Fairbrother JM. Avian pathogenic Escherichia coli (APEC). Veterinary Research, 1999, 30(2/3): 299-316. |
| [2] | Stathopoulos C, Provence DL, Curtiss Ⅲ R. Characterization of the avian pathogenic Escherichia coli hemagglutinin Tsh, a member of the immunoglobulin a protease-type family of autotransporters. Infection and Immunity, 1999, 67(2): 772-781. |
| [3] | Dou XH, Gong JS, Han XA, Xu M, Shen HY, Zhang D, Zhuang LL, Liu JS, Zou JM. Characterization of avian pathogenic Escherichia coli isolated in eastern China. Gene, 2016, 576(1): 244-248. DOI:10.1016/j.gene.2015.10.012 |
| [4] | Guabiraba R, Schouler C. Avian colibacillosis:still many black holes. FEMS Microbiology Letters, 2015, 362(15): fnv118. DOI:10.1093/femsle/fnv118 |
| [5] | Landman WJM, van Eck JHH. The incidence and economic impact of the Escherichia coli peritonitis syndrome in Dutch poultry farming. Avian Pathology, 2015, 44(5): 370-378. DOI:10.1080/03079457.2015.1060584 |
| [6] | Pereira CS, Thompson JA, Xavier KB. AI-2-mediated signalling in bacteria. FEMS Microbiology Reviews, 2013, 37(2): 156-181. DOI:10.1111/j.1574-6976.2012.00345.x |
| [7] | Xavier KB, Bassler BL. LuxS quorum sensing:more than just a numbers game. Current Opinion in Microbiology, 2003, 6(2): 191-197. DOI:10.1016/S1369-5274(03)00028-6 |
| [8] | Zhu JG, Dizin E, Hu XB, Wavreille AS, Park J, Pei DH. S-Ribosylhomocysteinase (LuxS) is a mononuclear iron protein. Biochemistry, 2003, 42(16): 4717-4726. DOI:10.1021/bi034289j |
| [9] |
Bai H, Han XG, Liu L, Shan XQ, Song J, Liu R, Dong HL, Liu HW, Ding C, Yu SQ. The regulation of autoinducer-2 in avian pathogenic Escherichia coli. Scientia Agricultura Sinica, 2012, 45(24): 5110-5116.
(in Chinese) 白灏, 韩先干, 刘蕾, 单雪芹, 宋军, 刘瑞, 董洪亮, 刘海文, 丁铲, 于圣青. 信号分子AI-2对禽致病性大肠杆菌的调控作用. 中国农业科学, 2012, 45(24): 5110-5116. DOI:10.3864/j.issn.0578-1752.2012.24.017 |
| [10] |
Han XG, Bai H, Liu L, Chen WJ, Ding C, Hu QH, Qi KZ, Yu SQ. Cloning and expression of luxS and
pfs and in vitro biosynthesis autoinducer 2 of avian pathogenic Escherichia coli from Anhui Province. Acta Microbiologica Sinica, 2012, 52(9): 1167-1172.
(in Chinese) 韩先干, 白灏, 刘蕾, 陈文静, 丁铲, 胡青海, 祁克宗, 于圣青. 禽致病性大肠杆菌安徽分离株luxS和pfs基因的克隆、表达与细胞外合成AI-2活性检测. 微生物学报, 2012, 52(9): 1167-1172. |
| [11] | Han XG, Bai H, Liu L, Dong HL, Liu R, Song J, Ding C, Qi KZ, Liu HW, Yu SQ. The luxS gene functions in the pathogenesis of avian pathogenic Escherichia coli. Microbial Pathogenesis, 2013, 55: 21-27. DOI:10.1016/j.micpath.2012.09.008 |
| [12] | Han XG, Lu CP. Biological activity and identification of a peptide inhibitor of LuxS from Streptococcus suis serotype 2. FEMS Microbiology Letters, 2009, 294(1): 16-23. DOI:10.1111/fml.2009.294.issue-1 |
| [13] | Han XG, Lu CP. Detection of autoinducer-2 and analysis of the profile of luxS and pfs transcription in Streptococcus suis serotype 2. Current Microbiology, 2009, 58(2): 146-152. DOI:10.1007/s00284-008-9291-9 |
| [14] |
Chen WJ, Han XG, He L, Hu QH, Yu SQ. Characterization of duck pathogenic Escherichia coli. Chinese Journal of Animal Infectious Diseases, 2010, 18(2): 34-40.
(in Chinese) 陈文静, 韩先干, 何亮, 胡青海, 于圣青. 鸭致病性大肠杆菌的分离鉴定及其生物学特性分析. 中国动物传染病学报, 2010, 18(2): 34-40. |
| [15] |
Zhang YX, Han XG, Zuo JK, Gong JS, Han Y, Fan GB, Wang SH, Tian MX, Ding C, Qi KZ, Yu SQ. Distribution of lipopolysaccharide core type in avian pathogenic Escherichia coli and its correlation with virulence gene. Microbiology China, 2015, 42(8): 1619-1625.
(in Chinese) 张宇曦, 韩先干, 左佳坤, 龚建森, 韩月, 范国博, 王少辉, 田明星, 丁铲, 祁克宗, 于圣青. 禽致病性大肠杆菌脂多糖核心型分布与毒力基因的相关性分析. 微生物学通报, 2015, 42(8): 1619-1625. |
| [16] | Reisner A, Krogfelt KA, Klein BM, Zechner EL, Molin S. In vitro biofilm formation of commensal and pathogenic Escherichia coli strains:impact of environmental and genetic factors. Journal of Bacteriology, 2006, 188(10): 3572-3581. DOI:10.1128/JB.188.10.3572-3581.2006 |
| [17] | Römling U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cellular and Molecular Life Sciences CMLS, 2005, 62(11): 1234-1246. DOI:10.1007/s00018-005-4557-x |
| [18] | Ling H, Kang A, Tan MH, Qi XB, Chang MW. The absence of the luxS gene increases swimming motility and flagella synthesis in Escherichia coli K12. Biochemical and Biophysical Research Communications, 2010, 401(4): 521-526. DOI:10.1016/j.bbrc.2010.09.080 |
| [19] | Ni B, Ghosh B, Paldy FS, Colin R, Heimerl T, Sourjik V. Evolutionary remodeling of bacterial motility checkpoint control. Cell Reports, 2017, 18(4): 866-877. DOI:10.1016/j.celrep.2016.12.088 |
| [20] | Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [21] | da Silveira WD, Ferreira A, Brocchi M, de Hollanda LM, de Castro AFP, Yamada AT, Lancellotti M. Biological characteristics and pathogenicity of avian Escherichia coli strains. Veterinary Microbiology, 2002, 85(1): 47-53. DOI:10.1016/S0378-1135(01)00482-5 |
| [22] | Paixão AC, Ferreira AC, Fontes M, Themudo P, Albuquerque T, Soares MC, Fevereiro M, Martins L, de Sá MIC. Detection of virulence-associated genes in pathogenic and commensal avian Escherichia coli isolates. Poultry Science, 2016, 95(7): 1646-1652. DOI:10.3382/ps/pew087 |
| [23] | Redanz S, Standar K, Podbielski A, Kreikemeyer B. Heterologous expression of sahH reveals that biofilm formation is autoinducer-2-independent in Streptococcus sanguinis but is associated with an intact activated methionine cycle. Journal of Biological Chemistry, 2012, 287(43): 36111-36122. DOI:10.1074/jbc.M112.379230 |
| [24] | Weiss-Muszkat M, Shakh D, Zhou YZ, Pinto R, Belausov E, Chapman MR, Sela S. Biofilm formation by and multicellular behavior of Escherichia coli O55:H7, an atypical enteropathogenic strain. Applied and Environmental Microbiology, 2010, 76(5): 1545-1554. DOI:10.1128/AEM.01395-09 |
| [25] | Nickzad A, Lépine F, Déziel E. Quorum sensing controls swarming motility of Burkholderia glumae through regulation of rhamnolipids. PLoS One, 2015, 10(6): e0128509. DOI:10.1371/journal.pone.0128509 |
| [26] | Chait R, Craney A, Kishony R. Antibiotic interactions that select against resistance. Nature, 2007, 446(7136): 668-671. DOI:10.1038/nature05685 |
 2018, Vol. 58
2018, Vol. 58




