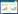中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 陈孝仁, 张烨, 黄沈鑫, 邢玉平, 纪兆林. 2018
- Xiaoren Chen, Ye Zhang, Shenxin Huang, Yuping Xing, Zhaolin Ji. 2018
- 辣椒疫霉RXLR型效应子PcAvh2的序列多态性、基因转录特征及功能
- Sequence polymorphism, gene transcriptional pattern and function analysis of the RXLR effector PcAvh2 from Phytophthora capsici
- 微生物学报, 58(12): 2204-2215
- Acta Microbiologica Sinica, 58(12): 2204-2215
-
文章历史
- 收稿日期:2018-03-26
- 修回日期:2018-04-22
- 网络出版日期:2018-04-27
疫霉菌(Phytophthora spp.)隶属于色菌界(Chromista)卵菌门(Oomycota),是一群重要的植物病原菌,引起的植物疫病是危害农林业生产最重的植物病害之一[1]。著名的种包括引起马铃薯晚疫病的致病疫霉(P. infestans)和引起大豆根腐病的大豆疫霉(P. sojae)[2]。辣椒疫霉(P. capsici)侵染危害茄科、葫芦科和豆类等上百种农作物,每年给全世界蔬菜生产造成的损失高达10亿美元[3]。由于疫霉菌在亲缘关系上与真菌相差甚远,多数针对真菌的杀菌剂对防治植物疫病无效,培育和利用抗病品种是目前防治植物疫病的主要手段[1]。因此,从植物与疫霉菌互作的角度入手深入解析疫霉菌操控寄主免疫抗性的致病机理,无疑对防控植物疫病具有重要的指导意义。
为阻止病原物的侵染,植物已经进化出两层免疫体系,即植物识别病原物相关的分子模式PAMP (pathogen-associated molecular pattern)产生的先天免疫PTI (PAMP triggered immunity)反应和识别效应子(effector)产生的后天诱导ETI (effector triggered immunity)反应[4]。为建立成功的侵染和定殖,病原物则抑制植物的免疫反应。植物通过细胞膜上的PRR (pattern recognition receptor)受体识别PAMP产生的PTI反应是一种普遍存在的基本防御机制,可以抵抗多数病原物的入侵;病原物为引起病害,必须通过分泌出效应子到植物细胞内抑制PTI反应,克服植物的基础抗病性;植物又通过NB-LRR类抗性蛋白(resistance protein,R)识别效应子产生ETI反应,通常引起过敏性坏死反应(hypersensitive reaction,HR),此时的效应子称为无毒蛋白(avirulence protein,Avr);病原物则又通过效应子逃避识别或者抑制ETI反应[4]。
疫霉菌泌出两类效应子以干扰植物的免疫反应:进入植物质外体空间的胞外效应子(apoplastic effectors)以及进入植物细胞内的效应子(cytoplasmic effectors)[5-6]。其中,RXLR效应子是胞内效应子中一个庞大的家族,包括目前已经得到鉴定的无毒蛋白[6]。它们序列N端的信号肽负责将其泌出到疫霉菌体外,紧随其后的保守RXLR基序(R,精氨酸;X,任意氨基酸;L,亮氨酸;R,精氨酸)负责将其进一步转运到寄主植物细胞内,而C端则执行效应子的功能[5, 7-8]。由于与寄主植物靶标蛋白共进化,选择压力多导致RXLR效应子的C端呈现序列多态性[9]。结构上,大约44%的疫霉菌RXLR效应子具有一个保守的核心α螺旋折叠[10]。大多数RXLR效应子能够抑制寄主的PTI或者ETI反应[9, 11]。近年来的研究发现,RXLR效应子作用于寄主植物的不同生物学途径上,或是调控PTI或者ETI引起的植物细胞死亡,或是招募植物蛋白激活自身,或是作用于植物的免疫分泌系统,或是影响植物激素途径,或是干扰寄主抗性物质运输,或是操控植物感病因子,或是干扰植物基因的转录表达等,以多种方式抑制植物免疫反应以利于自身的定殖[9, 12-16]。
辣椒疫霉(P. capsici)能够侵染模式植物拟南芥(Arabidopsis thaliana)和本氏烟(Nicotiana benthamiana),逐渐成为卵菌研究的重要模式材料[3, 17]。基因组测序发现辣椒疫霉含有357个RXLR效应子[18]。利用寄主诱导基因沉默技术(host-induced gene silencing),发现类似致病疫霉Avr3a的PcAvr3a1被烟草属多个种的R蛋白识别,导致这些种对辣椒疫霉产生非寄主抗性[19]。最近,几个RXLR效应子的毒性功能和晶体生成等得到了初步分析,Pc22053等可以抑制BAX、INF1等触发的植物免疫反应[20-23]。尽管取得了一定的进展,但目前仅是少数几个辣椒疫霉RXLR效应子得到了初步分析,而且尚无这些效应子在侵染过程中作用的研究报道。我们基于前期的转录组分析[20],进一步鉴定了一个辣椒疫霉RXLR效应子PcAvh2。本研究发现,辣椒疫霉、烟草疫霉和恶疫霉中均存在该效应子,在辣椒疫霉群体中该效应子具有10个等位基因,在11个氨基酸位点存在序列多态性;PcAvh2基因在辣椒疫霉的侵染阶段上调表达;它能够抑制6种效应子激发的植物免疫反应;PcAvh2的沉默导致辣椒疫霉的致病力显著下降。结果表明,PcAvh2是辣椒疫霉中一个重要的侵染致病因子。
1 材料和方法 1.1 材料 1.1.1 供试菌株:31个辣椒疫霉菌株、2个烟草疫霉(P. parasitica)菌株、1个恶疫霉(P. cactorum)菌株(表 1)、大肠杆菌(Escherichia coli) DH5α和农杆菌(Agrobacterium tumefaciens) GV3101均由本实验室保存。所有辣椒疫霉菌株均用于核苷酸多态性分析,只有菌株Pc537还用于其他试验。利用Chen等(2013)[20]中的方法获得辣椒疫霉菌株的菌丝、游动孢子囊、游动孢子和萌发的休止孢。
| Species | Isolate | Origin | Allelic sequence# |
| P. capsici | Pc704002 | Yunnan Province, China | 3 |
| Pc703903 | Yunnan Province, China | 2 | |
| Pc702703 | Yunnan Province, China | 2 | |
| Pc700902 | Yunnan Province, China | 6 | |
| Pc703203 | Yunnan Province, China | 3 | |
| Pc703805 | Yunnan Province, China | 2 | |
| Pc700502 | Yunnan Province, China | 3 | |
| Pc702701 | Yunnan Province, China | 2 | |
| Pc800906 | Yunnan Province, China | 2 | |
| PC2 | Anhui Province, China | 3 | |
| PC5 | Anhui Province, China | 3 | |
| Pc537 | Fujian Province, China | 3 | |
| JO36 | Fujian Province, China | 3 | |
| WYS-1 | Fujian Province, China | 4 | |
| Pc2W-3 | Fujian Province, China | 3 | |
| MH-1 | Fujian Province, China | 2 | |
| mA1 | NA | 10 | |
| mA2 | NA | 9 | |
| NJPC1 | Jiangsu Province, China | 5 | |
| NJPC2 | Jiangsu Province, China | 5 | |
| NJPC3 | Jiangsu Province, China | 3 | |
| NJPC4 | Jiangsu Province, China | 8 | |
| Hd3 | Hebei Province, China | 5 | |
| Hd3-2 | Hebei Province, China | 5 | |
| Hd7 | Hebei Province, China | 5 | |
| DZ8 | Hebei Province, China | 7 | |
| Pg1 | Hebei Province, China | 3 | |
| Pg10 | Hebei Province, China | 5 | |
| Pg12 | Hebei Province, China | 5 | |
| Pg14 | Hebei Province, China | 5 | |
| LT1534 | State of Tennessee, USA | 1 | |
| P. cactorum | PH-1-17-05 | Fars Province, Iran | 5 |
| P. parasitica | PP1 | Jiangsu Province, China | 2 |
| PP2 | Jiangsu Province, China | 2 | |
| NA, not applicable. #The numbers in this column correspond to those following ‘PcAvh2_’ in Figure 1. | |||
1.1.2 质粒:
PVX表达载体pGR106由英国剑桥大学David Baulcombe博士提供。致病疫霉RXLR效应子编码基因Avr3a及相应的马铃薯抗性基因R3a均构建在质粒pCB302-3上,由英国Sainsbury实验室的Sophien Kamoun博士馈赠。Gfp、Bax、Inf1、PsAvh241、PsCRN63和PsojNIP1均构建在载体pGR106上,来自南京农业大学王源超教授和窦道龙教授。质粒pTORmRFP4来自美国俄勒冈州立大学Brett M. Tyler教授。
1.1.3 主要试剂和仪器:限制性内切酶Not Ⅰ、Cla Ⅰ和BsiW Ⅰ等(NEB公司);高保真DNA聚合酶(Platinum Taq DNA polymerase High fidelity,Invitrogen公司),DNA凝胶回收试剂盒(AXYGEN AxyPrep DNA Gel Extraction Kit,杭州爱思进公司),T4 DNA连接酶(TaKaRa公司),TA载体pMD19-T (TaKaRa),RNAiso Plus (TaKaRa),DNase I (TaKaRa),RNA纯化试剂盒(RNAclean Kit,北京天根生物),反转录酶M-MLV (RNase H-) (TaKaRa),引物Oligo d(T)18 (TaKaRa),Recombinant RNase Inhibitor (TaKaRa),iQ SYBR Green Supermix(南京诺唯赞公司);LS-P96G型PCR仪(Thermo Scientific公司),CFX Connect荧光定量PCR仪(Bio-Rad公司)。
1.2 植物培养和接种本氏烟和辣椒(Capsicum annuum)均栽培于含有无菌土的塑料杯中,置于22–25 ℃、16 h/8 h光暗交替温室,生长4–6周后使用。
灌根接种本氏烟前2 h进行浇灌,以保证接种时土壤湿润。接种时,每株本氏烟的根部滴加5 mL辣椒疫霉游动孢子悬浮液(1×106孢子/mL),以接种无菌水的本氏烟作为对照。
吸取1 mL的游动孢子悬浮液(500个/μL)置于1.5 mL离心管中。取健康的辣椒植株,去除根部后置于游动孢子悬浮液中,于25 ℃避光孵育12 h。
1.3 核酸提取利用Zelaya-Molina等(2011)[24]的方法提取辣椒疫霉菌丝的基因组DNA。利用RNAiso Plus提取疫霉或植物样品的总RNA,然后用DNase I处理去除RNA中残余基因组DNA的污染,再使用RNA纯化试剂盒对RNA样品进行纯化。用1%琼脂糖凝胶电泳检测基因组DNA和总RNA的完整性,并用紫外分光光度法进行浓度和纯度分析。
1.4 PcAvh2的序列多态性分析 1.4.1 PCR扩增:基于辣椒疫霉基因组数据库(https://genome.jgi.doe.gov/Phyca11/Phyca11.home.html)中的基因序列(序列ID 107349),利用软件Primer 3 (http://primer3.ut.ee/)设计引物对PcAvh2-snpF/R (表 2)。RXLR效应子基因均无内含子,利用高保真DNA聚合酶和基因特异引物对辣椒疫霉基因组DNA进行扩增。PCR扩增体系含有:10×High Fidelity buffer 2 µL,DNA 100-300 ng,上下游引物(10 µmol/L)各1 µL,Mg2+ (25 mmol/L) 1.2 µL,dNTPs (2.5 mmol/L) 2 µL,Platinum Taq DNA聚合酶(5 U/µL) 0.2 µL,无菌水补齐到20 µL。PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72℃ 1 min,31个循环;72 ℃ 5 min。
| Primer | Sequence (5′→3′)* | Purpose |
| PcAvh2-RTF | TCATGGCTTTTCTTCGAGGT | Sense primer for RT-qPCR analysis |
| PcAvh2-RTR | TCAGCCACGTCTCGTACAAC | Antisense primer for RT-qPCR analysis |
| Ubc-RTF | GCGCATCTACCACTGCAAC | Sense primer for RT-qPCR analysis |
| Ubc-RTR | GACAGCAGCACCTTGGAGA | Antisense primer for RT-qPCR analysis |
| PcAvh2-snpF | TGTCACCGCTACAAATTCCA | Sense primer for SNP analysis |
| PcAvh2-snpR | TTGAAACGAGGCGAAAGACT | Antisense primer for SNP analysis |
| M13-47 | CGCCAGGGTTTTCCCAGTCACGAC | Sense primer for TA insert sequencing |
| RV-M | GAGCGGATAACAATTTCACACAGG | Antisense primer for TA insert sequencing |
| PcAvh2SP-ClaIF | GCCGATCGATATGGCTTCGGTCGACGAAAATAAG | Sense primer for pGR106 cloning |
| PcAvh2SP-NotIR | ATAGCGGCCGCTTAGACTGCGAGATGCGAG | Antisense primer for pGR106 cloning |
| PcAvh2-ClaIF | GCCGATCGATATGAGGCTGTTGTTCTGGAC | Sense primer for gene silencing |
| PcAvh2-BsiWIR | CGCGTACGGACTGCGAGATGCGAGTACT | Antisense primer for gene silencing |
| *Restriction sites in primer sequences are underlined. Primers were designed using Primer 3 (http://primer3.ut.ee/) based on the gene models (PcAvh2 ID 107349 and Ubc ID 510705) from the P. capsici genome database (https://genome.jgi.doe.gov/Phyca11/Phyca11.home.html). | ||
1.4.2 克隆、测序与分析:
利用胶回收试剂盒纯化回收PCR产物后,将其克隆进TA载体pMD19-T。重组质粒转化进DH5α后,利用M13通用引物对M13-47/RV-M (表 2)和上面的体系进行菌落PCR,将筛选出的阳性克隆送至南京金斯瑞公司进行序列测定。利用BioEdit软件对序列进行剪接、拼接、蛋白翻译和序列比对。
1.5 农杆菌浸润利用引物对PcAvh2SP-ClaI F/NotI R (表 2)和Cla Ⅰ、Not Ⅰ位点将PcAvh2克隆到pGR106,通过电转化技术导入农杆菌GV3101菌株中。转化子接种于3 mL、含有50 μg/mL卡那霉素的液体LB培养基中,于28 ℃恒温摇床振荡(220 r/min)培养48 h。然后4000 r/min离心4 min收集菌体,用10 mmol/L MgCl2溶液重新悬浮菌体,再次离心。重复3次后,用10 mmol/L MgCl2定容至菌体悬浮液吸光值OD600=0.4–0.6。取由上至下第3至第6片完全展开的本氏烟真叶渗透接种农杆菌。用无菌针头在叶片下表皮造成一个微小伤口,用无针头的注射器将20–30 μL农杆菌悬浮液注射到本氏烟叶片中,同一叶片上同时注射对照pGR106::Gfp和10 mmol/L MgCl2溶液。间隔24 h后,每个注射点分别再次注射相同量的含Inf1、Bax、PsCRN63、PsAvh241、PsojNIP及Avr3a/R3a的农杆菌。本氏烟置于22 ℃的温室培养,48 h后连续观察并记录叶片注射部位症状。
1.6 PcAvh2的转录水平分析 1.6.1 cDNA合成:分别取Pc537接种后1.5、3、6、12、24、36和72 h的本氏烟根部,以及辣椒疫霉菌丝、游动孢子囊、游动孢子和萌发休止孢的RNA样品,依据Chen等(2013)[20]的方法,利用反转录酶M-MLV (RNase H-)和引物Oligo d(T)18将纯化过的RNA反转录成第1链cDNA。依次取Oligo d(T)18 (50 μmol/L) 1 μL、总RNA (700 ng/μL) 1 µL和无核酸酶水4 µL,置入冰浴的不含核酸酶的PCR管中。混匀离心PCR管5 s后,于70 ℃孵育10 min,然后迅速置于冰上冷却5 min。离心PCR管5 s,往管中继续加入下列试剂:5×M-MLV Buffer 2 μL,dNTPs (各10 mmol/L) 0.5 µL,Recombinant RNase Inhibitor (40 U/μL) 0.3 μL,反转录酶M-MLV (200 U/μL) 0.3 μL,无核酸酶水0.9 µL。快速混匀后离心5 s,于42 ℃孵育1 h,然后70 ℃孵育15 min,再置于冰上5 min。
1.6.2 qPCR:将第1链cDNA溶液稀释10倍用于PCR扩增。20 µL的PCR扩增体系含有:iQ SYBR Green Supermix 10 μL,引物对PcAvh2-RTF/RTR (表 2) (10 µmol/L)各0.4 μL,第1链cDNA 100–300 ng,无菌水补足到20 μL。PCR反应在荧光定量PCR仪上进行,程序为:95 ℃预变性3 min;95 ℃变性10 s,56 ℃退火30 s,在退火及延伸阶段检测荧光强度,收集信号,共40个循环。扩增结束后,做熔解曲线分析以检测扩增产物的特异性:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以温度为横坐标,荧光强度的变化值为纵坐标制作熔解曲线,如熔解曲线为单峰时用于后续分析。将基因组DNA以10倍梯度稀释5–7次,并以稀释的DNA为模板进行qPCR扩增;以模板量的对数为横坐标,Ct值(PCR反应过程中荧光信号到达设定的域值时所经历的循环数)为纵坐标制作标准曲线,计算扩增效率E (E=10–1/直线斜率)。基因表达的数据分析采用Pfaffl (2001)[25]的方法进行,泛素连接酶基因Ubc (序列ID 510705) (表 2)为内参基因[20]。每个样品设置3个技术重复。实验重复3次,均得到一致的结果。
1.7 PcAvh2基因的沉默和表型分析利用引物对PcAvh2-ClaIF/BsiWIR (表 2)和酶切位点Cla Ⅰ、BsiW Ⅰ将PcAvh2克隆到pTORmRFP4。利用CaCl2-PEG介导的原生质体转化法[8],将重组载体pTORmRFP4::PcAvh2转入辣椒疫霉Pc537原生质体中,再生后获得20个抗G418 (37.5 μg/mL)的转化子。转入pTORmRFP4的菌株为转化对照。利用半定量RT-PCR分析接种本氏烟12 h后转化子中PcAvh2基因的转录水平,筛选基因沉默转化子。
取健康本氏烟植株从上至下第3至第6片完全展开的真叶,反面朝上置于垫有湿润滤纸的无菌培养皿中,在主叶脉两侧接种10 μL (500个/μL)游动孢子悬浮液。叶片左侧接种转化对照菌株的游动孢子,左侧接种基因沉默转化子。叶片置于25 ℃避光孵育,连续观察叶片的发病情况。48 h后将本氏烟叶片在Farmer’s溶液(乙酸、乙醇和氯仿体积比为1:6:3)中浸泡30 s后,再浸没于0.05%的Trypan Blue溶液中,在25 ℃黑暗孵育12 h。用超纯水漂洗干净叶片表面的染料后,利用95%乙醇对叶片进行水浴脱色。对叶片进行拍照并测量叶片病斑直径。被染成蓝色的为死亡的植物细胞。
2 结果和分析 2.1 PcAvh2的序列多态性经PCR扩增,获得了辣椒疫霉PcAvh2的基因组和cDNA序列(NCBI登录号MH106712),编码的蛋白长度为160个氨基酸,N端头21个氨基酸为信号肽序列,含有典型的RXLR和dEER基序(图 1)。经过与辣椒疫霉基因组数据库中序列的比对,发现该基因为单拷贝基因,不存在旁系同源基因。本研究利用PCR高保真扩增技术分析PcAvh2在31个辣椒疫霉菌株(表 1)中的序列多态性。经比对发现,在辣椒疫霉群体中PcAvh2存在10个等位基因序列(表 1,图 1),它们的信号肽序列一样,对应的成熟肽序列中在11个位点存在序列多态性(图 1),但未检测到自然选择压力作用位点。通过PCR扩增,发现烟草疫霉和恶疫霉也含有该效应子,序列分别属于第2组和第5组(表 1,图 1),但未在其他卵菌如荔枝疫霉(P. litchii)、瓜类疫霉(P. melonis)和植物腐霉(Phytopythium helicoides)中检测到该效应子。结果表明,PcAvh2可能是普遍存在于辣椒疫霉、烟草疫霉和恶疫霉中的一个保守的RXLR效应子,且在辣椒疫霉群体中具有10个等位基因。

|
| 图 1 辣椒疫霉群体中PcAvh2的10个等位基因对应的蛋白序列 Figure 1 Protein sequences of 10 PcAvh2 alleles in the P. capsici population. The red arrow indicates the cleavage site of signal peptide. RXLR-dEER motif is denoted by red boxes. |
2.2 PcAvh2基因在辣椒疫霉的侵染阶段上调表达
为了解PcAvh2在侵染过程中的作用,分别提取游动孢子接种1.5、3、6、12、24、36、72 h后的本氏烟根部总RNA,同时提取辣椒疫霉4个生长发育阶段(菌丝、孢子囊、游动孢子和萌发休止孢)的总RNA,分析PcAvh2基因在侵染和生长发育阶段的转录水平。结果(图 2)发现,在侵染初期PcAvh2的表达量很低,随着侵染时间的延长表达量逐渐上升,在接种72 h后表达量达到最高值;在生长发育阶段,仅在菌丝和萌发休止孢阶段检测到该基因的微弱表达。结果说明,该效应子在侵染阶段特异上调表达,参与了辣椒疫霉的侵染过程。
|
| 图 2 PcAvh2基因在侵染和生长发育阶段的转录特征 Figure 2 The transcriptional pattern of PcAvh2 during the infection and developmental stages of P. capsici. MY, vegetative mycelia; SP, sporangia; ZO, zoospores; GC, germinating cysts; 1.5-72 h, N. benthamiana roots at 1.5, 3, 6, 12, 24, 36, 72 hours post-inoculation. Sterile water and cDNA from sterile water-inoculated plants were used as negative control templates in RT-qPCR. |
2.3 PcAvh2抑制植物免疫反应
为分析PcAvh2是否具有毒性功能,本研究在本氏烟叶片中先表达该效应子,24 h后在同一注射点再表达触发本氏烟免疫反应的效应子(激发PTI的INF1、PsojNIP,激发ETI的PsCRN63、PsAvh241、R3a/Avr3a,以及激发植物细胞死亡的细胞凋亡因子BAX),观察PcAvh2是否具有抑制本氏烟免疫反应的毒性功能。这6个效应子激发本氏烟产生的PTI或ETI免疫反应为类似HR的细胞死亡[20]。结果发现,PcAvh2能够抑制所有效应子触发的免疫反应(图 3),表明它可能在辣椒疫霉侵染寄主植物的过程中发挥重要作用。

|
| 图 3 PcAvh2抑制效应子触发的本氏烟免疫反应 Figure 3 PcAvh2 suppresses plant immunity triggered by 6 different effectors (i.e. plant cell death inducers) in N. benthamiana. Inducers: A: P. infestans INF1; B: mouse BAX; C: P. sojae PsCRN63; D: P. sojae PsojNIP; E: P. sojae PsAvh241; F: the combination of P. infestans Avr3a and potato R3a. |
2.4 PcAvh2是辣椒疫霉侵染致病的毒性因子
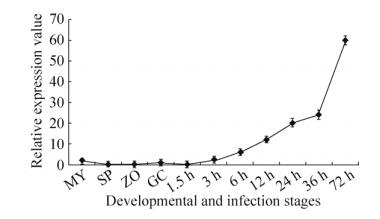
为进一步分析PcAvh2是否对辣椒疫霉的致病性具有重要作用,本研究利用CaCl2-PEG介导的原生质体稳定转化系统对PcAvh2基因进行了沉默分析。利用重组载体pTORmRFP4::PcAvh2转化辣椒疫霉原生质体,共获得20个G418抗性转化子。利用RT-PCR分析抗性转化子中PcAvh2基因的转录水平(在接种本氏烟12 h后),共获得3个基因沉默转化子,分别命名为S2、S6和S9 (图 4)。
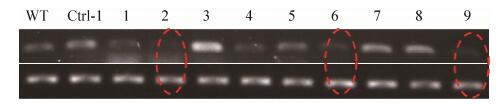
|
| 图 4 接种本氏烟12 h后不同菌株中PcAvh2基因的表达水平 Figure 4 The transcriptional level of PcAvh2 in different isolates at 12 h post-inoculation of N. benthamiana. The upper part is the transcripts of PcAvh2 while the lower part is the transcripts of the house-keeping NbEF1α gene in different isolates. WT, wild type isolate Pc537; Ctrl-1, mRFP-transgenic transformant; No. 1-9, representative transformants, of which 2, 6, 9 are PcAvh2-silenced transformants (namely S2, S6 and S9) indicated by red dotted circles. |
利用游动孢子悬浮液接种本氏烟,观察基因沉默是否导致辣椒疫霉致病力下降。与转化对照菌株Ctrl-1 (转入空载体pTORmRFP4)相比,PcAvh2基因的沉默导致辣椒疫霉对本氏烟的致病力显著下降(图 5)。利用游动孢子悬浮液接种辣椒幼苗茎秆,12 h后Ctrl-1菌株接种的辣椒幼苗茎秆出现水渍状病斑并且伴随着明显的缢缩,而沉默转化子(以S9为例)的接种结果与无菌水接种对照相似,并未出现肉眼可见的明显症状(图 5)。未发生PcAvh2基因沉默的转化子与Ctrl-1对照相比,毒性未出现改变。这些实验结果表明,效应子PcAvh2对于辣椒疫霉的致病性具有重要作用。

|
| 图 5 PcAvh2的沉默削弱了辣椒疫霉对寄主的致病力 Figure 5 Silencing of PcAvh2 compromises the virulence of P. capsici on host plants. A, B, C: Virulence activities of the P. capsici strains in N. benthamiana. The inoculated leaves were stained with trypan blue and discolored with ethanol. On the left of each leaf is the mRFP-transgenic control (Ctrl-1) while on the right of each leaf in order is S2 (A), S6 (B) and S9 (C). D: the virulence of the P. capsici strains on bell pepper stems. Mock means sterile water inoculation and arrows indicate the inoculation sites in parallel. E: Statistical analysis of lesion size in panels (A–C). Error bars are s.e. and the asterisks (*) denote statistically significant difference (Student t-test, P < 0.01). |
3 讨论
RXLR效应子在疫霉菌的进化和侵染致病中起着很重要的作用[9]。前期研究表明,疫霉菌物种之间存在一些保守的效应子,它们在疫霉菌致病过程中发挥重要作用[9]。例如,致病疫霉Avr3a在辣椒疫霉中存在同源蛋白PcAvr3a1,它可被烟草属多个种的R蛋白识别,导致这些种对辣椒疫霉产生非寄主抗性[19]。许静等进一步研究发现,辣椒疫霉中存在9个类似致病疫霉Avr3a的效应子,其中3个基因PcAvh128、PcAvh132、PcAvh134在疫霉菌侵染早期诱导表达,而且PcAvh128可以显著促进辣椒疫霉的侵染[22]。本研究克隆分析了辣椒疫霉中的PcAvh2,发现在烟草疫霉和恶疫霉中也存在该效应子;进一步分析发现,31个辣椒疫霉菌株中具有10个PcAvh2等位基因序列,其蛋白序列中11个位点具有多态性(图 1),但不存在自然选择压力作用的痕迹。这些结果说明效应子PcAvh2是疫霉菌中一个保守的效应子,可能具有重要的生物学功能。
转录研究结果显示,辣椒疫霉PcAvh2基因在生长发育阶段的表达量很低;在病原菌侵染的过程中随着时间的延长,其表达量逐渐升高,到接种后72 h达到最高值(图 2),这表明该效应子在辣椒疫霉的侵染过程中发挥重要的作用。该基因的转录模式与Wang等[11]提出的大豆疫霉RXLR效应子基因的三类表达模式(immediate-early effectors,early effectors,late effectors)不完全一致,可能与效应子的特异性或者互作系统有关。前期研究表明,侵染本氏烟18–42 h后,辣椒疫霉从活体营养阶段过渡到死体营养阶段[3]。因此,基于其转录表达特征,我们推测PcAvh2很有可能在活体和死体营养阶段都发挥了重要作用。
疫霉菌效应子具有触发或抑制植物免疫反应的功能[5]。利用农杆菌介导的PVX瞬时表达系统,我们分析发现PcAvh2不但可以抑制胞外效应子INF1、PsojNIP激发的PTI,而且可抑制胞内效应子PsCRN63、PsAvh241、R3a/Avr3a激发的ETI,以及细胞凋亡因子BAX引起的植物细胞死亡(图 3)。相关研究也发现,疫霉菌其他效应子如PsAvh328、Pc22053等也能抑制植物的免疫反应[9, 11, 20]。目前,多个疫霉菌RXLR效应子的植物靶标和作用机制得到了解析[9, 12-16]。例如,致病疫霉的Avr3a与马铃薯的E3泛素连接酶CMPG1互作,通过稳定CMPG1蛋白的活性以抑制INF1触发的植物免疫反应,从而促进病原菌的侵染[9];大豆疫霉的Nudix-RXLR效应子Avr3b以模拟植物防卫反应抑制因子的方式来抑制植物活性氧积累等免疫反应,从而干扰寄主植物抗病性[9]。这些相关研究结果对进一步分析PcAvh2通过何种信号途径,以何种方式抑制植物免疫反应的机制提供了重要的参考依据。
为进一步明确PcAvh2在辣椒疫霉侵染过程中的作用,我们对其进行基因沉默分析。结果发现,该基因的沉默导致辣椒疫霉对寄主植物的致病力显著下降(图 5),这说明PcAvh2是辣椒疫霉侵染致病中的重要毒性因子。由于疫霉菌的遗传特性和分子操作的困难,目前利用遗传工具仅分析了少数几个效应子的功能。最近,CRISPR/Cas9基因敲除系统在大豆疫霉中得到了成功应用[26],我们随即也在辣椒疫霉中成功建立了该系统。但是,在本研究中我们未能获得PcAvh2的基因敲除突变体。是否该效应子是一个非常保守且具有重要生物学功能的蛋白?敲除该基因是否导致辣椒疫霉丧失活力?目前并不清楚。然而,PcAvh2的沉默未导致辣椒疫霉的生物学性状(如生长速率、游动孢子形成等)出现异常。是否由于基因沉默引起的是基因的表达水平下调(knock-down)而不是基因从基因组的完全剔除(knock-out)才未导致辣椒疫霉出现异常?该效应子控制的是哪个生物学过程?要回答这些问题,还需要开展深入研究,比如明确PcAvh2作用的植物靶标蛋白以及参与的信号途径或生物学过程。这些结果也将为寻找新的植物抗病资源提供重要依据。
本研究通过基因克隆、转录分析、农杆菌浸润和基因沉默,对辣椒疫霉中一个RXLR型效应子PcAvh2进行了分析,鉴定它为辣椒疫霉中一个重要的毒性因子,也是烟草疫霉和恶疫霉中保守的效应子。这些结果为进一步阐明该效应子的生物学功能奠定了坚实基础。
| [1] | Erwin DC, Ribeiro OK. Phytophthora diseases worldwide. St Paul: American Phytopathological Society, 1996. |
| [2] | Kamoun S, Furzer O, Jones JDG, Judelson HS, Ali GS, Dalio RJD, Roy SG, Schena L, Zambounis A, Panabières F, Cahill D, Ruocco M, Figueiredo A, Chen XR, Hulvey J, Stam R, Lamour K, Gijzen M, Tyler BM, Grünwald NJ, Mukhtar MS, Tomé DFA, T r M, Van Den Ackerveken G, McDowell J, Daayf F, Fry WE, Lindqvist-Kreuze H, Meijer HJG, Petre B, Ristaino J, Yoshida K, Birch PRJ, Govers F. The top 10 oomycete pathogens in molecular plant pathology. Molecular Plant Pathology, 2015, 16(4): 413-434. DOI:10.1111/mpp.2015.16.issue-4 |
| [3] | Lamour KH, Stam R, Jupe J, Huitema E. The oomycete broad-host-range pathogen Phytophthora capsici. Molecular Plant Pathology, 2012, 13(4): 329-337. DOI:10.1111/j.1364-3703.2011.00754.x |
| [4] | Jones JDG, Dangl JL. The plant immune system. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [5] | Kamoun S. A catalogue of the effector secretome of plant pathogenic oomycetes. Annual Review of Phytopathology, 2006, 44: 41-60. DOI:10.1146/annurev.phyto.44.070505.143436 |
| [6] | McGowan J, Fitzpatrick DA. Genomic, network, and phylogenetic analysis of the oomycete effector arsenal. mSphere, 2017, 2(6): e00408-17. |
| [7] | Whisson SC, Boevink PC, Moleleki L, Avrova AO, Morales JG, Gilroy EM, Armstrong MR, Grouffaud S, van West P, Chapman S, Hein I, Toth IK, Pritchard L, Birch PRJ. A translocation signal for delivery of oomycete effector proteins into host plant cells. Nature, 2007, 450(7166): 115-118. DOI:10.1038/nature06203 |
| [8] | Dou DL, Kale SD, Wang X, Jiang RHY, Bruce NA, Arredondo FD, Zhang XM, Tyler BM. RXLR-mediated entry of Phytophthora sojae effector Avr1b into soybean cells does not require pathogen-encoded machinery. Plant Cell, 2008, 20(7): 1930-1947. DOI:10.1105/tpc.107.056093 |
| [9] | Anderson RG, Deb D, Fedkenheuer K, McDowell JM. Recent progress in RXLR effector research. Molecular Plant-Microbe Interactions, 2015, 28(10): 1063-1072. DOI:10.1094/MPMI-01-15-0022-CR |
| [10] | Boutemy LS, King SRF, Win J, Hughes RK, Clarke TA, Blumenschein TMA, Kamoun S, Banfield MJ. Structures of Phytophthora RXLR effector proteins: a conserved but adaptable fold underpins functional diversity. Journal of Biological Chemistry, 2011, 286(41): 35834-35842. DOI:10.1074/jbc.M111.262303 |
| [11] | Wang QQ, Han CZ, Ferreira AO, Yu XL, Ye WW, Tripathy S, Kale SD, Gu B, Sheng YT, Sui YY, Wang XL, Zhang ZG, Cheng BP, Dong SM, Shan WX, Zheng XB, Dou DL, Tyler BM, Wang YC. Transcriptional programming and functional interactions within the Phytophthora sojae RXLR effector repertoire. Plant Cell, 2011, 23(6): 2064-2086. DOI:10.1105/tpc.111.086082 |
| [12] | Boevink PC, Wang XD, McLellan H, He Q, Naqvi S, Armstrong MR, Zhang W, Hein I, Gilroy EM, Tian ZD, Birch PRJ. A Phytophthora infestans RXLR effector targets plant PP1c isoforms that promote late blight disease. Nature Communications, 2016, 7: 10311. DOI:10.1038/ncomms10311 |
| [13] | Huang J, Gu LF, Zhang Y, Yan TX, Kong GH, Kong L, Guo BD, Qiu M, Wang Y, Jing MF, Xing WM, Ye WW, Wu Z, Zhang ZG, Zheng XB, Gijzen M, Wang YC, Dong SM. An oomycete plant pathogen reprograms host pre-mRNA splicing to subvert immunity. Nature Communications, 2017, 8(1): 2051. |
| [14] | Kong L, Qiu XF, Kang JG, Wang Y, Chen H, Huang J, Qiu M, Zhao Y, Kong GH, Ma ZC, Wang Y, Ye WW, Dong SM, Ma WB, Wang YC. A Phytophthora effector manipulates host histone acetylation and reprograms defense gene expression to promote infection. Current Biology, 2017, 27(7): 981-991. DOI:10.1016/j.cub.2017.02.044 |
| [15] | Qiao YL, Shi JX, Zhai Y, Hou YN, Ma WB. Phytophthora effector targets a novel component of small RNA pathway in plants to promote infection. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(18): 5850-5855. DOI:10.1073/pnas.1421475112 |
| [16] | Yang LN, McLellan H, Naqvi S, He Q, Boevink PC, Armstrong M, Giuliani LM, Zhang W, Tian ZD, Zhan J, Gilroy EM, Birch PRJ. Potato NPH3/RPT2-like protein StNRL1, targeted by a Phytophthora infestans RXLR effector, is a susceptibility factor. Plant Physiology, 2016, 171(1): 645-657. DOI:10.1104/pp.16.00178 |
| [17] | Wang Y, Bouwmeester K, van de Mortel JE, Shan WX, Govers F. A novel Arabidopsis-oomycete pathosystem: differential interactions with Phytophthora capsici reveal a role for camalexin, indole glucosinolates and salicylic acid in defence. Plant, Cell & Environment, 2013, 36(6): 1192-1203. |
| [18] | Lamour KH, Mudge J, Gobena D, Hurtado-Gonzales OP, Schmutz J, Kuo A, Miller NA, Rice BJ, Raffaele S, Cano LM, Bharti AK, Donahoo RS, Finley S, Huitema E, Hulvey J, Platt D, Salamov A, Savidor A, Sharma R, Stam R, Storey D, Thines M, Win J, Haas BJ, Dinwiddie DL, Jenkins J, Knight JR, Affourtit JP, Han CS, Chertkov O, Lindquist EA, Detter C, Grigoriev IV, Kamoun S, Kingsmore SF. Genome sequencing and mapping reveal loss of heterozygosity as a mechanism for rapid adaptation in the vegetable pathogen Phytophthora capsici. Molecular Plant-Microbe Interactions, 2012, 25(10): 1350-1360. DOI:10.1094/MPMI-02-12-0028-R |
| [19] | Vega-Arreguín JC, Jalloh A, Bos JI, Moffett P. Recognition of an Avr3a homologue plays a major role in mediating nonhost resistance to Phytophthora capsici in Nicotiana species. Molecular Plant-Microbe Interactions, 2014, 27(8): 770-780. DOI:10.1094/MPMI-01-14-0014-R |
| [20] | Chen XR, Xing YP, Li YP, Tong YH, Xu JY. RNA-Seq reveals infection-related gene expression changes in Phytophthora capsici. PLoS One, 2013, 8(9): e74588. DOI:10.1371/journal.pone.0074588 |
| [21] |
Ma LL, Wang YJ, Sun BH, Chen SS, Zhang XG. Preliminary exploration for expression, purification and crystallization of RxLR101012 from Phytophthora capsici. Journal of Shandong Agricultural University (Natural Science Edition), 2017, 48(2): 210-214.
(in Chinese) 马璐璐, 王玉姣, 孙柏华, 陈姗姗, 张修国. 辣椒疫霉效应因子RxLR101012的表达纯化与结晶初探. 山东农业大学学报(自然科学版), 2017, 48(2): 210-214. DOI:10.3969/j.issn.1000-2324.2017.02.009 |
| [22] |
Xu J, Zhang MX, Ye TY, Shen DY, Dou DL. Identification and functional analysis of PiAvr3a-like genes in Phytophthora capsici. Acta Phytopathologica Sinica, 2016, 46(2): 160-168.
(in Chinese) 许静, 张美祥, 叶廷跃, 沈丹宇, 窦道龙. 辣椒疫霉菌PiAvr3a-like基因的鉴定及功能分析. 植物病理学报, 2016, 46(2): 160-168. |
| [23] |
Yang N, Zhang L, Ding P, Wang LY, Liu SY, Zhang XG. Functional analysis of an effector RxLR121504 in Phytophthora capsici. Mycosystema, 2017, 36(9): 1233-1242.
(in Chinese) 杨楠, 张丽, 丁鹏, 王俪颖, 刘淑艳, 张修国. 辣椒疫霉效应分子RxLR121504功能特性的研究. 菌物学报, 2017, 36(9): 1233-1242. |
| [24] | Zelaya-Molina LX, Ortega MA, Dorrance AE. Easy and efficient protocol for oomycete DNA extraction suitable for population genetic analysis. Biotechnology Letters, 2011, 33(4): 715-720. DOI:10.1007/s10529-010-0478-3 |
| [25] | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29(9): e45. DOI:10.1093/nar/29.9.e45 |
| [26] | Fang YF, Cui LK, Gu B, Arredondo F, Tyler BM. Efficient genome editing in the oomycete Phytophthora sojae using CRISPR/Cas9. Current Protocols in Microbiology, 2017, 44(1): 21A.1.1-21A.1.26. |
 2018, Vol. 58
2018, Vol. 58