中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 高旭红, 曲星梅, 周雅婷, 张恩平. 2018
- Xuhong Gao, Xingmei Qu, Yating Zhou, Enping Zhang. 2018
- 饲用微生物的分离鉴定及其对杏鲍菇菌糠发酵的效果
- Isolation and identification of forage microbial community and its effect on the fermentation quality of Pleurotus eryngii substrate
- 微生物学报, 58(12): 2110-2122
- Acta Microbiologica Sinica, 58(12): 2110-2122
-
文章历史
- 收稿日期:2017-12-12
- 修回日期:2018-03-10
- 网络出版日期:2018-03-30
菌糠(spent mushroom substrate,SMS)是指采菇后的食用菌栽培基质,主要成分为锯末、玉米芯、农业秸秆残渣和菇根。我国是世界第一食用菌生产大国,2015年食用菌产量达到3500万t,占世界总量的73.5%[1]。工厂化生产食用菌的同时会产生1.5-2.0倍量的菌糠,菌糠的饲料化利用,既可缓解我国饲料资源紧张状况,也能解决食用菌企业废弃物排放污染问题。
制约菌糠饲料化利用的因素主要有两方面,一是菌糠中纤维素含量高难以被家畜消化利用,二是其疏松多孔的原料特性容易发生霉变或滋生致病菌[2]。生物发酵处理是改善菌糠适口性、提高营养价值、防止霉变、延长保存时间的有效途径。不同的微生物菌株具有不同的泌酶活性与发酵特性。酵母菌与乳酸菌作为最常用的益生菌,既可将发酵基质部分转化成菌体蛋白,提高其营养价值,同时也产生风味物质以改善饲料适口性;枯草芽孢杆菌具有很高的蛋白酶与淀粉酶活性[3]。因此,构建多菌株复合菌剂,用于改善发酵饲料品质的研究受到专家学者和饲料生产企业的广泛关注。李红亚等[4]使用两种解淀粉芽孢杆菌使玉米秸秆木质纤维素含量显著降低;郑有坤等[5]发现同时使用酵母菌和乳酸菌发酵香菇菌糠比二者单独使用更能提升营养成分含量,并且可以延长饲料保质期;顾拥建等[6]在青贮大豆秸秆时发现,乳酸菌和纤维素酶复合添加组与其他单菌发酵组相比感官评分最高,酸性洗涤纤维含量最低。
目前针对杏鲍菇菌糠发酵的专用复合菌剂的研究较少,市售产品发酵效果不够理想。本试验用定量和定性相结合的方法,筛选具有较强纤维素酶分泌活性及抑菌活性的芽孢杆菌、酵母菌和乳酸菌,复合后发酵杏鲍菇菌糠,旨在改善发酵产物风味、促进纤维素降解、抑制有害细菌生长、提高菌糠饲料饲用价值,为饲用微生物发酵菌剂创制和菌糠饲料资源化利用提供技术支持。
1 材料和方法 1.1 菌种来源芽孢杆菌、乳酸菌和酵母菌分离自用EM原液发酵的杏鲍菇菌糠;黄曲霉菌和大肠埃希氏菌O157:H7购自北京北纳创联生物技术研究院。
1.2 发酵饲料原料试验用菌糠(NDF 53.02%、ADF 37.16%)取自陕西省国人菌业产业科技园有限公司,为出菇一次的杏鲍菇菌糠;麸皮(NDF 35.78%、ADF 11.48%)、红糖、食盐购自当地市场。
1.3 培养基 1.3.1 LB液体培养基(培养芽孢杆菌):蛋白胨10 g、酵母提取物5 g、氯化钠10 g,蒸馏水1 L。
1.3.2 PDA液体培养基(培养酵母菌):使用葡萄糖马铃薯培养基(02-023,奥博星,北京)。
1.3.3 MRS液体培养基(培养乳酸菌):牛肉膏10.0 g,蛋白胨10.0 g,酵母膏5.0 g,葡萄糖20.0 g,吐温80 1.0 g,磷酸氢二钾2.0 g,乙酸钠5.0 g,柠檬酸三铵2.0 g,硫酸镁0.2 g,硫酸锰0.05 g,蒸馏水1 L。
1.3.4 MRS-Ca培养基(筛选乳酸菌):在MRS固体培养基中加入20%的碳酸钙。
1.3.5 纤维素-刚果红培养基(筛选纤维素分解菌):磷酸氢二钾2.5 g,硫酸镁1.25 g,纤维素粉10.0 g,刚果红1 g (单独灭菌后加入),琼脂20.0 g,蒸馏水1 L。
1.3.6 苯胺蓝(Azure-B)培养基(筛选木质素分解菌):在灭菌后的PDA培养基中加入0.01 g/L单独灭菌的Azure-B溶液。
1.3.7 纤维素酶产酶培养基:在配置好的营养液[4]中加入1%羧甲基纤维素钠(CMC)。
1.3.8 木质素酶产酶培养基[7]:在配置好的营养液[4]中加入0.1%的碱木质素。
相应的固体培养基在液体培养基成分的基础上加入1.5%的琼脂;培养基灭菌条件均为121 ℃灭菌30 min。
1.4 乳酸菌、芽孢杆菌、酵母菌的筛选 1.4.1 富集培养(菌悬液的制备):无菌称量饲料样品5 g,放入盛有45 mL无菌生理盐水和玻璃珠的三角瓶中,160 r/min、30 ℃振荡30 min,静置10 min,上清液即为菌悬液。
1.4.2 初筛:使用无菌生理盐水对菌悬液进行梯度稀释,取3个合适梯度涂板于3种筛选培养基上,37 ℃培养24-48 h后挑取形态不同且有水解圈的单菌落,在相应的基础培养基上纯化培养至菌落形态一致;其中,酵母菌的挑选通过观察其形态(在平板上菌落呈乳白色,圆形,表面湿润光滑,不透明,黏稠,有光泽,中间凸起明显,边缘整齐,易挑起)和气味(打开平板后可闻到发酵香气)进行挑选。
1.4.3 种子液的制备:将解冻的菌液以4%的比例接种到液体基础培养基中,37 ℃、160 r/min恒温摇床(除乳酸菌厌氧、静置培养,下同)培养过夜(12 h)。
1.4.4 粗酶液的制备:将种子液以4%的比例接种到产酶培养基中,37 ℃、160 r/min恒温摇床培养24 h后10000 r/min离心15 min后取上清液。
1.4.5 复筛:先对初筛的菌株用管碟法筛选出纤维素和木质素酶活较高的菌株并进行菌属鉴定。再对鉴定出的芽孢杆菌测定纤维素和木质素酶活;酵母菌测定纤维素酶活;乳酸菌进行抑菌活性和产酸能力的测定。
1.5 管碟法将初筛得到的菌株分别用纤维素和木质素产酶培养基制备粗酶液,取100 μL点样于纤维素刚果红和苯胺蓝平板的微孔(6 mm),在4 ℃扩散8 h后于37 ℃避光静置培养36 h观察并记录脱色圈的有无及大小。
1.6 纤维素酶活性的测定葡萄糖标准曲线的绘制参考梁艳玲[8]的方法。使用纤维素产酶培养基制备粗酶液。
1.6.1 羧甲基纤维素酶活力(CMCase activities,CMCA)的测定:取3支试管分别加入450 μL 1% CMC (pH 5.5),在50 ℃水浴锅预热2 min后加入100 μL粗酶液继续保温30 min,接着立即加入1 mL DNS煮沸5 min后冷却至室温。用移液枪取出200 μL加入96孔酶标板中,用酶标仪测定OD540值,根据葡萄糖标准曲线计算纤维素酶活力。以煮沸灭活30 min的粗酶液作为对照组,用于调零。
1.6.2 滤纸酶活力(FPase activities,FPA)的测定:取3支试管分别加入50 mg(1 cm×6 cm)滤纸条、1 mL pH 5.5的柠檬酸-柠檬酸钠缓冲溶液,在50 ℃水浴锅预热2 min后加入500 μL粗酶液继续保温60 min,再加入2 mL DNS试剂煮沸5 min,对照组设定及比色方法同CMCA酶活力的测定。
1.7 木质素酶活性的测定使用木质素酶产酶培养基制备粗酶液。锰过氧化物酶(MnP)活性和漆酶(Lac)活性的测定参考Holt等[9]的方法,木质素过氧化物酶(LiP)活性的测定参考高云航等[10]的方法。
1.8 抑菌活性的测定微孔板法测定乳酸菌抑菌活性[11]:按照公式(1)计算。将待测乳酸菌种子液接种于5 mL MRS液体培养基中,37 ℃静置培养26 h,测定OD600 (OD1)值后将菌液10000 r/min离心10 min,取上清液测定pH值并于4 ℃留样备用。取无菌的96孔细菌培养板,每孔加入190 μL粗酶液和10 μL大肠埃希氏菌O157:H7菌液/黄曲霉菌孢子悬液(104 CFU/mL)。在37 ℃条件下静置培养48 h后于酶标仪下测定其OD600(OD2)值。每个乳酸菌发酵液进行3孔平行实验,结果取其平均值。
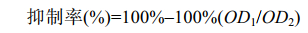
|
公式(1) |
在MRS液体培养基中接种4%的乳酸菌种子液,37 ℃培养12 h后,每4 h测定不同菌株发酵液pH及OD600,绘制不同菌株生物量对应发酵液pH的变化曲线。
1.10 菌种的鉴定芽孢杆菌、乳酸菌总DNA的提取使用细菌基因组提取试剂盒(D3350-01,Omega,广州);酵母菌使用酵母基因组提取试剂盒(D3370-01,Omega,广州),以待测菌株的基因组DNA为模板,细菌用16S rDNA通用引物F27/R1492、真菌用18S rDNA通用引物NS1/NS8扩增其DNA片段,将PCR产物送西安擎科泽西生物科技有限责任公司测序,应用NCBI BLAST在线分析工具对测序结果进行同源性比对,确定菌株类型。
1.11 杏鲍菇菌糠发酵试验将筛选保存的芽孢杆菌、酵母菌和乳酸菌菌液按照1.4.3中制备种子液的方法活化2代后等体积混合(现配现用),制成复合菌剂。以杏鲍菇菌糠为主要原料,混合5%麸皮、0.3%红糖和0.85%食盐作为发酵基质。试验组接种4%复合菌剂,对照组添加等量的无菌液体培养基,将发酵基质在饲料搅拌器中混合均匀,调节水分含量至40%,装袋密封,每袋净含量1 kg,每个处理3个重复,于30 ℃恒温培养箱中发酵。发酵开始后,每隔48 h测定1次发酵杏鲍菇菌糠的pH及乳酸含量,待含量稳定后终止发酵,取样测定饲料营养成分,并与使用相同工艺发酵7 d后的EM原液发酵杏鲍菇菌糠进行饲用品质的比较分析。
1.12 杏鲍菇菌糠品质评定 1.12.1 感官鉴定:从色泽、气味、质地等方面对杏鲍菇菌糠发酵饲料进行感官评价。
1.12.2 营养物质含量测定:取4 g发酵饲料鲜样,加入40 mL去离子水浸提40 min后用pH酸度计测定pH值;取发酵饲料鲜样用羟基联苯比色法测定乳酸(lactic acid,LA)含量[11]。发酵结束后将样品于65 ℃烘干恒重后粉碎过40目筛,装袋备用。干物质(dry matter,DM)含量使用冠亚水分测定仪测出水分后计算得到;酸性洗涤纤维(acid detergent fiber,ADF)和中性洗涤纤维(neutral detergent fiber,NDF)使用全自动纤维测定仪(A2000i,ANKOM,美国)测定,方法参考仪器说明书;粗灰分(crude ash,CA)按照GB /T 6438-2007测定;粗蛋白(crude protein,CP)按照GB/T 6432-94测定;粗脂肪(ether extract,EE)按照GB/T 14772-2008测定。
1.12.3 黄曲霉毒素B1(aflatoxin B1,AFB1)测定:使用黄曲霉毒素B1酶联免疫(ELISA)试剂盒(Beacon,美国)检测,方法参照产品说明书。
1.13 数据统计分析数据经Excel初步处理后用SPSS 20.0统计软件进行单因子方差分析(one-way ANOVA),多重比较采用Duncan’s法,结果用“平均数±标准差”表示,以“P < 0.05”为差异显著性判断标准。使用Graphpad Prism 6软件进行图表的绘制。
2 结果和分析 2.1 纤维素和木质素降解菌的复筛本试验经过初筛和复筛得到32株菌,其中纤维素、木质素降解菌22株、疑似酵母菌4株、疑似乳酸菌6株。对在纤维素和木质素筛选培养基上有脱色圈的疑似芽孢杆菌用管碟法进一步筛选,有纤维素、木质素降解能力的菌株在纤维素-刚果红(图 1-A)和苯胺蓝(图 1-B)培养基上可形成明显的透明圈,部分菌株试验效果如图 1所示。由表 1可知,菌株L6、L9、MU1、MU9、P1、P5、P7、P10、P11和P14在纤维素-刚果红培养基上的脱色能力相对强,表明这10株菌的纤维素酶活性较高;菌株L6、L9、MU1、MU3、MU6、MU7、P1、P2、P5和P10在苯胺蓝培养基上的脱色能力相对强,表明这10株菌木质素酶活较高。
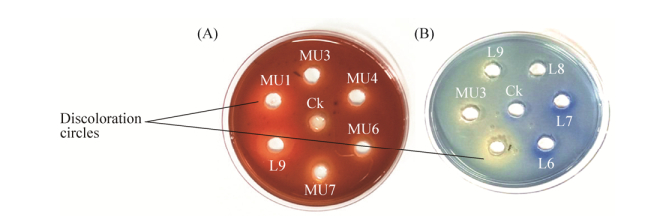
|
| 图 1 部分菌株在纤维素-刚果红(A)和苯胺蓝(B)培养基上形成的透明圈 Figure 1 Transparent circles on the cellulose-Congo red (A) and Azure-B (B) medium of some strains cultured. |
| Number | Congo red discoloration circles | Azure-B discoloration circles |
| L1 | + | + |
| L6 | +++ | ++ |
| L9 | +++ | ++ |
| MU1 | +++ | +++ |
| MU3 | + | +++ |
| MU4 | + | + |
| MU6 | + | ++ |
| MU7 | + | +++ |
| MU8 | + | - |
| MU9 | +++ | + |
| MU10 | + | + |
| MU11 | + | + |
| MU12 | + | + |
| P1 | ++ | +++ |
| P2 | + | +++ |
| P5 | ++ | +++ |
| P6 | + | + |
| P7 | +++ | + |
| P10 | ++ | +++ |
| P11 | +++ | + |
| P12 | + | + |
| P14 | ++ | + |
| "-" means no decolorization, "+, ++, +++" means decolorization circle gradually become larger. | ||
2.2 菌株的分子鉴定结果
对管碟法筛选出的菌株进行鉴定,将测序获得的细菌16S rRNA和真菌18S rDNA基因序列信息在NCBI数据库中进行BLAST相似性比对,所有序列与数据库中已知基因序列的相似性均为97%-100%。经鉴定得到13株芽孢杆菌、4株酵母菌和乳酸菌6株,结果见表 2。
| Reference strains | Number | Identity/% | Strains number |
| Bacillus | |||
| Bacillus subtilis strain JCM 1465 | L6、P7 | 99 | 2 |
| Bacillus tequilensis strain 10b | L9、MU6、MU9、P1、P5、P11 | > 98 | 6 |
| Bacillus methylotrophicus strain CBMB205 | MU1、MU3、P2、P10 | 99 | 4 |
| Bacillus amyloliquefaciens subsp. plantarum strain FZB42 | MU7 | 99 | 1 |
| Yeast | |||
| Pichia fermentans strain ATCC 10651 | R8 | 98 | 1 |
| Saccharomyces cerevisiae strain JCABSC21 | P9 | 99 | 1 |
| Kluyveromyces marxianus strain W103 | MU5 | 99 | 1 |
| Saccharomyces cerevisiae strain ySR127 | P15 | 99 | 1 |
| Lactic acid bacteria | |||
| Weissella paramesenteroides strain NRIC 1542 | R1、R4 | 99 | 2 |
| Pediococcus acidilactici strain DSM 20284 | R2、R3、R9 | > 97 | 3 |
| Lactobacillus brevis strain ATCC 14869 | R7 | 99 | 1 |
2.3 降解纤维素芽孢杆菌和酵母菌的筛选
不同株芽孢杆菌和酵母菌的纤维素酶活性测定结果如图 2所示,芽孢杆菌P11的CMCA酶活性显著高于其他菌株(P < 0.05);FPA酶活性与菌株MU1差异不显著(P > 0.05),但显著高于其他菌株(P < 0.05) (图 2-A)。酵母菌R8的CMCA酶活性及MU5的FPA酶活性显著高于其他菌株(P < 0.05) (图 2-B)。

|
| 图 2 不同株芽孢杆菌(A)和酵母菌(B)的纤维素酶活性 Figure 2 Cellulase activity of different Bacillus (A) and yeast (B) strains. The same colour bar chart with different letters mean significant difference (P < 0.05), while the same letters mean no significant difference (P > 0.05), the same as below. |
2.4 降解木质素芽孢杆菌的筛选
不同株芽孢杆菌的木质素酶活性测定结果如图 3所示,MU7的MnP和LiP酶活性显著高于其他菌株(P < 0.05);Lac酶活性与菌株MU1、MU3及MU6差异不显著(P > 0.05),但显著高于其他菌株(P < 0.05)。
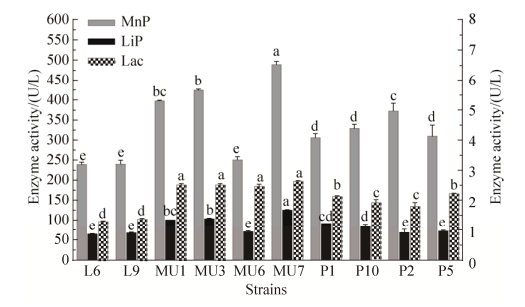
|
| 图 3 不同株芽孢杆菌的木质素酶活性 Figure 3 Ligninase activity of different Bacillus strains. |
2.5 具有抑菌活性乳酸菌的筛选
乳酸菌抑菌活性测定结果见图 4,乳酸菌在培养48 h后的抑菌活性均在60%以上,其中菌株R4、R9的大肠埃希氏菌O157:H7和黄曲霉菌抑菌活性与菌株R1、R2差异不显著(P > 0.05),但显著高于R3和R7(P < 0.05)(图 4-A)。乳酸菌在培养前16 h pH极速下降且各菌株呈现对数生长期,之后pH缓慢下降、OD600值稳定增加,直到28 h左右基本保持稳定。此时,R9和R4的产酸能力相较其他菌株强,pH值降至4.5 (图 4-B)。
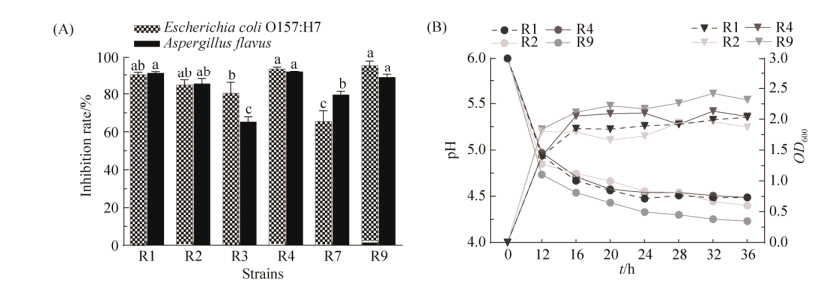
|
| 图 4 不同株乳酸菌的抑菌活性(A)及产酸速率曲线(B) Figure 4 Antibacterial activity (A) and acid production rate curve (B) of different lactic acid bacteria strains. |
依据上述试验结果,选用纤维素酶活较高的特基拉芽孢杆菌P11、发酵毕赤酵母R8和马克斯克鲁维应变酵母MU5;木质素酶活较高的解淀粉芽孢杆菌MU7;抑菌活性较高的类肠膜魏斯氏菌R4和乳酸片球菌R9作为发酵杏鲍菇菌糠复合菌剂的组成菌株。
2.6 复合菌剂对发酵杏鲍菇菌糠品质的影响将筛选的6种菌株菌液等量混合,按1.4.5方法进行杏鲍菇菌糠发酵试验,发酵过程取样检测结果见表 3。由表 3可知,与对照组相比,复合菌剂添加组杏鲍菇菌糠的pH、NDF、ADF和AFB1含量在发酵第3天显著降低(P < 0.05);LA含量在发酵第3天和第5天显著增高(P < 0.05),第7天下降至发酵前水平后趋于稳定,故在第7天终止发酵。发酵第7天,复合菌剂添加组的NDF和ADF含量降至最低,且显著低于对照组(P < 0.05),发酵3 d后复合菌剂添加组的AFB1含量显著低于相同发酵阶段的对照组(P < 0.05)。
| Items | Fermentation time/d | ||||||||||
| Control group | Compound microbial inoculants added group | ||||||||||
| 0 | 3 | 5 | 7 | 9 | 0 | 3 | 5 | 7 | 9 | ||
| pH | 5.35± 0.04a | 5.4± 0.01a | 5.28± 0.08b | 5.25± 0.01b | 5.4± 0.08a | 5.35± 0.04a | 4.66± 0.04c | 4.53± 0.03d | 4.66± 0.01c | 4.58± 0.03d | |
| LA/% | 0.05± 0.00c | 0.03± 0.01c | 0.13± 0.04b | 0.03± 0.01c | 0.03± 0.00c | 0.05± 0.00c | 0.16± 0.00a | 0.14± 0.03ab | 0.04± 0.03c | 0.03± 0.00c | |
| NDF/% | 47.06± 0.82a | 44.73± 0.79bc | 43.38± 1.08c | 43.53± 1.24c | 39.74± 0.94e | 47.06± 0.82a | 45.22± 0.78b | 41.53± 0.54d | 38.59± 0.67e | 39.74± 0.6e | |
| ADF/% | 30.43± 1.45a | 29.12± 1.05ab | 27.92± 0.05bc | 28.03± 0.89bc | 26.2± 0.74d | 30.43± 1.45a | 28.62± 0.94b | 26.65± 0.64cd | 25.39± 0.71d | 25.66± 0.36d | |
| AFB1/(μg/kg) | 4.89± 0.21a | 5.1± 0.65a | 1.5± 0.44c | 1.95± 0.73bc | 2.29± 0.31b | 4.89± 0.21a | 0.73± 0.36d | 1.49± 0.13c | 1.94± 0.02bc | 1.85± 0.16bc | |
| In the same row, values with different small letter superscripts mean significant difference (P < 0.05), while with same letter superscripts mean no significant difference (P > 0.05). | |||||||||||
发酵结束后,复合菌剂添加组杏鲍菇菌糠质地松散,颜色呈黄褐色,气味芳香,无菌斑;对照组在发酵到第5天有菌斑和结块的现象。
2.7 两种发酵杏鲍菇菌糠饲用品质的评价市售EM原液与复合菌剂发酵7 d后的杏鲍菇菌糠饲用品质指标测定结果见表 4,复合菌剂发酵组的DM、NDF、ADF含量显著低于EM原液发酵组(P < 0.05),CP、CA和EE含量显著高于EM原液发酵组(P < 0.05),由此可见本试验发酵工艺条件下,杏鲍菇菌糠的饲用价值得到提高。
| Items | Pleurotus eryngii substrate fermented by EM solution | Pleurotus eryngii substrate fermented by composite microbial inoculants | P-value |
| DM | 70.00±1.56 | 63.75±1.68 | < 0.05 |
| NDF | 48.00±1.00 | 38.59±0.67 | < 0.05 |
| ADF | 32.32±1.49 | 25.39±0.71 | < 0.05 |
| CP | 9.39±0.15 | 10.37±0.08 | < 0.05 |
| CA | 11.03±0.04 | 11.61±0.04 | < 0.05 |
| EE | 0.17±0.02 | 0.38±0.06 | < 0.05 |
| “P < 0.05” means there is a significant difference between two groups. | |||
综合评价,复合菌剂添加组的各项指标表现优于对照组,饲用价值高于EM原液发酵的杏鲍菇菌糠;发酵进行到第7天时杏鲍菇菌糠的pH值、LA含量趋于稳定,纤维含量最低,AFB1含量小于20 μg/kg,符合国家饲料卫生要求。因此,使用复合菌剂发酵杏鲍菇菌糠,发酵时间以7 d为宜。
3 讨论 3.1 有纤维素和木质素降解能力芽孢杆菌与酵母菌的筛选木质纤维素是由木质素、纤维素以及半纤维素组成的有机物质,存在于木本、草本植物的细胞壁中,分子结构稳定且不易降解[13]。尽管许多微生物能分解单独存在的纤维素,但由于在细胞壁中纤维素受到木质素的保护而阻碍了纤维素的分解[14-15]。所以,想要更好地降解菌糠中的纤维就要同时使用能够分解木质素和纤维素的微生物菌种。
芽孢杆菌由于其非致病性、分解纤维素能力较强、生长速率快等优点被广泛用作高纤饲料生物处理的菌种。有诸多学者分离出能够有效分解纤维素[16-18]和木质素[19-20]的芽孢杆菌。本试验利用纤维素-刚果红筛选培养基中的刚果红可使CMC着色但不能将小分子低聚糖类物质着色的原理定性筛选纤维素分解菌,得到10株脱色圈明显的细菌;再结合CMCA和FPA两种纤维素酶活性的测定,较为全面地评价菌株产纤维素酶能力的大小,由此筛选出了纤维素酶活较高的特基拉芽孢杆菌P11。木质素的强降解作用依赖于LiP及MnP的产生[21],这两种酶能够使加有Azure-B的平板脱色,因此根据平板上菌落周围脱色圈的大小和脱色速度的快慢可初步衡量菌株分解木质素能力的大小[22]。本试验用上述方法筛选到10株芽孢杆菌,再定量测定LiP、MnP和Lac三种参与木质素分解的重要酶活,综合评定得到一株木质素酶活较高的解淀粉芽孢杆菌MU7。
酵母菌根据其作用可分成两类:一类是有较高发酵速率和完全发酵能力的酿酒酵母;另一类是对发酵食品风味的形成有着重要作用的非酿酒酵母[23]。有研究发现酵母菌[24-26]也可分泌纤维素酶,只是产量和酶活性不高,但可以确定的是酵母菌参与的多菌发酵有利于降解纤维素[27]。本试验筛选出一株纤维素酶活性相对较高的发酵毕赤酵母R8 (非酿酒酵母)和马克斯克鲁维应变酵母MU5 (酿酒酵母),既兼顾到降解纤维功能的需求又能改善菌糠饲料风味。
3.2 有抑菌能力乳酸菌的筛选杏鲍菇菌糠在栽菇生长和堆积存放的过程中容易滋生霉菌或携带大肠杆菌、沙门氏菌等病原微生物,这些有害菌会严重因影响饲料品质,降低饲料效价。因此采取安全有效的方法对杏鲍菇菌糠饲料进行脱毒处理尤为重要。使用抗生素防治饲料细菌毒素污染虽然简便易行,但其带来的负面影响已引起人们的严重关切,因而逐渐被生物脱毒方式取代。乳酸菌能够产生有机酸、细菌素、过氧化氢等具有抑菌活性的代谢产物[28]。研究人员已分离出能够抑制大肠埃希氏菌[29-31]和黄曲霉菌[32-33]生长的乳酸菌。由于不同菌株的产酸性能和抑菌效果不同,本试验通过对乳酸菌抑菌活性和产酸性能测定最终获得两株抑菌率在90%以上的菌株,经鉴定分别是类肠膜魏斯氏菌和乳酸片球菌。乳酸片球菌属于同型发酵乳酸菌,可快速产生大量乳酸从而迅速降低发酵饲料的pH,抑制有害微生物的生长;类肠膜魏斯氏菌属于异型发酵乳酸菌,虽然产酸能力低于同型发酵乳酸菌,但可产生能有效抑制霉菌的乙酸[34]。这两株菌合并使用可更好地发挥抑菌作用,延长发酵饲料的保存时间。
3.3 复合菌剂对发酵杏鲍菇菌糠品质的影响菌糠主要由木屑、棉籽壳、玉米芯、农业秸秆等高纤维原料组成,因其适口性差、消化率低,阻碍了菌糠的饲料化利用。生物发酵能有效降解纤维素,改善饲料风味。本研究结果表明,使用复合菌剂发酵的杏鲍菇菌糠气味芳香,质地松软,pH保持在4.66左右,AFB1含量显著降低。与发酵前相比NDF降低了18.00%,ADF降低了16.56%,CP、CA和EE含量分别达到10.37%、11.61%和0.38%;与市售EM原液发酵的杏鲍菇菌糠相比,NDF和ADF分别降低了19.6%和21.44%;CP、CA和EE含量分别提高了10.44%、5.26%和123.53%,饲用价值显著提高(P < 0.05)。郑有坤等[5]用乳酸菌和酵母菌发酵香菇菌糠,15 d后的NDF和ADF降解率分别为7.32%和4.66%;庄益芬等[35]使用纤维素酶处理灵芝菌糠,14 d后NDF和ADF含量呈下降趋势,但与发酵前差异不显著(P > 0.05);Kim等[36]用乳酸菌发酵平菇菌糠,10 d后气味评分提高,NDF和ADF降解率分别为2.11%和4.85%。本研究筛选的复合菌剂发酵杏鲍菇菌糠,纤维降率均高于上述研究案例,且发酵周期短,为杏鲍菇菌糠饲料发酵菌剂开发提供了良好范例。
4 结论本试验分离筛选得到了2株酵母菌株(发酵毕赤酵母R8和马克斯克鲁维应变酵母MU5)、2株芽孢杆菌(特基拉芽孢杆菌P11和淀粉芽孢杆菌MU7)、2株乳酸菌(类肠膜魏斯氏菌R4和乳酸片球菌R9)组成复合菌剂发酵的杏鲍菇菌糠饲料具有感官好、纤维降解率高、毒素含量低的优点,显著提高了杏鲍菇菌糠的饲用品质。
| [1] |
Zhang P, Zheng ZA, Zhao ZSY. Development and countermeasures of edible fungus industry in China. Northern Horticulture, 2017(22): 167-174.
(in Chinese) 张平, 郑志安, 赵祖松颖. 我国食用菌产业发展变化及对策分析. 北方园艺, 2017(22): 167-174. |
| [2] | Chu GM, Yang JM, Kim HY, Kim CH, Song YM. Effects of fermented mushroom (Flammulina velutipes) by-product diets on growth performance and carcass traits in growing-fattening Berkshire pigs. Animal Science Journal, 2012, 83(1): 55-62. DOI:10.1111/asj.2012.83.issue-1 |
| [3] | Yang CX, Wang T, Gao LN, Yin HJ, Lü X. Isolation, identification and characterization of lignin-degrading bacteria from Qinling, China. Journal of Applied Microbiology, 2017, 123(6): 1447-1460. DOI:10.1111/jam.2017.123.issue-6 |
| [4] |
Li HY, Li W, Li SN, Wang SX, Li M, Tian MM, Zhu BC. Analysis of the degradation of corn stalk fermented by complex bacteria composed of two Bacillus amyloliquefaciens strains. Acta Prataculturae Sinica, 2017, 26(6): 153-167.
(in Chinese) 李红亚, 李文, 李术娜, 王树香, 李猛, 田苗苗, 朱宝成. 解淀粉芽孢杆菌复合菌剂对玉米秸秆的降解作用及表征. 草业学报, 2017, 26(6): 153-167. |
| [5] |
Zheng YK, Yi M, Chen JZ, Gu YF, Zhang XP. Influence of microorganism fermentation on feed quality of spent mushroom compost of Lentinula edodes. Southwest China Journal of Agricultural Sciences, 2013, 26(3): 1143-1147.
(in Chinese) 郑有坤, 易敏, 陈建州, 辜运富, 张小平. 微生物发酵对香菇菌糠饲料品质的影响. 西南农业学报, 2013, 26(3): 1143-1147. DOI:10.3969/j.issn.1001-4829.2013.03.059 |
| [6] |
Gu YJ, Zhan JS, Sha WF, Zhu J, Zhan K, Lin M, Zhang WY. Effect of Lactobacillus and cellulase on fermentation quality and nutrition composition of ensiled soybean straw. Cereal & Feed Industry, 2016, 12(3): 52-55.
(in Chinese) 顾拥建, 占今舜, 沙文锋, 朱娟, 詹康, 林淼, 张维有. 乳酸菌和纤维素酶对青贮大豆秸秆的发酵品质和营养成分的影响. 粮食与饲料工业, 2016, 12(3): 52-55. |
| [7] |
Si MY, Shi DQ, Dai YZ, Chen YH. Screening of high active lignin-degrading strains and the measurement of their lignin degradation. Guangxi Sciences, 2015, 21(1): 48-52, 59.
(in Chinese) 司梦莹, 师德强, 戴友芝, 陈跃辉. 高效木质素降解菌的筛选及降解性能研究. 广西科学, 2015, 21(1): 48-52, 59. DOI:10.3969/j.issn.1005-9164.2015.01.008 |
| [8] | 梁艳玲.产纤维素酶细菌的分离、鉴定及地类芽孢杆菌ME27-1产酶条件优化.南宁: 广西大学硕士学位论文, 2014. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_D525331 |
| [9] | Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. Bergey's manual of determinative bacteriology 9th ed. Ballimore, USA: Williams and Wilkins, 1994. |
| [10] |
Gao YH, Wang W, Liu M, Gou CL, Lou YJ, Ma HX. Isolation, identification and optimization of fermentation conditions of lignin decomposition bacterium and decolorization bacteria in termite gut. Journal of Shanghai Jiaotong University (Agricultural Science Edition), 2014, 32(5): 12-19.
(in Chinese) 高云航, 王巍, 刘萌, 勾长龙, 娄玉杰, 马红霞. 白蚁肠道木质素分解菌、染料脱色菌的分离鉴定及产酶条件优化. 上海交通大学学报(农业科学版), 2014, 32(5): 12-19. DOI:10.3969/J.ISSN.1671-9964.2014.05.003 |
| [11] | Gerez CL, Torres MJ, de Valdez GF, Rollán G. Control of spoilage fungi by lactic acid bacteria. Biological Control, 2013, 64(3): 231-237. DOI:10.1016/j.biocontrol.2012.10.009 |
| [12] |
Luo J, Lin BS, He YQ, Yang XY. Comparative analysis of analytical methods of lactic acid content in microbial fermentation feeds. Feed Review, 2012(5): 37-39.
(in Chinese) 罗建, 林标声, 何玉琴, 杨小燕. 微生物发酵饲料中乳酸含量的测定方法比较分析. 饲料博览, 2012(5): 37-39. DOI:10.3969/j.issn.1001-0084.2012.05.014 |
| [13] |
Bao WY, Jiang JW, Zhou Y, Wu YF, Liang ZQ. Screening and genomic analysis of a lignocellulose degrading bacterium. Acta Microbiologica Sinica, 2016, 56(5): 765-777.
(in Chinese) 鲍文英, 江经纬, 周云, 吴玉峰, 梁志清. 一株木质纤维素降解菌的筛选及其全基因组分析. 微生物学报, 2016, 56(5): 765-777. |
| [14] | Mathews SL, Pawlak J, Grunden AM. Bacterial biodegradation and bioconversion of industrial lignocellulosic streams. Applied Microbiology and Biotechnology, 2015, 99(7): 2939-2954. DOI:10.1007/s00253-015-6471-y |
| [15] | Bugg TD, Ahmad M, Hardiman EM, Singh R. The emerging role for bacteria in lignin degradation and bio-product formation. Current Opinion in Biotechnology, 2011, 22(3): 394-400. DOI:10.1016/j.copbio.2010.10.009 |
| [16] |
Gao YH, Wang W, Li QJ, Ma HX, Lou YJ. Isolation, identification and enzyme-producing conditions optimization of lignin-utilizing and cellulose-utilizing bacterium from the gut of termite. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2013, 52(2): 84-89.
(in Chinese) 高云航, 王巍, 李秋菊, 马红霞, 娄玉杰. 白蚁肠道木质素及纤维素分解菌的分离鉴定及产酶条件优化. 中山大学学报(自然科学版), 2013, 52(2): 84-89. |
| [17] | Manhar AK, Bashir Y, Saikia D, Nath D, Gupta K, Konwar BK, Kumar R, Namsa ND, Mandal M. Cellulolytic potential of probiotic Bacillus subtilis AMS6 isolated from traditional fermented soybean (Churpi): An in-vitro study with regards to application as an animal feed additive. Microbiological Research, 2016, 186-187: 62-70. DOI:10.1016/j.micres.2016.03.004 |
| [18] | Manhar AK, Saikia D, Bashir Y, Mech RK, Nath D, Konwar BK, Mandal M. In vitro evaluation of celluloytic Bacillus amyloliquefaciens AMS1 isolated from traditional fermented soybean (Churpi) as an animal probiotic. Research in Veterinary Science, 2015, 99: 149-156. DOI:10.1016/j.rvsc.2015.01.008 |
| [19] |
Wang Q, Wang H, Li HY, Li SN. Isolation, identification and enzyme activity determination of a high effective lignin-degradation fungi LG-1. Feed Industry, 2016, 37(12): 47-52.
(in Chinese) 王全, 王会, 李红亚, 李术娜. 一株高效木质素降解菌株LG-1的筛选、鉴定及酶活测定. 饲料工业, 2016, 37(12): 47-52. |
| [20] | Sakpetch P, Hkittikun A, Chandumpai A. Isolation and screening of potential lignocellulolytic microorganisms from rubber bark and other agricultural residues. Agricultural Technology and Biological Sciences, 2017, 14(12): 953-967. |
| [21] |
Li HY, Li SN, Wang SX, Wang Q, Zhu BC. Screening, identification of lignin-degradating Bacillus MN-8 and its characteristics in degradation of maize straw lignin. Scientia Agricultura Sinica, 2014, 47(2): 324-333.
(in Chinese) 李红亚, 李术娜, 王树香, 王全, 朱宝成. 产芽孢木质素降解菌MN-8的筛选及其对木质素的降解. 中国农业科学, 2014, 47(2): 324-333. |
| [22] |
Zhang QF, Yu ZL. A strain of lignin-degrading bacteria's screening and optimization of enzyme-producing condition. Journal of Agricultural Science and Technology, 2014, 16(2): 143-148.
(in Chinese) 张庆芳, 于宗莲. 一株高效木质素降解细菌的筛选及产酶条件的优化. 中国农业科技导报, 2014, 16(2): 143-148. |
| [23] | Ciani M, Comitini F. Non-Saccharomyces wine yeasts have a promising role in biotechnological approaches to winemaking. Annals of Microbiology, 2011, 61(1): 25-32. |
| [24] |
Zhang LL, Wei XB, Ma G, Zhang RJ. Screening and identification of cellulase producing strains. Feed Industry, 2016, 37(14): 49-53.
(in Chinese) 张璐璐, 卫旭彪, 马广, 张日俊. 产纤维素酶酵母菌的筛选及鉴定. 饲料工业, 2016, 37(14): 49-53. |
| [25] |
Wang R, Wang LF, Yan DR, Zhao ZG, Liu L. Optimization of pilot-scale conditions of β-glucosidase fermentation by Pichia pastoris. Food Science and Technology, 2015, 40(12): 15-19.
(in Chinese) 王蕊, 王林风, 闫德冉, 赵子高, 刘乐. 毕赤酵母表达β-葡萄糖苷酶中试条件优化. 食品科技, 2015, 40(12): 15-19. |
| [26] | Kanti A. Carboxymethyl cellulose hydrolyzing yeast isolated from South East Sulawesi. Jurnal Biologi Indonesia, 2015, 11(2): 285-294. |
| [27] | Zuroff TR, Xiques SB, Curtis WR. Consortia-mediated bioprocessing of cellulose to ethanol with a symbiotic Clostridium phytofermentans/yeast co-culture. Biotechnology for Biofuels, 2013, 6: 59. DOI:10.1186/1754-6834-6-59 |
| [28] | Rabelo CHS, Basso FC, Lara EC, Jorge LGO, Härter CJ, Mesquita LG, Silva LFP, Reis RA. Effects of Lactobacillus buchneri as a silage inoculant and as a probiotic on feed intake, apparent digestibility and ruminal fermentation and microbiology in wethers fed low-dry-matter whole-crop maize silage. Grass and Forage Science, 2017, 73(1): 67-77. |
| [29] |
Wang J, Cai GL, Fang H, Lu J. Isolation and identification of a lactobacillus strain producing antibacterial material. Food and Fermentation Industries, 2016, 42(8): 38-43.
(in Chinese) 王娟, 蔡国林, 方华, 陆健. 产细菌素的饲用乳酸菌的分离与鉴定. 食品与发酵工业, 2016, 42(8): 38-43. |
| [30] | Demirbaş F, İspirli H, Kurnaz AA, Yilmaz MT, Dertli E. Antimicrobial and functional properties of lactic acid bacteria isolated from sourdoughs. LWT-Food Science and Technology, 2017, 79: 361-366. DOI:10.1016/j.lwt.2017.01.067 |
| [31] | Li CK, Chen YF, Kwok LY, Chen X, Yu HJ, Yang H, Yang J, Xue JG, Sun TS, Zhang HP. Identification of potential probiotic Lactobacillus plantarum isolates with broad-spectrum antibacterialactivity. Dairy Science & Technology, 2015, 95(3): 381-392. |
| [32] | Roger T, Léopold TN, Carl MMF. Effect of selected lactic acid bacteria on growth of Aspergillus flavus and aflatoxin B1 production in Kutukutu. Journal of Microbiology Research, 2015, 5(3): 84-94. |
| [33] | Olonisakin OO, Jeff-Agboola YA, Ogidi CO, Akinyele BJ. Isolation of antifungal lactic acid bacteria (LAB) from "Kunu" against toxigenic Aspergillus flavus. Preventive Nutrition and Food Science, 2017, 22(2): 138-143. |
| [34] |
Lei ZM, Wang JF, Wu JP, He YQ, Wu R, Jiang H, Wan XR. Effect of 5 strains of lactic acid bacteria with antibacterial activity on the corn silage quality. Acta Prataculturae Sinica, 2017, 26(11): 77-84.
(in Chinese) 雷赵民, 王建福, 吴建平, 何轶群, 吴润, 姜辉, 万学瑞. 5株优良抑菌活性乳酸菌对全株玉米青贮品质的影响. 草业学报, 2017, 26(11): 77-84. DOI:10.11686/cyxb2017145 |
| [35] |
Zhuang YF, Chen GF, Ye H, Chen XZ, Zhu XQ, Zhang WC. Effect of cellulase on feed quality and fermentation process of fermented Ganoderma lucidum substrate. Feed Research, 2015(3): 21-25, 31.
(in Chinese) 庄益芬, 陈国富, 叶杭, 陈鑫珠, 朱小清, 张文昌. 纤维素酶对灵芝菌糟发酵饲料品质和发酵进程的影响. 饲料研究, 2015(3): 21-25, 31. |
| [36] | Kim JS, Lee YH, Kim YI, Ahmadi F, Oh YK, Park JM, Kwak WS. Effect of microbial inoculant or molasses on fermentative quality and aerobic stability of sawdust-based spent mushroom substrate. Bioresource Technology, 2016, 216: 188-195. DOI:10.1016/j.biortech.2016.05.056 |
 2018, Vol. 58
2018, Vol. 58