中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 方恋, 龚泽龙, 林岱华, 黄胜和, 曹虹. 2018
- Lian Fang, Zelong Gong, Lin Daihua, Shenghe Huang, Hong Cao. 2018
- 口服微生态制剂对孕妇肠道和阴道大肠杆菌K1和B族链球菌定殖的干预
- Intervention on colonization of Escherichia coli K1 and Group B Streptococcus in the gut and vaginal of pregnant women by orally administrated probiotics
- 微生物学报, 58(11): 1989-1996
- Acta Microbiologica Sinica, 58(11): 1989-1996
-
文章历史
- 收稿日期:2018-05-01
- 修回日期:2018-07-16
- 网络出版日期:2018-08-02
2. 广东省第二人民医院产科, 广东 广州 510317
2. Guangdong Second Provincial General Hospital, Guangzhou 510317, Guangdong Province, China
新生儿中枢神经系统感染中最常见的是细菌性脑膜炎。新生儿细菌性脑膜炎最常见的病原体是B族链球菌(GBS)和大肠埃希菌(Escherichia coli)。研究表明,GBS在产妇胃肠道或生殖道定殖是引起侵入性新生儿感染的主要途径。目前临床上针对GBS感染的孕妇治疗方案主要以产时抗生素预防治疗为主,但长期使用抗生素会导致耐药问题。近几年,新生儿感染E. coli脑膜炎的报道越来越多,资料表明,E. coli已上升为主要致病菌之一[1]。孕妇肠道是E. coli的主要来源,定殖于肠道的E. coli可能因孕妇的特殊体质而容易转移至阴道,新生儿通过产道出生时便可能被感染。侵入性E. coli一旦经口或皮肤等进入新生儿肠道,因新生儿肠道屏障发育不完善,容易突破屏障而转移进入血液,E. coli随血液上行入脑,穿过血脑屏障进入中枢神经系统诱发脑膜炎。已有体外实验及动物实验证明,益生菌具有抑制新生儿细菌性脑膜炎病原菌黏附、侵袭和血性转移的功效[2],但尚缺乏临床数据验证,本研究拟对孕妇口服微生态制剂,探究其能否抑制脑膜炎主要致病菌的定殖,从而为益生菌预防新生儿细菌性脑膜炎提供初步的临床依据。
1 材料和方法 1.1 研究对象收集2011年至2017年期间在广东省范围(包括3家三甲医院)门诊就诊的孕晚期(35周)妊娠健康孕妇阴道、直肠分泌物,共2539例,进行GBS携带率调查。选择符合条件的47例E. coli K1检出阳性的妊娠32周孕妇参与口服益生菌抑制E. coli K1定殖实验,分成观察组(22例)和对照组(25例),其中观察组服用益生菌,对照组不服,分别于1周后、2周后和3周后取肠道、阴道标本进行E. coli K1检测。同时,选择符合要求的50例GBS检出阳性的35周孕妇参与口服益生菌抑制GBS定殖实验,随机分成观察组(25例)和对照组(25例),观察组服用益生菌,对照组不服,1周后取阴道、肠道标本进行B型链球菌检测。所有孕妇采样前遵循知情同意的原则,且随访性好,胎儿无异常,近3 d无性生活史,无阴道不适、阴道冲洗以及阴道用药,近1个月无阴道炎症及肠道炎症病史。
观察组孕妇所服益生菌为内蒙古双奇药业有限公司生产的金双歧,国药准字号S19980004,规格为0.5 g/片,内含长型双歧杆菌、嗜热链球菌和保加利亚乳杆菌,双歧杆菌长型的活菌大于0.5×107 CFU/片,嗜热链球菌和保加利亚乳杆菌的活菌大于0.5×106 CFU/片。使用方法:口服,1次4片,2次/日。
1.2 标本采集所有标本采集方法按试剂盒说明由产科医生完成。标本保存:取样后的标本放入保存液管中,拧紧管盖,常温条件下放置12–24 h,超过24 h应放入2–8℃冰箱,冷藏密封保存,拭子保存超过7 d应放置–20℃冰箱。
1.3 主要仪器和试剂B族链球菌核酸检测试剂盒(荧光PCR法)购自厦门泰普生物科学有限公司,DNA提取试剂盒购自天根生化科技公司,引物由广州艾基生物技术公司合成,Tris碱购自美国Sigma公司,2×Taq Mix购自北京康为世纪生物公司,DNAMAK I购自宝生物工程,SYBR Green购自TOYOBO公司。紫外分光光度计(美国BIO-RAD公司),DNA扩增仪PE9600 (美国BIO-RAD公司),ABI 7500荧光定量PCR仪(美国ABI公司),金属浴(厦门泰普生物科学中国有限公司),振荡仪(厦门泰普生物科学有限公司),不同规格的移液器(德国Eppendorf公司),不同规格的枪头、96孔板和封口膜(美国康宁Corning公司)。
1.4 荧光定量PCR检测E. coli K1参照细菌基因组DNA提取试剂盒说明书进行核酸提取,根据E. coli 16S rRNA设计通用引物为:上游引物5′-CATGCCGCGTGTATGAAGA-3′,下游引物5′-CGGGTA ACGTCAATGAGCAAA-3′。上游引物、下游引物分别与大肠杆菌全基因组比对,结果显示特异性好,扩增片段大小为95 bp。以下是其扩增片段“CATGCCGCGTGTATGAAGA AGGCCTTCGGGTTGTAAAGTACTTTCAGCGGG GAGGAAGGGAGTAAAGTTAATACCTTTGCTCA TTGACGTTACCCG”。标准品荧光定量PCR反应:总反应体系为20 μL,包括8.0 μL上述浓度梯度细菌的DNA模板,l.0 μL的上下游引物,2.0 μL ddH2O,8.0 μL SYBR-Green。反应条件为:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 45 s,40个循环;72 ℃ 10 min。熔解曲线95 ℃ 1 min,40 ℃ 1 min,65 ℃ 1 s,至95 ℃完成。实时荧光定量PCR仪处理直接给出定量结果。
1.5 荧光定量PCR检测GBS参照B族链球菌核酸检测试剂盒(厦门泰普生物科学有限公司),按反应管数n将GBS-PCR反应液43.3 μL×n,Taq DNA Polymerase 0.5 μL×n,Uracil N-Glycosylase (UNG) 0.2 μL×n加入离心管,振荡混匀,瞬时离心后,分装到n个PCR反应管中,每管45 μL,避光备用。各取待检样品,阳、阴性对照样品,在95 ℃干浴2 min后,立即冰浴2–5 min再以13000 r/min离心1 min,将上清液用于PCR扩增。分别加入待测样品和对照品5 μL至准备好的PCR反应管中,设置参数:37 ℃ 2 min;94 ℃ 2 min;94 ℃ 15 s,55 ℃ 45 s,10个循环;94 ℃ 15 s,55 ℃ 45 s,30个循环;进行PCR扩增。
1.6 统计学分析本研究通过采用SPSS 21.0软件进行统计学分析,其中用百分率(%)表示计数资料,采用χ2检验;用均数±标准差表示计量资料,采用t检验。重复测量数据采用重复测量方差法进行统计分析。图表制作采用软件GraphPad Prism 5.0,P < 0.05认为差异有统计学意义。
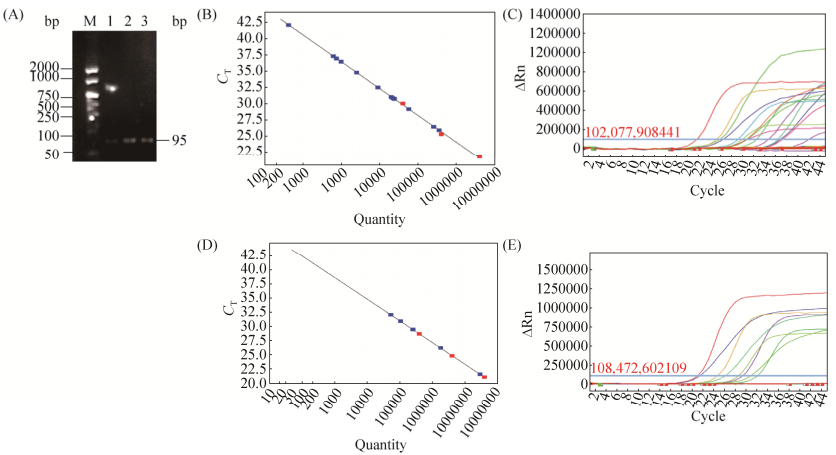
2 结果和分析 2.1 E. coli K1和GBS荧光定量PCR标准品制备和鉴定本实验采用绝对定量Real-time PCR法对孕妇肠道、阴道分泌物中E. coli K1和GBS定殖量进行检测,此法操作简单、结果准确,适合用于肠道相关分子微生态的研究。自孕妇直肠、阴道分泌物提取E. coli K1和GBS的DNA核酸后,用常规PCR法扩增设计引物所对应的目的片段,所获得目的片段用琼脂糖凝胶电泳鉴定(图 1-A)。凝胶回收后的E. coli和GBS的DNA样本即为进行荧光定量PCR的标准品。分光光度仪分别检测肠E. coli和GBS标准品OD600值,公式计算出PCR产物中所含的拷贝数。将标准品做连续10倍系列稀释并检测不同稀释度的CT值,分别获得E. coli K1的标准曲线(图 1-B,1-C)和GBS的标准曲线(图 1-D,1-E)。
|
| 图 1 荧光定量PCR检测E. coli和GBS标准品的分离及标准曲线 Figure 1 Standard curve and standards' isolation of Real time PCR for detecting E. coli and GBS. A: Different concentrations of E. coli electrophoresis; M: Marker; lane 1: specimen 3 μL; lane 2: 10 times diluted specimen; lane 3: 10 times diluted sample supernatant. B: Standard curve of E. coli. C: Amplification curve of E. coli. D: Standard curve of GBS. E: Amplification curve of GBS. |
2.2 益生菌服用前后孕妇大肠埃希菌定殖率显著降低
在E. coli K1携带孕妇中进行口服益生菌疗效实验,研究前分别对2组孕妇的基本资料进行差异分析,结果显示2组在年龄差别、经产妇比例和受教育水平3个方面比较均无显著差异(P > 0.05) (表 1),故本实验前通过随机分组所得的观察组和对照组具有可比性。
| Group | n | Age | Multipara | Education | |||
| High school | vocational degree | Bachelor degree | Master degree | ||||
| Observation group | 22 | 28.45±4.14 | 8 (36) | 4 (18) | 7 (32) | 6 (27) | 5 (23) |
| Control group | 25 | 28.04±3.96 | 10 (40) | 3 (12) | 8 (32) | 10 (40) | 4 (16) |
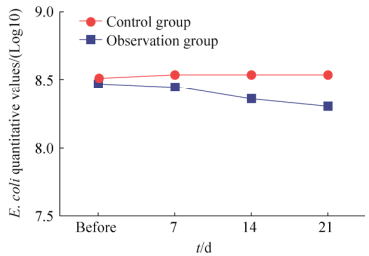
将结果对数值进行log10换算,重复测量数据用重复测量方差分析结果显示:(1)服用益生菌组(观察组)服药前后对比,直肠、阴道分泌物大肠杆菌定殖差异有统计学意义(F=32.866,P < 0.001),服用益生菌组(观察组)服用益生菌后标本内大肠杆菌的数量较服用益生菌前有降低趋势;(2)服用益生菌组(观察组)、未服用益生菌组(对照组)服药前后的大肠杆菌数量变化的趋势不同,差异有统计学意义(F=41.546,P < 0.001),服用益生菌组(观察组)与未服用益生菌组(对照组)比,观察组大肠杆菌数量降低幅度大于对照组(表 2、图 2)。
| Group | n | Before treatment | One week after treatment | Two weeks after treatment | Three weeks after treatment |
| Observation group | 22 | 8.48±0.28 | 8.45±0.28 | 8.37±0.29 | 8.31±0.29 |
| Control group | 25 | 8.52±0.32 | 8.54±0.32 | 8.54±0.31 | 8.54±0.32 |
|
| 图 2 服用益生菌前后E. coli定量变化 Figure 2 E. coli quantitative changes before and after oral administration of probiotics. |
2.3 益生菌服用前后孕妇B族链球菌定殖率有下降趋势
在GBS携带孕妇中进行口服益生菌疗效实验,研究前分别对2组孕妇的基本资料进行差异分析,结果显示2组在年龄差别、经产妇比例和受教育水平3个方面比较均无显著差异(P > 0.05) (表 3),故本实验前通过随机分组所得的观察组和对照组具有可比性。
| Group | n | Age | Multipara | Education | |||
| High school | vocational degree | Bachelor degree | Master degree | ||||
| Observation group | 25 | 28.76±3.89 | 6 (24) | 2 (8) | 10 (40) | 8 (32) | 5 (20) |
| Control group | 25 | 29.32±4.27 | 7 (28) | 3 (12) | 8 (32) | 10 (40) | 4 (16) |
将结果对数值进行log10换算,使用配对t检验方法分析。结果发现:观察组服用益生菌后B族链球菌数量有降低趋势,服用益生菌组(观察组)比未服用益生菌组(对照组)的B族链球菌定殖有降低趋势,但阴道、直肠分泌物B族链球菌数量差异无统计学意义(t=1.27,P=0.217)(表 4)。推测此原因可能与孕妇给药次数、观察时间不足和样本例数不够有关。
| Group | n | Before treatment | After treatment |
| Observation group | 25 | 5.00 ±1.42 | 4.95±0.97 |
| Control group | 25 | 4.77 ±0.81 | 4.82±0.79 |
2.4 产科门诊健康孕妇B型链球菌带菌率
通过荧光标记聚合酶链式扩增(PCR)法对孕晚期孕妇生殖道分泌物和直肠分泌物标本进行B族链球菌的检测,2539例孕晚期(35周)孕妇中共检出GBS携带者205例,带菌率为8.07%。
3 讨论妊娠期妇女B族链球菌(GBS)带菌率在不同地区的报道差异很大,在国外的调查研究中,法国孕妇GBS的带菌率约为13%-14%[3],德国约为21.1%[4],韩国约为10%[5]。在我国,目前孕妇GBS带菌情况未作大范围常规筛查,无法收集大样本的流行病学资料,在有条件的地区已有相关的GBS筛查文献报导。本研究中通过荧光定量PCR技术对广东省范围内的2539例孕晚期(35周)孕妇进行了GBS检测,其中共检出GBS携带者205例,带菌率为8.07%,与国内北京、河北秦皇岛、安徽等地区的研究调查相近。孕妇携带GBS可通过垂直传播等使新生儿获得病原菌,新生儿因防御体制发育不成熟,容易发生早期侵袭性感染,重者发展为败血症、细菌性脑膜炎。Singh T等学者收集2002–2012年间澳大利亚和新西兰新生儿早发型感染的数据进行回顾性分析,研究发现相比早发性GBS脓毒症死亡率(11%),E. coli早发性败血症的病死率(25%)更高[7]。
有研究显示益生菌可预防和治疗多种感染性疾病,在细胞实验、动物实验等都已很好地证实益生菌能对抗致病菌的黏附、侵袭作用[2, 6]。益生菌能通过上调肠道Mucin2抑制脑膜炎E. coli的黏附定殖[8],并促进内环境稳定,调节肠道微生态,从而发挥其抗感染功效[9-11]。目前,国内外有关益生菌在人体微生态环境内对病原菌黏附的抑制作用的研究较为成熟,但研究水平多停留在离体细胞和小鼠实验的层面上,以临床患者为对象设计的前瞻性研究甚少[9-10]。本研究选取3家广州市的三甲医院收集E. coli K1或GBS筛查阳性的孕妇例数,对孕晚期妇女肠道和阴道菌群进行益生菌干预的数据是在这一领域的深入研究。本实验从临床水平探究口服益生菌对孕妇微生态环境(生殖道和肠道内环境)中E. coli K1和GBS的定殖的疗效,从而预防新生儿在孕妇分娩过程中经产道感染血流播散性细菌性脑膜炎。设置实验组、对照两组,两组孕妇均居住在广州市,均予健康饮食宣教,排除了年龄、文化等差异,收集服药前后孕妇及对照组孕妇的直肠、阴道分泌物标本,经系列稀释后行荧光定量PCR检测服用益生菌组、对照组的孕妇微生态(肠道、阴道)内的E. coli和GBS定殖的数量变化。结果显示两组孕妇B族链球菌定殖无差异,但孕妇服用益生菌后其直肠、阴道分泌物内B族链球菌的定殖有减少趋势,故推测可能原因包括:(1)采集标本例数不够;(2)益生菌服用疗程过短。针对以上可能,将在后期研究中增加标本例数并延长益生菌疗程时间。而服用益生菌组孕妇的肠道、阴道标本E. coli定量值与对照组比较发生了明显的变化,将孕妇服益生菌前和服用后结果进行比较,可见孕妇在服益生菌后E. coli定量值低于服药前的数值,益生菌的服用导致大肠杆菌在肠道内的生长和粘附性均受到影响,提示孕妇服用益生菌能抑制E. coli的定殖。后续可增加研究例数,并追踪孕产妇及新生儿的结局,全面评价益生菌的作用。总之本研究结果为益生菌用于新生儿败血症和脑膜炎的早期预防提供了临床证据。
| [1] | Zhu ML, Mai JY, Zhu JH, Lin ZL. Clinical analysis of 31 cases of neonatal purulent meningitis caused by Escherichia coli. Chinese Journal of Contemporary Pediatrics, 2012, 14(12): 910-912. |
| [2] | Huang SH, He LN, Zhou YH, Wu CH, Jong A. Lactobacillus rhamnosus GG suppresses meningitic E. coli K1 penetration across human intestinal epithelial cells in vitro and protects neonatal rats against experimental hematogenous meningitis. International Journal of Microbiology, 2009, 2009: 647862. |
| [3] | Honderlick P, Gravisse J, Cahen P, Vignon D. Evaluation of 6 years of group B streptococcus (GBS) screening in near-term pregnant women. Pathologie Biologie, 2010, 58(2): 144-146. DOI:10.1016/j.patbio.2009.07.010 |
| [4] | Kunze M, Ziegler A, Fluegge K, Hentschel R, Proempeler, Berner R. Colonization, serotypes and transmission rates of group B streptococci in pregnant women and their infants born at a single University Center in Germany. Journal of Perinatal Medicine, 2011, 39(4): 417-422. |
| [5] | Hong JS, Choi CW, Park KU, Kim SN, Lee HJ, Lee HR, Choi EH, Park KH, Suh CS, Kim BI, Choi ST, Kim SS. Genital Group B Streptococcus carrier rate and serotype distribution in Korean pregnant women: implications for Group B Streptococcal disease in Korean neonates. Journal of Perinatal Medicine, 2010, 38(4): 373-377. |
| [6] | Jayashree S, Karthikeyan R, Nithyalakshmi S, Ranjani J, Gunasekaran P, Ranjendhran J. Anti-adhesion property of the potential probiotic strain Lactobacillus fermentum 8711 against methicillin-resistant Staphylococcus aureus (MRSA). Frontiers in Microbiology, 2018, 9: 411. DOI:10.3389/fmicb.2018.00411 |
| [7] | Singh T, Barnes EH, Isaacs D. Early-onset neonatal infections in Australia and New Zealand, 2002-2012. Archives of Disease in Childhood. Fetal and Neonatal Edition, 2018. DOI:10.1136/archdischild-2017-314671 |
| [8] | Yu JY, He XL, Puthiyakunnon S, Li Y, Wu LS, Peng WL, Gao J, Zhang YY, Boddu S, Long M, Cao H, Huang SH. Mucin2 is required for probiotic agents-mediated blocking effects on meningitic E. coli-induced pathogenicities. Journal of Microbiology and Biotechnology, 2015, 25(10): 1751-1760. DOI:10.4014/jmb.1502.02010 |
| [9] | Boirivant M, Strober W. The mechanism of action of probiotics. Current Opinion in Gastroenterology, 2007, 23(6): 679-692. DOI:10.1097/MOG.0b013e3282f0cffc |
| [10] | Kang HJ, Im SH. Probiotics as an immune modulator. Journal of Nutritional Science and Vitaminology, 2015, 61(Suppl): S103-S105. |
| [11] | Rojas MA, Lozano JM, Rojas MX, Rodriguez VA, Rondon MA, Bastidas JA, Perez LA, Rojas C, Ovalle O, Garcia-Harker JE, Tamayo Me, Ruiz GC, Ballesteros A, Archila MM, Arevalo M. Prophylactic probiotics to prevent death and nosocomial infection in preterm infants. Pediatrics, 2012, 130(5): e1113-e1120. DOI:10.1542/peds.2011-3584 |
 2018, Vol. 58
2018, Vol. 58