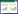中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 熊智, 王连荣, 陈实. 2018
- Zhi Xiong, Lianrong Wang, Shi Chen. 2018
- 肠道微生物组与宿主的表观遗传修饰
- Epigenetic regulation role of gut microbiome in host
- 微生物学报, 58(11): 1916-1925
- Acta Microbiologica Sinica, 58(11): 1916-1925
-
文章历史
- 收稿日期:2018-04-02
- 修回日期:2018-05-23
- 网络出版日期:2018-07-17
在真核生物中存在着多种重要的表观遗传修饰,如DNA甲基化、组蛋白修饰和非编码RNA等能够调控基因的表达[1]。研究表明,肠道微生物组可以通过影响宿主表观遗传过程继而引起某些疾病,如过敏反应、炎症性肠病(inflammatory bowel disease,IBD)、自身免疫病、代谢综合症、结直肠癌、压力相关疾病和神经发育紊乱等[2-4]。这些疾病的产生可能来自于肠道微生物组的微生态失调和代谢产物的改变。已有报道表明人体肠道内优势菌门和宿主甲基化模式具有重要关系,以厚壁菌门作为优势菌群的孕妇在某些基因启动子区域甲基化模式存在差异,这些基因会增加宿主患病风险[5];此外,肠道微生物组代谢产物的变化主要由饮食、年龄和有毒化学物质等环境因素引起的,大量数据显示短链脂肪酸(short-chain fatty acids,SCFAs)等肠道微生物组代谢产物对人体很多组织(包括结肠、肝脏和白色脂肪组织)具有重要影响,会提高其组蛋白乙酰化水平[6]。
20世纪中期,科学家们开始分析DNA甲基化和组蛋白修饰等表观遗传修饰,分析手段主要包括高效液相色谱、质谱分析和蛋白质印迹[7]。然而,逐渐发展的基因组重亚硫酸盐测序(whole- genome bisulfite sequencing,WGBS)、简化代表性重亚硫酸盐测序(reduced representation bisulfite sequencing,RRBS)、甲基化DNA免疫沉淀测序(methylated DNA immunoprecipitation sequencing,MeDIP-seq)和染色质免疫共沉淀测序(chromatin immunoprecipitation sequencing,ChIP-seq),以及近期兴起的包括单分子实时测序(single-molecular real-time sequencing,SMRT sequencing)和纳米孔测序(nanopore sequencing)在内的第三代基因测序技术等分析方法彻底变革了表观遗传学研究[8]。基于这些方法,研究者们逐步阐明了肠道微生物组和宿主表观遗传学修饰的相互关系。本文将综述肠道微生物组对宿主表观遗传学修饰的直接和间接影响,疾病中肠道微生物组和宿主表观修饰的相互关系以及它们在疾病诊断和治疗中的潜在应用。
1 肠道微生物组肠道微生物组是指寄居在人体和其他动物肠道内复杂微生物群落的总称,包括细菌、古菌、病毒和单细胞真核生物等,其中细菌最为丰富。肠道微生物组的研究手段主要为高通量测序,高通量DNA测序技术的兴起,从最初对细菌和古菌16S rRNA扩增后测序从而进行微生物组的鉴定和分类,到现在可以直接将肠道微生物组进行无需扩增的全基因组测序获取基因组功能、菌群分类与进化分布信息,使得人们不需要通过传统细菌培养法而可以直接对肠道样本进行检测。这种先进的技术能够分析不同环境下的微生物组(如肠道微生物组、土壤微生物组),以及同一环境下微生物组结构随着时间发生的变化。虽然不同个体之间肠道微生物组的组成存在差异性,相同个体内肠道微生物组在不同时间也有明显波动,但定殖于人体内的肠道微生物组都具有一些核心特征[9],如菌群结构的相对稳定。
宏基因组和宏转录组测序(来自cDNA文库)能够确定微生物组的潜在功能和实时活动,反映微生物代谢与宿主发育的相互作用。肠道微生物组能够影响宿主基因的调控、基因的表达[10],其中就包括对宿主表观修饰的调控。同样,宿主基因也能改变微生物组的结构和功能[11]。而且,对宿主基因组、肠道微生物组进行宏基因组和宏转录组联合分析能够阐明宿主-微生物组共生机制以及健康个体和疾病个体间的差异。随着技术的更新与发展,研究者可以利用鉴定和改造基因来探究更多的生物学途径,使得肠道微生物组的功能特点更加清楚明晰,这对于宿主的健康至关重要[12]。
2 宿主的表观遗传学修饰表观遗传学修饰不改变DNA序列,通过调控基因表达发挥功能来传递遗传信息,调控胞内代谢网络,帮助生命体适应复杂多变的生存环境。肠道微生物组的表观修饰包括DNA甲基化修饰、磷硫酰化修饰等,而宿主的表观修饰则更为复杂,除了甲基化之外,还含有组蛋白翻译后修饰等。
2.1 DNA甲基化修饰DNA甲基化主要是指胞嘧啶环上C-5位置在DNA甲基转移酶(DNA methyltransferases,DNMTs)的作用下加上一个甲基而形成的5-甲基胞嘧啶(5-methylcytosine,5mC)修饰,此外还包括4-甲基胞嘧啶(4-methylcytosine,4mC)和6-甲基腺嘌呤(6-methyladenine,6mA)修饰,这两种甲基化在哺乳动物中丰度相对较低。原核生物中,除了抵御外源DNA入侵,甲基化主要参与了胞内生理过程,如基因调控、DNA复制和错配修复等。真核生物中,表观遗传学的研究主要为DNA甲基化参与的细胞分化、胚胎发育和癌症的发生,其中癌症的发生与基因的沉默和错误表达有关[13]。人类基因组中5mC修饰对转座原件的沉默、抵御病毒基因的入侵和某些基因的转录抑制具有重要影响。5mC具有高度致突变作用,会使二核苷酸C:G转变为T:A而引起人类DNA中CPG岛甲基化受体位点的强烈抑制。CpG岛是一段GC含量超过55%、片段大小超过500个碱基对的序列,由于在进化过程中免于被甲基化而保留下来,位于约40%哺乳动物的启动子区,一旦被甲基化会形成稳定可遗传的转录沉默。在早期癌变过程中发现CpG岛上会发生异常再甲基化,这也认为是一种人类癌症发生的特征性标志。
此外有报道显示,肠道微生物组能改变宿主上皮细胞的甲基化模式进而调控胞内功能。Takahashi等[14]发现肠道微生物组可以显著提高小肠细胞TLR4基因CPG区域的甲基化修饰频率从而避免产生过度的炎症反应,即肠道微生物组的抗炎症活性是通过增加TLR4基因启动子区域甲基化修饰频率产生的,表明肠道微生物组与宿主细胞的表观遗传学修饰有重要联系。除了DNA甲基化系统,细菌内还存在磷硫酰化修饰(phosphorothiation,PT),磷硫酰化修饰是近期发现的首例修饰位点发生在DNA骨架上的新型修饰,是指在Dnd相关蛋白的作用下,DNA骨架的磷酸二酯键上非桥连氧原子被第六种元素硫原子取代产生的修饰[15]。DNA磷硫酰化修饰可以提高对H2O2的耐受能力,即具有潜在的抗氧化作用[16],但是其调控机制和生物学功能仍待发掘。肠道微生物组也是含有磷硫酰化修饰的,两者之间的关系和生物学功能值得深入研究。
2.2 组蛋白修饰组蛋白修饰主要是指组蛋白乙酰转移酶(histone acetyltransferases,HATs)将乙酰辅酶A (acetylcoenzyme A,acetyl-CoA)的乙酰基团转移到赖氨酸残基(Nε)上来催化组蛋白乙酰化,这一过程伴随着CoA的产生[17]。组蛋白乙酰化使核小体DNA更容易接近转录因子,引起转录激活,影响基因表达水平、酶的活性和蛋白稳态[18],而组蛋白去乙酰化酶(histone deacetylases,HDACs)的功能与HATs相反,它们将赖氨酸残基上的乙酰基团转移出去。组蛋白乙酰化的调控过程是通过细胞能量代谢的三羧酸循环(tricarboxylic acid,TCA)进行,而肠道微生物组代谢过程中所产生的短链脂肪酸可以通过TCA循环产生ATP从而为宿主提供能量并影响宿主组蛋白修饰;此外HDACs活性也能被肠道微生物组代谢产物(如丙酸盐和丁酸盐)所抑制。除了组蛋白乙酰化,组蛋白甲基化也是一种重要的表观修饰过程,甲基化的组蛋白能够招募特定的转录因子到染色质上,引起基因转录激活或者抑制。此外,组蛋白修饰还包括组蛋白磷酸化、泛素化、类泛素化、多聚ADP核糖基化、生物素酰化、瓜氨酸化和脯氨酸异构化。这些组蛋白修饰之间不仅有交叉作用,而且还能与DNA甲基化修饰发挥协同作用控制基因表达[1]。
3 肠道微生物组对宿主表观遗传学修饰的影响 3.1 肠道微生物组直接调控宿主表观修饰2012年,Olszak等通过研究表明,肠道微生物组可以与恒定自然杀伤细胞(invariant natural killer cells,iNKTs)直接作用来影响免疫系统的表观遗传学调控[19]。iNKTs细胞能识别脂质抗原呈递分子CD1d和分泌白介素-4 (Interleukin-4,IL-4)及白介素-13 (Interleukin-13,IL-13)等前炎性细胞活素,在溃疡性结肠炎、炎性肠病和哮喘中发挥重要作用[20-21]。Olszak等[19]报道,肠道微生物组与无菌鼠中iNKT细胞作用时,会减少编码C-X-C趋化因子配体(C-X-C motif chemokine ligand 16,CXCL16)基因的DNA甲基化和表达水平,避免宿主体内iNKT细胞的大量积累,以及相关病理学状态的形成(图 1)。CXCL16充当已激活CD8 T细胞、NKT细胞和Th1极化T细胞的化学引诱物[22],能够引起iNKT的减少并增强肠道屏障功能,对于iNKT细胞在体内平衡的维持至关重要。虽然肠道微生物组对CXCL16的表达以及iNKT细胞积累的调控机制仍不清楚,但是可以确定的是它不依赖于Toll样受体衔接蛋白Myd88。因此生命初期肠道共生微生物组发挥着重要作用,能够限制iNKT通路的持续激活,防止宿主感染炎性肠病和哮喘等免疫疾病。

|
| 图 1 肠道微生物组对宿主表观遗传修饰的直接和间接作用 Figure 1 The direct and indirect roles of gut microbiome in epigenetic modification of host. |
3.2 肠道微生物组通过代谢产物等间接方式影响宿主表观修饰
由于饮食里的营养素直接与肠道微生物组接触,营养素的改变会引起肠道微生物组的变化,并可能引起由肠道微生物组生态失调导致的疾病[23]。肠道微生物组的改变也可能引起微生物代谢产物的变化从而间接调控宿主表观修饰。肠道微生物组在代谢过程中产生很多小分子(low molecular weight,LMW)生物活性代谢物如短链脂肪酸丁酸盐、乙酸盐,还有叶酸、生物素和维生素B等,能够参与到宿主表观修饰和生理功能的调控,从而影响宿主细胞发育、功能以及基因的表达[24] (图 1)。
3.2.1 小分子生物活性物质: 叶酸是一种维生素,作为供体分子提供一碳单位,参与到很多代谢过程比如核苷酸、维生素和氨基酸的甲基生物转化和生物合成[25]。DNA复制、DNA损伤修复和DNA甲基化的效率都会受到叶酸利用率的影响;快速增殖的细胞如白细胞、红细胞和肠细胞都需要大量叶酸。叶酸广泛分布于整个生物世界,肠道微生物组也是这种维生素的来源之一[26]。在肠道和肝脏中,叶酸通过代谢作用转化为5-甲基四氢叶酸(5-methytetrahydrofolate,5-methylTHF)而被非肝脏组织吸收后在胞内进行多聚谷氨酸化并发挥一碳循环辅助因子功能。此外,5-methylTHF在甲硫氨酸合酶作用下转变为多聚谷氨酸盐合酶的重要底物——四氢叶酸(tetrahydrofolate,THF),同时5-methylTHF还参与到了宿主DNA甲基化的调控网络中。因此,来源于饮食和微生物组的叶酸的供应不足,会改变宿主一碳代谢过程,使得很多重要表观修饰相关途径处于低甲基化状态,这种变化会修复宿主DNA甲基化,增加高半胱氨酸浓度和降低硫腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)浓度,可能引起心血管疾病、神经管缺陷和癌症,但具体机制仍不清楚[27]。Steegers等[28]研究发现,孕妇在持续补充了叶酸并分娩后,体内胰岛素样生长因子基因IGF2甲基化水平比未补充叶酸的孕妇高,暗示了叶酸可以影响宿主表观修饰,而且这种DNA甲基化修饰的改变可能会引起子代表型的变化,具体表现为IGF2高度甲基化导致新生儿体重的减轻,表明叶酸具有潜在的疾病预防和治疗作用,如预防新生儿出生时神经管缺陷以及一些慢性疾病。另一项研究[29]发现通过给类原始淋巴细胞系补充叶酸时,可以观察到细胞启动子区域CPG岛的甲基化,导致FMR1基因表达的降低,FMRP蛋白能抑制特定mRNA的转录,会引起海马体突触神经传递的长期抑制,从而影响大脑功能。老年人长期服用叶酸将会改变细胞正常发育所需基因和癌症相关基因的DNA甲基化状态[30],所以可以利用肠道微生物组代谢产物叶酸来研究某些基因所处的调控网络、表观过程。丁酸盐是一种由肠道微生物组代谢产生的短链脂肪酸(SCFA),也是潜在的组蛋白去乙酰化酶(HDACs)抑制剂。最重要的丁酸盐产生菌有普拉梭菌(Faecalibacterium prausnitzii)(属于厚壁菌门Firmicute),包括柔嫩梭菌(Clostridium leptum)、直肠真杆菌(Eubacterium rectale)、球形梭菌(Clostridium coccoides)等[31]。丁酸盐能够激活癌细胞中的表观沉默基因如p21和bak[32],主要通过抑制HDACs的活性增加p21和bak基因启动子区域的组蛋白乙酰化水平发挥作用。丁酸盐能在体内和体外抑制血管再生并降低血管生成因子VEGF和HIF-1α的表达[33],对抑制肿瘤的生长和转移具有重要意义;丁酸盐可以调节肠道内的pH进而影响肠道微生物组并且通过表观遗传学机制对肠腔产生有益影响[34]。此外丁酸盐还能促进人体髓母细胞瘤的神经元分化并能引起髓母细胞瘤的细胞坏死[35],绿茶中提取的表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和丁酸钠可以诱导细胞凋亡和细胞周期停滞,而这一过程受到表观修饰酶HDAC1、DNMT1的调控和结肠癌细胞中生存素的调节[36]。肠道微生物组代谢产物中短链脂肪酸驱动的HDACs抑制作用能够形成一种耐受性抗炎症细胞表型,能够维持宿主免疫稳态,因此肠道微生物组可作为宿主生理学机能的一种特殊的间接性表观调控因子。当外周血单核细胞和嗜中性白细胞遇到SCFAs时,通过抑制HDACs对组蛋白产生去乙酰化作用从而导致NF-κB (nuclear factor-κB)信号通路的失活和促炎症细胞因子TNF (tumour necrosis factor)的下调[37],所以SCFA诱导产生的HDACs抑制作用是NF-κB活性和促炎性先天免疫应答的重要调控因子。此外,SCFA也会通过抑制HDAC影响外周T细胞,特别是调节性T细胞(Treg),可以在体内调节T细胞的数量和功能,对HDAC9的抑制能够增加FOXP3的表达和Treg细胞数量[38],有利于肠道内稳态。SCFAs对免疫功能具有潜在的表观遗传学调控作用并能防止宿主感染疾病,同时还能调控局部和系统性免疫反应并维持肠粘膜稳态。
生物素是一种哺乳动物无法产生的维生素,哺乳动物依赖于肠道微生物组对生物素的持续供应,来保持蛋白质生物素酰化的正常水平。哺乳动物细胞中组蛋白生物素酰化是由羧化全酶合成酶(holocarboxylase synthatase,HCS)、生物素酶和肠道微生物非选择性酶BirA合酶共同完成的。生物素酰化是一种重要的表观修饰,生物素附着在组蛋白上引起基因表达的变化,同时它在DNA修复和染色质结构上发挥重要功能[39]。生物素缺陷会引起组蛋白低生物素酰化并导致基因调控异常,如逆转录转座子的去抑制引起染色体不稳定[40]。生物素和叶酸联用可以通过表观调控机制协同抑制人体T淋巴白血病细胞的长末端重复序列的产生。可见这些肠道微生物组的代谢产物不仅能单独发挥表观调控作用,还能够协同发挥调节功能。
3.2.2 其他辅酶因子: 肠道微生物组能够帮助促进人体矿物质的吸收和排放,其中包括锌、碘、硒、钴和其他参与表观修饰的辅酶因子。此外肠道微生物组与宿主的能量代谢产物,包括硫腺苷甲硫氨酸(SAM)、乙酰CoA、NAD+、α-KG和ATP都是大多数表观修饰酶的重要辅因子,这些表观修饰酶调控DNA甲基化、组蛋白翻译后修饰和核小体位置。真核细胞线粒体和原核细胞细胞膜上的能量代谢,产生了这些辅酶因子,一旦这些过程发生紊乱都会引起各种与表观修饰有关的疾病,如慢性代谢疾病等[41]。所以肠道微生物组的稳态维持着辅酶因子的平衡,而这些辅酶因子除了与能量转换有直接关系,还参与到宿主细胞表观修饰网络中。染色质水平上,大量数据表明组蛋白、非组蛋白的乙酰化和去乙酰化状态之间的平衡对于基因表达的调控具有重要作用[42]。乙酰化的调控借助葡萄糖代谢的中间产物进行,其中一种主要的酶是ATP柠檬酸裂合酶,可以将线粒体产生的柠檬酸转变为乙酰CoA,而乙酰CoA与CoA的比值对于乙酰化的调控来说是重要的,在缺乏葡萄糖的时候,乙酰CoA与CoA的比值下降,反而会影响组蛋白乙酰化水平,对酵母的研究表明高水平乙酰CoA能激活启动子组蛋白乙酰化[43]。这对于癌症治疗有重要启示,致癌基因可能通过充分利用乙酰CoA代谢来改变染色质[44]。辅酶能够影响宿主细胞染色质的表观修饰状态,而肠道微生物组可以通过辅酶因子调节相应辅酶的作用来定向改变组蛋白等表观修饰的激活状态以及其修饰水平,因此肠道微生物组是一种潜在的表观调控平衡因子和疾病治疗突破口。
4 总结和展望肠道微生物组作为人体内“被遗忘的器官”对整个生命进程起到至关重要的作用,参与体内物质与能量代谢过程,能够获取并储存能量,还能参与到人体免疫过程抵御外来病原菌的入侵,防止疾病的感染。肠道微生物组和宿主细胞的表观遗传学修饰具有密不可分的联系,它们之间相互影响、相互依存。肠道微生物组除了能够直接与宿主细胞相互作用影响其表观遗传学修饰,还可以产生一些代谢产物如叶酸、SCFA、生物素等,改变宿主细胞表观修饰酶的胞内水平,如HATs、HDACs、DNMTs、DNA去甲基化酶、组蛋白甲基转移酶和组蛋白脱甲基酶激酶等,这些表观修饰酶的变化最终会影响宿主的生理机能。
临床实践中,基于肠道微生物组调控宿主表观修饰的诊断和治疗应用逐渐盛行,表观修饰的鉴定可能成为诊断和治疗某些疾病的有效方法[45]。DNA甲基化异常是肿瘤的主要特征之一,被认为是一种潜在的治疗靶点,例如抑癌基因(如BRCA1突变载体)CPG岛的高度甲基化是检测乳腺癌的生物标记[46]。类似,对肠道微生物组变化的评估也是一种疾病诊断标记,包括结肠癌和炎症性肠病[47]。Vrieze等[48]将身材较瘦个体的肠道微生物组转移到患有代谢综合征的病人体内,发现其胰岛素敏感度增加以及产丁酸盐的肠道微生物增多。这些研究表明通过肠道微生物组的代谢产物与宿主表观遗传学修饰相互作用来理解具体的细胞和分子途径是必不可少的,但是还需要更多的深入研究来阐明其中的机制。人体肠道微生物组为人类生物学的发展开辟了一条新的道路,人类基因组和来源于肠道微生物组的生物活性产物作为一个整体成为“人类宏基因组”的一部分。随着高通量测序技术的发展,使得研究者们利用ChIP-chip和ChIP-seq等方法来绘制全局染色质修饰图谱成为可能,运用益生菌来改变肠道微生物组并且充当一种表观修饰器可能开辟另一个新的研究领域。多组学分析和无菌生物学方法的结合开辟了探索肠道微生物组对宿主表观修饰影响的新领域,对人体健康和代谢疾病的治疗具有深远影响。阐明肠道微生物组小分子代谢物与宿主表观组的相互作用将对设计新的能治愈癌症和代谢综合征等复杂疾病的药物有重要启示。
| [1] | Cedar H, Bergman Y. Linking DNA methylation and histone modification: patterns and paradigms. Nature Reviews Genetics, 2009, 10(5): 295-304. DOI:10.1038/nrg2540 |
| [2] | Frank DN, St Amand AL, Feldman RA, Boedeker EC, Harpaz N, Pace NR. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(34): 13780-13785. DOI:10.1073/pnas.0706625104 |
| [3] | Wu HJ, Ivanov Ⅱ, Darce J, Hattori K, Shima T, Umesaki Y, Littman DR, Benoist C, Mathis D. Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells. Immunity, 2010, 32(6): 815-827. DOI:10.1016/j.immuni.2010.06.001 |
| [4] | Yang T, Owen JL, Lightfoot YL, Kladde MP, Mohamadzadeh M. Microbiota impact on the epigenetic regulation of colorectal cancer. Trends in Molecular Medicine, 2013, 19(12): 714-725. DOI:10.1016/j.molmed.2013.08.005 |
| [5] | Kumar H, Lund R, Laiho A, Lundelin K, Ley RE, Isolauri E, Salminen S. Gut microbiota as an epigenetic regulator: pilot study based on whole-genome methylation analysis. mBio, 2014, 5(6): e02113-14. |
| [6] | Krautkramer KA, Kreznar JH, Romano KA, Vivas EI, Barrett-Wilt GA, Rabaglia ME, Keller MP, Attie AD, Rey FE, Denu JM. Diet-microbiota interactions mediate global epigenetic programming in multiple host tissues. Molecular Cell, 2016, 64(5): 982-992. DOI:10.1016/j.molcel.2016.10.025 |
| [7] | Toraño EG, García MG, Fernández-Morera JL, Niño-García P, Fernández AF. The impact of external factors on the epigenome: in utero and over lifetime. BioMed Research International, 2016, 2016: 2568635. |
| [8] | Roach HI, Bronner F, Oreffo ROC. Epigenetic Aspects of Chronic Diseases. London: Springer-Verlag, 2011. |
| [9] | Ding T, Schloss PD. Dynamics and associations of microbial community types across the human body. Nature, 2014, 509(7500): 357-360. DOI:10.1038/nature13178 |
| [10] | Franzosa EA, Hsu T, Sirota-Madi A, Shafquat A, Abu-Ali G, Morgan XC, Huttenhower C. Sequencing and beyond: integrating molecular 'omics' for microbial community profiling. Nature Reviews Microbiology, 2015, 13(6): 360-372. DOI:10.1038/nrmicro3451 |
| [11] | Blekhman R, Goodrich JK, Huang K, Sun Q, Bukowski R, Bell JT, Spector TD, Keinan A, Ley RE, Gevers D, Clark AG. Host genetic variation impacts microbiome composition across human body sites. Genome Biology, 2015, 16: 191. DOI:10.1186/s13059-015-0759-1 |
| [12] | Morgan XC, Huttenhower C. Meta'omic analytic techniques for studying the intestinal microbiome. Gastroenterology, 2014, 146(6): 1437-1448. DOI:10.1053/j.gastro.2014.01.049 |
| [13] | Egger G, Liang G, Aparicio A, Jones PA. Epigenetics in human disease and prospects for epigenetic therapy. Nature, 2004, 429(6990): 457-463. DOI:10.1038/nature02625 |
| [14] | Takahashi K, Sugi Y, Nakano K, Tsuda M, Kurihara K, Hosono A, Kaminogawa S. Epigenetic control of the host gene by commensal bacteria in large intestinal epithelial cells. Journal of Biological Chemistry, 2011, 286(41): 35755-35762. DOI:10.1074/jbc.M111.271007 |
| [15] | Wang LR, Chen S, Xu TG, Taghizadeh K, Wishnok JS, Zhou XF, You DL, Deng ZX, Dedon PC. Phosphorothioation of DNA in bacteria by dnd genes. Nature Chemical Biology, 2007, 3(11): 709-710. DOI:10.1038/nchembio.2007.39 |
| [16] | Xie XQ, Liang JD, Pu TN, Xu F, Yao F, Yang Y, Zhao YL, You DL, Zhou XF, Deng ZX, Wang ZJ. Phosphorothioate DNA as an antioxidant in bacteria. Nucleic Acids Research, 2012, 40(18): 9115-9124. DOI:10.1093/nar/gks650 |
| [17] | Roth SY, Denu JM, Allis CD. Histone acetyltransferases. Annual Review of Biochemistry, 2001, 70(1): 81-120. DOI:10.1146/annurev.biochem.70.1.81 |
| [18] | Zhao S, Xu W, Jiang W, Yu W, Lin Y, Zhang T, Yao J, Zhou L, Zeng Y, Li H, Li Y, Shi J, An W, Hancock SM, He F, Qin L, Chin J, Yang P, Chen X, Lei Q, Xiong Y, Guan KL. Regulation of cellular metabolism by protein lysine acetylation. Science, 2010, 327(5968): 1000-1004. DOI:10.1126/science.1179689 |
| [19] | Olszak T, An D, Zeissig S, Vera MP, Richter J, Franke A, Glickman JN, Siebert R, Baron RM, Kasper DL, Blumberg RS. Microbial exposure during early life has persistent effects on natural killer T cell function. Science, 2012, 336(6080): 489-493. DOI:10.1126/science.1219328 |
| [20] | Fuss IJ, Heller F, Boirivant M, Leon F, Yoshida M, Fichtner-Feigl S, Yang ZQ, Exley M, Kitani A, Blumberg RS, Mannon P, Strober W. Nonclassical CD1d-restricted NK T cells that produce IL-13 characterize an atypical Th2 response in ulcerative colitis. The Journal of Clinical Investigation, 2004, 113(10): 1490-1497. DOI:10.1172/JCI19836 |
| [21] | Cohen NR, Garg S, Brenner MB. Antigen presentation by CD1: lipids, T cells, and NKT cells in microbial immunity. Advances in Immunology, 2009, 102: 1-94. DOI:10.1016/S0065-2776(09)01201-2 |
| [22] | Matloubian M, David A, Engel S, Ryan JE, Cyster JG. A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo. Nature Immunology, 2000, 1(4): 298-304. DOI:10.1038/79738 |
| [23] | David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature, 2014, 505(7484): 559-563. DOI:10.1038/nature12820 |
| [24] | Nicholson JK, Holmes E, Kinross J, Burcelin R, Gibson G, Jia W, Pettersson S. Host-gut microbiota metabolic interactions. Science, 2012, 336(6086): 1262-1267. DOI:10.1126/science.1223813 |
| [25] | Pompei A, Cordisco L, Amaretti A, Zanoni S, Matteuzzi D, Rossi M. Folate production by bifidobacteria as a potential probiotic property. Applied and Environmental Microbiology, 2007, 73(1): 179-185. DOI:10.1128/AEM.01763-06 |
| [26] | Hooper LV, Midtvedt T, Gordon JI. How host-microbial interactions shape the nutrient environment of the mammalian intestine. Annual Review of Nutrition, 2002, 22(1): 283-307. DOI:10.1146/annurev.nutr.22.011602.092259 |
| [27] | Crider KS, Yang TP, Berry RJ, Bailey LB. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate's role. Advances in Nutrition, 2012, 3(1): 21-38. DOI:10.3945/an.111.000992 |
| [28] | Steegers-Theunissen RP, Obermann-Borst SA, Kremer D, Lindemans J, Siebel C, Steegers EA, Slagboom PE, Heijmans BT. Periconceptional maternal folic acid use of 400 µg per day is related to increased methylation of the IGF2 gene in the very young child. PloS One, 2009, 4(11): e7845. DOI:10.1371/journal.pone.0007845 |
| [29] | Junaid MA, Kuizon S, Cardona J, Azher T, Murakami N, Pullarkat RK, Brown WT. Folic acid supplementation dysregulates gene expression in lymphoblastoid cells-implications in nutrition. Biochemical and Biophysical Research Communications, 2011, 412(4): 688-692. DOI:10.1016/j.bbrc.2011.08.027 |
| [30] | Kok DEG, Dhonukshe-Rutten RAM, Lute C, Heil SG, Uitterlinden AG, van der Velde N, van Meurs JBJ, van Schoor NM, Hooiveld GJEJ, de Groot LCPGM, Kampman E, Steegenga WT. The effects of long-term daily folic acid and vitamin B12 supplementation on genome-wide DNA methylation in elderly subjects. Clinical Epigenetics, 2015, 7: 121. DOI:10.1186/s13148-015-0154-5 |
| [31] | Barcenilla A, Pryde SE, Martin JC, Duncan SH, Stewart CS, Henderson C, Flint HJ. Phylogenetic relationships of butyrate-producing bacteria from the human gut. Applied and Environmental Microbiology, 2000, 66(4): 1654-1661. DOI:10.1128/AEM.66.4.1654-1661.2000 |
| [32] | Berni Canani R, Di Costanzo M, Leone L. The epigenetic effects of butyrate: potential therapeutic implications for clinical practice. Clinical Epigenetics, 2012, 4: 4. DOI:10.1186/1868-7083-4-4 |
| [33] | Zgouras D, Wächtershäuser A, Frings D, Stein J. Butyrate impairs intestinal tumor cell-induced angiogenesis by inhibiting HIF-1α nuclear translocation. Biochemical and Biophysical Research Communications, 2003, 300(4): 832-838. DOI:10.1016/S0006-291X(02)02916-9 |
| [34] | Walker AW, Duncan SH, McWilliam Leitch EC, Child MW, Flint HJ. pH and peptide supply can radically alter bacterial populations and short-chain fatty acid ratios within microbial communities from the human colon. Applied and Environmental Microbiology, 2005, 71(7): 3692-3700. DOI:10.1128/AEM.71.7.3692-3700.2005 |
| [35] | Nör C, Sassi FA, de Farias CB, Schwartsmann G, Abujamra AL, Lenz G, Brunetto AL, Roesler R. The histone deacetylase inhibitor sodium butyrate promotes cell death and differentiation and reduces neurosphere formation in human medulloblastoma cells. Molecular Neurobiology, 2013, 48(3): 533-543. DOI:10.1007/s12035-013-8441-7 |
| [36] | Saldanha SN, Kala R, Tollefsbol TO. Molecular mechanisms for inhibition of colon cancer cells by combined epigenetic-modulating epigallocatechin gallate and sodium butyrate. Experimental Cell Research, 2014, 324(1): 40-53. DOI:10.1016/j.yexcr.2014.01.024 |
| [37] | Usami M, Kishimoto K, Ohata A, Miyoshi M, Aoyama M, Fueda Y, Kotani J. Butyrate and trichostatin A attenuate nuclear factor κB activation and tumor necrosis factor α secretion and increase prostaglandin E2 secretion in human peripheral blood mononuclear cells. Nutrition Research, 2008, 28(5): 321-328. DOI:10.1016/j.nutres.2008.02.012 |
| [38] | Tao R, de Zoeten EF, Ozkaynak E, Chen CX, Wang LQ, Porrett PM, Li B, Turka LA, Olson EN, Greene MI, Wells AD, Hancock WW. Deacetylase inhibition promotes the generation and function of regulatory T cells. Nature Medicine, 2007, 13(11): 1299-1307. DOI:10.1038/nm1652 |
| [39] | Zempleni J. Uptake, localization, and noncarboxylase roles of biotin. Annual Review of Nutrition, 2005, 25: 175-196. DOI:10.1146/annurev.nutr.25.121304.131724 |
| [40] | Chew YC, West JT, Kratzer SJ, Ilvarsonn AM, Eissenberg JC, Dave BJ, Klinkebiel D, Christman JK, Zempleni J. Biotinylation of histones represses transposable elements in human and mouse cells and cell lines and in Drosophila melanogaster. The Journal of Nutrition, 2008, 138(12): 2316-2322. DOI:10.3945/jn.108.098673 |
| [41] | Shenderov BA, Midtvedt T. Epigenomic programing: a future way to health?. Microbial Ecology in Health and Disease, 2014, 25: 24145. |
| [42] | Simonsson M, Heldin CH, Ericsson J, Grönroos E. The balance between acetylation and deacetylation controls Smad7 stability. Journal of Biological Chemistry, 2005, 280(23): 21797-21803. DOI:10.1074/jbc.M503134200 |
| [43] | Cai L, Sutter BM, Li B, Tu BP. Acetyl-CoA induces cell growth and proliferation by promoting the acetylation of histones at growth genes. Molecular Cell, 2011, 42(4): 426-437. DOI:10.1016/j.molcel.2011.05.004 |
| [44] | Carrer A, Wellen KE. Metabolism and epigenetics: a link cancer cells exploit. Current Opinion in Biotechnology, 2015, 34: 23-29. DOI:10.1016/j.copbio.2014.11.012 |
| [45] | Kelly TK, de Carvalho DD, Jones PA. Epigenetic modifications as therapeutic targets. Nature Biotechnology, 2010, 28(10): 1069-1078. DOI:10.1038/nbt.1678 |
| [46] | Stefansson OA, Jonasson JG, Olafsdottir K, Hilmarsdottir H, Olafsdottir G, Esteller M, Johannsson OT, Eyfjord JE. CpG island hypermethylation of BRCA1 and loss of pRb as co-occurring events in basal/triple-negative breast cancer. Epigenetics, 2011, 6(5): 638-649. DOI:10.4161/epi.6.5.15667 |
| [47] | Dickson I. Gut microbiota: Diagnosing IBD with the gut microbiome. Nature Reviews Gastroenterology & Hepatology, 2017, 14(4): 195. |
| [48] | Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JF, Dallinga-Thie GM, Ackermans MT, Serlie MJ, Oozeer R, Derrien M, Druesne A, Van Hylckama Vlieg JE, Bloks VW, Groen AK, Heilig HG, Zoetendal EG, Stroes ES, de Vos WM, Hoekstra JB, Nieuwdorp M. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology, 2012, 143(4): 913-916.e7. DOI:10.1053/j.gastro.2012.06.031 |
 2018, Vol. 58
2018, Vol. 58