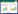中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郑芳芳, 王金佩, 林宇, 王子龙, 韦宇拓, 黄日波, 杜丽琴. 2018
- Fangfang Zheng, Jinpei Wang, Yu Lin, Zilong Wang, Yutuo Wei, Ribo Huang, Liqin Du. 2018
- 链霉菌GXT6 β-葡萄糖苷酶的酶学性质及葡萄糖耐受性分子改造
- Characterization of β-glucosidase from Streptomyces sp. GXT6 and its molecular modification of glucose tolerance
- 微生物学报, 58(10): 1839-1852
- Acta Microbiologica Sinica, 58(10): 1839-1852
-
文章历史
- 收稿日期:2018-01-11
- 修回日期:2018-03-28
- 网络出版日期:2018-05-29
β-葡萄糖苷酶(β-D-glucosidase,EC 3.2.1.21),又称β-D-吡喃葡萄糖苷水解酶,是从非还原端水解β-葡萄糖苷键并释放出β-D-葡萄糖和糖基配体的一类酶。从广义意义上讲β-葡萄糖苷酶是催化葡萄糖基在氧亲核基团之间转移的一类酶[1]。
由于β-葡萄糖苷酶具有使β-糖苷键断裂和合成的双重活性,这种作用使其在很多生物通路如细胞信号传导、生物合成、结构物质的降解、多糖物质的存储、宿主与病原菌之间的相互作用及其他生物技术方面具有重要作用[2]。例如,β-葡萄糖苷酶在医药方面用于生产白藜芦醇和水解大豆异黄酮等糖苷类物质。白藜芦醇是一种非黄酮类多酚化合物[3],具有抗菌[4]、抗氧化、防治心脑血管疾病、抗肿瘤[5]等多种生物学活性。但从植物中直接提取的产量不足以满足市场需求,因此,研究安全有效的方法获取白藜芦醇是人们研究的热点。大豆异黄酮具有预防癌症[6]、降低心脑血管疾病风险[7]的功效。大豆异黄酮类有糖苷和苷元两种存在形式,其中以糖苷类占多数[8]。但糖苷类多难以被人体吸收,因此,选取合适的β-葡萄糖苷酶水解得到苷元形式,提高其生物利用度,使其具有应用价值。β-葡萄糖苷酶在食品和饮料中的应用:水果中[9]有数百种不同的糖苷键合态的香味前体物质,这些前体物质的酸解或是酶解可产生有天然香气的风味物质,且绝大部分天然糖苷能被β-葡萄糖苷酶作用,这些风味物质的释放可以增强其对饮料和食品的口感与质量[10]。如利用β-葡萄糖苷酶水解青梅中的苦杏仁苷改善青梅的口味[11]。β-葡萄糖苷酶在依赖于酶合成反应中的应用:β-葡萄糖苷酶合成反应可以用来合成低聚龙胆糖、烷基糖苷[12]和糖基复合物。这些糖苷类物质可用作治疗剂、诊断工具、益生菌的生长促进剂和表面活性剂[13]等。由于酶法合成具有反应条件温和、产物单一、易于分离等优点而逐渐被人们青睐。
β-葡萄糖苷酶被划分到糖基水解酶1、3、5、9、30、116家族,目前报道较多的是GH1和GH3家族,GH1家族的β-葡萄糖苷酶的葡萄糖耐受性普遍优于GH3家族,然而GH3家族β-葡萄糖苷酶的高Kcat/Km值是GH1家族无法相比的[14]。大部分的GH3家族的β-葡萄糖苷酶最适温度一般较高,多数在50-70℃之间,且热稳定性较好,这种特性对于工业生产非常有利。GH3家族的很多β-葡萄糖苷酶底物特异性广泛,有的具有双功能。例如,来自大麦的ExoⅠ[15],它具有β-葡萄糖苷酶的活性,同时又具有β-D-葡聚糖外切酶活性。
β-葡萄糖苷酶是纤维素酶系的重要组成成分,负责纤维素的彻底降解,在饲料、食品、能源、医疗等领域都有重要应用[16]。β-葡萄糖苷酶是纤维素生物质转化的关键,它能够将纤维素水解为葡萄糖,但葡萄糖的积累又可以通过阻断活性位点或阻止产物离开引起反馈抑制,从而降低纤维素生物质水解的速率。为了促进β-葡萄糖苷酶的应用,通过分子改造来改变酶的特性,从而筛选出性状优良、高葡萄糖耐受性、便于工业利用的β-葡萄糖苷酶是目前研究中常用方法。Liu等[17]从海洋微生物宏基因组中分离得到一个β-葡萄糖苷酶通过与已知结构的β-葡萄糖苷酶进行比对选取2个点进行定点突变,得到突变酶H184F和L409E,且H184F的葡萄糖耐受性最高,与野生型的相比Ki值提高了5倍。Seidle等[18]研究发现黑曲霉Aspergillus niger GH3家族β-葡萄糖苷酶的Trp-262是决定其水解活性与转糖基活性的关键氨基酸。利用定点突变的方法对Trp-262进行突变,替代氨基酸为苯丙氨酸Phe、丙氨酸Ala、亮氨酸Leu和半胱氨酸Cys的突变酶在纤维二糖和4-硝基苯基-β-D-吡喃葡萄糖苷pNPG分别作为各自反应的糖基供体和受体时,与突变前相比,所获突变酶的反应产物多为转糖基产物。
本研究从链霉菌GXT6中克隆出一个新的β-葡萄糖苷酶基因,并在大肠杆菌中进行诱导表达,研究重组酶的酶学性质。结合定点饱和突变的方法对β-葡萄糖苷酶进行分子改造,希望能够获得具有高葡萄糖耐受性的β-葡萄糖苷酶突变体。
1 材料和方法 1.1 菌株链霉菌Streptomyces sp. GXT6由本实验室保藏并经过全基因组测序,大肠杆菌XL1-blue购买自TaKaRa公司,质粒购自Invitrogen公司。
1.2 材料本研究所使用的DNA聚合酶、DNA连接酶、限制性内切酶等均购买自TaKaRa公司;质粒提取试剂盒,PCR产物纯化试剂盒,胶回收试剂盒均购买自BioFlux公司;Ni-NTA填料购买自QIAGEN公司;实验使用的pNPG等对硝基苯基底物均购买自Sigma公司;瑞鲍迪苷A、甜菊双糖苷、甜菊醇、甜茶苷购买自四川成都维克奇生物科技有限公司;黄豆苷、染料木苷、染料木素、宝藿苷Ⅰ等购买自上海阿拉丁生化科技股份有限公司;淫羊藿苷、朝藿定A、朝藿定B、朝藿定C均购买自上海源叶生物科技有限公司;所使用的各种糖类及其他试剂均为国产分析纯。
1.3 链霉菌GXT6中β-葡萄糖苷酶基因的扩增本实验室已经对链霉菌GXT6全基因组进行测序,根据全基因的测序结果,找到其中一个注释为糖基水解酶的基因,对其所编码的蛋白质序列进行蛋白质组件分析。根据分析结果,设计引物PCR扩增β-葡萄糖苷酶基因bgl3:上游引物bgl3 F:5′-CACTCATGATGCACCACCACCACCACCACACCGCGACCGAAGAAGACGCCG-3′ (引入PagⅠ酶切位点和组氨酸标签),下游引物bgl3 R:5′-CATAAGCTTTCAGCTCACCTGCCGACCG CTC-3′ (引入Hind Ⅲ酶切位点)。PCR反应程序:94℃ 2 min;94℃ 1 min,54.5℃ 30 s,72℃ 150 s,30个循环;72℃ 10 min。将PCR产物纯化并酶切处理后连接至经过限制酶(NcoⅠ和Hind Ⅲ)酶切处理的pSE380表达载体,转化至大肠杆菌XL1-blue中经过测序。将成功构建的重组质粒命名为pSE-bgl3。
1.4 重组酶BGL3-GXT6诱导表达和纯化将重组菌株在37℃条件下培养至OD600约0.4-0.6,加入终浓度为1 mmol/L的IPTG进行诱导,在37℃条件下继续培养6-8 h。收集菌体,超声破胞后收集上清经过镍亲和层析Ni-NTA纯化重组酶BGL3-GXT6。对纯化得到的重组酶进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)和酶谱分析(native-PAGE:一部分用七叶苷-柠檬酸铁铵进行活性染色,另一部分用考马斯亮蓝R-250染液进行染色)。
1.5 重组酶BGL3-GXT6的酶学性质研究β-葡萄糖苷酶酶活力单位U定义:在最适反应条件下,每分钟催化1 μmol底物pNPG转化为产物pNP所需要的酶量。
酶活测定方法:70 μL的0.1 mol/L柠檬酸- 0.2 mol/L磷酸氢二钠缓冲液和20 μL的20 mmol/L pNPG在最适反应条件下预热2 min,加入适当稀释倍数的酶液,反应20 min,加入50 μL 2 mol/L Na2CO3溶液终止酶反应,混匀,取200 μL反应液加入酶标板中,读取OD405的读数。
1.5.1 pH和温度对重组酶BGL3-GXT6的影响: 在37℃条件下,测定重组酶BGL3-GXT6在不同pH条件下的酶活力,确定其最适pH。将纯酶分别在不同的pH 3.5-8.0环境中保存12 h,在BGL3-GXT6的最适酶反应条件下测定残余酶活力,研究其pH稳定性。在最适pH条件下,测定重组酶在不同温度条件下的酶活力,确定其最适温度。将纯酶分别在不同的温度25-55℃条件下保温1 h,处理完立即拿出置于冰上,在最适酶反应条件下测定BGL3-GXT6的残余酶活力,研究其温度稳定性。
1.5.2 BGL3-GXT6的Km、Vmax的测定: 在最适酶反应条件下,测定BGL3-GXT6在以不同浓度的pNPG (0.1-4.0 mmol/L)为底物时的酶活力,每个浓度均有3个平行。 1.5.3 BGL3-GXT6的葡萄糖耐受性及葡萄糖抑制常数Ki值的测定: 在最适酶反应条件下,按照标准酶反应体系,测定终浓度为0-20 mmol/L的葡萄糖对BGL3-GXT6酶活力的影响。在最适酶反应条件下,以一系列不同终浓度的pNPG (0.1-4.0 mmol/L)测定不添加葡萄糖时以及添加2个不同终浓度的葡萄糖(5 mmol/L和10 mmol/L)时BGL3-GXT6的活力。根据GraphPad Prism 5.0软件的Competivitive inhibition方法计算BGL3-GXT6的葡萄糖抑制常数。
1.5.4 重组酶BGL3-GXT6的底物特异性测定: 分别取2 mmol/L的芳基类物质作为底物和适当稀释的酶液在最适条件下进行反应,反应时间为20 min。4-甲基伞形酮-β-D-吡喃葡萄糖苷的反应产物用紫外灯来检测。取终浓度为1% (M/V)的糖类作为底物和纯酶在最适条件下反应,二糖和部分糖苷类参与反应的时间为20 min,通过葡萄糖氧化还原试剂盒来测定二糖和糖苷的活性;多糖类参与反应的时间为6 h,煮沸5 min终止反应,用DNS法检测还原糖。
1.6 BGL3-GXT6对天然底物水解功能研究分别以0.12 mmol/L终浓度的黄豆苷、染料木苷为底物,和纯酶在最适酶反应条件下分别反应15 min和12 h,对水解产物进行HPLC分析。
分别以1%终浓度的瑞鲍迪苷A、甜菊苷、甜菊双糖苷和甜茶苷为底物,和纯酶在最适酶反应条件下反应12 h,对水解产物进行HPLC分析。
分别以100 μg/mL终浓度的淫羊藿苷、朝藿定A、朝藿定B、朝藿定C和虎杖苷为底物,和纯酶在最适酶反应条件下反应12 h,对水解产物进行HPLC分析。
1.7 BGL3-GXT6转糖苷功能研究分别以60 mmol/L pNPG、16% (M/V)葡萄糖和16% (M/V)纤维二糖为葡萄糖基供体,20% (M/V)的甘露糖、D-果糖、D-木糖、D(+)半乳糖、D(-)阿拉伯糖、麦芽糖、异麦芽糖、α-乳糖、α, α-海藻糖、蔗糖为受体,在最适酶反应条件下反应12 h,HPLC检测反应产物。
分别以60 mmol/L pNPG、20% (M/V)葡萄糖和20% (M/V)纤维二糖为葡萄糖基供体,分别以10% (V/V)的甲醇、乙醇、正丙醇、异丙醇、丁醇和20% (V/V)的乙二醇、1, 2-丙二醇、1, 3-丙二醇、2, 3-丁二醇、丙三醇为受体,在最适酶反应条件下反应12 h,HPLC检测反应产物。
分别以50 mmol/L pNPG、20% (M/V)葡萄糖和20% (M/V)纤维二糖为葡萄糖基供体,以己醇、辛醇、壬醇、癸醇为受体,在37℃条件下反应12 h,取有机相进行HPLC分析。
以50 mmol/L pNPG为糖基供体,以烷基糖苷类、咖啡酸、苯甲酸、L-抗坏血酸为糖基受体,在最适酶反应条件下反应12 h,HPLC检测反应产物。
1.8 BGL3-GXT6酶分子改造β-葡萄糖苷酶上具有1个或者是多个色氨酸Trp对于固定糖类物质具有非常重要的作用。因此,通过对比GH3家族的β-葡萄糖苷酶的氨基酸序列找出保守区内的Trp,设计38对引物采用定点饱和突变的方法通过反向PCR手段将Trp突变成其他19种氨基酸残基,希望得到葡萄糖耐受性提高的突变酶。
定点饱和突变:以重组质粒pSE-bgl3为模板,PCR反应程序:95℃ 3 min;98℃ 10 s,60℃ 15 s,68℃ 7 min,30个循环;72℃ 10 min。
参照1.4中的方法对突变体进行诱导表达和纯化;参照1.5中的方法对突变体进行酶学性质研究。
1.9 基因的核苷酸序列号将来自链霉菌GXT6 (Streptomyces sp. GXT6)的基因bgl3的核苷酸序列上传到GenBank数据库中,得到基因的序列号为MG 762745。
2 结果和讨论 2.1 链霉菌GXT6中β-葡萄糖苷酶基因的扩增对链霉菌GXT6全基因组中注释为糖基水解酶的一段核苷酸序列进行ORF Finder,ORF大小为2319 bp,通过BLASTx比对分析,结果与S. ambofaciens ATCC 23877的putative beta- glucosidase的Identities=536/750 (71%),Positives= 597/750 (80%),Gaps=10/750 (1%)。对该基因编码的氨基酸序列进行SMART分析,发现其含有典型的糖基水解酶3家族结构域,不具有信号肽。
以链霉菌GXT6的基因组DNA为模板,用引物bgl3 F、bgl3 R按照1.3中的方法PCR扩增目的基因,得到一条大小约为2.3 kb的特异性条带,对所得片段测序后发现成功获得一个β-葡萄糖苷酶基因,将其命名为bgl3,对应编码的蛋白质大小预计为83 kDa,将其命名为BGL3-GXT6。
2.2 重组酶BGL3-GXT6诱导表达和纯化将成功构建的重组质粒pSE-bgl3导入大肠杆菌XL1-blue中,诱导表达并收集菌体,通过镍亲和层析技术纯化得到目的蛋白质BGL3-GXT6,通过对表达产物进行SDS-PAGE和酶谱分析,发现其约在83 kDa处有一条明显的蛋白质表达条带,与理论大小一致。对BGL3-GXT6进行酶谱分析,在经过七叶苷-柠檬酸铁铵活性染色后,在相对应的位置出现了明显的黑色条带(图 1),说明纯化得到的目的蛋白质BGL3-GXT6具有β-葡萄糖苷酶活性。
|
| 图 1 重组蛋白BGL3-GXT6的SDS-PAGE和native-PAGE分析 Figure 1 SDS-PAGE and native-PAGE analysis of recombinant protein BGL3-GXT6. Lane 1: protein marker; lane 2: E. coli XL1-blue with pSE380; lane 3: recombinant E. coli XL1-blue with pSE-bgl3; lane 4: purified protein BGL3-GXT6; lane 5-7: BGL3-GXT6 stained with 0.2% esculin-0.5% ferric ammonium citrate (Native-PAGE of purified BGL3-GXT6). |
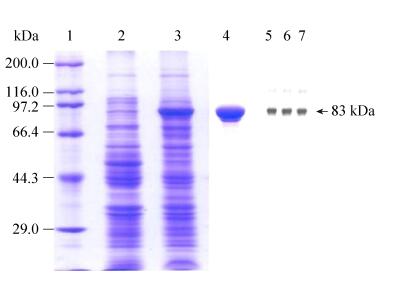
2.3 重组酶BGL3-GXT6的酶学性质研究 2.3.1 pH和温度对重组酶BGL3-GXT6的影响: 根据结果显示,BGL3-GXT6的最适pH为6.0,在pH 5.0-7.0之间BGL3-GXT6能保持50%以上的酶活力,在pH低于5.0时,BGL3-GXT6的酶活急剧下降。在不同的pH缓冲液中保存12 h后,重组酶BGL3-GXT6在pH 4.0-8.0之间还能保持80%以上酶活力,在pH低于4.0时,BGL3-GXT6酶活力急剧下降,BGL3-GXT6具有良好的pH稳定性。已报道的β-葡萄糖苷酶的pI值多数为3.6-5.5,但是最适pH可以超过7.0,多数酶的酸碱耐受性很强[19]。
根据结果显示(图 2),BGL3-GXT6的最适酶反应温度为40℃,25-50℃还能保持50%以上的酶活力,在温度高于50℃时,BGL3-GXT6的酶活力急剧下降。将纯酶在不同温度条件下保存1 h后,在温度25-45℃条件下,BGL3-GXT6酶活较为稳定,能保持80%以上酶活力,但在温度高于45℃时酶活力迅速下降。β-葡萄糖苷酶的最适温度在40-110℃中均有分布,不同来源的β-葡萄糖苷酶的最适温度差异明显。一般来说,细菌来源的β-葡萄糖苷酶的最适温度比其他来源的要高,并且温度稳定性较好[20]。
|
| 图 2 pH和温度对重组蛋白质BGL3-GXT6酶活的影响 Figure 2 Effect of pH and temperature on recombinant enzyme activity. A: effect of pH on BGL3-GXT6 enzyme activity; B: pH stability of BGL3-GXT6; C: effect of temperature on BGL3-GXT6 enzyme activity; D: thermal stability of BGL3-GXT6. |
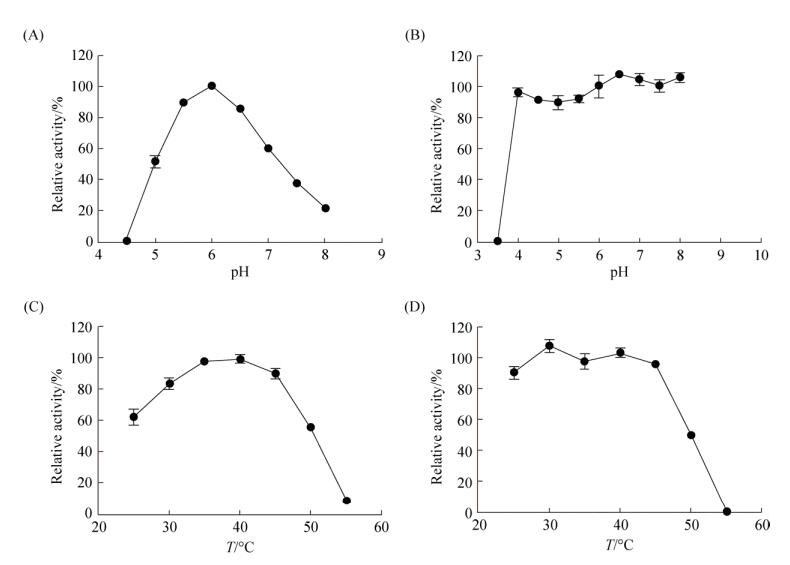
2.3.2 BGL3-GXT6的Km、Vmax的测定: 利用软件GraphPad Prism 5通过非线性回归拟合出BGL3- GXT6的Km和Vmax值分别为(0.4712±0.0180) mmol/L和(128.000±1.741) μmol/(min·mg),Kcat值为(182.57±2.48)/s (图 3)。
|
| 图 3 BGL3-GXT6的Km和Vmax值 Figure 3 Km and Vmax values of BGL3-GXT6. |
2.3.3 BGL3-GXT6的葡萄糖耐受性及葡萄糖抑制常数Ki值: 根据结果可知(图 4),随着体系中葡萄糖终浓度的逐渐增加,BGL3-GXT6的酶活逐渐下降。当体系中葡萄糖终浓度为20 mmol/L时,BGL3-GXT6的残余酶活只有40%左右。

|
| 图 4 BGL3-GXT6的葡萄糖耐受性及葡萄糖抑制常数Ki值 Figure 4 Glucose tolerance and glucose inhibition constant Ki of BGL3-GXT6. A: effect of glucose on BGL3-GXT6 enzyme activity. B: glucose inhibition constant Ki of BGL3-GXT6. |
根据GraphPad prism 5.0软件的Competitive inhibition的方法计算BGL3-GXT6的葡萄糖抑制常数Ki值为(1.8880±0.1307) mmol/L。不同来源的β-葡萄糖苷酶对葡萄糖的反应各不相同,多数β-葡萄糖苷酶被低浓度的葡萄糖强烈抑制,它们的葡萄糖抑制常数一般不超过0.1 mol/L。目前发现葡萄糖耐受性最高的β-葡萄糖苷酶来自于土壤宏基因组[21]文库,其Ki为4.28 mol/L。
2.3.4 BGL3-GXT6底物特异性研究: 根据表 1结果显示,BGL3-GXT6除了水解pNPG外,还能够水解MU-Glc、水杨苷和苦杏仁苷,对龙胆二糖、纤维二糖、昆布二糖和槐糖具有微弱的水解能力,不能水解4-硝基苯基-2-乙酰氨基-2-脱氧-β-D-吡喃葡糖苷、oNPG、pNPGal、pNPC、α-pNPG、异麦芽糖、乳糖、麦芽糖、蔗糖、海藻糖,另外也不能水解羧甲基纤维素、桦木木聚糖、淀粉等多糖类物质。结果显示,BGL3-GXT6在水解芳基类物质和二糖时对形成糖苷键的糖较为严格,能够水解pNPG、七叶苷、MUG、黄豆苷、染料木苷纤维二糖和龙胆二糖等由葡萄糖基参与形成的β-糖苷键,但是却不能水解pNP-纤维二糖苷、pNP-木糖苷、pNP-半乳糖苷和乳糖,这与多数GH3家族的β-葡萄糖苷酶不同。| Substrates | Relative activity/% |
| pNPG | 100.00±0.49 |
| MU-Glc | + |
| oNPG/pNPGal/pNP-Xyl/pNPC/α-pNPG/pNPNAG | 0 |
| Cellobiose | 0.08±0.01 |
| CMC | 0 |
| Soluble starch | 0 |
| Xylan from birchwood | 0 |
| Maltose | 0 |
| Isomaltose | 0 |
| Sucrose | 0 |
| Trehalose | 0 |
| Lactose | 0 |
| Gentiobiose | 0.79±0.11 |
| Salicin | 2.80±0.79 |
| Amygdalin | 3.80±0.13 |
| Laminaribiose | 0.073±0.002 |
| Sophorose | 0.026±0.001 |
| +: The substrate can be hydrolyzed, but can not calculate production yield. | |
2.4 BGL3-GXT6对天然底物水解功能研究
将重组酶BGL3-GXT6与不同的天然底物进行水解反应,对水解产物进行HPLC分析,水解结果及产物信息见表 2。
| Substrates | Hydrolysis results | Hydrolyzate |
| Daidzin | + | Daidzein |
| Genistin | + | Genistein |
| Glycitin | + | Glycitein |
| Polydatin | + | Resveratrol |
| Icariin | + | BaohuosideⅠ |
| Epimedium A | + | Sagittatoside A |
| Epimedium B | + | Sagittatoside B |
| Epimedium C | + | 2-O-Rhamnosylicariside Ⅱ |
| Rebaudioside A | - | - |
| Steviolbioside | - | - |
| Stevioside | - | - |
| Rubusoside | + | Steviol + mid product |
| -: The substrate can’t be hydrolyzed. | ||
BGL3-GXT6能够水解黄豆苷、染料木苷、黄豆黄苷、虎杖苷、淫羊藿苷、朝藿定A、朝藿定B、朝藿定C等底物上的糖苷键,生成对应的产物。大豆异黄酮在大豆中主要以糖苷和苷元两种形式存在,其中以糖苷为主要存在形式,但是苷元更容易被人体吸收;白藜芦醇是一种非黄酮类多酚化合物,但天然植物中提取出的白藜芦醇不能满足人们对它的需求。因此,采用安全有效的酶解法[22]从虎杖中水解得到白藜芦醇成为研究热点;淫羊藿的主要化学成分为黄酮类化合物、生物碱、多糖、木质素、挥发油及一些微量元素[23]。其中黄酮类化合物含量高并且有较强的生物活性但不易被人体吸收,黄酮类化合物主要是朝藿定A、B、C和淫羊藿苷。因此,水解大豆异黄酮糖苷、淫羊藿黄酮类和虎杖苷,得到更容易被人体利用吸收的苷元形式是一项具有商业价值的应用。
BGL3-GXT6不能水解瑞鲍迪苷A、甜菊双糖苷、甜菊苷中的糖苷键,只能将甜茶苷中C-13和C-19位的葡萄糖苷键水解,生成甜菊醇和一个去掉葡萄糖基的中间产物。甜菊醇是甜菊糖苷类物质的苷元部分,由于具有广泛的生理活性而逐渐被人们研究。目前已报道的水解甜菊糖苷的酶有7个,其中3个是β-半乳糖苷酶,另外4个均是β-葡萄糖苷酶。其中来自Penicillium decumbens[24]的β-葡萄糖苷酶SPGase能够水解甜菊苷、甜茶苷、甜菊单糖苷和甜菊单糖脂,能够将甜菊苷水解为甜菊醇。另外本课题组已经鉴定了一个来自链霉菌Streptomyces sp. GXT6的β-葡萄糖苷酶能够水解甜菊糖苷中的甜菊苷和甜菊双糖苷[25]。而本研究中的BGL3-GXT6能够水解甜茶苷,生成甜菊醇,是除了SPGase外能够将甜菊糖苷水解生成甜菊醇的β-葡萄糖苷酶,具有一定的应用潜力。
2.5 BGL3-GXT6转糖苷功能的研究选用不同的供受体与重组酶BGL3-GXT6进行转糖苷研究,将转糖苷反应产物用HPLC检测,结果见表 3和表 4。
| Receptor | Donor | ||
| Glucose | Cellobiose | pNPG | |
| D-Mannose | - | - | - |
| D-Fructose | - | - | - |
| D-Xylose | - | - | - |
| D+Galactose | - | - | - |
| D+Arabinose | - | - | - |
| Maltose | - | - | - |
| Isomaltose | - | - | - |
| α-Lactose | - | - | - |
| α, α-Trehalose | - | - | - |
| Sucrose | - | - | - |
| Methanol | - | - | + |
| Ethanol | - | - | - |
| N-propanol | - | - | - |
| Isopropanol | - | - | + |
| Butanol | - | - | - |
| Glycol | - | - | + |
| 1, 2-propanediol | - | - | + |
| 1, 3-propanediol | - | - | + |
| 2, 3-butanediol | - | - | + |
| Glycerol | - | - | + |
| (+)-Catechin | - | - | - |
| Hexanol | + | - | ++ |
| Octanol | + | - | ++ |
| Nonanol | + | - | ++ |
| Decanol | - | - | + |
| +: Transglycosylation product generated, the amount is proportional to the output; -: No transglycosylation product was generated. | |||
| Receptor | Donor:pNPG |
| Hexyl-β-D-glucopyranoside | + |
| Heptyl-β-D-glucopyranoside | + |
| n-Octyl-β-D-Glucopyranoside | + |
| Nonyl-β-D-glucopyranoside | + |
| Decyl-β-D-glucopyranoside | + |
| Caffeic acid | - |
| Benzoic acid | - |
| L-Ascorbic acid | - |
| +: Transglycosylation product generated; -: No transglycosylation product was generated. | |
根据表 3结果显示,BGL3-GXT6以pNPG为糖基供体,以单糖和二糖为受体时没有转糖苷能力,以甲醇、异丙醇、乙二醇、1, 2-丙二醇、1, 3-丙二醇、2, 3-丁二醇、丙三醇为受体时虽有转糖基产物生成,但是转糖苷能力较弱,转糖苷产物的产量都很低。以pNPG和葡萄糖为糖基供体,以己醇、辛醇、壬醇为受体时均有较为明显的转糖苷产物生成,同时以pNPG为供体时的转糖苷产物产量比以葡萄糖为供体时要高。在以癸醇为糖基受体时,只有以pNPG为供体时才有少量转糖苷产物生成。以上结果均表明,BGL3-GXT6在发生转糖苷反应时偏好以pNPG作为糖基供体。
根据表 4结果显示,以pNPG为糖基供体,以烷基糖苷类为受体时虽然均有转糖苷产物生成,但是只有在以庚基-β-D-吡喃葡萄糖苷为受体时,BGL3-GXT6的转糖苷能力较强,有比较明显的转糖苷产物生成。
2.6 β-葡萄糖苷酶BGL3-GXT6的分子改造相关文献研究表明[18],β-葡萄糖苷酶上具有一个或者多个色氨酸Trp(W),对于固定糖具有非常重要的作用。糖与Trp上的吲哚环能够产生范德华力、弱静电作用、氢键等相互作用力,是Trp具有如此重要作用的原因。因此,对比糖基水解酶3家族(GH3)的氨基酸序列找出其保守区内的Trp,通过定点饱和突变的方法将Trp突变成其他19种氨基酸。以期望能够改变BGL3-GXT6的葡萄糖耐受性,获得具有较高葡萄糖耐受性的突变菌株。
在NCBI上通过BlastX查找GH3家族β-葡萄糖苷酶氨基酸序列并进行序列比对,结果显示BGL3-GXT6的81位和233位色氨酸W在其他32个同源性较高的GH3家族的酶中是严格保守的,因此对这2个点进行定点饱和突变。
通过反向PCR的方法获得目的DNA序列,将DNA序列进行测序并与bgl3基因序列进行比对后确定W81和W233位点的核苷酸均已成功饱和突变。将成功构建的重组质粒导入大肠杆菌,按照方法1.4对重组菌株进行诱导表达和纯化。将W81和W233位点的所有突变体用七叶苷-柠檬酸铁铵平板进行活性筛选,结果显示W81位点的突变体有7个具有酶活,W233位点有18个具有酶活(图 5),因此挑选这25个突变体按照方法1.5中BGL3-GXT6酶活测定方法测定各突变体酶的最适pH、最适温度、动力学常数、葡萄糖抑制常数,结果如表 5所示。

|
| 图 5 七叶苷-柠檬酸铁铵平板筛选到的阳性突变子 Figure 5 Positive mutants screened on the selective plate. A: Positive mutants of W81 screened on the selective plate; B: Positive mutants of W233 screened on the selective plate. |
| Mutants | Optimal temperature/℃ | Optimal pH | Km/(mmol/L) | Vmax/[μmol/(min·mg)] | Ki/(mmol/L) | Kcat/(1/S) |
| BGL3-GXT6 | 40 | 6.0 | 0.47±0.02 | 128.00±1.74 | 1.88±0.13 | 182.57±2.48 |
| W81C | 45 | 5.5 | 0.41±0.02 | 25.71±0.15 | 2.25±0.14 | 36.67±0.21 |
| W81F | 50 | 5.5 | 0.36±0.02 | 137.6±2.38 | 2.94±0.30 | 196.26±3.39 |
| W81I | 45 | 5.5 | 0.44±0.02 | 3.88±0.06 | 1.73±0.09 | 5.53±0.08 |
| W81L | 45 | 5.5 | 0.42±0.03 | 13.01±0.24 | 2.04±0.14 | 18.55±0.34 |
| W81M | 40 | 6.0 | 0.35±0.02 | 73.62±1.32 | 1.48±0.09 | 105.01±1.88 |
| W81V | 45 | 5.5 | 0.48±0.03 | 3.39±0.06 | 2.43±0.18 | 4.83±0.08 |
| W81Y | 40 | 6.0 | 0.39±0.02 | 147.3±2.32 | 1.95±0.11 | 210.09±3.30 |
| W233A | 35 | 6.5 | 1.60±0.08 | 3.52±0.05 | 60.66±2.98 | 5.02±0.07 |
| W233C | 45 | 5.5 | 0.93±0.05 | 2.52±0.04 | 120.2±8.82 | 3.59±0.05 |
| W233D | 40 | 5.5 | 4.4±0.16 | 2.13±0.04 | 396.4±11.99 | 3.03±0.05 |
| W233E | 35 | 6.0 | 1.12±0.04 | 1.41±0.01 | 197.7±6.17 | 2.01±0.01 |
| W233F | 45 | 6.0 | 0.66±0.004 | 32.58±0.54 | 12.05±0.70 | 46.46±0.77 |
| W233G | 35 | 6.0 | 2.38±0.14 | 0.32±0.01 | 8.88±0.58 | 0.45±0.01 |
| W233H | 45 | 6.5 | 1.43±0.06 | 6.69±0.10 | 17.03±0.78 | 9.54±0.14 |
| W233I | 45 | 6.0 | 0.86±0.07 | 0.25±0.01 | 312.6±34.00 | 0.35±0.01 |
| W233K | 45 | 6.0 | 2.01±0.09 | 0.48±0.01 | 146.1±6.67 | 0.68±0.01 |
| W233L | 50 | 6.0 | 0.68±0.05 | 1.58±0.03 | 215.3±14.94 | 2.25±0.04 |
| W233M | 50 | 6.0 | 1.09±0.08 | 3.34±0.07 | 65.68±6.03 | 4.76±0.09 |
| W233N | 45 | 6.0 | 2.71±0.13 | 1.31±0.02 | 98.38±4.64 | 1.86±0.02 |
| W233Q | 45 | 6.0 | 2.99±0.09 | 2.21±0.03 | 84.96±3.01 | 2.88±0.04 |
| W233R | 45 | 6.0 | 1.27±0.05 | 0.65±0.01 | 43.07±2.33 | 0.92±0.01 |
| W233S | 40 | 6.0 | 2.10±0.13 | 3.23±0.07 | 62.67±4.37 | 4.60±0.09 |
| W233T | 45 | 6.0 | 0.71±0.04 | 0.44±0.01 | 226.2±18.42 | 0.62±0.01 |
| W233V | 45 | 6.0 | 0.78±0.05 | 0.32±0.01 | 385.4±43.29 | 0.45±0.01 |
| W233Y | 45 | 6.0 | 0.55±0.03 | 21.12±0.39 | 23.00±1.62 | 30.12±0.55 |
表中结果显示,突变酶的最适温度和最适pH与野生重组酶BGL3-GXT6相比有不同程度的变化。W81位的7个突变酶的Km和葡萄糖抑制常数Ki值与野生重组酶相比基本上没有变化,但是Vmax却有不同变化。突变酶W81F和W81Y与BGL3- GXT6相比略有提高,W81C、W81L、W81M、W81I和W81V的Vmax有不同程度的降低。
W233位点饱和突变后获得的突变酶的Km、Vmax和葡萄糖抑制常数Ki与野生重组酶BGL3- GXT6相比均发生了明显变化。各突变酶的Km与BGL3-GXT6相比均出现不同程度的升高,其中W233D 4.4 mmol/L升高了3.53;突变酶的酶活与野生重组酶相比都有很大程度的降低;各突变酶的葡萄糖抑制常数Ki值都有不同程度的提高,突变酶W233C、W233D、W233E、W233I、W233K、W233L、W233T和W233V的Ki值变化较为明显,与BGL3-GXT6相比分别提高了约63、209、104、165、77、114、119和204倍,变化最小的突变酶W233G的Ki值也提升了4倍。因此,233位的饱和突变成功获得了葡萄糖耐受性提高的突变酶。
W81位点和W233位点获得的突变体对于葡萄糖耐受性呈现出不同的变化,通过SWISS- MODEL对BGL3-GXT6进行建模分析,结果(图 6)是以新阿波罗栖热胞菌的β-葡萄糖苷酶[26] (PDB:2×42)为模板,其中绿色标注的氨基酸为亲核试剂Asp和质子供体Glu,蓝色标注为突变位点。通过分析BGL3-GXT6的模型图发现,W81位点远离β-葡萄糖苷酶的活性中心,而W233位点位于其活性中心。因而推测,造成2个位点对于葡萄糖耐受性变化不同的原因可能是因为W81位点远离BGL3-GXT6的活性中心,它的突变对于葡萄糖与BGL3-GXT6结合影响不大;而W233位点位于活性中心,它的突变影响了BGL3-GXT6与葡萄糖的结合,而且突变成不同的氨基酸后对于葡萄糖耐受程度也有所不同。

|
| 图 6 BGL3-GXT6的3D结构 Figure 6 3D structure of BGL3-GXT6. |
根据文献报道[27],BGL3-GXT6中的Trp-81是其转糖基活性的关键氨基酸。对该位点饱和突变所获得的5个有活性的突变酶按照方法1.7进行转糖苷活性研究,结果见表 6。
| Receptor | Donor:pNPG | ||||
| W81C | W81F | W81M | W81L | W81I | |
| Hexyl-β-D-glucopyranoside | - | - | + | - | - |
| Heptyl-β-D-glucopyranoside | - | - | - | - | - |
| n-Octyl-β-D-Glucopyranoside | - | + | + | - | - |
| Nonyl-β-D-glucopyranoside | - | + | + | - | - |
| Decyl-β-D-glucopyranoside | - | - | - | - | - |
| Hexanol | - | + | + | + | + |
| Octanol | + | + | + | + | + |
| Nonanol | - | + | + | + | + |
| Decanol | - | - | + | + | - |
| Caffeic acid | - | - | - | - | - |
| Benzoic acid | - | - | - | - | - |
| L-Ascorbic acid | - | - | - | - | - |
| (+)-Catechin | - | - | - | - | - |
| +: Transglycosylation product generated; -: No transglycosylation product was generated. | |||||
将突变酶的转糖苷结果与BGL3-GXT6的转糖苷结果进行对比分析发现,突变酶的转糖苷能力并没有明显的变化。
3 结论本研究以经过全基因测序的链霉菌GXT6为出发菌株,从中克隆出一个β-葡萄糖苷基因,命名为bgl3,该基因核苷酸序列长度为2319 bp。选用pSE380为表达载体,转化至大肠杆菌XL1-blue中诱导表达,通过镍亲和层析方法纯化得到大小为83 kDa的目的蛋白质BGL3-GXT6,对BGL3-GXT6进行酶学性质研究。BGL3-GXT6的最适温度为40℃,最适pH为6.0,Km值为(0.4712± 0.0180) mmol/L,Vmax值为(128.000±1.741) μmol/(min·mg),葡萄糖抑制常数Ki值为(1.8880±0.1307) mmol/L。BGL3-GXT6对天然底物黄豆苷、染料木苷、黄豆黄苷、甜茶苷和虎杖苷具有水解能力。对BGL3-GXT6中葡萄糖耐受性相关的氨基酸位点(Trp-81,Trp-233)进行饱和突变,获得25个有活性的突变酶。对突变酶进行酶学性质研究,W81位点和W233位点获得的突变体对葡萄糖耐受性呈现出不同的变化,其中W81位点的突变体葡萄糖抑制常数和BGL3-GXT6相比基本上没有变化,W233位点的突变体的葡萄糖抑制常数均有提高,突变酶W233C、W233D、W233E、W233I、W233K、W233L、W233T和W233V的Ki值变化较为明显,与BGL3-GXT6相比分别提高了约63、209、104、165、77、114、119和204倍,变化最小的突变酶W233G的Ki值也提升了4倍。因此,233位的饱和突变成功获得了葡萄糖耐受性提高的突变酶。对W81位点获得的突变体进行转糖苷活性研究,发现各突变体的转糖苷活性相比BGL3-GXT6基本上没有正向的变化。
| [1] | Crespim E, Zanphorlin LM, de Souza FHM, Diogo JA, Gazolla AC, Machado CB, Figueiredo F, Sousa AS, Nóbrega F, Pellizari VH, Murakami MT, Ruller R. A novel cold-adapted and glucose-tolerant GH1β-glucosidase from Exiguobacterium antarcticum B7. International Journal of Biological Macromolecules, 2016, 82: 375-380. DOI:10.1016/j.ijbiomac.2015.09.018 |
| [2] | Zhou X, Huang Z, Yang HW, Jiang Y, Wei W, Li QY, Mo QG, Liu JL. β-Glucosidase inhibition sensitizes breast cancer to chemotherapy. Biomedicine & Pharmacotherapy, 2017, 91: 504-509. |
| [3] | Zhao XY, Li R, Liu Y, Zhang XH, Zhang M, Zeng Z, Wu LM, Gao XL, Lan T, Wang YQ. Polydatin protects against carbon tetrachloride-induced liver fibrosis in mice. Archives of Biochemistry and Biophysics, 2017, 629: 1-7. DOI:10.1016/j.abb.2017.06.017 |
| [4] |
Zhang R, Li YJ, Wang X. Research progress on the antimicrobial action of resveratrol. Journal of Hebei Medical University, 2010, 31(9): 1151-1154.
(in Chinese) 张瑞, 李永军, 王鑫. 白藜芦醇抗菌作用的研究进展. 河北医科大学学报, 2010, 31(9): 1151-1154. DOI:10.3969/j.issn.1007-3205.2010.09.049 |
| [5] | Scherzberg MC, Kiehl A, Zivkovic A, Stark H, Stein J, Fürst R, Steinhilber D, Ulrich-Rückert S. Structural modification of resveratrol leads to increased anti-tumor activity, but causes profound changes in the mode of action. Toxicology and Applied Pharmacology, 2015, 287(1): 67-76. DOI:10.1016/j.taap.2015.05.020 |
| [6] | Chen X, Tang LJ, Sun YN, Qiu PH, Liang G. Syntheses, characterization and antitumor activities of transition metal complexes with isoflavone. Journal of Inorganic Biochemistry, 2010, 104(4): 379-384. DOI:10.1016/j.jinorgbio.2009.11.008 |
| [7] | Cano A, García-Pérez MÁ, Tarín JJ. Isoflavones and cardiovascular disease. Maturitas, 2010, 67(3): 219-226. DOI:10.1016/j.maturitas.2010.07.015 |
| [8] | Ahn-Jarvis JH, Teegarden MD, Schwartz SJ, Lee K, Vodovotz Y. Modulating conversion of isoflavone glycosides to aglycones using crude beta-glycosidase extracts from almonds and processed soy. Food Chemistry, 2017, 237: 685-692. DOI:10.1016/j.foodchem.2017.05.122 |
| [9] |
Fan G, Wang KX, Pan SY. Advances in research of glycosidically bound aroma compounds in fruits. Scientia Agricultura Sinica, 2010, 43(24): 5100-5111.
(in Chinese) 范刚, 王可兴, 潘思轶. 水果中糖苷键合态香气物质的研究进展. 中国农业科学, 2010, 43(24): 5100-5111. DOI:10.3864/j.issn.0578-1752.2010.24.014 |
| [10] | Agrawal R, Verma AK, Satlewal A. Application of nanoparticle-immobilized thermostable β-glucosidase for improving the sugarcane juice properties. Innovative Food Science & Emerging Technologies, 2016, 33: 472-482. |
| [11] |
Li P, Wan XC, Tao WY, Ding XL. Enhancing the aroma of foods by using β-glucosidase. Food and Fermentation Industries, 1999, 26(2): 5-6, 32.
(in Chinese) 李平, 宛晓春, 陶文沂, 丁霄霖. 黑曲霉β-葡萄糖苷酶的食品增香应用. 食品与发酵工业, 1999, 26(2): 5-6, 32. |
| [12] | Florindo RN, Souza VP, Mutti HS, Camilo C, Manzine LR, Marana SR, Polikarpov I, Nascimento AS. Structural insights into β-glucosidase transglycosylation based on biochemical, structural and computational analysis of two GH1 enzymes from Trichoderma harzianum. New Biotechnology, 2018, 40: 218-227. DOI:10.1016/j.nbt.2017.08.012 |
| [13] | Kumar P, Ryan B, Henehan GTM. β-Glucosidase from Streptomyces griseus:Nanoparticle immobilisation and application to alkyl glucoside synthesis. Protein Expression and Purification, 2017, 132: 164-170. DOI:10.1016/j.pep.2017.01.011 |
| [14] | Teugias H, Väljamäe P. Selecting β-glucosidases to support cellulases in cellulose saccharification. Biotechnology for Biofuels, 2013, 6: 105. DOI:10.1186/1754-6834-6-105 |
| [15] | Varghese JN, Hrmova M, Fincher GB. Three-dimensional structure of a barley β-D-glucan exohydrolase, a family 3 glycosyl hydrolase. Structure, 1999, 7(2): 179-190. DOI:10.1016/S0969-2126(99)80024-0 |
| [16] | Chan AKN, Wang YY, Ng KL, Fu ZB, Wong WKR. Cloning and characterization of a novel cellobiase gene, cba3, encoding the first known β-glucosidase of glycoside hydrolase family 1 of Cellulomonas biazotea. Gene, 2012, 493(1): 52-61. DOI:10.1016/j.gene.2011.11.027 |
| [17] | Liu JJ, Zhang XC, Fang ZM, Fang W, Peng H, Xiao YZ. The 184th residue of β-glucosidase Bgl1B plays an important role in glucose tolerance. Journal of Bioscience and Bioengineering, 2011, 112(5): 447-450. DOI:10.1016/j.jbiosc.2011.07.017 |
| [18] | Seidle HF, McKenzie K, Marten I, Shoseyov O, Huber RE. Trp-262 is a key residue for the hydrolytic and transglucosidic reactivity of the Aspergillus niger family 3β-glucosidase:Substitution results in enzymes with mainly transglucosidic activity. Archives of Biochemistry and Biophysics, 2005, 444(1): 66-75. DOI:10.1016/j.abb.2005.09.013 |
| [19] |
Pan LH, Luo JP. Advance in research and application of β-D-glucosidse. Food Science, 2006, 27(12): 803-807.
(in Chinese) 潘利华, 罗建平. 葡萄糖苷酶的研究及应用进展. 食品科学, 2006, 27(12): 803-807. DOI:10.3321/j.issn:1002-6630.2006.12.210 |
| [20] | Parry NJ, Beever DE, Owen E, Vandenberghe I, Beeumen JV, Bhat MK. Biochemical characterization and mechanism of action of a thermostable beta-glucosidase purified from Thermoascus aurantiacus. Biochemical Journal, 2001, 353(1): 117-127. |
| [21] | Li G, Jiang Y, Fan XJ, Liu YH. Molecular cloning and characterization of a novel β-glucosidase with high hydrolyzing ability for soybean isoflavone glycosides and glucose-tolerance from soil metagenomic library. Bioresource Technology, 2012, 123: 15-22. DOI:10.1016/j.biortech.2012.07.083 |
| [22] |
Chen RR, Jiang H, Pu HL. Optimization technology for production of resveratrol by enzyme. China Food Additives, 2011(5): 64-67.
(in Chinese) 陈蓉蓉, 姜华, 蒲含林. 酶解法制备白藜芦醇的工艺优化. 中国食品添加剂, 2011(5): 64-67. DOI:10.3969/j.issn.1006-2513.2011.05.004 |
| [23] |
Lei YT, Liang Y, Hao XY, Qiu L, Hu ZY. Four active components of epimedium in different habitats determination of content of high performance liquid chromatography. Lishizhen Medicine and Materia Medica Research, 2013, 24(6): 1404-1405.
(in Chinese) 雷永涛, 梁妍, 郝小燕, 裘璐, 胡朝阳. 不同产地淫羊藿中4种活性成分含量的高效液相色谱法测定. 时珍国医国药, 2013, 24(6): 1404-1405. DOI:10.3969/j.issn.1008-0805.2013.06.050 |
| [24] | Ko JA, Ryu YB, Kwon HJ, Jeong HJ, Park SJ, Kim CY, Wee YJ, Kim D, Lee WS, Kim YM. Characterization of a novel steviol-producing β-glucosidase from Penicillium decumbens and optimal production of the steviol. Applied Microbiology and Biotechnology, 2013, 97(18): 8151-8161. DOI:10.1007/s00253-013-4883-0 |
| [25] | Wang ZL, Wang JP, Jiang MH, Wei YT, Pang H, Wei H, Huang RB, Du LQ. Selective production of rubusoside from stevioside by using the sophorose activity of β-glucosidase from Streptomyces sp. GXT6. Applied Microbiology and Biotechnology, 2015, 99(22): 9663-9674. DOI:10.1007/s00253-015-6802-z |
| [26] | Pozzo T, Pasten JL, Karlsson EN, Logan DT. Structural and functional analyses of β-glucosidase 3B from Thermotoga neapolitana:a thermostable three-domain representative of glycoside hydrolase 3. Journal of Molecular Biology, 2010, 397(3): 724-739. DOI:10.1016/j.jmb.2010.01.072 |
| [27] | Seidle HF, Allison SJ, George E, Huber RE. Trp-49 of the family 3β-glucosidase from Aspergillus niger is important for its transglucosidic activity:Creation of novel β-glucosidases with low transglucosidic efficiencies. Archives of Biochemistry and Biophysics, 2006, 455(2): 110-118. DOI:10.1016/j.abb.2006.09.016 |
 2018, Vol. 58
2018, Vol. 58