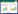中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 赵佳琳, 陈军, 崔玉琳, 于淑贤, 陈高, 秦松. 2018
- Jialin Zhao, Jun Chen, Yulin Cui, Shuxian Yu, Gao Chen, Song Qin. 2018
- 集胞藻PCC 6803中丝氨酸/苏氨酸激酶SpkC对高温胁迫的响应
- Response of serine/threonine protein kinase SpkC to high temperature stress in Synechocystis sp. PCC 6803
- 微生物学报, 58(10): 1732-1742
- Acta Microbiologica Sinica, 58(10): 1732-1742
-
文章历史
- 收稿日期:2017-11-07
- 修回日期:2018-01-24
- 网络出版日期:2018-03-07
2. 中国科学院大学, 北京 100049;
3. 山东省农业科学院生物技术研究中心, 山东 济南 250100;
4. 山东省作物遗传改良与生态生理重点实验室, 山东 济南 250100
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Biotechnology Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong Province, China;
4. Shandong Provincial Key Laboratory of Genetic Improvement, Ecology and Physiology of Crops, Jinan 250100, Shandong Province, China
蓝藻是一种能够进行光合作用的低等原核生物,起源于距今三十多亿年前[1]。蓝藻具有复杂的外界信号感知和转导系统,能够适应不同的极端环境,如强光、高温、低温等极端环境[2-3]。蓝藻信号转导基本过程主要为:当外界环境发生变化时,其通过感受器感知外来的环境胁迫信号;信号转导分子将信号传递给下游的相关基因,以调节自身的转录、翻译等过程,从而合成特异性的蛋白质和酶,调节自身的生长代谢;最终对外界环境信号作出反应,以适应外界环境变化。蓝藻信号转导系统主要包括二元信号转导系统和丝氨酸/苏氨酸激酶[4]。
集胞藻PCC 6803是蓝藻中的模式生物,生长速率快、培养条件简单[5];具有天然的转化系统,便于遗传操作和突变株的构建;遗传背景清晰,是第一个完成全基因组测序的蓝藻[6]。集胞藻PCC 6803的基因组中共预测编码丝氨酸/苏氨酸激酶基因12个,其中7个属于Pkn2亚族型(spkA、spkB、spkC、spkD、spkE、spkF、spkG),5个属于ABC1型(spkH、spkI、spkJ、spkK、spkL)[7]。研究表明,所有的丝氨酸/苏氨酸激酶都包括250–300个氨基酸保守区域,并通过磷酸化作用实现功能,对于集胞藻感知外界逆境传递信号具有重要作用[8]。不同丝氨酸/苏氨酸激酶在集胞藻信号转导、生理调节等方面发挥着不同作用。Zorina等[8]发现,spkC、spkF、spkK基因的敲除使热激蛋白GroES在高温胁迫条件下无法磷酸化,表明SpkC、SpkF、SpkK可能共同参与高温胁迫的响应过程;已有研究证明SpkE参与了冷胁迫的响应[9];此外,本实验室的前期工作表明SpkG参与高盐胁迫信号的响应[10]。
SpkC具有自磷酸化和磷酸化底物的蛋白激酶活性,是一种重要的丝氨酸/苏氨酸激酶[11],但目前对于其功能研究较少。本课题组在前期的工作初步表明SpkC可能对高温胁迫有响应[12]。因此,本文利用同源重组的方法在集胞藻PCC 6803中完全敲除SpkC编码基因slr0599,从而构建突变株ΔspkC,并通过检测高温胁迫下生长速率、色素含量、光合系统Ⅱ活性,以及高温恢复阶段的藻株的存活情况等生理表型变化,以期探讨SpkC在集胞藻PCC 6803适应高温胁迫过程中发挥的作用,为完善高温胁迫下蓝藻信号转导网络提供基础。
1 材料和方法 1.1 材料 1.1.1 菌株和质粒: 野生型集胞藻PCC 6803 (Synechocystis sp. PCC 6803)购自中国科学院淡水藻种库,藻种编号FACHB-898;大肠杆菌(Escherichia coli) DH5α,质粒pEGFP-N1、pUC18均由本实验室保存。 1.1.2 主要试剂: 植物基因组提取试剂盒购自天根生化科技(北京)有限公司;SanPrep柱式质粒DNA小量抽提试剂盒购自生工生物工程(上海)股份有限公司;KOD-plus购自东洋纺(上海)生物科技有限公司;限制性核酸内切酶EcoRⅠ、Hind Ⅲ,T4 DNA ligase购自Thermo Scientific公司;氨苄青霉素、卡那霉素为Sigma公司产品,TaKaRa Ex Taq、DNA分子标准量marker均购自大连宝生物工程有限公司,实验所用引物由北京睿博兴科生物技术有限公司合成。 1.1.3 引物: 根据NCBI中基因序列,用Primer 5.0软件设计引物,表 1为本研究中所用引物。| Primers | Primer sequences (5′→3′) | Restriction site |
| spkCUP-F1 | GTAAAACGACGGCCAGTGCCAAGCTTTCCCTTTCTCTGCCATGGTG | Hind Ⅲ |
| spkCUP-R1 | GTTCTTTCCGCCTCAGAGCAATGCCCTATGCTCCTA | |
| spkC-F2 | TGCTCTGAGGCGGAAAGAAC | |
| spkC-R2 | ATCCTCAGAAGAACTCGTCA | |
| spkCDN-F3 | TGACGAGTTCTTCTGAGGATTTATACTAAGAATAGA | |
| spkCDN-R3 | ACAGCTATGACCATGATTACGAATTCACCTGGTTTAAACCTTTTTTC | EcoRⅠ |
| spkC-F1 | ATGGTTACCCCACTCAAACT | |
| spkC-R1 | CTAATTTTGCTCGGGGTC | |
| spkC-kan-F1 | ATCCCAAAACATTTTTTGCAACT | |
| spkC-kan-R1 | TTGCCTCCTTTGTGACCACC | |
| 0599-R1 | ATCCCAAAACATTTTTTGCAACT | |
| 0599-F1 | TTGCCTCCTTTGTGACCACC |
1.2 藻种培养方法
使用BG11培养基培养集胞藻PCC 6803,培养条件为30 ℃,50 μmol/(m2·s),连续光照静置培养。BG11固体培养基中包含0.3%硫代硫酸钠、8×10–3 mol/L TES (pH 8.2)、5×10–3 mol/L葡萄糖、2%琼脂。通过向BG11培养基中添加硫酸卡那霉素,筛选突变株。
1.3 ΔspkC突变株的构建 1.3.1 同源重组载体的构建: 基因spkC的完全敲除载体构建示意图如图 1所示。本实验采用融合PCR法构建基因敲除片段,即用含有卡那霉素抗性基因片段来取代目的基因spkC。通过PCR的方法用spkCUP-F1/spkCUP-R1、spkC-FDN3/ spkCDN-R3引物分别扩增基因,得到spkC上游同源臂和spkC下游同源臂片段(上下游1000 bp基因片段),用spkC-F2/spkC-R2引物扩增pEGFP-N1质粒,得到卡那霉素抗性基因。将上述3个产物回收后作为模板,以spkCUP-F1/spkCDN-R3为引物扩增,得到全长片段spkC-kan。将全长产物spkC-kan和载体pUC18分别用EcoRⅠ、Hind Ⅲ进行酶切,将产物纯化回收后,用T4连接酶连接后转化至大肠杆菌DH5α,经PCR验证,引物见表 1。50 μg/mL卡那霉素和50 μg/mL氨苄青霉素筛选后将阳性克隆送至生工生物工程(上海)股份有限公司测序。
|
| 图 1 ΔspkC突变株构建 Figure 1 Construction of ΔspkC mutant. A: Construction of the spkC homologous recombination vector; B: Schematic representation of the constructs used to generate ΔspkC mutant. |
1.3.2 集胞藻的转化: 参照Williams[13]的方法,将生长至对数期的集胞藻离心收集,用新鲜BG11培养基悬浮藻细胞至藻细胞OD730值为2.5左右。加入含目的片段的质粒10 μg,低光照温育6 h。随后在含有卡那霉素抗性(50 μg/mL)的BG11固体培养基上进行涂布筛选,并在30 ℃、50 μmol/(m2·s)连续光照条件下培养。待阳性转化子出现后,逐步增加平板上的抗生素浓度,进行传代培养,并最终获得完全基因敲除的集胞藻6803突变株ΔspkC。针对spkC基因、kanR基因和整个同源重组片段分别设计上、下游引物,并在同源臂(L)上游700 bp及同源臂(R)下游540 bp处设计引物,通过PCR扩增及测序进行检测,引物见表 1。 1.4 生长曲线的测定
取处于对数生长期(OD730=0.6–0.8)的集胞藻,调节初始接种浓度OD730值为0.1,每24 h取样1次,用普析Tu-1810紫外分光光度计测定OD730值,绘制生长曲线。实验组和对照组各设置3个平行。
1.5 全细胞吸收光谱测定用普析Tu-1810紫外分光光度计进行波长扫描,扫描范围为400–800 nm,扫描速度为快速。测量前,先用BG11培养基进行基线校正,测量时取3 mL藻液进行检测。以波长为横坐标,以对应的OD值为纵坐标作图绘制全细胞吸收光谱图。各样品的全细胞吸收光谱图以730 nm处的OD值进行归一化处理。
1.6 高温胁迫处理生长曲线和全细胞吸收测量时,高温胁迫处理条件为42 ℃水浴,50 μmol/(m2·s)连续光照静置培养;叶绿素荧光参数测定时,高温胁迫温度为45 ℃,处理时间为30、60、90、120、150 min。每个时间点设置3个平行。
1.7 叶绿素荧光参数的测量叶绿素荧光参数用水下调制荧光仪Diving-PAM进行测定。测量时,取处于对数期(OD730=0.6)的藻液,先将集胞藻PCC 6803进行2 min暗处理,实际光量子产量(Yield)和反映光合系统Ⅱ(PSII)的最大量子产量的Fv/Fm可直接读出,其中标准测量光强为0.15 μmol/(m2·s),饱和脉冲为5640 μE/(m2·s)。
1.8 藻株存活情况检测将初始OD730值为0.1的藻液,分别在42 ℃下高温处理1 d和5 d后,调节OD730=0.1,放置于正常培养条件下培养,每24 h测定OD730,绘制生长曲线。
2 结果和分析 2.1 突变株的构建和鉴定PCR验证突变株基因的敲除情况,分别检测野生株和突变株基因组DNA中是否存在kanR基因、spkC基因、整个同源交换片段spkC-kan,以及克隆自同源臂(L)上游700 bp至同源臂(R)下游540 bp的大片段,检测外源序列是否进行同源重组。结果如图 2所示。

|
| 图 2 ΔspkC突变株DNA水平鉴定 Figure 2 The identification of ΔspkC mutant in DNA level. A: PCR analysis of genomic DNA from wild type (lanes 1, 2, 5, 6) and ΔspkC (lanes 3, 4, 7, 8) mutant using the primers amplifying the open reading frame of spkC (lanes 1–4) or the fragment of kanR (lanes 5–8). B: PCR analysis of genomic DNA from wild type (lanes 1, 2, 5, 6) and ΔspkC (lanes 3, 4, 7, 8) mutant using the primers amplifying the open reading frame of spkC-kan or the fragment from 700 bp upstream of homology arm (L) to 540 bp downstream of homology arm (R). |
使用kanR基因、spkC基因、整个同源交换片段spkC-kan的引物,以及在同源臂(L)上游700 bp至同源臂(R)下游540 bp片段处设计的引物对藻株进行鉴定,引物序列见表 1。电泳图表明突变株中存在kanR抗性基因,而spkC基因条带消失。此外,对整个同源交换片段spkC-kan及同源臂(L)上游700 bp至同源臂(R)下游540 bp片段进行测序的结果表明,kanR抗性基因已经替换spkC基因,验证了PCR的检验结果。以上结果表明spkC基因完全敲除,突变株ΔspkC已构建成功。
2.2 正常培养条件下藻株的生长情况为了检测spkC基因敲除是否对藻株的生长产生影响,本实验检测了突变株与野生株在正常培养条件下的生长情况,结果显示,野生株和突变株的生长速率相似(图 3)。另外,藻株叶绿素a、藻胆色素、类胡萝卜素特征峰分别为675 nm、625 nm、485 nm[14],据此检测处于对数期(OD730=0.6)的野生株和突变株色素的相对含量,结果显示野生株和突变株的色素含量略有不同(图 4),但是无显著性差异(P > 0.1)。综上所述,藻株的生长情况与色素含量没有明显差别,说明spkC基因敲除对集胞藻的生长基本没有影响。
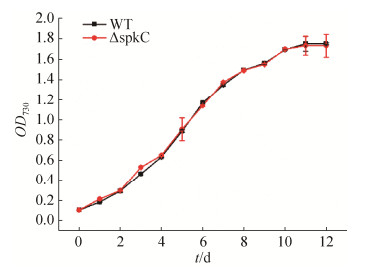
|
| 图 3 正常培养条件下野生株和突变株的生长曲线 Figure 3 The growth curve of wild strain and ΔspkC mutant under normal condition. Error bars indicate standard error of triplicate. |

|
| 图 4 处于对数期的藻株的吸收光谱 Figure 4 The whole cell absorption spectra of wild type and mutant strains at exponential phase. |
2.3 高温胁迫下野生株和突变株的表型差异 2.3.1 高温胁迫(42 ℃)下藻株生长情况: 高温42 ℃处理后,野生株和突变株的生长速率均减慢(图 5),表明二者均受高温胁迫的影响。突变株ΔspkC在第6天的生长几乎停滞,由此推断SpkC可能与集胞藻适应高温胁迫有关,并在响应高温胁迫中发挥重要作用。

|
| 图 5 高温胁迫(42 ℃)下生长曲线 Figure 5 The growth curve of wild strain and mutant under high temperature stress (42 ℃). Error bars indicate standard error of triplicate. |
2.3.2 ΔspkC突变株在高温胁迫(42 ℃)下的全细胞吸收光谱: 通过比较类胡萝卜素、藻胆色素、叶绿素的含量来分析敲除spkC基因对集胞藻PCC 6803生长的影响(图 6)。高温处理后,野生株和突变株中三种色素的含量均下降,表明高温处理对野生株和突变株的色素合成有抑制作用,并对其生长状态造成影响。第1天热处理后,野生株和突变株的三种色素含量均显著下降,并且突变株的色素含量降低幅度相对更大,这表明高温可能对突变株的影响更为显著。高温处理第2天,野生株和突变株的色素含量相近。高温处理第3天,野生株的色素含量上升,但突变株的色素含量几乎没有变化,表明野生株可能已经开始适应高温环境,而突变株的色素合成则一直受到抑制。综合上述结果,可以推断spkC编码基因slr0599可能对集胞藻在高温胁迫适应过程中的色素合成起到调控作用。

|
| 图 6 野生株和ΔspkC突变株在高温胁迫下的全细胞吸收图 Figure 6 The whole cell absorption spectra of wild strain and mutant under high temperature stress.Whole cell absorption spectra was measured after 1 day (A), 2 days (B), 3 days (C) of growth under high temperature. |
2.3.3 ΔspkC突变株在高温胁迫(45℃)下叶绿素荧光参数: Fv/Fm是PSII的最大量子产量,反映了光合系统Ⅱ的最大活性。一般情况下,PSII在外界胁迫条件下受损,Fv/Fm会显著降低[15]。YII是作用光下PSⅡ实际光化学效率,反映了光合作用的能量效率。本研究检测了在高温胁迫下,藻株叶绿素荧光参数的变化情况(图 7)。在高温胁迫(45 ℃)后,野生株和突变株的Fv/Fm均下降,这表明高温对二者的生长均有抑制作用。高温胁迫可能造成了藻株PSⅡ的结构破坏,从而使光合功能降低。在Fv/Fm变化曲线中,野生株的Fv/Fm下降了约70.5%,而突变株则下降88.0%;与野生株相比,突变株的Fv/Fm显著降低(P < 0.05)。在高温胁迫(45 ℃)后,野生株和突变株的YII呈下降趋势,表明高温抑制野生株和突变株的能量传递效率。在高温胁迫150 min后,野生株YII值为突变株的3倍,说明突变株对高温更加敏感;观察YII变化曲线,二者每个时间点的Fv/Fm之间的P值均小于0.05,表明突变株ΔspkC较WT的明显降低。以上结果说明,spkC基因敲除后,藻株的光合系统Ⅱ更容易受到高温的影响,光合能力受损程度较野生株更为严重。

|
| 图 7 高温胁迫下(45 ℃)突变株的光合系统Ⅱ活性 Figure 7 PSII activity of wild and mutant strains under high temperature stress (45 ℃). A: Maximal photochemical efficiency of photosystem II. Error bars indicate standard error of triplicate. B: Yield. Error bars indicate standard error of triplicate. |
2.4 高温胁迫(42 ℃)恢复阶段藻株的生长情况
将野生株和突变株放置在42 ℃下分别处理1 d和5 d,然后调节OD730至0.1,置于正常温度(30 ℃)下生长。结果如图 8所示,高温处理1 d后恢复生长,野生株和突变株的长势没有显著差异;但是在高温处理5 d后,突变株生长缓慢,几乎停滞生长,表明长期的高温对其生长造成了损害。据此推断,spkC基因的缺失会造成藻株对高温的耐受性下降,并且在正常条件下也无法恢复正常生长。

|
| 图 8 高温胁迫(42 ℃)恢复后野生株与ΔspkC突变株的生长曲线 Figure 8 The growth curve of wild strain and mutant under the recovery. Error bars indicate standard error of triplicate. |
3 讨论
集胞藻PCC 6803具有复杂的信号转导网络系统,能够适应多样的生存环境[16]。丝氨酸/苏氨酸激酶被认为是真核生物信号转导网络的重要组成部分,于1991年被发现也存在于原核生物中,并在原核生物的细胞功能调节中发挥重要作用[9]。SpkC是集胞藻PCC 6803中的一种丝氨酸/苏氨酸激酶,研究其在信号转导中的功能对于完善信号转导调控机制具有重要意义。本研究通过敲除spkC基因来构建突变株,并观察基因敲除突变株ΔspkC在高温胁迫下的表型,以此来探究SpkC在响应高温信号时的作用。
集胞藻最适生长温度为30–35 ℃,一般认为温度升高10 ℃以上,则藻株受到高温胁迫[17]。在42 ℃高温条件下,突变株生长速度明显慢于野生株,表明ΔspkC突变株为高温敏感株,这与实验室之前的研究结果一致[12];色素是集胞藻类囊体膜的重要组成成分,是参与光合作用的主要参与者,光合色素的变化与植物适应环境的能力有关[18]。叶绿素是光能吸收的初始物质,高温会抑制叶绿素的合成,而且由于高温下活性氧大量积累,加速叶绿素分解[19]。类胡萝卜素是光合膜的重要成分,其参与了光捕获以及PII光合系统复合物的组装,从而使藻株不受外界环境胁迫的影响[20]。而藻胆色素的含量变化会导致光合作用中的电子传递链中氧化还原状态的改变[21]。在本研究中,我们检测了高温胁迫前3天色素的变化情况,发现三种色素含量均在下降,并且基因敲除突变株的色素含量一直下降,而野生株的色素含量则是先下降后上升,表明基因的敲除对色素合成造成严重影响。同时,突变株的光合能力也相应下降,说明其耐受逆境的能力也下降。
光合系统Ⅱ是对热最为敏感的光合作用元件[22-23],叶绿素荧光的变化可以灵敏地反映出逆境对光合作用光反应阶段的影响[24]。本研究中对上述两个叶绿素荧光参数进行了研究,并发现在45 ℃高温处理下,ΔspkC的Fv/Fm和YII显著低于野生株,其光合系统活性严重受损,影响了光合电子传递的过程。该结果与Tuominen等[25]在研究SigB调控高温响应的结果趋势相同,提示SpkC在高温响应上可能与SigB有相同的作用机制。
同时,本文对藻株在高温胁迫恢复阶段的存活情况进行了分析。在42 ℃高温处理1 d后,藻株存活情况没有出现明显差异。然而在高温胁迫5 d后,野生株生长恢复,这与Sheng等[26]的研究结果相符,即野生株经历4 d长期高温胁迫后仍可以恢复生长。突变株ΔspkC高温胁迫恢复阶段生长停滞,表明ΔspkC的藻细胞生存能力下降,而且在基因敲除后耐热性下降。
在本研究中,我们根据生理表型确定了丝氨酸/苏氨酸激酶SpkC参与高温胁迫信号的响应。研究结果显示,激酶SpkC与色素合成、光合系统等途径存在调控关系。由此推测,高温胁迫下集胞藻PCC 6803中SpkC的缺失导致下游靶序列, 如光合系统中的相关基因——藻胆蛋白、类胡萝卜素和叶绿素合成基因等高温胁迫响应基因,其表达受到抑制或激酶的缺失使得下游相关蛋白的磷酸化程度受到影响,从而导致藻株对高温胁迫的响应出现缺陷,这也提示我们后续有必要从分子水平上研究SpkC与二者之间的调控作用。此外,作为一种可能的温度调控因子,SpkC可能与热休克蛋白之间也存在调控关系,这些蛋白包括GroES、GroEL、DnaJ、DnaK、HspA等,均在集胞藻的热适应上起到重要作用[3]。作为蓝藻信号转导系统的一部分,丝氨酸/苏氨酸激酶还可能与其他信号转导系统存在相互作用。如今,研究公认的高温调控因子有组氨酸激酶Hik34[27]、RNA聚合酶σ因子SigB和SigC[28]等,研究SpkC与以上几个信号转导因子间的作用,将为揭示丝氨酸/苏氨酸激酶SpkC在蓝藻信号转导中调节机制、解析蓝藻信号转导系统间的相互作用提供证据。
| [1] | Rozanov AY, Astafieva MM. The evolution of the Early Precambrian geobiological systems. Paleontological Journal, 2009, 43(8): 911-927. DOI:10.1134/S0031030109080103 |
| [2] | Rast A, Rengstl B, Heinz S, Klingl A, Nickelsen J. The role of Slr0151, a tetratricopeptide repeat protein from Synechocystis sp. PCC 6803, during photosystem Ⅱ assembly and repair. Frontiers in Plant Science, 2016, 7: 605. |
| [3] | Kobayashi I, Watanabe S, Kanesaki Y, Shimada T, Yoshikawa H, Tanaka K. Conserved two-component Hik34-Rre1 module directly activates heat-stress inducible transcription of major chaperone and other genes in Synechococcus elongatus PCC 7942. Molecular Microbiology, 2017, 104(2): 260-277. DOI:10.1111/mmi.2017.104.issue-2 |
| [4] | Ibrahim IM, Puthiyaveetil S, Allen JF. A two-component regulatory system in transcriptional control of photosystem stoichiometry:redox-dependent and sodium ion-dependent phosphoryl transfer from cyanobacterial histidine kinase Hik2 to response regulators Rre1 and RppA. Frontiers in Plant Science, 2016, 7: 137. |
| [5] | Anderson SL, McIntosh L. Light-activated heterotrophic growth of the cyanobacterium Synechocystis sp. strain PCC 6803:a blue-light-requiring process. Journal of Bacteriology, 1991, 173(9): 2761-2767. DOI:10.1128/jb.173.9.2761-2767.1991 |
| [6] | Grigorieva G, Shestakov S. Transformation in the cyanobacterium Synechocystis sp. 6803. FEMS Microbiology Letters,, 1982, 13(4): 367-370. DOI:10.1111/fml.1982.13.issue-4 |
| [7] | Rajagopal L, Vo A, Silvestroni A, Rubens CE. Regulation of purine biosynthesis by a eukaryotic-type kinase in Streptococcus agalactiae. Molecular Microbiology, 2005, 56(5): 1329-1346. DOI:10.1111/j.1365-2958.2005.04620.x |
| [8] | Zorina A, Stepanchenko N, Novikova GV, Sinetova M, Panichkin VB, Moshkov IE, Zinchenko VV, Shestakov SV, Suzuki I, Murata N, Los DA. Eukaryotic-like Ser/Thr protein kinases SpkC/F/K are involved in phosphorylation of GroES in the cyanobacterium Synechocystis. DNA Research, 2011, 18(3): 137-151. DOI:10.1093/dnares/dsr006 |
| [9] | Zorina AA, Bedbenov VS, Novikova GV, Panichkin VB, Los DA. Involvement of serine/threonine protein kinases in the cold stress response in the cyanobacterium Synechocystis sp. PCC 6803:functional characterization of SpkE protein kinase. Molecular Biology, 2014, 48(3): 390-398. DOI:10.1134/S0026893314030212 |
| [10] | Liang CW, Zhang XW, Chi XY, Guan XY, Li YX, Qin S, Shao HB. Serine/threonine protein kinase SpkG is a candidate for high salt resistance in the unicellular cyanobacterium Synechocystis sp. PCC 6803. PLoS One, 2011, 6(5): e18718. DOI:10.1371/journal.pone.0018718 |
| [11] | Kamei A, Yuasa T, Geng XX, Ikeuchi M. Biochemical examination of the potential eukaryotic-type protein kinase genes in the complete genome of the unicellular cyanobacterium Synechocystis sp. PCC 6803. DNA Research, 2002, 9(3): 71-78. DOI:10.1093/dnares/9.3.71 |
| [12] | 张晓雯.蓝藻信号转导系统的比较基因组学分析及重要基因功能的验证.中国科学院研究生院(海洋研究所)博士学位论文, 2008. |
| [13] | Williams JGK. Construction of specific mutations in photosystem Ⅱ photosynthetic reaction center by genetic engineering methods in Synechocystis 6803. Methods in Enzymology, 1988, 167: 766-778. DOI:10.1016/0076-6879(88)67088-1 |
| [14] | Antal T, Kurkela J, Parikainen M, Kårlund A, Hakkila K, Tyystjärvi E, Tyystjärvi T. Roles of group 2 sigma factors in acclimation of the cyanobacterium Synechocystis sp. PCC 6803 to nitrogen deficiency. Plant and Cell Physiology, 2016, 57(6): 1309-1318. DOI:10.1093/pcp/pcw079 |
| [15] | Björkman O, Demmig B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins. Planta, 1987, 170(4): 489-504. DOI:10.1007/BF00402983 |
| [16] | Lei HJ, Chen G, Wang YL, Ding QL, Wei D. Sll0528, a site-2-protease, is critically involved in cold, salt and hyperosmotic stress acclimation of cyanobacterium Synechocystis sp. PCC 6803. International Journal of Molecular Sciences, 2014, 15(12): 22678-22693. DOI:10.3390/ijms151222678 |
| [17] | Sinetova MA, Los DA. Lessons from cyanobacterial transcriptomics:universal genes and triggers of stress responses. Molecular Biology, 2016, 50(4): 606-614. DOI:10.1134/S0026893316040117 |
| [18] | Willekens H, van Camp W, van Montagu M, Inzé D, Langebartels C, Sandermann Jr H. Ozone, sulfur dioxide, and ultraviolet B have similar effects on mRNA accumulation of antioxidant genes in Nicotiana plumbaginifolia L. Plant Physiology, 1994, 106(3): 1007-1014. DOI:10.1104/pp.106.3.1007 |
| [19] | Allakhverdiev SI, Kreslavski VD, Klimov VV, Los DA, Carpentier R, Mohanty P. Heat stress:an overview of molecular responses in photosynthesis. Photosynthesis Research, 2008, 98(1/3): 541-550. |
| [20] | Zakar T, Herman E, Vajravel S, Kovacs L, Knoppová J, Komenda J, Domonkos I, Kis M, Gombos Z, Laczko-Dobos H. Lipid and carotenoid cooperation-driven adaptation to light and temperature stress in Synechocystis sp. PCC6803. Synechocystis sp. PCC6803., 2017, 1858(5): 337-350. |
| [21] | Schwarzkopf M, Yoo YC, Hückelhoven R, Park YM, Proels RK. Cyanobacterial phytochrome2 regulates the heterotrophic metabolism and has a function in the heat and high-light stress response. Plant Physiology, 2014, 164(4): 2157-2166. DOI:10.1104/pp.113.233270 |
| [22] | Rowland JG, Pang X, Suzuki I, Murata N, Simon WJ, Slabas AR. Identification of components associated with thermal acclimation of photosystem Ⅱ in Synechocystis sp. PCC6803. PLoS One, 2010, 5(5): e10511. DOI:10.1371/journal.pone.0010511 |
| [23] | Mamedov M, Hayashi H, Murata N. Effects of glycinebetaine and unsaturation of membrane lipids on heat stability of photosynthetic electron-transport and phosphorylation reactions in Synechocystis PCC6803. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1993, 1142(1/2): 1-5. |
| [24] | Lloyd J, Kriedemann P, Prior L, Grieve A. Citrus leaf fluorescence:water and salt effects. Acta Horticulturae, 1986, 175: 333-337. |
| [25] | Tuominen I, Pollari M, Tyystjärvi E, Tyystjärvi T. The SigB σ factor mediates high-temperature responses in the cyanobacterium Synechocystis sp. PCC6803. FEBS Letters, 2006, 580(1): 319-323. DOI:10.1016/j.febslet.2005.11.082 |
| [26] | Sheng J, Kim HW, Badalamenti JP, Zhou C, Sridharakrishnan S, Krajmalnik-Brown R, Rittmann BE, Vannela R. Effects of temperature shifts on growth rate and lipid characteristics of Synechocystis sp. PCC6803 in a bench-top photobioreactor. Bioresource Technology, 2011, 102(24): 11218-11225. DOI:10.1016/j.biortech.2011.09.083 |
| [27] | Červený J, Sinetova MA, Zavřel T, Los DA. Mechanisms of high temperature resistance of Synechocystis sp. PCC 6803:an impact of histidine kinase 34. Life, 2015, 5(1): 676-699. DOI:10.3390/life5010676 |
| [28] | Koskinen S, Hakkila K, Gunnelius L, Kurkela J, Wada H, Tyystjärvi T. In vivo recruitment analysis and a mutant strain without any group 2σ factor reveal roles of different σ factors in cyanobacteria. Molecular Microbiology, 2016, 99(1): 43-54. DOI:10.1111/mmi.13214 |
 2018, Vol. 58
2018, Vol. 58