中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 吴安宁, 许国超, 韩瑞枝, 董晋军, 倪晔. 2018
- Anning Wu, Guochao Xu, Ruizhi Han, Jinjun Dong, Ye Ni. 2018
- 基于膜压力应答途径的大肠杆菌丁醇耐受性
- Improving n-butanol tolerance of Escherichia coli based on membrane stress response pathways
- 微生物学报, 58(1): 154-165
- Acta Microbiologica Sinica, 58(1): 154-165
-
文章历史
- 收稿日期:2017-02-22
- 修回日期:2017-05-10
- 网络出版日期:2017-05-25
2. 江南大学生物工程学院, 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
近年来随着石油能源的大量消耗,寻找可再生能源缓解能源危机逐渐成为人们关注的焦点,其中利用微生物发酵生产新型能源越来越受到人们的青睐。然而,在微生物发酵生产过程中,发酵产物溶剂对细胞具有毒害作用。一般来说,Log P为2–5的溶剂较容易进入细胞膜磷脂双分子层,破坏细胞膜的结构,从而严重损害细胞的生理功能[1-3]。有机溶剂的插入会增加细胞膜的流动性,使得细胞内部代谢紊乱,导致细胞生长受到严重抑制甚至死亡[4-5]。因此,深入了解溶剂与微生物细胞之间的作用,并在此基础上运用现代生物学技术提高细胞对溶剂的耐受性显得尤为重要。
微生物细胞内存在多种压力应答途径,当细胞所处的外界环境(pH、温度以及溶剂等)发生改变时,胞内的一些应答途径可以被诱导激活并通过一系列复杂的网络调控调节相关基因的转录,从而使细胞能更好地适应外界环境的变化。在革兰氏阴性菌中(例如大肠杆菌),根据功能不同分类主要有δE、Cpx、Psp、Rcs以及Bae五种压力应答途径,研究报道显示,这些应答途径可以通过改变周质以及外膜蛋白的组成,从而使细胞更好地适应外界恶劣的环境[6-8]。
大肠杆菌具有生长快、遗传背景清楚、操作工具丰富等优点,是研究工业生物技术的模型菌之一。Zhang等利用全局转录机制工程的方法成功获得了耐受69% (V/V)环己烷的大肠杆菌[5];Okochi等通过对全局转录调节子的研究,发现cyaA (adenylate cyclase)基因的敲除能够提高细胞的溶剂耐受性,并且敲除菌的耐受性受到外源cAMP的影响[9]。为了进一步了解细胞和溶剂之间的作用机理并且提高溶剂耐受性,本研究从细胞压力应答途径出发,通过用不同浓度丁醇处理细胞,筛选参与丁醇溶剂压力的应答途径,并对应答途径中负责信号感应的关键组分分别进行过表达和敲除,考察细胞溶剂耐受性的变化,尝试通过测定细胞表面疏水性的变化解释溶剂耐受性提高的原因。
1 材料和方法 1.1 菌株和质粒E. coli JM109 (DE3)为本实验室保藏;质粒pQE80L-Kan购自Qiagen GmbH公司(Hilden,Germany)。
1.2 主要分子生物学试剂和培养基实时荧光定量PCR过程中所使用的DNA聚合酶SYBR® Premix Ex Taq Ⅱ (Tli RNaseH Plus) (2×Conc.)、高保真DNA聚合酶PrimerSTAR®以及限制性内切酶均购自大连宝生物有限公司,一步克隆连接酶Exnase Ⅱ购自南京诺唯赞生物科技有限公司,琼脂糖凝胶DNA回收试剂盒、质粒小量制备试剂盒以及PCR产物纯化试剂盒购自上海捷瑞生物工程有限公司,其他材料和所用试剂为国产分析纯。引物由苏州泓迅生物科技有限公司合成,基因测序服务由赛音生物技术(上海)有限公司提供。
LB培养基:酵母提取物0.5%,胰蛋白胨1.0%,NaCl 1.0%,1×105 Pa灭菌20 min。
1.3 荧光定量PCRcDNA制备:将过夜活化后的E. coli JM109按照1% (V/V)的接种量转接至30 mL新鲜LB液体培养基中,于37 ℃、120 r/min培养至OD600约为0.8时,向摇瓶中添加不同浓度(0.2%–0.8%,V/V)丁醇,继续培养90 min后,吸取菌液2 mL,于5510×g室温离心2 min,倒出上清培养基收集菌体,进行RNA的抽提。通过一步法cDNA合成(逆转录)试剂盒(上海捷瑞生物工程有限公司)合成对应的cDNA。
荧光定量PCR:以上述cDNA为模板,以qPCR-rcsB-F/R、qPCR-cpxR-F/R、qPCR-baeR-F/R、qPCR-pspA-F/R、qPCR-rpoE-F/R为引物(表 1),采用SYBR®Green Ⅰ嵌合荧光法(大连宝生物工程有限公司),SYBR®Green Ⅰ与双链DNA结合后发出荧光,通过检测PCR反应生成双链DNA与SYBR®Green Ⅰ结合发出的荧光强度,从而可以达到对目的基因进行准确定量的目的,反应体系参照试剂盒说明。
| Primers | Primer sequences (5′→3′) |
| qPCR-rcsB-F | ATCAAGTACATCAAGCGCCA |
| qPCR-rcsB-R | GCTTTCCGGGGTAAATTTCTTC |
| qPCR-cpxR-F | GCGCGGCAGTGAACTTGATCG |
| qPCR-cpxR-R | ACGCTGTGCCGGGAAATTCG |
| qPCR-baeR-F | ACGCTGTGCCGGGAAATTCG |
| qPCR-baeR-R | GCAACGGCGCAAAATGGTTTT |
| qPCR-pspA-F | GCAGGAAAAAGCCGAACTGG |
| qPCR-pspA-R | GTGTTTCGCTCAATTTGTTTTCCAG |
| qPCR-rpoE-F | ACATGGCTGTATCGGATTGCTG |
| qPCR-rpoE-R | CGGAAAACTATCTGTCTCA |
| pQE80L-nlpE-F | CACCATCACCATCACGGATCCATGGTGAAAAAAGCGATAGTGACA |
| pQE80L-nlpE-R | CAAGCTCAGCTAATTAAGCTTTTACTGCCCCAAACTACTGCAA |
| pQE80L-spy-F | CACCATCACCATCACGGATCCATGCGTAAATTAACTGCACTGTTTG |
| pQE80L-spy-R | CAAGCTCAGCTAATTAAGCTTTTATTCAGCAGTTGCAGGCATT |
1.4 pQE80L-nlpE和pQE80L-spy重组质粒的构建
以E. coli JM109基因组为模板,分别以pQE-nlpE-F和pQE-nlpE-R、pQE-spy-F和pQE-spy-R为引物,通过高保真PCR扩增获得2个基因片段,大小分别为711 bp和486 bp。PCR程序:95 ℃ 5 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,16 ℃ 30 s。
使用BamH Ⅰ和Hind Ⅲ两种限制性内切酶对pQE80L载体进行双酶切线性化,酶切条件为37 ℃酶切6–8 h。
将PCR扩增带有同源臂的nlpE和spy基因片段与通过BamH Ⅰ和Hind Ⅲ两种限制性内切酶双酶切后的pQE80L载体通过一步克隆酶法连接体系(南京诺唯赞生物科技有限公司)连接,构建质粒pQE80L-nlpE和pQE80L-spy(图 1)。一步克隆连接体系为:50–200 ng线性化pQE80L,20–200 ng插入片段,2 μL 5×CE Ⅱ Buffer,1 μL Exnase Ⅱ。连接体系置于37 ℃反应30 min,待反应完成后置于冰上冷却5 min,通过化学转化方法将连接产物转入E. coli JM109感受态细胞,并涂布在含有卡那霉素的固体平板。次日通过菌落PCR初步验证平板阳性单菌落,将验证出的阳性转化子测序验证。

|
| 图 1 重组质粒pQE80L-nlpE和pQE80L-spy示意图 Figure 1 Scheme of recombinant plasmids pQE80L-nlpE and pQE80L-spy |
1.5 nlpE和spy基因敲除菌的构建
分别以spy-K-F/R和nlpE-K-F/R为引物,以质粒pKD13为模板扩增带有同源臂的FRT-Kan-FRT片段(约1450 bp),通过电击法将含有同源臂FRT-Kan-FRT片段转入含有pKD46的E. coli JM109感受态中,使其整合到E. coli JM109基因组上。将验证成功的阳性重组子按照化学转化感受态细胞的制备方法制备成感受态细胞,并将质粒pCP20电转入感受态细胞中,30 ℃过夜静置培养,再通过42 ℃高温培养10 h以消除质粒pCP20。
1.6 E. coli JM109/pQE80L-nlpE和E. coli JM109/ pQE80L-spy的溶剂耐受性分析 1.6.1 重组菌的蛋白表达分析: 将过夜活化的重组菌按照1% (V/V)的接种量转接至30 mL新鲜LB液体培养基中,于37 ℃、120 r/min培养菌体至OD600到达0.6时,添加终浓度为0.2 mmol/L的IPTG,于30 ℃诱导培养6 h,在4 ℃、8801×g离心10 min收集菌体。在超声破碎仪上进行超声破碎15 min (超声1 s,间歇3 s,500 W),破碎液进行SDS-PAGE分析蛋白表达状况。 1.6.2 重组菌的溶剂耐受性测定: 将重组菌和带有pQE80L的E. coli JM109 (对照菌)经转接诱导培养(0.2 mmol/L IPTG)至OD600达到为0.8时,将0.8% (V/V)正丁醇加入到细胞培养液中,30 ℃、120 r/min培养10 h。其间每隔2 h取样通过分光光度计OD600读数监测菌体的生长状况。 1.6.3 重组菌的MATH分析: 采用细胞粘着碳烃化合物法(microbial adhesion to hydrocarbons,MATH)来测定细胞表面疏水性变化[10]。根据重组菌耐受性测定的方法,将过夜活化后的对照菌株E. coli JM109/pQE80L和重组菌株E. coli JM109/pQE80L-nlpE、E. coli JM109/pQE80L-spy经转接诱导培养(0.2 mmol/L IPTG) 6 h,在4 ℃、8801×g条件下离心10 min收集菌体。彻底吸取培养基,用0.1 mol/L的磷酸钾缓冲液(pH 6.0)悬浮细胞,控制初始OD400值为0.8–0.9 (A0)。吸取4.8 mL菌液与0.8 mL溶剂充分混匀,室温静置15 min,分层后取水相样品测定其OD400值(A1)。粘附率用公式(1)计算。
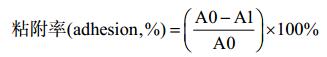
|
公式(1) |
高环境适应性是微生物的基本特征之一,是保证其自身正常生长和繁殖的必要条件。瞬息万变的生长环境使得微生物进化出不同的细胞信号传导途径。微生物可以感知外界环境中的信号变化,并迅速传入体内,启动相关基因的转录、翻译和表达,发挥相应的生物学功能。细胞主要通过蛋白质磷酸化将信号进行传递和放大,目前已发现多种细胞信号传导途径。其中,双组分应答途径是原核生物最常采用的细胞信号传导系统,其核心由两个蛋白组成,组氨酸蛋白激酶(跨膜蛋白)和反应调节蛋白(胞质蛋白)。双组分调控系统广泛存在于革兰氏阳性和阴性菌,以及真菌、植物和酵母中,在细菌的基本生命活动中发挥重要作用。
在大肠杆菌中主要存在五种细胞膜压力应答途径,分别为Bae (bacterial adaptative response)、Cpx (conjugative plasmid expression)、Psp (phage shock protein)、Rcs (regulator of colanic acid capsule synthesis)和δE途径[6-7]。通常外界环境(有机溶剂、pH、温度变化等)改变时,细胞会在周质空间中积累过多的特异性外膜蛋白,这些蛋白的积累往往会激活膜内蛋白水解酶水解δE结合物内膜蛋白RseA,游离的δE进入细胞质与RNA聚合酶发生作用,最终调控相关基因的转录,完成对外界信号压力的响应[9]。在大肠杆菌中,针对细胞所处的外界恶劣环境,Psp响应途径主要通过pspABCDE操纵子来维持细胞膜的质子动力势,从而维持细胞的正常代谢生长[11]。除此之外,双组分压力应答途径Cpx和Bae在对环境的敏感性和适应性方面表现出了非常重要的作用,通过位于细胞质的输入域感知外界环境变化,传递信号到转移域激酶核心,活化CpxR作为反应调节因子结合目的基因启动子区域序列,实现对调控基因的转录调控[8]。在细胞膜肽聚糖层受到环境影响发生改变时,可以激活Rcs调控系统发挥作用,提高细胞对抗生素的抗性[12]。可以看出,大肠杆菌内存在的五种压力应激途径在维持细胞功能的完整性方面扮演着十分重要的角色。
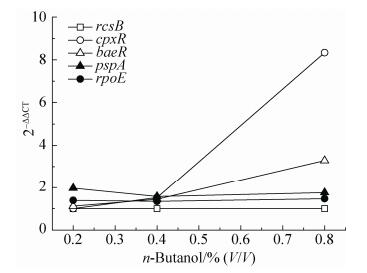
通常由于细胞内某些基因的缺失或受到外界某种压力刺激时,将会激活细胞内相应的压力应答途径。据报导吲哚可以激活Bae和Cpx途径[13],戊脉安或乙醇则可以诱导激活Psp和δE系统,抗生素青霉素结合蛋白可激活Rcs、δE、Bae和Cpx系统[14]。反应调节因子在整个信号转导过程中通常可以通过改变转录速率,从而调控相关基因的表达,为了确定在特定的溶剂压力下细胞是否会产生专一性的信号并且通过相应的压力应答途径来缓解溶剂压力,本实验决定以五种压力应答途径中的反应调节因子为研究对象,将大肠杆菌内的各个应激途径与丁醇等有机溶剂的毒害作用联系起来。外加不同浓度的正丁醇刺激E. coli JM109,通过荧光定量PCR分析各个应激途径组分中反应调节因子的表达量变化。图 2显示了随着丁醇浓度(0.2%、0.4%、0.8%)的提高,cpxR (Cpx)和baeR (Bae)基因的表达量分别相对提高了1.0、1.5、8.3倍和1.1、1.4、3.3倍;rpoE (δE)、pspA (Psp)、rcsB (Rcs)基因的表达量变化较小,且rpoE随丁醇浓度提高先降低后增加。不难发现对于丁醇的刺激,两种典型的双组分压力调控途径Cpx和Bae会被专一性地激活从而能更好地缓解丁醇给细胞带来的压力,尤其是在较高的丁醇浓度下。因此,选定Cpx和Bae为研究对象,通过过表达和敲除两个应答系统中关键基因(nlpE和spy)以及外源添加cAMP和细胞表面疏水性分析等探究应答系统与溶剂耐受性关系。
|
| 图 2 不同丁醇浓度下E. coli JM109压力应答途径中关键功能基因的表达水平 Figure 2 Expression level analysis of key functional components in the stress response pathway of E. coli JM109 under different butanol concentrations. 2–ΔΔCT means fold change of expression levels of genes |
2.2 nlpE和spy的过表达、敲除及重组菌耐受性验证
Cpx应答途径的主要功能是感知细胞膜压力变化,进而选择性激活下游相关基因的转录,最终实现对细胞生长代谢的精细调节[8]。Snyder阐明在细胞粘附到疏水表面时,外膜脂蛋白NlpE (new lipoprotein E)可以感知细胞膜特性和细胞膜组分的变化,产生专一性信号从而激活Cpx应答途径。研究报道在多种药物、抗生素以及酸性耐受菌株中,NlpE通常呈现出相对较高的表达水平[10, 15]。作为Cpx应答途径的重要激活信号,NlpE外膜脂蛋白的表达量至关重要。Spy (spheroplast protein Y)编码一种周质分子伴侣,在外界压力刺激的条件下,主要通过抑制蛋白质的聚集和辅助蛋白的正确折叠,从而最终提高蛋白的折叠效率。研究表明,spy基因的上游拥有一段和baeR高度同源的结合序列,BaeR能够通过结合序列直接调控spy、mdtA、acrD和ycaC的表达[16]。另一方面,Yamamoto等通过观察发现在铜离子作用下,调节蛋白CpxR能够严格调控spy基因的表达,最终提高细胞的金属离子抗性[17]。Rutherford等通过转录组学分析,在外界丁醇压力下,spy的表达水平呈明显的上调趋势[2]。Spy作为Cpx和Bae两个应答途径中的重要调控蛋白,在感知细胞膜压力变化以及辅助蛋白折叠方面发挥着无可替代的作用[18]。丁醇等有机溶剂的毒害作用主要体现在对细胞膜的破坏,基于NlpE和Spy对细胞膜压力信号的感知及传递作用,本研究试图通过提高和降低2个蛋白表达水平,进而强化和弱化两种压力应答途径对宿主菌有机溶剂耐受性的作用。
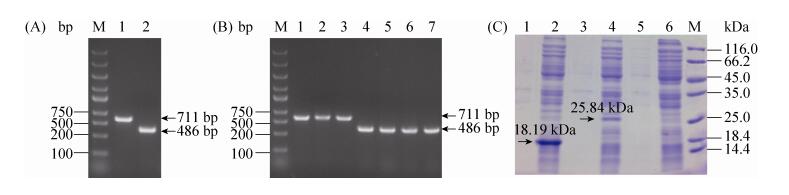
2.2.1 nlpE和spy的过表达: 首先将nlpE和spy与pQE80L表达载体连接,并转入宿主菌获得重组菌株E. coli JM109/pQE80L-nlpE和E. coli JM109/pQE80L-spy。图 3显示了基因nlpE和spy (大小分别为711 bp和486 bp)已经成功连接到载体pQE80L上。通过SDS-PAGE验证NlpE和Spy蛋白成功表达(图 3),分子量大小分别约为25.84 kDa和18.19 kDa。
|
| 图 3 nlpE和spy的克隆和异源表达 Figure 3 Cloning and heterogenous expression of nlpE and spy. M: marker; A: amplification of nlpE and spy. Lane 1: nlpE; lane 2: spy; B: colony PCR of recombinant strains. Lanes 1–3: E. coli JM109/pQE80L-nlpE; lanes 4–7: E. coli JM109/pQE80L-spy; C: SDS-PAGE of recombinant strains. Lanes 1–6: supernatant and precipitant of E. coli JM109/pQE80L-spy, E. coli JM109/pQE80L-nlpE and E. coli JM109 |
2.2.2 nlpE和spy的基因敲除: 通过电击法将PCR获得的FRT-Kan-FRT片段转入含有pKD46质粒的E. coli JM109感受态细胞中。并利用鉴定引物spy-C-F/R,nlpE-C-F/R分别对转化子进行菌落PCR验证,成功获得E. coli JM109-ΔnlpE::Kan和E. coli JM109-Δspy::Kan基因插入片段(约1500 bp) (图 4-A);最后将质粒pCP20电转至E. coli JM109-ΔnlpE::Kan和E. coli JM109-Δspy::Kan中,并通过42 ℃高温处理后,利用引物spy-C-F/R,nlpE-C-F/R扩增获得消除Kan后的FRT基因片段(长度约250 bp) (图 4-B),最终获得nlpE和spy的敲除菌株E. coli JM109 (ΔnlpE)和E. coli JM109 (Δspy)。SDS-PAGE分析可知,在NlpE (25.84 kDa)和Spy (18.19 kDa)的对应位置无蛋白条带,因此nlpE和spy得到成功敲除(图 4-C)。

|
| 图 4 nlpE和spy的基因敲除及蛋白表达验证 Figure 4 Deletion of nlpE and spy from E. coli JM109 and verification of protein expression. M: marker; A: verification of inserted fragments FRT-Kan-FRT. Lane 1: ΔnlpE, lane 2: Δspy; B: elimination of Kan resistance gene. Lane 1: ΔnlpE, lane 2: Δspy; C: SDS-PAGE of recombinant strains. lanes 1–6: supernatant and precipitant of E. coli JM109 (Δspy), E. coli JM109 (ΔnlpE) and E. coli JM109 |
2.2.3 nlpE和spy重组菌耐受性验证: 在外源添加0.8% (V/V)丁醇的条件下,监测菌株的生长状况。图 5-A结果显示丁醇处理10 h后,敲除菌E. coli JM109 (ΔnlpE)和E. coli JM109 (Δspy)的OD600可达1.219和1.174,对照组OD600为1.331,菌体量分别降低了8.41%和11.80%;nlpE和spy的敲除显著降低了菌株的丁醇耐受性;图 5-B结果显示E. coli JM109/pQE80L-spy在0.8% (V/V)的丁醇处理10 h后,细胞的生长速率以及总菌体量明显高于对照组E. coli JM109/pQE80L,最高OD600可达1.475,比对照组(OD6001.301)高13.37%,说明Spy的过表达有利于提高菌株对丁醇的耐受性。相反E. coli JM109/pQE80L-nlpE菌株最终OD600为1.198,比对照组低7.92%,NlpE的过表达则使得菌株在丁醇压力下处于相对生长劣势。实验结果表明,在外界溶剂压力的条件下,Spy表达量的提高,致使磷酸化的CpxR和BaeR能更有效地调控许多膜压力相关靶基因的转录[17];此外,研究报导Spy的过表达还可以提高胞内许多参与物质运输、辅助蛋白折叠的分子伴侣的活性[18]。另一方面,NlpE是细胞外膜感知蛋白,可参与某些溶剂结合并加大溶剂的摄入量,且过表达NlpE能够激活胞内编码AcrD、TolC和MdtABC等许多药物外排泵的表达,从而提高菌株的耐药性以及金属离子抗性[19]。然而,AcrAB-TolC外排泵不参与短链醇类(如丁醇)的排出[20]。因此,过表达NlpE对提高E. coli丁醇耐受性没有贡献。

|
| 图 5 0.8% (V/V)丁醇浓度下nlpE和spy敲除菌株(A)和重组菌株(B)的生长曲线 Figure 5 Growth profiles of nlpE and spy knockout (A) and over-expressed strains (B) in the presence of 0.8% (V/V) n-butanol. Error bars indicate standard error of triplicate |
2.3 外源添加cAMP对nlpE和spy重组菌株丁醇耐受性的影响
当细胞受到外界刺激时,胞外信号分子首先与受体结合形成复合体,然后细胞膜上的腺苷酸环化酶(adenylate cyclase,AC)催化ATP脱去焦磷酸而生成cAMP。cAMP作为第二信使通过激活PKA (cAMP依赖性蛋白激酶)使靶细胞蛋白磷酸化,从而激活细胞应答反应。cAMP最终又被磷酸二酯酶水解成5′-AMP而失活[9]。其中双组分系统中Cpx系统主要是由细胞内膜上的组氨酸激酶CpxA以及位于细胞质的响应调节蛋白CpxR组成[8]。基于胞内第二信使分子对于蛋白激酶的作用,本实验尝试通过外部添加cAMP考察对重组菌株丁醇耐受性的影响。
比较图 5-B和图 6-A可知,在添加cAMP后,实验组和对照组菌体的生长速率以及菌体总量相对于不添加cAMP (图 5-B)来说都有显著的增加,菌株E. coli JM109/pQE80L-nlpE、E. coli JM109/pQE80L-spy和对照菌的OD600值由1.188、1.455和1.309分别增长到1.676、1.817和1.565。重组菌株E. coli JM109/pQE80L-nlpE菌株在添加cAMP条件下具有比对照菌更高的丁醇耐受性,推测可能是因为辅助感知蛋白NlpE在添加cAMP的条件下,对Cpx压力应答途径发挥正调控作用。重组菌株E. coli JM109/pQE80L-spy同样表现出了更好的丁醇耐受性,cAMP作为胞内第二信使分子能与cAMP receptor protein (CRP)形成复合物,参与胞内许多代谢过程的调控,CRP调节的多数基因可能会诱导激活δE和Cpx压力应答途径,调节耐受性相关基因的转录[21],从而提高细胞的丁醇耐受性。
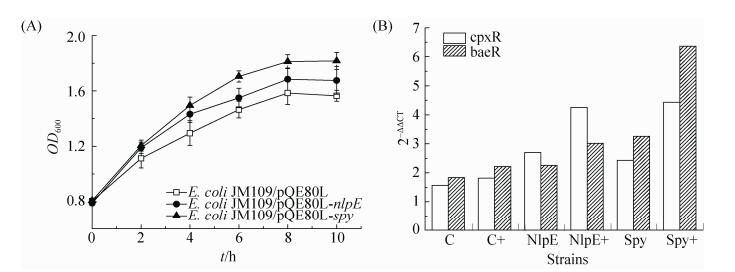
|
| 图 6 外源添加cAMP对重组菌株丁醇耐受性的影响 Figure 6 Effect of exogenous addition of cAMP on the n-butanol tolerance of recombinant strains. A: effects of exogenous addition of 5 mmol/L cAMP on the n-butanol tolerance of overexpression strains. Error bars indicate standard error of triplicate. B: transcriptional level analysis of regulators in overexpression strains by RT-PCR. C, NlpE and Spy: E. coli JM109 and strains overexpression of NlpE and Spy; +: exogenous addition of 5 mmol/L cAMP; 2–ΔΔCT means fold change of expression level of gene |
为了进一步验证Cpx和Bae压力应答途径是否得到激活和过表达,我们选择了Cpx应答途径中的cpxR基因和Bae应答途径中的baeR基因,通过实时荧光定量PCR从转录水平上考察其表达量变化。结果如图 6-B所示,加入cAMP后,在NlpE重组菌株中cpxR和baeR基因的表达量分别提高了1.56和1.30倍;同时在Spy重组菌株中cpxR提高了约1.83倍,而baeR提高了约1.94倍。相比对照菌株cpxR和baeR基因的表达水平都有了很明显的提升。由此可知,cAMP的添加可以激活Cpx和Bae压力应答途径,提高系统中调节基因的表达水平。
2.4 nlpE和spy重组菌株对其他溶剂的耐受性分析研究重组菌株对不同溶剂的耐受性可对其机制有更全面的认识,更好地指导溶剂耐受菌在发酵和生物催化等方面的应用。因此选取了具有不同疏水性和极性的溶剂(甲苯、四氢呋喃、环己烷和乙酸丁酯),考察重组菌株对它们的耐受性规律。当菌株生长至OD600为0.8时,分别添加0.1% (V/V)甲苯、0.6% (V/V)四氢呋喃、0.6% (V/V)乙酸丁酯和0.6% (V/V)环己烷,并继续培养10 h,生长曲线如图 7。首先,对照菌株在上述溶剂条件下均几乎不能生长或者自溶,说明大肠杆菌本身不能耐受上述溶剂。过表达spy的菌株在甲苯、四氢呋喃和环己烷溶剂刺激下,其OD600可由初始的0.79分别增长到0.94、0.92和0.97,在乙酸丁酯中几乎不能生长。过表达nlpE的菌株在四氢呋喃、甲苯和环己烷溶剂刺激下,其OD600可由初始的0.80分别增长到0.83、0.92和0.87,与对照菌株相近,乙酸丁酯的加入导致细胞裂解,OD600下降。结果表明,重组菌株pQE80L-spy在对于甲苯、环己烷、四氢呋喃、丁醇四种有机溶剂的耐受性方面具有良好的遗传优势。Spy表达量的提高不仅提高胞内许多参与物质运输、辅助蛋白折叠的分子伴侣的活性,还激活了Bae以及Cpx双组分压力应答途径[17-18]。为了抵抗有机溶剂对细胞的危害,受BaeR和CpxR调控的一系列编码能量代谢以及维持细胞膜稳定性的基因大量表达,从而缓解溶剂带来的生长压力[22]。另一方面,NlpE的过表达提高了细胞对甲苯和环己烷的耐受性,相反对短链醇类(丁醇)的刺激却没有发挥出预想的作用。

|
| 图 7 不同溶剂对E. coli JM109/pQE80L-nlpE和E. coli JM109/pQE80L-spy菌株生长的影响 Figure 7 Effect of different solvents on the growth of E. coli JM109/pQE80L-nlpE and E. coli JM109/pQE80L-spy. A: 0.6% (V/V) butyl acetate; B: 0.6% (V/V) cyclohexane; C: 0.1% (V/V) toluene; D: 0.6% (V/V) tetrahydrofuran. Error bars indicate standard error of triplicate |
2.5 细胞表面疏水性分析
细胞粘着碳烃化合物法(microbial adhesion to hydrocarbons,MATH)可以对细胞表面疏水性进行定性分析,有助于理解细胞溶剂耐受性的变化。采用MATH法分别测定了E. coli JM109与E. coli JM109/pQE80L-spy和E. coli JM109/pQE80L-nlpE对丁醇、甲苯、乙酸丁酯和环己烷的粘附率(表 2)。相比对照菌株,Spy过表达导致细胞对丁醇和乙酸丁酯粘附率降低,而NlpE过表达导致细胞对这两种溶剂的粘附率增加。粘附率升高表明细胞表面与待测溶剂性质趋于相似,溶剂的吸附和摄入量增大,这与过表达NlpE导致细胞对丁醇和乙酸丁酯的耐受性降低的结果一致(图 5-B,图 7-A)。反之粘附率降低,导致溶剂的粘附和摄入降低,有助于降低丁醇的毒性,提高对丁醇的耐受性。Spy和NlpE重组菌株对环己烷和甲苯的粘附率均降低,表明重组菌株细胞对这两种溶剂的粘附能力降低,因而可在一定程度上缓解其对细胞的毒性,这与2.4中环己烷和甲苯对重组菌株生长影响的结果一致(图 7-B,图 7-C)。此外,四氢呋喃为亲水性溶剂,可充分溶解于缓冲液中,因而水相菌体浓度的监测难度较大,无法用MATH法准确测定其粘附率。综上,不同细胞对同一溶剂的粘附率越大,即细胞表面的疏水性越强,溶剂对细胞的毒害作用越大(耐受性低),反之则越小(耐受性高)。
| Solvents | E. coli JM109/pQE80L | E. coli JM109/pQE80L-nlpE | E. coli JM109/pQE80L-spy |
| Butanol | 27.55%±1.56% | 31.59%±1.24%↑ | 8.48%±1.32%↓ |
| Butyl acetate | 33.76%±1.24% | 39.76%±4.85%↑ | 26.22%±5.94%↓ |
| Toluene | 15.49%±1.24% | 11.59%±2.33%↓ | 7.65%±0.86%↓ |
| Cyclohexane | 35.80%±7.99% | 17.54%±3.01%↓ | 11.71%±6.81%↓ |
| The values in the table are the adhesion rate. | |||
3 结论
本研究通过对大肠杆菌内压力应答途径的分析,结合丁醇对细胞毒害作用的机理,首次将大肠杆菌溶剂耐受性与信号响应途径联系起来,是对大肠杆菌溶剂耐受性机理的初步探索。Cpx和Bae压力应答途径在丁醇压力下发挥了重要作用,外源添加cAMP可以有效地激活胞内Cpx和Bae压力响应途径,提高系统中调节子的表达水平。通过对这2个压力应答途径的功能以及调控机制的探究,成功构建了Spy和NlpE重组菌株;其中Spy的过表达能有效地提高菌株对丁醇、甲苯、环己烷以及四氢呋喃的耐受性,NlpE表达水平的提高在对甲苯和环己烷的耐受性方面显示出了较好的优势。
| [1] | 朱森康. FNR转录因子定向进化提高大肠杆菌对乙醇和丁醇的耐受性. 浙江工业大学硕士学位论文, 2011. |
| [2] | Rutherford BJ, Dahl RH, Price RE, Szmidt HL, Benke PI, Mukhopadhyay A, Keasling JD. Functional genomic study of exogenous n-butanol stress in Escherichia coli. Applied and Environmental Microbiology, 2010, 76(6): 1935-1945. DOI:10.1128/AEM.02323-09 |
| [3] | 杨春宇. 丁醇耐受菌株复合诱变的研究. 黑龙江八一农垦大学硕士学位论文, 2013. |
| [4] | Liu SQ, Qureshi N. How microbes tolerate ethanol and butanol. New Biotechnology, 2009, 26(3/4): 117-121. |
| [5] |
Zhang F, Han RZ, Xu GC, Dong JJ, Ni Y. Enhanced organic solvent tolerance of Escherichia coli by arcA. Microbiology China, 2016, 43(1): 17-25.
(in Chinese) 张法, 韩瑞枝, 许国超, 董晋军, 倪晔. arcA基因提高大肠杆菌对有机溶剂的耐受性. 微生物学通报, 2016, 43(1): 17-25. |
| [6] | Rowley G, Spector M, Kormanec J, Roberts M. Pushing the envelope:extracytoplasmic stress responses in bacterial pathogens. Nature Reviews Microbiology, 2006, 4(5): 383-394. DOI:10.1038/nrmicro1394 |
| [7] | Bury-Moné S, Nomane Y, Reymond N, Barbet R, Jacquet E, Imbeaud S, Jacq A, Bouloc P. Global analysis of extracytoplasmic stress signaling in Escherichia coli. PLoS Genetics, 2009, 5(9): e1000651. DOI:10.1371/journal.pgen.1000651 |
| [8] |
Xu L, Zhou XH, He XL. Cpx two-component regulatory system in gram-negative bacteria-a review. Acta Microbiologica Sinica, 2014, 54(3): 269-275.
(in Chinese) 徐乐, 周晓辉, 何晓亮. 革兰氏阴性菌的Cpx双组分调控系统. 微生物学报, 2014, 54(3): 269-275. |
| [9] | Okochi M, Kurimoto M, Shimizu K, Honda H. Effect of global transcriptional regulators related to carbohydrate metabolism on organic solvent tolerance in Escherichia coli. Journal of Bioscience and Bioengineering, 2008, 105(4): 389-394. DOI:10.1263/jbb.105.389 |
| [10] | Hamadi F, Latrache H. Comparison of contact angle measurement and microbial adhesion to solvents for assaying electron donor-electron acceptor (acid-base) properties of bacterial surface. Colloids and Surfaces B:Biointerfaces, 2008, 65(1): 134-139. DOI:10.1016/j.colsurfb.2008.03.010 |
| [11] | Kleerebezem M, Crielaard W, Tommassen J. Involvement of stress protein PspA (phage shock protein A) of Escherichia coli in maintenance of the protonmotive force under stress conditions. The EMBO Journal, 1996, 15(1): 162-171. |
| [12] | Ramos JL, Cuenca MS, Molina-Santiago C, Segura A, Duque E, Gómez-García, M R, Udaondo Z, Roca A. Mechanisms of solvent resistance mediated by interplay of cellular factors in Pseudomonas putida. FEMS Microbiology Reviews, 2015, 39(4): 555-566. DOI:10.1093/femsre/fuv006 |
| [13] | Raffa RG, Raivio TL. A third envelope stress signal transduction pathway in Escherichia coli. Molecular Microbiology, 2002, 45(6): 1599-1611. DOI:10.1046/j.1365-2958.2002.03112.x |
| [14] | Andersen CL, Holland IB, Jacq A. Verapamil, a Ca2+ channel inhibitor acts as a local anesthetic and induces the sigma E dependent extra-cytoplasmic stress response in E. coli. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2006, 1758(10): 1587-1595. DOI:10.1016/j.bbamem.2006.05.022 |
| [15] | Otto K, Silhavy TJ. Surface sensing and adhesion of Escherichia coli controlled by the Cpx-signaling pathway. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(4): 2287-2292. DOI:10.1073/pnas.042521699 |
| [16] | Nishino K, Honda T, Yamaguchi A. Genome-wide analyses of Escherichia coli gene expression responsive to the BaeSR two-component regulatory system. Journal of Bacteriology, 2005, 187(5): 1763-1772. DOI:10.1128/JB.187.5.1763-1772.2005 |
| [17] | Srivastava SK, Lambadi PR, Ghosh T, Pathania R, Navani NK. Genetic regulation of spy gene expression in Escherichia coli in the presence of protein unfolding agent ethanol. Gene, 2014, 548(1): 142-148. DOI:10.1016/j.gene.2014.07.003 |
| [18] | Wang D, Fierke CA. The BaeSR regulon is involved in defense against zinc toxicity in E. coli. Metallomics, 2013, 5(4): 372-383. DOI:10.1039/c3mt20217h |
| [19] | Nishino K, Yamasaki S, Hayashi-Nishino M, Yamaguchi A. Effect of NlpE overproduction on multidrug resistance in Escherichia coli. Antimicrobial Agents and Chemotherapy, 2010, 54(5): 2239-2243. DOI:10.1128/AAC.01677-09 |
| [20] | Ankarloo J, Wikman S, Nicholls IA. Escherichia coli mar and acrAB mutants display no tolerance to simple alcohols. International Journal of Molecular Sciences, 2010, 11(4): 1403-1412. DOI:10.3390/ijms11041403 |
| [21] | Strozen TG, Langen GR, Howard SP. Adenylate cyclase mutations rescue the degP temperature-sensitive phenotype and induce the sigma E and Cpx extracytoplasmic stress regulons in Escherichia coli. Journal of Bacteriology, 2005, 187(18): 6309-6316. DOI:10.1128/JB.187.18.6309-6316.2005 |
| [22] | Imamovic L, Martínez-Castillo A, Benavides C, Muniesa M. BaeSR, involved in envelope stress response, protects against lysogenic conversion by Shiga toxin 2-encoding phages. Infection and Immunity, 2015, 83(4): 1451-1457. DOI:10.1128/IAI.02916-14 |
 2018, Vol. 58
2018, Vol. 58