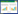中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张秋香, 胡梦莎, 任晟诚, 陈卫. 2018
- Qiuxiang Zhang, Mengsha Hu, Chengcheng Ren, Wei Chen. 2018
- 干酪乳杆菌干预对花生过敏小鼠模型的免疫调节作用
- Immunomodulatory effects of Lactobacillus casei on a murine model of peanut allergy
- 微生物学报, 58(1): 73-82
- Acta Microbiologica Sinica, 58(1): 73-82
-
文章历史
- 收稿日期:2017-01-14
- 修回日期:2017-05-22
- 网络出版日期:2017-07-10
花生是重要的营养食品,作为食品添加剂、风味剂和起泡剂等广泛存在于多种食物当中。同时,花生也是一种非常重要的过敏原[1]。花生过敏主要影响人群为婴幼儿,一般不易随着年龄的增长而产生免疫耐受。在欧美等发达国家,大约有6%的婴幼儿对花生过敏,成人发生率为3%-4%,而且这一比例逐渐上升[2]。中国协和医科大学变态反应科曾对北京地区的食物过敏患者进行了一项调查,约有4%的食物过敏患者对花生过敏[3]。对于严重花生过敏的患者来说,0.1%个花生即可引起临床症状,会引起致命性的休克并危及生命。
花生过敏反应是由IgE介导的一类过敏反应,表现为体内Th1/Th2免疫失衡,IL-4和IL-10等Th2型细胞因子表达显著增强,刺激B细胞生成过量的IgE抗体[4],临床上表现为水肿、心律不齐、哮喘、腹痛腹泻和过敏性休克等多种病症。目前对于花生过敏的治疗尚无良策,唯一途径就是严格控制饮食,避免摄入过敏食物。但由于食品配料多样化、食品标签制度不够完善、食品加工过程中存在交叉污染等原因,日常生活中总有不少患者误食花生制品。近年来,许多研究者希望借助益生菌调整肠道菌群平衡以及调节免疫的特性来预防及减缓过敏反应,取得了一定的成果。艾春青等发现嗜热链球菌CCFM218可诱导IL-10的表达而抑制IL-4的产生,增加特异性IgG2a的产生,从而缓解小鼠尘螨过敏反应症状[5]。牛乳过敏的婴儿服用4周的鼠李糖乳杆菌LGG后,可增加外周血单核细胞中IFN-γ的含量,使免疫反应向Th1方向偏移[6]。乳酸菌的抗过敏作用具有菌株特异性,有的乳酸菌不仅不具有抗过敏作用,反而会增加过敏反应的程度[7]。干酪乳杆菌张Lactobacillus casei Zhang是一株分离自内蒙古传统酸马奶的乳酸菌,具有良好的酸性和胆盐耐受性,对体液及细胞免疫系统具有明显的调节作用[8]。但L. casei Zhang调节Th1/Th2免疫反应平衡的能力尚未见报道,因此本研究以L. casei Zhang为研究对象,采用Balb/c小鼠为模型,研究其对花生过敏反应的影响。
1 材料和方法 1.1 实验动物4周龄雌性SPF (Specific pathogen free)级Balb/c健康小鼠24只,购于上海市斯莱克实验动物有限公司。实验动物饲料由上海斯莱克实验动物有限公司提供。动物实验流程均经过江南大学动物管理和使用委员会许可,所有小鼠被饲养于恒温恒湿的动物房内,严格遵循12 h白天和12 h黑夜的循环标准,标准配方商业化饲料喂养,自由进水。
1.2 菌株和培养条件本文所用菌株L. casei Zhang由内蒙古农业大学张和平教授赠送,于MRS培养基中37 ℃静置培养。用于动物免疫时,在37 ℃培养16 h后收集菌体,以冰预冷的PBS缓冲液洗涤2次后,再以无菌PBS重悬,调整菌体浓度为1×1010 CFU/mL。
1.3 花生粗蛋白的提取参照文献[7]中的方法,稍有修改,具体步骤如下:100 g去皮粉碎的花生(购于无锡市欧尚超市)中加入250 mL 20 mmol/L的Tris缓冲液(pH 7.2)混匀。每隔20 min搅拌1 min,2 h后于4 ℃以3000 r/min离心30 min收集水相。再次于4 ℃下以10000 r/min离心30 min,去除上层残留的脂肪和下层的不溶颗粒,留取中间层反复离心,得到澄清的花生粗蛋白(CPE)。SDS-PAGE检测CPE蛋白的成分,以BCA蛋白浓度测定试剂盒(Thermo Scientific Pierce,美国)检测CPE蛋白的浓度。
1.4 动物实验程序24只小鼠随机分为4组,分别为对照组、模型组、预防组和治疗组。整个实验过程分为预防、致敏、治疗和激发4个阶段,免疫程序见图 1。对照组小鼠只灌胃PBS;模型组在预防和治疗阶段均灌胃PBS,而在致敏阶段灌胃6 mg CPE和10 μg霍乱毒素(Cholera toxin,CT,Sigma);预防组小鼠在预防阶段灌胃0.2 mL L. casei Zhang (2×109 CFU),而治疗组小鼠则在治疗阶段灌胃0.2 mL L. casei Zhang。
|
| 图 1 免疫程序 Figure 1 The immunization protocol. Balb/c mice were randomly divided into 4 groups (n=6). Group 1: unsensitization group; Group 2: CPE-sensitization group, mice were sensitized i.g. with CPE together with CT over an 4-week period; Group 3: prophylactic group, i.e. L. casei Zhang administration prior to sensitization phase; Group 4: therapeutic group, i.e. L. casei Zhang administration after sensitizations phase. |
1.5 花生过敏反应评分
激发后30-60 min内,对各组小鼠的花生过敏症状进行评价。根据文献[9]制定的过敏反应评分体系如下:0,无症状;1,搔扰头和鼻;2,腹泻,眼周、嘴部水肿,毛发直立,活动频率下降;3,口周紫绀,呼吸困难;4,刺激后无反应或仅有轻度反应,震颤及痉挛;5,死亡。
1.6 粪便和血清样品采集激发30 min后,收集各组小鼠的粪便。称取0.1 g粪便重悬于1 mL的PBS中,充分振荡后于4 ℃下7000 r/min离心5 min,取上清,于-20 ℃保存。
收集粪便后,摘除小鼠眼球取血。室温静置2 h后,于4000 r/min离心10 min,小心取出上层血清于-20 ℃保存。
1.7 血清中总IgE抗体、IgG抗体和单核细胞趋化蛋白-1含量的检测血清中总IgE抗体、总IgG和单核细胞趋化蛋白-1(MCP-1)的含量采用ELISA试剂盒进行检测,参照说明书进行。
其中MCP-1是一种单核细胞趋化因子,能激活肥大细胞和嗜碱性粒细胞脱粒,这两类细胞脱粒后释放标志物组胺。
1.8 血清中特异性IgE、IgG1和IgG2a抗体的检测参照文献[10]的方法进行。用包被缓冲液将提取的CPE蛋白稀释到10μg/mL,在96孔板中每孔加入100μL,4 ℃包被过夜。洗涤后,于37 ℃以封闭缓冲液封闭2 h。再次洗涤,加100μL适度稀释的小鼠血清(IgE以1:20稀释,IgG1以1:105稀释,IgG2a按照1:103稀释)于已包被的反应孔中,分别设置空白对照和阴性对照(对照组血清,同比例稀释),置37 ℃孵育1 h。分别加入HRP标记的羊抗鼠IgE、IgG1和IgG2a二抗(1:6000),37 ℃孵育1 h。随后向反应孔中加入新鲜配置的TMB底物溶液,室温暗处放置反应15 min显色,以2 mol/L H2SO4终止反应,酶标仪450 nm处检测吸光度。
1.9 粪便中组胺和IgA抗体的检测小鼠粪便中组胺和IgA的含量使用ELISA试剂盒进行检测,具体步骤按照试剂盒说明书进行。
1.10 细胞因子的检测参考文献[10]的方法进行。实验结束后断颈处死小鼠,分离得到小鼠脾脏及肠系膜淋巴结(MLN)细胞,以完全RPMI-1640培养液(含10%胎牛血清,1%青霉素/链霉素,1%谷氨酰胺)稀释成细胞悬浮液,将细胞悬浮液及终浓度为200 μg/mL的CPE加入到96孔培养板中,使每孔中细胞含量为5×106 cells/mL,每个样品设3个重复。同时设置仅含完全RPMI-1640培养液的阴性对照孔,阳性对照孔添加终浓度1μg/mL的LPS。将96孔细胞培养板放入37 ℃、5% CO2培养箱饱和湿度条件下孵育72 h,于3000 r/min离心10 min取上清,-70 ℃保存备用。IL-4、IL-10、IL-12 (p70)以及IFN-γ含量的检测均按照试剂盒说明书操作。
1.11 CD4+Foxp3+ Tregs细胞的含量检测参照文献[11]的方法进行。CD4+Foxp3+标记的Tregs细胞采用小鼠染色试剂盒进行染色,具体的方法及操作参照说明书,染色后的细胞用流式细胞仪进行分析。
1.12 数据处理数据以均值±标准差表示。数据统计学差异采用SPSS 20.0软件进行one-way ANOVA分析,Duncan’s多重检验,P<0.05被认为有显著差异。
2 结果和讨论 2.1 花生粗蛋白提取按照1.3中方法对去皮后的花生进行粉碎、蛋白抽提等操作,提取的花生粗蛋白用BCA蛋白浓度测定试剂盒进行检测,其蛋白浓度为28 mg/mL。
CPE蛋白SDS-PAGE的电泳条带分布在14-116 kDa之间(图 2)。结合文献[12]可知,66 kDa下方较粗的条带可能为Ara h 1,其分子量约为64 kDa;45 kDa下方3条蛋白条带可能为Ara h 3 (分子量在42-45 kDa之间);Ara h 2的条带位于18-25 kDa之间,大小约为19 kDa;位于14 kDa附近的条带可能为Ara h 6。其中Ara h 1和Ara h 2被认为是最主要的花生过敏原,大约90%的花生过敏患者对其过敏;Ara h 3和Ara h 6分别能被45%、63%的花生过敏患者所识别,也是主要的花生过敏原[13-14]。用含有这些主要过敏原的CPE对Balb/c小鼠进行致敏,为成功建立花生过敏模型提供了可能。

|
| 图 2 花生粗蛋白SDS-PAGE图 Figure 2 SDS-PAGE analysis of crude peanut extract. |
2.2 花生过敏症状评分
经CPE激发后,观察各组小鼠的过敏症状并评分,结果如图 3所示。对照组小鼠行动灵活,偶有骚挠鼻子,粪便正常。而模型组小鼠过敏症状较为明显,出现频繁挠头搔耳、眼周水肿、腹泻等症状,其中1只小鼠还出现口周紫绀、呼吸困难的现象。
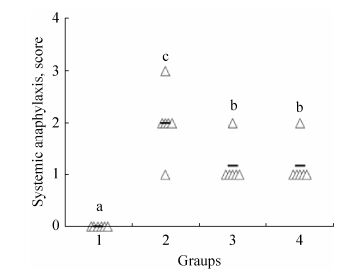
|
| 图 3 花生过敏症状评分 Figure 3 Anaphylactic symptom scores. Symbols (△) indicate individual mouse (n=6). Bars indicate the medians. Group 1: unsensitization group; Group 2: CPE-sensitization group; Group 3: prophylactic group, i.e. L. casei Zhang administration prior to sensitization phase; Group 4: therapeutic group, i.e. L. casei Zhang administration after sensitizations phase. Bars indicate the medians. Different letters (a-c) represent significant differences between groups (P < 0.05). |
小鼠实验预防组与治疗组小鼠过敏症状较模型组轻微,频繁骚挠头鼻的行为普遍存在,但每组均仅有1只小鼠出现腹泻症状。结果表明,不论是预防组还是治疗组,灌胃L. casei Zhang均能显著减缓小鼠花生过敏症状。
食物过敏模型建立成功与否的最大障碍是动物对摄入的抗原有强烈的免疫耐受倾向。对小鼠的各项研究表明,口服耐受与小鼠品系、周龄、抗原性质和剂量、使用的佐剂种类与剂量都有密切的关系[15]。霍乱毒素是一种有效的免疫佐剂,可激活Th2细胞产生IL-4和IgE抗体[16]。本实验选择4周龄雌性Balb/c小鼠,使用花生粗蛋白为免疫原,并以CT为佐剂,成功建立了小鼠花生过敏模型。
2.3 干酪乳杆菌对小鼠血清特异性抗体表达的影响血清特异性IgE抗体水平是目前公认的检测Ⅰ型过敏反应的最有效评价指标[17]。在小鼠体内,Th2反应主要产生IgE和IgG1型抗体,而Th1反应则产生IgG2a型抗体[18]。为分析L. casei Zhang对过敏反应的抑制效果,本研究分别对小鼠血清中CPE特异性IgE、IgG1及IgG2a抗体的含量进行检测。相比对照组,模型组小鼠体内CPE特异性IgE的表达水平显著升高(表 1),说明小鼠产生了明显的过敏反应。摄入L. casei Zhang明显降低了预防组和治疗组小鼠体内特异性IgE的表达水平,两者之间并无显著差异。Ai等[5]的结果表明,表达过敏原的重组乳酸菌可以抑制过敏小鼠体内特异性IgE的表达,并表明这种抑制作用与重组菌株诱导产生的特异性IgG2a存在密切关系。在本研究中,预防组及治疗组的小鼠血清中特异性IgE表达下降的同时,特异性IgG2a的表达水平有明显的上调(表 1)。
| Groups | CPE-specific antibody (OD450) | ||
| CPE-specific IgE | CPE-specific IgG1 | CPE-specific IgG2a | |
| Group 1 | 0.06±0.02a | 0.06±0.04a | 0.06±0.05a |
| Group 2 | 0.72±0.17c | 1.22±0.15b | 0.21±0.10b |
| Group 3 | 0.42±0.12b | 0.96±0.48b | 0.36±0.12c |
| Group 4 | 0.52±0.13b | 0.96±0.40b | 0.37±0.16c |
| Different letters (a-c) represent significant differences between groups (P<0.05). | |||
特异性IgG抗体可以通过抑制特异性IgE与过敏原的结合、抑制过敏原信号的传递以及嗜碱性粒细胞中炎症因子的释放等途径缓解或抑制过敏反应,临床研究也发现过敏原特异性免疫治疗可以使过敏患者血清中IgG抗体的水平明显增加[19]。但在本研究中,尽管模型组和实验组中CPE特异性IgG1抗体水平远远高于对照组,但预防组和治疗组CPE特异性IgG1抗体水平与模型组相比无显著差异。Ren等[10]的实验结果也发现重组乳酸菌对过敏小鼠体内特异性IgG1的表达并没有明显的影响。
2.4 干酪乳杆菌对小鼠血清总IgE抗体及粪便IgA抗体的影响花生过敏是IgE介导的过敏反应,血清中IgE抗体是过敏反应发生的关键作用因子。与小鼠过敏症状的变化相对应,本研究中模型组小鼠的血清总IgE含量达到2053.7 ng/mL(表 2),超过对照组的8倍,而预防组和治疗组小鼠血清的总IgE含量分别降至模型组的一半左右,说明L. casei Zhang可显著降低花生过敏小鼠血清中总IgE水平,这与Kim等[20]的结果相似。
| Groups | Total IgE/(ng/mL) | Total IgA/(ng/mL) |
| Group 1 | 235.9±48.6a | 68.9±0.6a |
| Group 2 | 2053.7±68.4c | 69.8±4.5a |
| Group 3 | 1142.9±50.3b | 81.5±2.2b |
| Group 4 | 1275.2±70.7b | 81.6±1.4b |
| Different letters (a-c) represent significant differences between groups (P<0.05). | ||
IgA抗体在胃肠道防护中起着至关重要的作用,是肠粘膜主要的保护性抗体。肠道中IgA抗体含量较高能降低肠道炎症和IgE介导的过敏性疾病的发生率,而含量低或选择性IgA缺乏都容易引起过敏反应,同时IgA还能诱导机体对食物过敏原产生口服耐受[21]。由表 2可知,模型组与对照组中IgA抗体水平基本接近,并没有明显的差别(P>0.05);而经过L. casei Zhang的处理,小鼠粪便中IgA的含量较对照组和模型组均有明显的上升,表明L. casei Zhang可以顺利通过小鼠的胃部进入肠道,引发肠道黏膜的免疫应答,从而使相应的IgA抗体水平有所提高。
2.5 干酪乳杆菌对小鼠血清MCP-1和粪便组胺含量的影响MCP-1是一种单核细胞趋化因子,能激活肥大细胞和嗜碱性粒细胞脱粒并释放组胺。组胺是引起过敏反应的重要介质,进入体液循环中能引起机体全身毛细血管扩张、血管通透性升高,产生局部水肿;使肺的气管平滑肌收缩,引起呼吸道狭窄进而呼吸困难[22]。与对照组相比,模型组小鼠血清中MCP-1的含量显著增加(P<0.05)。而摄入L. casei Zhang明显降低了预防组和治疗组血清中MCP-1的含量(图 4-A)。组胺含量的变化趋势与MCP-1大致相同(图 4-B),模型组小鼠粪便中组胺的含量为173.9 nmol/L,是对照组中含量的5倍,而预防组和治疗组粪便中的组胺水平分别下降了27.3%和39.7%。这些结果表明L. casei Zhang能抑制肥大细胞和嗜碱性粒细胞的脱粒反应,减缓花生过敏反应。

|
| 图 4 L. casei Zhang对小鼠血清MCP-1(A)和粪便组胺(B)含量的影响 Figure 4 Effects of L. casei Zhang on the serum MCP-1 (A) and fecal histamine (B) levels. Group 1: unsensitization group; Group 2: CPE-sensitization group; Group 3: prophylactic group, i.e. L. casei Zhang administration prior to sensitization phase; Group 4: therapeutic group, i.e. L. casei Zhang administration after sensitizations phase. Different letters (a-d) represent significant differences between groups (P < 0.05). |
2.6 干酪乳杆菌对过敏小鼠体内细胞免疫反应的影响
体液免疫中抗体的产生及表达水平的改变与细胞因子的表达之间存在着密切的联系。为探究L. casei Zhang是否通过调节过敏小鼠体内的细胞免疫反应抑制IgE介导的过敏反应,本研究对分离自不同组小鼠的脾脏和肠系膜淋巴结(MLN)中T细胞的反应能力进行了检测,其中IL-4是典型的Th2型细胞因子,IL-12和IFN-γ是Th1型细胞因子,而IL-10是由调节性T细胞(Tregs)产生的细胞因子。如表 3所示,实验组小鼠脾脏细胞释放的IL-4细胞因子水平明显低于模型组。同时,尽管释放的Th1型细胞因子并没有显著的变化,但是IFN-γ/IL-4的比例明显增加(P<0.05)。小鼠MLN细胞中这些细胞因子的变化趋势与脾脏中大致相同(表 4)。此外,各组小鼠脾脏和MLN细胞释放的IL-10细胞因子水平的变化不明显。
| Groups | Cytokines/(pg/mL) | ||||
| IL-4 | IL-12 (p70) | IFN-γ | IFN-γ/IL-4 | IL-10 | |
| Group 1 | 162.2±2.8a | 27.1±0.2a | 880.8±36.8a | 5.4±0.1a | 459.5±30.3a |
| Group 2 | 255.3±8.1b | 31.2±2.1ab | 1304.6±42.6b | 5.1±0.1a | 586.0±18.0b |
| Group 3 | 179.8±12.5a | 35.6±1.6b | 1227.6±66.3b | 6.8±0.3b | 627.2±40.2b |
| Group 4 | 190.2±3.9a | 35.6±3.1b | 1264.6±65.0b | 6.7±0.2b | 634.0±49.9b |
| Different letters (a, b) represent significant differences between groups (P<0.05). | |||||
| Groups | Cytokines/(pg/mL) | ||||
| IL-4 | IL-12 (p70) | IFN-γ | IFN-γ/IL-4 | IL-10 | |
| Group 1 | 161.2±5.3a | 23.9±1.6a | 935.8±49.7a | 5.8±0.1ab | 475.4±11.7a |
| Group 2 | 259.2±7.8b | 36.6±0.2b | 1364.7±144.7b | 5.3±0.4a | 570.5±2.0b |
| Group 3 | 199.6±6.7a | 35.6±1.6b | 1286.5±25.6b | 6.5±0.1bc | 634.3±24.5b |
| Group 4 | 185.4±17.7a | 39.1±4.6b | 1261.2±65.0b | 6.8±0.3c | 676.9±31.9bc |
| Different letters (a-c) represent significant differences between groups (P<0.05). | |||||
其他研究者也发现服用益生菌或重组乳酸菌导致的小鼠过敏反应的降低与脾脏或肠系膜淋巴结内减少的Th2细胞因子的表达有关,这是因为IL-4可以促进B细胞的扩增及IgE的表达[23]。Shahid等[24]指出,IFN-γ/IL-4的比例可以用于评价Th1细胞与Th2细胞之间的平衡。在恢复Th1/Th2平衡的过程中,抑制Th2型细胞因子可能比促进IFN-γ的分泌发挥着更重要的作用。结合本实验结果,表明L. casei Zhang能下调Th2型细胞因子,促使花生过敏小鼠体内的Th2型免疫反应向Th1型反应转变。
2.7 干酪乳杆菌对脾脏和肠系膜淋巴结中CD4+Foxp3+ Tregs细胞表达的影响益生菌对过敏反应的抑制作用与其对粘膜免疫系统中Tregs的诱导表达之间关系密切。先前的研究证实肠系膜淋巴结中的调节性T细胞是外周黏膜免疫耐受形成过程中不可或缺的重要组成部分,在维持机体免疫平衡、抑制有害免疫反应及维持对无害抗原的免疫耐受中扮演着重要的角色[25]。流式分析结果显示,与对照组相比,CPE的刺激对脾脏和肠系膜淋巴结中CD4+Foxp3+ Tregs细胞的表达水平影响不明显,预防组和治疗组脾脏中CD4+Foxp3+细胞的表达则分别达到了15.22%和15.70% (图 5-A)。与脾脏中结果类似,致敏后摄入L. casei Zhang增加了肠系膜淋巴结CD4+细胞中Foxp3+细胞的比例(13.01%,图 5-B),但在预防组中的变化不明显。

|
| 图 5 小鼠脾脏(A)和MLN(B)中CD4+Foxp3+ Tregs细胞的比例 Figure 5 The percentage of Foxp3+ cells in CD4+ T-cell population was analyzed by flow cytometry in spleen (A) and MLN (B) from mice of each group. Representative histograms gated on CD4+ cells from one of three independent experiments were shown. Numbers indicate the percentages of cells in the gate. |
Tregs细胞在调控免疫应答方面有着很重要的作用,Tregs数量及功能的不足可能是过敏免疫耐受缺陷的重要因素[26]。Tregs细胞主要分为2种类型,一种是天然存在的Tregs,即nTregs;另一种是诱导的Tregs,包括Tr1和Th3两种。Foxp3是nTregs的特异性标志,转录因子Foxp3几乎专一表达于小鼠nTregs[27]。Feleszko等[28]的研究表明,早期接触L. rhamnosus LGG可减轻小鼠的过敏性哮喘症状,并伴随T细胞中Foxp3的表达增加。本研究结果也表明,L. casei Zhang能增加CD4+Foxp3+Tregs细胞的数量。结合前面的脾脏与MLN中细胞因子产生的结果进一步证实,L. casei Zhang可以使Th2型免疫反应向Th1型方向转变,从而减缓过敏反应。
3 结论本研究成功建立小鼠的花生过敏模型,并利用该动物模型研究L. casei Zhang对花生过敏的影响。结果表明,口服L. casei Zhang可减轻小鼠过敏症状,并通过降低小鼠血清中总IgE抗体、CPE特异性IgE抗体、MCP-1和粪便中组胺水平,增加血清中IgG2a抗体起到抑制Th2型免疫反应的作用。同时,体外细胞实验结果也证实,实验组脾脏和MLN细胞释放的Th2细胞因子水平显著下调,IFN-γ/IL-4的比例明显升高,表明L. casei Zhang可以使Th2型免疫反应向Th1型方向转变,从而减缓过敏反应。此外,L. casei Zhang对于花生过敏能发挥一定的预防及治疗作用,但预防组及治疗组之间的差异不明显。
| [1] | Al-Muhsen S, Clarke AE, Kagan RS. Peanut allergy:an overview. Canadian Medical Association Journal, 2003, 168(10): 1279-1285. |
| [2] | Sicherer SH, Sampson HA. Food allergy. The Journal of Allergy and Clinical Immunology, 2010, 125(2 Suppl): S116-S125. |
| [3] |
Li H, Zhang HY. Analysis of sensitizing components for peanut allergen. Chinese Journal of Microbiology and Immunology, 2001, 21(S2): 12-15.
(in Chinese) 李宏, 张宏誉. 花生过敏原致敏组分分析. 中华微生物学和免疫学杂志, 2001, 21(S2): 12-15. |
| [4] | Burks AW. Peanut allergy. The Lancet, 2008, 371(9623): 1538-1546. DOI:10.1016/S0140-6736(08)60659-5 |
| [5] | Ai CQ, Zhang QX, Ren CC, Wang G, Liu XM, Tian FW, Zhao JX, Zhang H, Chen YQ, Chen W. Protective effect of Streptococcus thermophilus CCFM218 against house dust mite allergy in a mouse model. Food Control, 2015, 50: 283-290. DOI:10.1016/j.foodcont.2014.08.040 |
| [6] | Pohjavuori E, Viljanen M, Korpela R, Kuitunen M, Tiittanen M, Vaarala MO, Savilahti E. Lactobacillus GG effect in increasing IFN-γ production in infants with cow's milk allergy. Journal of Allergy and Clinical Immunology, 2004, 114(1): 131-136. DOI:10.1016/j.jaci.2004.03.036 |
| [7] | Meijerink M, Wells JM, Taverne N, de Zeeuw Brouwer ML, Hilhorst B, Venema K, van Bilsen J. Immunomodulatory effects of potential probiotics in a mouse peanut sensitization model. FEMS Immunology & Medical Microbiology, 2012, 65(3): 488-496. |
| [8] | Ya T, Zhang QJ, Chu FL, Merritt J, Bilige M, Sun TS, Du RT, Zhang HP. Immunological evaluation of Lactobacillus casei Zhang:a newly isolated strain from koumiss in Inner Mongolia, China. BMC Immunology, 2008, 9(1): 68. DOI:10.1186/1471-2172-9-68 |
| [9] | Li XM, Srivastava K, Huleatt JW, Bottomly K, Burks AW, Sampson HA. Engineered recombinant peanut protein and heat-killed Listeria monocytogenes coadministration protects against peanut-induced anaphylaxis in a murine model. The Journal of Immunology, 2003, 170(6): 3289-3295. DOI:10.4049/jimmunol.170.6.3289 |
| [10] | Ren CC, Zhang QX, Wang G, Ai CQ, Hu MS, Liu XM, Tian FW, Zhao JX, Chen YQ, Wang M, Zhang H, Chen W. Modulation of peanut-induced allergic immune responses by oral lactic acid bacteria-based vaccines in mice. Applied Microbiology and Biotechnology, 2014, 98(14): 6353-6364. DOI:10.1007/s00253-014-5678-7 |
| [11] | Ai CQ, Zhang QX, Ding JR, Wang G, Liu XM, Tian FW, Zhao JX, Zhang H, Chen W. Mucosal delivery of allergen peptides expressed by Lactococcus lactis inhibit allergic responses in a BALB/c mouse model. Applied Microbiology and Biotechnology, 2016, 100(4): 1915-1924. DOI:10.1007/s00253-015-7187-8 |
| [12] | Koppelman SJ, Hefle SL, Taylor SL, de Jong GAH. Digestion of peanut allergens Ara h 1, Ara h 2, Ara h 3, and Ara h 6:a comparative in vitro study and partial characterization of digestion-resistant peptides. Molecular Nutrition & Food Research, 2010, 54(12): 1711-1721. |
| [13] | Van Wijk F, Hartgring S, Koppelman SJ, Pieters R, Knippels LMJ. Mixed antibody and T cell responses to peanut and the peanut allergens Ara h 1, Ara h 2, Ara h 3 and Ara h 6 in an oral sensitization model. Clinical & Experimental Allergy, 2004, 34(9): 1422-1428. |
| [14] | Koppelman SJ, Wensing M, Ertmann M, Knulst AC, Knol EF. Relevance of Ara h1, Ara h2 and Ara h3 in peanut-allergic patients, as determined by immunoglobulin E Western blotting, basophil-histamine release and intracutaneous testing:Ara h2 is the most important peanut allergen. Clinical & Experimental Allergy, 2004, 34(4): 583-590. |
| [15] | Li XM, Serebrisky D, Lee SY, Huang CK, Bardina L, Schofield BH, Stanley JS, Burks AW, Bannon GA, Sampson HA. A murine model of peanut anaphylaxis:T-and B-cell responses to a major peanut allergen mimic human responses. Journal of Allergy and Clinical Immunology, 2000, 106(1): 150-158. DOI:10.1067/mai.2000.107395 |
| [16] | Li XM, Schofield BH, Huang CK, Kleiner GI, Sampson HA. A murine model of IgE-mediated cow's milk hypersensitivity. Journal of Allergy and Clinical Immunology, 1999, 103(2): 206-214. DOI:10.1016/S0091-6749(99)70492-6 |
| [17] | Bilsborough J, Viney JL. Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease. Gastroenterology, 2004, 127(1): 300-309. DOI:10.1053/j.gastro.2004.01.028 |
| [18] | Cortes-Perez NG, Ah-Leung S, Bermúdez-Humarán LG, Corthier G, Wal JM, Langella P, Adel-Patient K. Intranasal coadministration of live lactococci producing interleukin-12 and a major cow's milk allergen inhibits allergic reaction in mice. Clinical and Vaccine Immunology, 2007, 14(3): 226-233. DOI:10.1128/CVI.00299-06 |
| [19] | Daniel C, Repa A, Wild C, Pollak A, Pot B, Breiteneder H, Wiedermann U, Mercenier A. Modulation of allergic immune responses by mucosal application of recombinant lactic acid bacteria producing the major birch pollen allergen Bet v 1. Allergy, 2006, 61(7): 812-819. DOI:10.1111/all.2006.61.issue-7 |
| [20] | Kim H, Kwack K, Kim DY, Ji GE. Oral probiotic bacterial administration suppressed allergic responses in an ovalbumin-induced allergy mouse model. FEMS Immunology & Medical Microbiology, 2005, 45(2): 259-267. |
| [21] | Kukkonen K, Kuitunen M, Haahtela T, Korpela R, Poussa T, Savilahti E. High intestinal IgA associates with reduced risk of IgE-associated allergic diseases. Pediatric Allergy and Immunology, 2010, 21(1): 67-73. |
| [22] | Bachert C. Histamine-a major role in allergy?. Clinical & Experimental Allergy, 1998, 28(S6): 15-19. |
| [23] | Schwarzer M, Repa A, Daniel C, Schabussova I, Hrncir T, Pot B, Stepankova R, Hudcovic T, Pollak A, Tlaskalova-Hogenova H, Wiedermann U, Kozakova H. Neonatal colonization of mice with Lactobacillus plantarum producing the aeroallergen Bet v 1 biases towards Th1 and T-regulatory responses upon systemic sensitization. Allergy, 2011, 66(3): 368-375. DOI:10.1111/all.2011.66.issue-3 |
| [24] | Shahid SK, Kharitonov SA, Wilson NM, Bush A, Barnes PJ. Increased interleukin-4 and decreased interferon-γ in exhaled breath condensate of children with asthma. American Journal of Respiratory and Critical Care Medicine, 2002, 165(9): 1290-1293. DOI:10.1164/rccm.2108082 |
| [25] | Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory T cells and immune tolerance. Cell, 2008, 133(5): 775-787. DOI:10.1016/j.cell.2008.05.009 |
| [26] | Akdis CA, Akdis M. Mechanisms and treatment of allergic disease in the big picture of regulatory T cells. Journal of Allergy and Clinical Immunology, 2009, 123(4): 735-746. DOI:10.1016/j.jaci.2009.02.030 |
| [27] | Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nature Immunology, 2003, 4(4): 330-336. DOI:10.1038/ni904 |
| [28] | Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, Ahrens B, Groneberg DA, Wahn U, Hamelmann E. Probiotic-induced suppression of allergic sensitization and airway inflammation is associated with an increase of T regulatory-dependent mechanisms in a murine model of asthma. Clinical & Experimental Allergy, 2007, 37(4): 498-505. |
 2018, Vol. 58
2018, Vol. 58