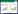中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 商丽, 史晓翀, 王晓宇, 张晓华. 2017
- Li Shang, Xiaochong Shi, Xiaoyu Wang, Xiao-Hua Zhang. 2017
- 北欧海海水可培养细菌多样性
- Diversity of culturable bacterial in the surface seawater of the Nordic Sea
- 微生物学报, 57(9): 1323-1331
- Acta Microbiologica Sinica, 57(9): 1323-1331
-
文章历史
- 收稿日期:2017-02-14
- 修回日期:2017-05-09
- 网络出版日期:2017-06-15
2. 中国海洋大学海洋与大气学院, 山东 青岛 266100
2. College of Oceanic and Atmospheric Sciences, Ocean University of China, Qingdao 266100, Shandong Province, China
北欧海包括格陵兰海、冰岛海和挪威海,海底盆脊交错,且挪威暖流和东格陵兰寒流在此交汇,水文特征十分复杂[1],同时也是连通北冰洋与大西洋的最主要的通道。这些特殊的水文环境决定了北欧海的微生物群落结构可能具有特殊性。由于北欧海常年低温,且处于冰岛低压系统影响下,气旋发生频繁,海况恶劣,这些因素限制了对北欧海海水微生物多样性的研究。目前对北欧海微生物的研究主要集中于北欧海近岸的积雪、海冰及海洋沉积物等的微生物多样性研究,如Amato等[2]对斯匹茨卑尔根地区(Spitzberg)不同季节降雪中的细菌丰度、可培养细菌多样性及其对有机质的降解能力等进行了研究;Larose等[3]利用克隆文库的方法对从挪威斯瓦尔巴德地区(Svalbard)采集的雪样及融化后的雪水中的微生物进行研究;Olsen等[4]对北欧海热液系统中的浮游真核生物进行了研究;Mateosrivera等[5]研究了温度变化对亚北极冰川前缘Styggedalsbreen (挪威)微生物多样性和群落结构的影响,但是关于北欧海表层海水中的可培养细菌的多样性研究较少。
北欧海作为全球热盐环流的重要组成部分,深刻影响着北极以至全球的气候变化[1]。大洋环流与微生物群落结构之间是否具有一定的联系还未可知。本文对北欧海表层海水中可培养细菌的多样性进行分析,寻找北欧海不同区域可培养细菌类群的异同;结合采样位点环境参数,研究不同环境中微生物群落结构与水文环境之间的相关性,为丰富北极海洋细菌资源库,促进北欧海海洋微生物资源的开发利用提供理论基础。
1 材料和方法 1.1 表层海水样品及处理北欧海表层海水样品采集自2015年中挪北欧海水文调查航次,下放采水泵采集表层海水,每个站点取200 μL海水样品,分别涂布于2216E、R2A和海水琼脂培养基平板,4 ℃培养,带回实验室进行分离纯化及鉴定。采样站位信息见表 1。根据北欧海海域水团特性[6],可以将该海域大致划分为4个区域,分别为暖流区、寒流区、海盆区和交汇区,图 1为北欧海地理分布图。
| Position No. | Longitude (W) | Latitude (N) | T/℃ | Property |
| A04 | 4°30'2.952" | 71°59'55.176" | 1.87 | The cold area |
| A07 | 5°40'13.152" | 72°17'58.812" | 2.87 | |
| A08 | 4°40'43.248" | 72°17'52.224" | 2.05 | |
| A09 | 3°40'12.036" | 72°18'3.599" | 2.27 | |
| A10 | 2°40'33.564" | 72°18'1.799" | 1.92 | |
| A11 | 1°50'19.824" | 72°18'4.212" | 1.83 | |
| C25 | 5°9'46.763" | 71°26'2.4" | 1.92 | |
| R11 | 0°52'59.987" | 73°24'59.975" | 1.08 | |
| S14 | 8°57'46.188" | 71°19'52.824" | 2.42 | |
| Y09 | -0°0'33.588" | 72°38'2.976" | 2.86 | |
| Y10 | -0°29'47.400" | 72°53'2.976" | 1.56 | |
| A01 | 1°19'14.988" | 71°55'8.4" | 3.83 | The intersection area |
| A02 | 2°24'50.94" | 71°59'55.788" | 3.30 | |
| A03 | 3°23'40.2" | 72°0'4.824" | 2.84 | |
| F08 | 6°57'47.412" | 70°NaN'NaN" | 5.13 | |
| I02 | 9°15'29.988" | 69°34'45.588" | 3.45 | |
| C11 | 0°51'27.612" | 71°41'55.788" | 5.68 | The warm area |
| C12 | 1°50'0.024" | 71°42'7.776" | 6.11 | |
| C13 | 2°50'8.375" | 71°42'4.176" | 5.32 | |
| C14 | 3°50'1.248" | 71°41'57.011" | 4.52 | |
| C22 | 2°9'56.448" | 71°23'57.588" | 4.82 | |
| C23 | 3°10'57.647" | 71°24'13.176" | 4.72 | |
| C24 | 4°4'27.624" | 71°24'0.612" | 5.08 | |
| D04 | 4°0'29.448" | 70°30'11.988" | 6.01 | |
| G04 | 4°59'40.236" | 69°0'4.212" | 6.17 | |
| G07 | 2°0'28.224" | 68°59'54.600" | 7.38 | |
| R09 | -0°1'0.012" | 72°28'0.012" | 4.20 | |
| Y07 | -1°9'2.412" | 72°13'40.800" | 5.83 | |
| G09 | -0°0'16.2" | 69°0'9" | 8.06 | The basin area |
| G12 | 1°49'17.4" | 69°43'8.4" | 7.52 | |
| Y01 | 3°40'4.800" | 70°45'4.824" | 8.20 | |
| Y02 | 3°3'44.388" | 71°10'1.812" | 7.34 |
|
| 图 1 北欧海地理分布图 Figure 1 The geographic distribution map of Nordic Sea. |
1.2 菌株表型特征描述
记录菌株的菌落大小、颜色、透明度、边缘特征、湿润度、菌落突起或凹陷等特征。
1.3 菌株的分离、纯化与保藏根据菌落形态、大小等特征挑取单菌落,划线分离纯化3次后,接种于斜面,用15%的甘油保种液洗脱菌苔,-80 ℃保藏。
1.4 DNA的提取采用煮沸法或酚氯仿抽提法提取菌株的基因组DNA[7]。
1.5 16S rRNA基因扩增使用细菌16S rRNA基因通用引物[8]:上游引物B8F:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物B1510:5′-GGGGTTACCTTGTTACGACT T-3′,对菌株DNA进行扩增。PCR反应的条件为:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 90 s,30个循环;72 ℃ 10 min。PCR产物以1.0%琼脂糖凝胶电泳检测后,以限制性内切酶Hae Ⅲ进行酶切,进行2.0%琼脂糖凝胶电泳检测后进行RFLP分析,选取酶切图谱不同的PCR产物送北京六合华大有限公司进行测序。
1.6 16S rRNA基因序列测定及构建系统树将所得的16S rRNA基因序列在NCBI中用BLAST程序进行比对,选取与分离菌株相似度最高的种的标准株,用MEGA 5.0软件以邻接法(Neighbor-Joining)构建系统进化树,Bootstrap设为1000次。
2 结果和分析 2.1 菌株的分离纯化和保藏从2216E、R2A和海水琼脂培养基上,根据菌落的大小、颜色等形态特征的不同,共分离菌株407株,纯化后-80 ℃保藏。提取菌株基因组DNA,PCR扩增16S rRNA基因后进行电泳检测,均能得到长度约为1.5 kb的单一条带。
2.2 北极海域表层海水可培养菌株的鉴定及系统发育分析对407株菌株的酶切图谱进行RFLP分析(图 2),根据分析结果选取其中154株菌株进行16S rRNA基因测序,16S rRNA基因序列提交GenBank,获得序列号KY471020-KY471046。

|
| 图 2 部分克隆16S rRNA基因RFLP分型图谱 Figure 2 RFLP maps for 16S rRNA of partial strains. According to the RFLP maps, the bands 1, 4 and 6 were the same, so the corresponding strain of 1 were selected to be sequenced; the bands of 2, 3 and 5 were different, the corresponding strains were sequenced all. |
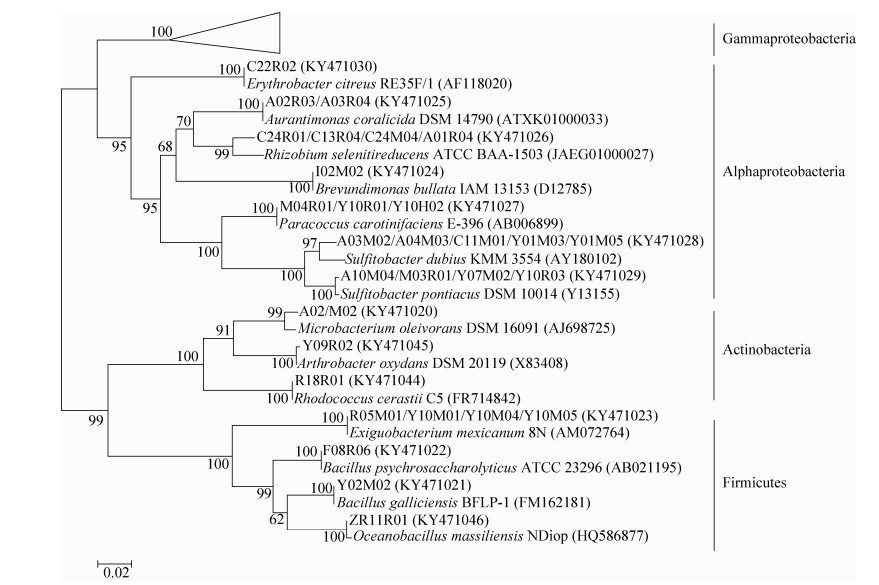
测序结果在NCBI上用BLAST程序进行比对分析,结果表明测序菌株分属于3个门,18个属,27个种。3个门包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),其中变形菌门(Proteobacteria)又包括α-变形菌纲(α-Proteobacteria)和γ-变形菌纲(γ-Proteobacteria)。γ-变形菌纲共有6个属,13个种;α-变形菌纲共有6个属,6个种;厚壁菌门共有3个属,4个种;放线菌门共有3个属,3个种。
送测的154株菌中,变形菌门中的γ-变形菌纲细菌占的比例最高,占总数的77%,放线菌门的细菌最少,只占到3%;优势属菌株中假交替单胞菌属(Pseudoalteromonas)细菌所占比例最大,为48%,其次是嗜冷杆菌属(Psychrobacter),占20%;优势种菌株中的食琼脂假交替单胞菌(Pseudoalteromonas agarivorans)为最优势种,占比达到30%,其次是海雪嗜冷杆菌(Psychrobacter nivimaris)和闪烁交替单胞菌(Alteromonas fuliginea),各占23%和18%。
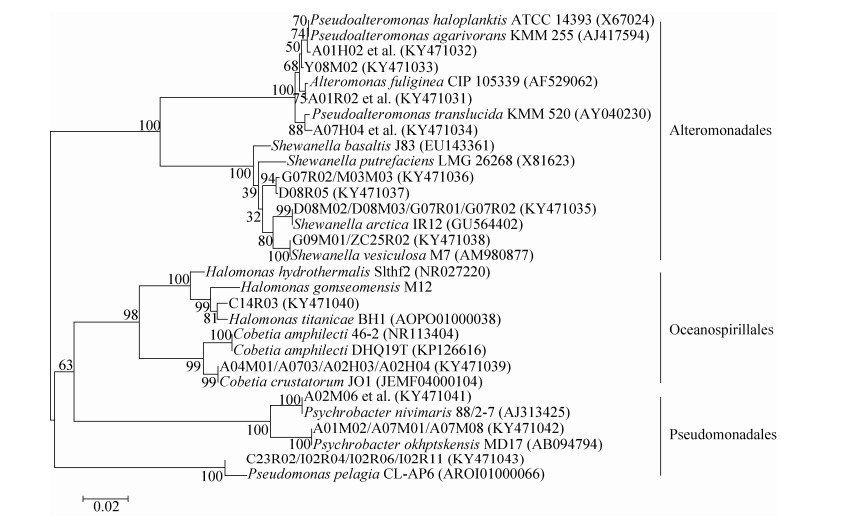
选取与送测菌株16S rRNA基因序列相似度最高的种的标准株,用MEGA 5.0软件构建系统进化树如图 3所示,从图 3中可以看出所有细菌共分成4个分类单元:γ-变形菌纲、α-变形菌纲、放线菌门和厚壁菌门。将γ-变形菌纲单独构建系统进化树(图 4),从图中可以看出γ-变形菌纲分为3个分类单元:交替单胞菌目(Alteromonadales)、假单胞菌目(Pseudomonadales)、海洋螺菌目(Oceanospirillales)。
|
| 图 3 北欧海可培养细菌系统进化树 Figure 3 Neighbor-Joining tree showing the relationship of bacterial strains isolated from the Nordic Sea. The numbers at nodes represent the percentage levels of bootstrap support (%) (expressed as percentages of 1000 replications). The GenBank accession numbers of 16S rRNA sequences are given in the parentheses. Bar=0.02 substitutions per nucleotide position. |
|
| 图 4 γ-变形菌纲可培养细菌系统进化树 Figure 4 Neighbor-Joining tree showing the relationship of γ-Proteobacteria strains isolated from the Nordic Sea. The numbers at nodes represent the percentage levels of bootstrap support (%) (expressed as percentages of 1000 replications). The GenBank accession numbers of 16S rRNA sequences are given in the parentheses. Bar=0.02 substitutions per nucleotide position. |
2.3 不同培养基可培养细菌分类
利用2216E、R2A和海水琼脂3种培养基对细菌进行分离培养。其中利用2216E和R2A培养基都分离到了放线菌门、厚壁菌门和变形菌门的细菌,用海水琼脂培养基只分离到了变形菌门的细菌。
2.4 不同区域可培养细菌分类根据水团特性[6],将北欧海上层水分为4个区域:海盆区、挪威暖流区、东格陵兰寒流区及寒流暖流交汇区,4个区域都以变形菌门中的γ-变形菌纲为主,4个区域的细菌分类大致相同,都分离到了变形菌门、厚壁菌门和放线菌门的细菌,但海盆区未分离到放线菌门的细菌。在寒流区分离到的厚壁菌门的细菌较多,占厚壁菌门总菌株数的70%。从属的种类上来看,从交汇区分离到的细菌种类最多,有10种,而从海盆区分离到的细菌种类最少,仅4种。
3 讨论北欧海气候寒冷,冬季较长,夏季只有短短几个月,平均气温多在10 ℃以下,海域面积达4.1×106 km2,占全球海洋总面积的1%。高温高盐的北大西洋暖流水和低温低盐的北冰洋寒流水在北欧海发生交汇混合,再加上其特殊的地理自然环境为水团变性和深对流提供了得天独厚的条件,这里被认为是大洋上层水体和深层高密度水体发生直接对流交换与变性的关键地区[1]。这种独特的环境也使得北欧海微生物生存环境特殊,多样性独特,得到越来越多的关注。
许多研究表明,在海洋环境中,由于α-变形菌纲的细菌较难分离培养,所以基于培养方法获得的优势类群主要为γ-变形菌纲的细菌,而通过非可培养方式获得的优势类群为α-变形菌纲的细菌[2]。本研究利用平板培养法从北欧海表层海水中分离到的菌株以γ-变形菌纲为主,其次是放线菌门和厚壁菌门的细菌,这与Li等[9]对南极德雷克海峡表层海水、Prasad等[10]对北极王湾海水样品的研究结果一致。而Teske等[11]利用16S rRNA克隆文库对取自斯瓦尔巴德岛的北极峡湾表层和深层水进行研究时发现α-变形菌纲的细菌占主导;Lovejoy等[12]利用16S rRNA克隆文库对北冰洋及周边海域样品进行研究时发现α-变形菌纲的细菌占据优势地位。这些研究再次证明了培养法和非培养法对菌株群落多样性研究结果的偏好性。为更加全面深入了解北欧海微生物群落结构,可多种方法结合使用以准确评估其多样性。
本研究采用包括2216E培养基、R2A培养基和海水培养基等多种培养基对北欧海海水中细菌进行分离培养,获得的细菌主要包括变形菌门、厚壁菌门和放线菌门的细菌,以变形菌门居多;其中利用2216E和R2A培养基分离得到全部3个门的细菌种类。表明与海水培养基相比,2216E和R2A培养基更适合作为分离极地微生物的培养基;而利用海水培养基也培养出了变形菌门细菌,说明变形菌门的细菌代谢方式多样,可在寡营养、低温环境下生存。另据报道,许多对低温极端环境微生物的研究中发现了拟杆菌门细菌[3, 13],但本研究中未发现。
生存于北欧海的很多细菌可以归属于极端微生物,能够在寒冷、寡营养、强辐射、高盐、高压等环境下生存,具有极强的环境适应能力。相对于陆地生境来说,大多数海洋生境缺乏营养,微生物的生命活动不活跃[14],而北欧海环境比一般海洋环境更恶劣,所以该环境中微生物必然有其独特的代谢调控和环境适应机制,如形成孢子、积累色素[15]、增加细胞膜流动性[16]和分泌低温酶[17]等。本研究分离得到的菌株中有部分菌株具有白色、黄色、乳黄色、金黄色、橙色和红褐色等颜色特征,如本实验分离到的菌株游海假交替单胞菌(Pseudoalteromonas haloplanktis)呈现乳黄色,直径为1-2 mm的规则圆形菌落;水泡希瓦氏菌(Shewanella vesiculosa)为橙色,直径为1 mm的规则圆形菌落。这种色素产生菌在低温极端环境中经常被发现[2, 15]。有研究表明,色素中的类胡萝卜素在维持细胞膜流动性方面发挥重要作用,对于细菌在低温环境中生存起重要作用[18],在本次实验中也分离到了产类胡萝卜素副球菌(Paracoccus carotinifaciens)等菌株,它们产生的类胡萝卜素可能与其低温环境适应机制有关。这些菌株产生的色素种类和功能还需要进一步研究。
对海盆区、挪威暖流区、东格陵兰寒流区和寒暖流交汇区这4个不同区域的细菌多样性进行比较发现,除海盆区未分离到放线菌门的细菌外,4个区域都分离到了变形菌门、厚壁菌门和放线菌门的细菌。格陵兰寒流与挪威暖流在北欧海地势复杂变化剧烈的洋中脊附近交汇,形成较强的海洋锋面和流剪切,围绕北极锋区多发中尺度海洋涡旋,加剧了寒暖水系间跨越锋区的水平交汇和混合,改变了局地海水温度、盐度等性质的变化及营养盐的分布,进而影响微生物群落的结构和分布。在本研究中,交汇区分离到的细菌种类最多(属水平),共有10种,寒流区和暖流区次之,都是8种,而海盆区仅为4种。且各个区域都有其特有类群,如微杆菌属(Microbacterium)和橙单胞菌属(Aurantimonas)只在交汇区站位中分离到,大洋短杆菌属(Oceanobacillus)和副球菌属(Paracoccus)仅在寒流区发现,而盐单胞菌属(Halomonas)和赤杆菌属(Erythrobacter)仅在暖流区站位获得,海盆区未分离到特有的类群。推测这些特有类群出现可能是由于来自中低纬度的北大西洋暖流。与东格陵兰寒流相比,自身高温高盐、浮游植物相对较多,初级生产力高[1],使得该暖流流经区域的细菌丰度及多样性都较其他地区高;而来自于北冰洋的东格陵兰寒流海水温度低,与北欧海微生物生长温度相近,同时寒流也可能会带来一些极地细菌类群,如分离到的闪烁交替单胞菌(Alteromonas fuliginea)最早就分离自北冰洋[19]。在交汇区,寒暖流交汇形成锋区,能十分有效地聚集浮游碎片及其他颗粒物质,使得此地生产力较高;在海盆区,其初级生产力高于周围海脊,但是当表层水温较高时,会形成较强的温盐跃层,阻止营养盐向表层运输,因此表层营养盐消耗完毕后,强水体层化作用会对初级生产力产生抑制作用[20]。在本航次站位中,海盆区站位表层海水温度在7.34-8.20℃之间,高于其他区域温度,再加上海盆周围有寒流或是暖流形成的环流,与外界物质交换较少,所以在海盆区分离到的细菌种类较少,主要是一些常见类群,如在海洋中分布广泛的假交替单胞菌属(Pseudoalteromonas)等。最后,站位选择可能也是影响可培养多样性研究结果的因素之一。
北极地区具有一些独特的环境,如冰川、永久冻结带、苔原冻土带等,存在大量嗜冷及适冷细菌,本研究中分离得到的假单胞菌属细菌是目前所有低温环境微生物研究中数量最多的类群[21-22]。本研究中,嗜冷杆菌及芽孢杆菌约占总菌株数的1/5。从全部细菌的系统进化树(图 3)中可以看出,所有细菌可分为4个分类单元:γ-变形菌纲、α-变形菌纲、放线菌门和厚壁菌门,根据系统发育分析表明,该区域分离得到的可培养嗜冷菌与北冰洋及周围海域表层海水[12]及深海[23]等研究中获得的嗜冷菌种类高度相似,说明这些细菌类群在低温环境中普遍存在。
同时,北欧地区气候相对来说温暖湿润,这主要依赖于大洋环流带动的热量输送,因此该地区对温度变化尤为敏感[1]。全球变暖早已是一个全球性的亟待解决的问题,低温微生物广泛分布于地球的低温环境中,且其最适生长温度较一般微生物来说低,可作为全球气候变化的晴雨表[24],因此对北欧海及海洋微生物的研究显得格外重要。本实验对北欧海表层海水微生物进行了分离培养,并对微生物群落结构与海洋环流之间的关系进行了初步探究,丰富了北欧海微生物资源库。获得的微生物菌株可能在食品、医药、环境保护等领域具有开发价值。
| [1] | Furevik T, Mauritzen C, Ingvaldsen R. The flow of Atlantic water to the Nordic Seas and Arctic Ocean//Ørbæk JB, Kallenborn R, Tombre I, Hegseth EN, Falk-Petersen S, Hoel AH. Arctic Alpine Ecosystems and People in a Changing Environment. Berlin, Heidelberg:Springer, 2007:123-146. |
| [2] | Amato P, Hennebelle R, Magand O, Sancelme M, Delort AM, Barbante C, Boutron C, Ferrari C. Bacterial characterization of the snow cover at Spitzberg, Svalbard. FEMS Microbiology Ecology, 2007, 59(2): 255-264. DOI:10.1111/fem.2007.59.issue-2 |
| [3] | Larose C, Berger S, Ferrari C, Navarro E, Dommergue A, Schneider D, Vogel TM. Microbial sequences retrieved from environmental samples from seasonal arctic snow and meltwater from Svalbard, Norway. Extremophiles, 2010, 14(2): 205-212. DOI:10.1007/s00792-009-0299-2 |
| [4] | Olsen BR, Troedsson C, Hadziavdic K, Pedersen RB, Rapp HT. The influence of vent systems on pelagic eukaryotic micro-organism composition in the Nordic Seas. Polar Biology, 2015, 38(4): 547-558. DOI:10.1007/s00300-014-1621-8 |
| [5] | Mateos-Rivera A, Yde JC, Wilson B, Finster KW, Reigstad LJ, Øvreås L. The effect of temperature change on the microbial diversity and community structure along the chronosequence of the sub-arctic glacier forefield of Styggedalsbreen (Norway). FEMS Microbiology Ecology, 2016, 92(4): fnw038. DOI:10.1093/femsec/fiw038 |
| [6] | Swift JH, Aagaard K. Seasonal transitions and water mass formation in the Iceland and Greenland Seas. Deep Sea Research Part A, Oceanographic Research Papers, 1981, 28(10): 1107-1129. DOI:10.1016/0198-0149(81)90050-9 |
| [7] | 尹琦. 南太平洋环流区表层海水微生物群落结构研究. 中国海洋大学硕士学位论文, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505140.htm |
| [8] | Heuer H, Krsek M, Baker P, Smalla K, Wellington EM. Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients. Applied and Environmental Microbiology, 1997, 63(8): 3233-3241. |
| [9] | Li Z, Xing MX, Wang W, Wang D, Zhu JC, Sun M. Phylogenetic diversity of culturable bacteria in surface seawater from the Drake Passage, Antarctica. Chinese Journal of Oceanology and Limnology, 2016, 34(5): 952-963. DOI:10.1007/s00343-016-5132-z |
| [10] | Prasad S, Manasa P, Buddhi S, Tirunagari P, Begum Z, Rajan S, Shivaji S. Diversity and bioprospective potential (cold-active enzymes) of cultivable marine bacteria from the subarctic glacial fjord, Kongsfjorden. Current Microbiology, 2014, 68(2): 233-238. DOI:10.1007/s00284-013-0467-6 |
| [11] | Teske A, Durbin A, Ziervogel K, Cox C, Arnosti C. Microbial community composition and function in permanently cold seawater and sediments from an Arctic fjord of Svalbard. Applied and Environmental Microbiology, 2011, 77(6): 2008-2018. DOI:10.1128/AEM.01507-10 |
| [12] | Lovejoy C, Galand PE, Kirchman DL. Picoplankton diversity in the Arctic Ocean and surrounding seas. Marine Biodiversity, 2011, 41(1): 5-12. DOI:10.1007/s12526-010-0062-z |
| [13] | Liu YQ, Yao TD, Jiao NZ, Tian LD, Hu AY, Yu WS, Li SH. Microbial diversity in the snow, a moraine lake and a stream in Himalayan glacier. Extremophiles, 2011, 15(3): 411-421. DOI:10.1007/s00792-011-0372-5 |
| [14] |
Zhao CH, Ye DZ, Wei WL. Research on deep-sea microbiology. Microbiology China, 2006, 33(3): 142-146.
(in Chinese) 赵昌会, 叶德赞, 魏文铃. 深海微生物的研究进展. 微生物学通报, 2006, 33(3): 142-146. |
| [15] | Mueller DR, Vincent WF, Bonilla S, Laurion I. Extremotrophs, extremophiles and broadband pigmentation strategies in a high arctic ice shelf ecosystem. FEMS Microbiology Ecology, 2005, 53(1): 73-87. DOI:10.1016/j.femsec.2004.11.001 |
| [16] | Kumar GS, Jagannadham MV, Ray MK. Low-temperature-induced changes in composition and fluidity of lipopolysaccharides in the Antarctic psychrotrophic bacterium Pseudomonas syringae. Journal of Bacteriology, 2002, 184(23): 6746-6759. DOI:10.1128/JB.184.23.6746-6749.2002 |
| [17] | Groudieva T, Kambourova M, Yusef H, Royter M, Grote R, Trinks H, Antranikian G. Diversity and cold-active hydrolytic enzymes of culturable bacteria associated with Arctic sea ice, Spitzbergen. Extremophiles, 2004, 8(6): 475-488. DOI:10.1007/s00792-004-0409-0 |
| [18] | Fong N, Burgess M, Barrow K, Glenn D. Carotenoid accumulation in the psychrotrophic bacterium Arthrobacter agilis in response to thermal and salt stress. Applied Microbiology and Biotechnology, 2001, 56(5/6): 750-756. |
| [19] | Ivanova EP, Kiprianova EA, Mikhailov VV, Levanova GF, Garagulya AD, Gorshkova NM, Vysotskii MV, Nicolau DV, Yumoto N, Taguchi T, Yoshikawa S. Phenotypic diversity of Pseudoalteromonas citrea from different marine habitats and emendation of the description. International Journal of Systematic Bacteriology, 1998, 48(1): 247-256. DOI:10.1099/00207713-48-1-247 |
| [20] |
Cai PH, Huang YP, Shen GY, Li WQ, Liu GS, Chen M, Qiu YS, Cai MG. The relationship between primary productivity and vertical stability of water column in the South China Sea. Acta Oceanologica Sinica, 2000, 22(5): 137-140.
(in Chinese) 蔡平河, 黄奕普, 沈国英, 李文权, 刘广山, 陈敏, 邱雨生, 蔡明刚. 南沙海域初级生产力与水柱垂直稳定度的关系. 海洋学报, 2000, 22(5): 137-140. |
| [21] |
Chen XL, Zhang YZ, Gao PJ. Progress in cold-adapted microorganisms and their cold-adapted mechanism. Journal of Chinese Biotechnology, 2003, 23(2): 86-90.
(in Chinese) 陈秀兰, 张玉忠, 高培基. 适冷微生物及其适冷机制研究进展. 中国生物工程杂志, 2003, 23(2): 86-90. |
| [22] | Kelly LC, Cockell CS, Herrera-Belaroussi A, Piceno Y, Andersen G, DeSantis T, Brodie E, Thorsteinsson T, Marteinsson V, Poly F, LeRoux X. Bacterial diversity of terrestrial crystalline volcanic rocks, Iceland. Microbial Ecology, 2011, 62(1): 69-79. DOI:10.1007/s00248-011-9864-1 |
| [23] | Antony R, Krishnan KP, Laluraj CM, Thamban M, Dhakephalkar PK, Engineer AS, Shivaji S. Diversity and physiology of culturable bacteria associated with a coastal Antarctic ice core. Microbiological Research, 2012, 167(6): 372-380. DOI:10.1016/j.micres.2012.03.003 |
| [24] | Morita RY. Psychrophilic bacteria. Bacteriological Reviews, 1975, 39(2): 144-167. |
 2017, Vol. 57
2017, Vol. 57