中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李越鲲, 孙燕飞, 雷勇辉, 周旋, 尹跃, 秦垦. 2017
- Yuekun Li, Yanfei Sun, Yonghui Lei, Xuan Zhou, Yue Yin, Ken Qin. 2017
- 枸杞根际土壤真菌群落多样性的高通量测序
- Fungal community diversity in rhizosphere soil of Lycium barbarum L. based on high-throughput sequencing
- 微生物学报, 57(7): 1049-1059
- Acta Microbiologica Sinica, 57(7): 1049-1059
-
文章历史
- 收稿日期:2016-10-12
- 修回日期:2017-02-20
- 网络出版日期:2017-02-04
2. 石河子大学生命科学学院, 新疆 石河子 832003;
3. 石河子大学农学院, 新疆 石河子 832003
2. College of Life Sciences, Shihezi University, Shihezi 832003, Xinjiang Uygur Autonomous Region, China;
3. Agricultural College of Shihezi University, Shihezi 832003, Xinjiang Uygur Autonomous Region, China
Ken Qin, Tel/Fax:+86-951-6886783;E-mail:qinken7@163.com
土壤微生物是自然环境中最主要的分解者,是最重要的土壤肥力活性因子[1]。土壤中的物种和能量转化主要依赖于土壤微生物,其更容易受土壤生态系统的影响。微生物多样性指标作为重要的土壤健康指标受到更为广泛的关注。
宁夏枸杞(Lycium barbarum L.)为茄科多年生落叶灌木,分布于宁夏、甘肃、青海、新疆等全国16个省区的不同生态区域,在宁夏、青海、新疆有较大规模的栽培。宁夏地区独特地理环境和气候条件,是宁夏枸杞成为全国知名道地药材的重要因素。当前宁夏枸杞道地性研究主要集中在光照、温度、湿度、空气等气候条件以及地理环境对枸杞道地性形成的影响[2]。而对于土壤与道地药材相关性的研究主要集中于土壤理化性质等方面,有关枸杞根际微生物对药材道地性的形成还缺乏足够认识和系统研究[3]。
目前关于中药材枸杞道地性的研究多集中在枸杞栽培、育种、耐盐性机理、土壤含盐量对枸杞多糖积累的影响、化学成分分析、药理学研究等方面[4-8],而关于枸杞及其相关微生物的关系方面的研究则很少,对于枸杞优良品质与根际微生物的相互关系还未见报道。枸杞根际是否存在可提高植物抗旱、耐盐碱的微生物种群等问题也都需要进一步探讨。
因此,进行枸杞主要化学成分与根际微生物的相关性研究具有十分重要的意义,同时对今后更好地开发利用宁夏枸杞优良品质奠定基础[9]。
在以土壤为宿主载体,植物根系与其根际微生物相互作用而形成的微生态环境中,根际微生物通过物质循环、能量转换与宿主相互作用。因此,通过改变药用植物根际土壤酸碱度、氧化还原状况等特性,可促进根际土壤有效养分的转化与储存,加快植物根系对养分的吸收,从而提高药材的品质,形成道地药材[10]。土壤中的微生物在这个过程中起到了非常重要的作用,因此,对于枸杞道地性与其根际微生物的研究显得尤为重要。高通量测序技术(high-throughput sequencing)具有高通量、高灵敏度、高准确性和低运行成本的特点,该测序技术已被应用于多种生态系统的微生物多样性研究,如海洋[11-12]、肠道[13-14]、土壤[15-16]等,它可以深入、细致地研究微生物群落结构。本文采用高通量测序方法对新疆精河、青海格尔木、宁夏兴仁和宁夏中宁4个地区枸杞的根际土壤真菌进行了菌群多样性研究,探索枸杞主要成分与根际微生物可能存在的某种关系。
1 材料和方法 1.1 土壤及枸杞样品采集方法采样地点:于2014年在宁夏中宁、宁夏兴仁、新疆精河、青海格尔木4个地区,选择“宁杞1号”5龄树为采样树。采样点地理信息见表 1。
| Places | Longitude | Latitude | Altitude/m |
| NX.X (宁夏兴仁镇郝集村) | 105°10′57″ | 36°53′22″ | 1764 |
| NX.Z (宁夏中宁舟塔乡) | 105°36′17″ | 37°29′06″ | 1196 |
| QH.G (青海格尔木新乐村) | 94°26′57″ | 36°24′32″ | 2806 |
| XJ.J (新疆精河托里乡克孜勒加尔村) | 82°37′41″ | 44°34′15″ | 301 |
土样采样时间:第1次盛花期。
枸杞样品采样时间:第1批夏果成熟期。采样时天气晴朗,地面无杂草。
土样采样方法:枸杞地中心定一个采样点,等距离等角度辐射4点,采用五点法采样,采样树做标记。距枸杞树主干20 cm处,铲除植被表面土壤后,在植株根际周围五点垂直取15-40 cm深度的根际土壤,每个点取样量为3 kg,5个点的土壤均匀混合,装入无菌密封塑料袋中,贴上标签,立即带回实验室,保存于-80 ℃冰箱。
枸杞样品采样方法:采样树与土样采样树保持一致,五点采样法采尽每棵树的成熟果实,晒干,混匀,装入自封袋常温保存。
1.2 土壤理化因子的测定土壤常规九项按以下标准测定。pH值:LY/T1239-1999[17];全氮:LY/T 1228-1999[18];全磷:LY/T 1232-1999[19];全钾:LY/T 1234-1999[20];全盐:LY/T 1251-1999[21];速效磷:LY/T 1233-1999[22];速效氮:LY/T 1229-1999[23];速效钾:LY/T 1236-1999[24];有机质:NY/T 1221.6-2006[25]。
1.3 枸杞主要有效成分的测量多糖、甜菜碱、类胡萝卜素的测量方法分别按以下3个标准进行:NY/T 1676-2008[26]、NY/T1746-2009[27]、GB/T5009.83-2003[28]。
1.4 土壤基因组DNA提取及MiSeq测序土壤碾碎过80目筛后测量土壤理化性质和提取其土壤总DNA。利用试剂盒提取基因组DNA (Powersoil® DNA isolation kit),然后采用NanoDrop-ND1000测定提取的DNA浓度,并利用1%的琼脂糖凝胶电泳检测DNA提取质量。提取质量合格的DNA样品,送北京华诺时代科技有限公司对真菌ITS区进行Paired-end测序,测序使用Illumina (MiSeq)平台。
1.5 生物信息学分析下机数据经过预处理,去除低质量reads,然后根据PE数据之间的overlap关系将成对的reads拼接成一条序列,为得到高质量的reads,去除tags两端的barcode序列及引物序列,去除嵌合体及其短序列等后得到clean tags。拼接过滤后的clean tags,在0.97相似度下利用QIIME (v1.8.0) 软件将其聚类为用于物种分类的OTU (Operational Taxonomic Units),统计各个样品每个OTU中的丰度信息,OTU的丰度初步说明了样品的物种丰富程度。
1.6 多样性分析Alpha多样性是对单个样品中物种多样性的分析,基于OTU的结果,计算香农指数(Shannon index),Chao1指数,谱系多样性和观察种数共4个指数来进行生物多样性分析。丰富度指数(Chao、Ace)和α-多样性指数(Shannon、Simpson)的计算利用Mothur 1.30.1软件完成。
1.7 物种组成分析获得的OTU与RDP数据库(Release 11.1,http://rdpcme.msu.edu/)比对,通过RDP Classifier鉴定OTU代表性序列的微生物分类地位。各组样品在不同水平的分类比较柱形图是用QIIME (v1.8.0) 软件得到的,单个样品的群落分布柱形图和盒型图是根据QIIME (v1.8.0) 软件计算的结果用R (v3.1.1) 软件绘制。
1.8 典型对应分析CCA (canonical correspondenceanalysis)通过典型对应分析(CCA)探讨土壤性质、枸杞有效药用成分含量与土壤根际微生物真菌群落的相互关系。测试分析在软件CANOCO Version 4.5A中完成,显著水平确定为P < 0.05。箭头表示环境因子,箭头所处的象限表示环境因子与排序轴之间的正负相关性,箭头连线的长度代表某个环境因子与群落分布和种类分布之间相关程度的大小,连线越长,相关性越大,代表这个环境因子对研究对象的分布影响越大;反之越小。箭头连线和排序轴的夹角代表着某个环境因子与排序轴的相关性大小,夹角越小,相关性越高;反之越低。
2 结果和分析 2.1 枸杞根际土壤基本理化性质及枸杞有效成分分析采集新疆精河、青海格尔木、宁夏兴仁和宁夏中宁4个地区枸杞的根际土壤后分别测定了其根际土壤基本理化性质9项指标。结果表明4个土壤样品中兴仁和格尔木偏碱性,全盐含量格尔木最高,有机质含量中宁和精河偏高,格尔木普遍偏低(表 2)。在多糖、甜菜碱、类胡萝卜素含量的测量,以多糖含量和甜菜碱含量来看,中宁枸杞高于兴仁和精河,格尔木最低(表 3)。
| Sample pH | Total salt/ (g/kg) | Organic matter/ (g/kg) | Total nitrogen/ (g/kg) | Total phosphorus/ (g/kg) | Total potassium/ (g/kg) | Available nitrogen/ (mg/kg) | Available phosphorus/ (mg/kg) | Available potassium/ (mg/kg) | |
| NX.Z | 7.59±0.01d | 2.15±0.00b | 12.20±0.04a | 1.00±0.00a | 1.32±0.02a | 19.80±0.29b | 152.00±0.89a | 54.50±0.51a | 295.00±3.33a |
| XJ.J | 7.90±0.00c | 0.75±0.01d | 10.30±0.04b | 0.67 ±0.00b | 0.74±0.01b | 22.00±0.18a | 79.00±0.89b | 43.90±1.67b | 120.00±2.22b |
| NX.X | 8.10±0.00a | 0.97±0.01c | 6.19±0.00d | 0.40±0.00d | 0.37±0.02d | 18.50±0.29c | 54.00±0.89c | 6.10±0.13c | 120.00±2.22b |
| QH.G | 7.95±0.00b | 2.70±0.01a | 6.94±0.05c | 0.46±0.02c | 0.64±0.01c | 16.50±0.29d | 58.00±1.78c | 58.40±1.04a | 95.00±2.22c |
| Different letters within a column indicates significant difference amongbiochar at P < 0.05. | |||||||||
| Sample ID | LBP/(g/100g) | Betaine/(g/100g) | Carotenoid/(mg/100g) |
| NX.Z XJ.J NX.X QH.G | 1.86±0.06a 1.68±0.06b 1.68±0.03b 1.54±0.09b | 0.53±0.03b 0.65±0.03a 0.41±0.01c 0.34±0.02d | 340.70±4.31a 302.88±16.27ab 290.95±3.73b 302.33±32.44ab |
| Different letters within a column indicates significant difference among biochar at P < 0.05. | |||
2.2 枸杞根际土壤真菌OTU水平分析
经数据前处理,最终得到的测序长度集中在180-360 bp之间,且4个样品共产生4566个OTU,其中Singletons OTU (即丰度为1的OTU)个数为2011,Singletons OTU可能由于测序错误造成,故将这部分OTU去除,不加入后期分析,Nonsingletons OTU个数为2555,各样本统计结果见表 4所示。采用随机抽样的方法抽取数据,以抽到的序列数与它们所能代表OTU的数目构建曲线,即稀释性曲线。4个样品的稀释曲线如图 1所示[R (v3.1.1) 画图软件所作]。曲线趋于平坦,说明测序数据量合理,更多的数据量对发现新OTU的边际贡献很小。
| Sample ID | Raw_tag | Clean_tag | Final_tag | OTUs |
| QH.G | 78953 | 75150 | 74653 | 1300 |
| NX.X | 92847 | 88124 | 87386 | 1532 |
| NX.Z | 75253 | 68116 | 67686 | 1106 |
| XJ.J | 88333 | 83779 | 83433 | 1236 |

|
| 图 1 枸杞根际土壤样品真菌测序的稀释曲线 Figure 1 Rarefaction curves in the samples of soil around root of Lycium barbarum L. (X axis number of Reads sampled, Y axis number of OTUs). Lable: 0.03. |
2.3 物种组成分析
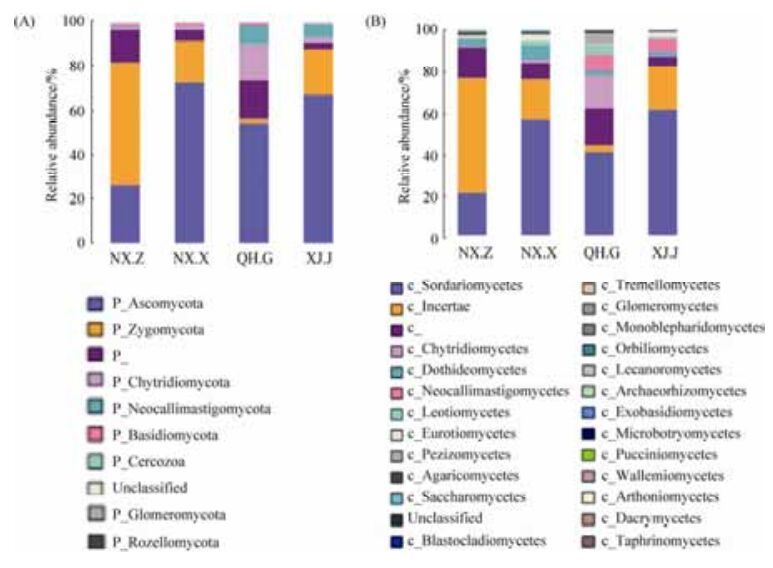
物种组成分析反映样品在不同分类学水平上的群落结构。图 2-A和图 2-B分别展示门(phylum)水平和纲(class)水平的群落结构和分类比较结果,相对含量最多的菌门为子囊菌门(Ascomycota),其中含量较低的球囊菌门(Glomeromycota)可形成丛枝菌根。在纲水平,鉴定出24个纲,其中粪壳菌纲(Sordariomycetes)、丝足虫纲(Incertae)、壶菌纲(Chytridiomycetes)、座囊菌纲(Dothideomycetes)相对含量最多,其次是新丽鞭毛菌纲(Neocallimastigomycetes)、锤舌菌纲(Leotiomycetes)、散囊菌纲(Eurotiomycetes)、盘菌纲(Pezizomycetes)、伞菌纲(Agaricomycetes)、酵母菌(Saccharomycetes)和担子菌纲(Blastocladiomycetes) (图 2-B)。不同产地的土样中真菌菌群分布有差异,其中宁夏中宁、宁夏兴仁和新疆精河菌群结构相似,子囊菌门和接合菌门占总菌群的80%左右,而青海格尔木除了子囊菌门占58%外,壶菌门和新丽鞭毛菌门远远高于其他3个地区,比例占总菌群的近25%。4个样本的core microbiome共包含323个OTUs,其主要物种分类信息和核心微生物见表 5所示,主要是镰刀菌属、赤霉菌属、蛇形虫草属和球囊霉科等。
|
| 图 2 样品的群落分布图 Figure 2 Distribution of major phylum and class in the samples of soil around root of Lycium barb arum L. A: community distribution of major phylum; B: community distribution of class. |
| OTUs of Cover all samples | Level | Taxonomy | OTUs of Cover all samples | Level | Taxonomy |
| Otu3790 | genus | g_Fusarium | Otu3828 | genus | g_Fusarium |
| Otu3803 | genus | g_Fusarium | Otu3832 | genus | g_Gibberella |
| Otu3805 | genus | g_Fusarium | Otu3833 | genus | g_Ophiocordyceps |
| Otu3806 | genus | g_Fusarium | Otu3836 | genus | g_Fusarium |
| Otu3815 | genus | g_Fusarium | Otu3838 | order | o_Microascales |
| Otu3818 | class | c_Incertae | Otu3848 | genus | g_Fusarium |
| Otu3824 | genus | g_Fusarium | Otu3855 | genus | g_Gibberella |
| Otu3826 | genus | g_Fusarium | Otu3889 | family | f_Glomeraceae |
2.4 枸杞根际土壤真菌生物多样性分析 2.4.1 单个样品复杂性分析: 4个样品的Alpha多样性指数,Shannon index、Chao1 index、Phylogenetic dive rsity (PD,whole tree)和observed number of species四个指数见表 6所示。丰富度方面(Chao1表示),宁夏兴仁 > 青海格尔木 > 宁夏中宁 > 新疆精河。多样性方面(Shannon指数表示),宁夏兴仁 > 青海格尔木 > 新疆精河 > 宁夏中宁。
| #Alpha | Chao1 | Goods_coverage | Observed_species | PD_whole_tree | Shannon |
| NX.Z | 1366.865 | 0.995316 | 1106 | 24.25838 | 5.059734 |
| NX.X | 1631.879 | 0.995316 | 1453 | 21.99762 | 6.950555 |
| QH.G | 1567.299 | 0.994637 | 1270 | 18.99822 | 6.288257 |
| XJ.J | 1345.503 | 0.996144 | 1175 | 16.58024 | 6.435677 |
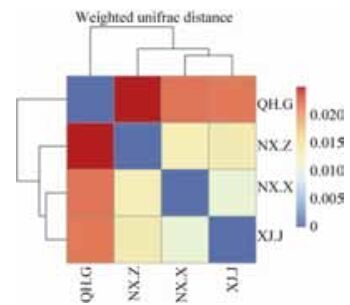
2.4.2 样品间复杂度比较分析: Beta多样性(Beta diversity)分析表明宁夏兴仁和新疆精河地区枸杞根际土壤中真菌菌群组成最相似,与青海格尔木差异较大。通过对UniFrac结果的聚类(图 3),宁夏兴仁和新疆精河地区聚类在一起,反映其枸杞根际土壤中真菌菌群的相似性高。
|
| 图 3 加权UniFrac的heatmap图 Figure 3 Weighted Unirac Distance in four samples of soil root of Lycium barbarum L. |
2.5 OTU水平的cluster (样品聚类)
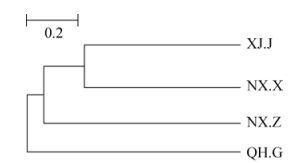
根据每个样品OTU的组成情况的聚类分析,可以展示各个样品之间的关系,组成越相似的样品,聚类的关系越近。图 4是基于OTU丰度的样品聚类,结果表明宁夏兴仁和新疆精河地区OTU水平相似,与青海格尔木地区枸杞根际真菌菌群的相似性较低。
|
| 图 4 基于OTU的样本树状聚类图 Figure 4 Cluster tree based on the OTU. Scale bar represents 20% estimated distance. |
2.6 差异菌属水平NMDS分析结果
NMDS分析(Nonmetric Multidimensional Scaling),即非线性多维标度分析,常用于比对样本组之间的差异。4个样品有差异的门水平NMDS图如图 5所示,样品点的排布代表了样本与样本之间的相似度的程度,而箭头与样本之间的夹角表明菌种和样本的相关程度,夹角越小相关程度越高。可见兴仁和精河两地相似度最高。

|
| 图 5 基于有差异门的NMDS分析 Figure 5 NMDS analysis based on the major different phylum. |
2.7 CCA分析结果
对枸杞根际土壤真菌群落结构和土壤性质及枸杞有效成分含量的典范对应分析结果如图 6所示。结果表明,宁夏兴仁和新疆精河地区枸杞根际土壤的真菌群落结构与其根际土壤中速效磷(图 6-C)、全盐(图 6-A)和枸杞类胡萝卜素含量(图 6-D)呈极显著正相关,与速效钾和速效氮也呈正相关,但影响效果不显著(图 6-C)。从排序图可以看出,枸杞根际土壤中全盐(其中钾盐)和速效磷含量与其真菌菌群相关性密切。而微生物菌群可能与速效肥料的转化相关。

|
| 图 6 枸杞根际真菌菌群多样性和土壤化学性质、主要有效成分的典范对应分析结果 Figure 6 Canonical correspondence analysis for soil chemical properties, main active ingredients and microbial diversity of soils. A: canonical correspondence analysis (CCA) for pH, total salt, organic mater and microbial diversity of soils; B: CCA for total N, P, K and microbial diversityof soils; C: CCA for available N, P, K and microbial diversity of soils; D: CCA for major medicinal ingredients and microbial diversityof soils. |
3 结论和讨论
枸杞根际土壤样品真菌物种组成丰富,不同地区枸杞根际土壤真菌种群结构有一定差异。在宁夏兴仁、青海格尔木、宁夏中宁、新疆精河4个地区中,与宁夏兴仁地区枸杞根际土壤真菌种群结构的相似性最高的是新疆精河,其次是宁夏中宁,相似性最低的是青海格尔木地区。枸杞根际土壤理化性质影响其中的真菌菌群,进而真菌群落可能进一步影响枸杞品质。本实验CCA分析显示枸杞主要有效成分与其根际土壤微生物菌群结构有一定的相关性。
道地药材主要的药用价值在于其次生代谢产物的种类,有关次生代谢产物与根际微生物的相互作用的研究显得非常重要。根际微生物的生长及代谢活动极其旺盛,可加快固化的无机形态的P、K矿物元素和有机P、K矿物元素的有效分解与释放,促进土壤中固化P、K等植物营养元素的有效性以及植物的吸收[29]。李凤霞等[30]从宁夏枸杞(Lycium barbarum L.)根际微环境中分离得到4株具有较强溶P能力的菌株NQ1、NQ2、NQ3和NQ4,并且其中菌株NQ2对无机P的溶P强度达到最强,高达91.2 μg/mL。贝盏临等[31-32]利用无氮培养基和无机培养基从宁夏枸杞根际分离出具有固氮能力的自生固氮菌47株,并筛选获得具有解磷功能的菌株46株,并通过进一步筛选获得固氮且溶解无机磷能力较强的菌株1株。罗青等[33]研究了施加NutriSmart生态型微肥料对枸杞产量的影响,研究结果表明,微生物肥料可以提高枸杞产量和品质[9]。
菌根真菌作为特殊的土壤微生物种群,与植物根微系可形成菌根共生体,促进植物生长[34-35]。菌根的物理生理特性及其与干旱地区微生态修复问题的对应性可使菌根的利用程度加大,能够克服黄土高原植被恢复工程中气候干旱、土壤表层缺水、土壤贫瘠和偏碱等障碍因素。当然,在枸杞共生真菌研究方面也取得了较大的进展,Wang等[36]和He等[37]对大量文献进行综述表明枸杞(Lycium barbarum L.)可形成AM菌根,本研究中也发现来自宁夏中宁、宁夏兴仁、新疆精河、青海格尔木4个样品中均发现存在可形成AM菌根球囊菌门(Glomeromycota)真菌,说明枸杞AM菌根的形成是比较普遍的现象。
| [1] |
Xing HQ, Xiao ZW, Yan JZ, Ma JC, Meng Y. Effects of continuous cropping of maize on soil microbes and main soil nutrient. Pratacultural Science, 2011, 28(10): 1777-1780.
(in Chinese) 邢会琴, 肖占文, 闫吉智, 马建仓, 孟嫣. 玉米连作对土壤微生物和土壤主要养分的影响. 草业科学, 2011, 28(10): 1777-1780. |
| [2] |
Jiang S, Duan JA, Qian DW, Yan H, Yu G. Effects of microbes in plant rhizosphere on geoherbalism. Soils, 2009, 41(3): 344-349.
(in Chinese) 江曙, 段金廒, 钱大玮, 严辉, 于光. 根际微生物对药材道地性的影响. 土壤, 2009, 41(3): 344-349. |
| [3] |
Sun K, Zhang H, Chen W, Chen XL, Ma RJ. Review on the geo-herbalism of medicinal plant by DNA molecular markers. Journal of Northwest Normal University (Natural Science), 2003, 39(3): 100-103.
(in Chinese) 孙坤, 张辉, 陈纹, 陈学林, 马瑞君. 应用DNA分子遗传标记研究药用植物道地性的进展. 西北师范大学学报(自然科学版), 2003, 39(3): 100-103. |
| [4] |
Zhang ZG, An W. Research progress on cultivation techniques of Lycium barbarum L. Anhui Agricultural Science Bulletin, 2012, 18(3): 46, 48.
(in Chinese) 张振国, 安巍. 枸杞栽培技术的研究进展. 安徽农学通报, 2012, 18(3): 46, 48. |
| [5] |
An W, Zhang HX, He J, Li XY, Fan YF. Progress and prospects of wolfberry breeding. Northern Horticulture, 2009(5): 125-128.
(in Chinese) 安巍, 章惠霞, 何军, 李晓莺, 樊云芳. 枸杞育种研究进展. 北方园艺, 2009(5): 125-128. |
| [6] |
Zheng GQ, Ma HW, Xu X. The relationship between the accumulation of salt ions and betaine, and the photosynthesis in leaves of Lycium barbarum L. under salt stress. Chinese Journal of Eco-Agriculture, 2003, 11(3): 51-54.
(in Chinese) 郑国琦, 马宏玮, 许兴. 盐胁迫下宁夏枸杞盐分与甜菜碱累积及其与光合作用的关系. 中国生态农业学报, 2003, 11(3): 51-54. |
| [7] |
Xu X, Zheng GQ, Zhou T, Hui HX. Research on character of physiology and biochemistry and salt-tolerance of wolfberry in Ochr-Sierozems soil of Ningxia. Chinese Journal of Eco-Agriculture, 2002, 10(3): 70-73.
(in Chinese) 许兴, 郑国琦, 周涛, 惠红霞. 宁夏枸杞耐盐性与生理生化特征研究. 中国生态农业学报, 2002, 10(3): 70-73. |
| [8] |
Hou XQ, Zhu WF, Qu W, Feng F. Advances in studies on chemical constituents in lycium medicinal Plants and their pharmacological activities. Strait Pharmaceutical Journal, 2016, 28(8): 1-7.
(in Chinese) 侯学谦, 祝婉芳, 曲玮, 冯锋. 枸杞化学成分及药理活性研究进展. 海峡药学, 2016, 28(8): 1-7. |
| [9] |
Zhu YX, Han XH, Wu DP, Wu H, Li ZQ. The advances of the genuineness of Lyceum bararum L. and rhizosphere microorganism. Chinese Agricultural Science Bulletin, 2013, 29(34): 40-43.
(in Chinese) 朱永兴, 韩学宏, 武东坡, 吴昊, 李占清. 枸杞道地性与其根际微生物的研究进展. 中国农学通报, 2013, 29(34): 40-43. DOI:10.11924/j.issn.1000-6850.2013-1006 |
| [10] |
Yan FK, Xu X, Zhou T, Wei YQ, Zhang ZP. Review and prospect the genuineness of Lycium barbarum L. from Ningxia. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2007, 28(2): 42-45.
(in Chinese) 严奉坤, 许兴, 周涛, 魏玉清, 张自萍. 宁夏枸杞道地性研究回顾与展望. 云南中医中药杂志, 2007, 28(2): 42-45. |
| [11] | Cho JC, Giovannoni SJ. Cultivation and growth characteristics of a diverse group of oligotrophic marine Gammaproteobacteria. Applied and Environmental Microbiology, 2004, 70(1): 432-440. DOI:10.1128/AEM.70.1.432-440.2004 |
| [12] | Gilbert JA, Field D, Huang Y, Edwards R, Li WZ, Gilna P, Joint I. Detection of large numbers of novel sequences in the metatranscriptomes of complex marine microbial communities. PLoS One, 2008, 3(8): e3042. DOI:10.1371/journal.pone.0003042 |
| [13] | Qin JJ, Li RQ, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li JH, Xu JM, Li SC, Li DF, Cao JJ, Wang B, Liang HQ, Zheng HS, Xie YL, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le PD, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu HM, Yu C, Li ST, Jian M, Zhou Y, Li YR, Zhang XQ, Li SG, Qin N, Yang HM, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J, MetaHIT Consortium, Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [14] | Yatsunenko T, Rey FE, Manary MJ, Trehan I, Dominguez-Bello MG, Contreras M, Magris M, Hidalgo G, Baldassano RN, Anokhin AP, Heath AC, Warner B, Reeder J, Kuczynski J, Caporaso JG, Lozupone CA, Lauber C, Clemente JC, Knights D, Knight R, Gordon JI. Human gut microbiome viewed across age and geography. Nature, 2012, 486(7402): 222-227. |
| [15] | Teixeira LCRS, Peixoto RS, Cury JC, Sul WJ, Pellizari VH, Tiedje J, Rosado AS. Bacterial diversity in rhizosphere soil from Antarctic vascular plants of Admiralty Bay, maritime Antarctica. The ISME Journal, 2010, 4(8): 989-1001. DOI:10.1038/ismej.2010.35 |
| [16] | Urich T, Lanzén A, Qi J, Huson DH, Schleper C, Schuster SC. Simultaneous assessment of soil microbial community structure and function through analysis of the meta-transcriptome. PLoS One, 2008, 3(6): e2527. DOI:10.1371/journal.pone.0002527 |
| [17] | 国家林业局. LY/T 1239-1999森林土壤pH值的测定. 北京: 中国标准出版社, 1999. |
| [18] | 国家林业局. LY/T 1228-1999森林土壤全氮的测定. 北京: 中国标准出版社, 1999. |
| [19] | 国家林业局. LY/T 1232-1999森林土壤全磷的测定. 北京: 中国标准出版社, 1999. |
| [20] | 国家林业局. LY/T 1234-1999森林土壤全钾的测定. 北京: 中国标准出版社, 1999. |
| [21] | 国家林业局. LY/T 1251-1999森林土壤水溶性盐分分析. 北京: 中国标准出版社, 1999. |
| [22] | 国家林业局. LY/T 1233-1999森林土壤有效磷的测定. 北京: 中国标准出版社, 1999. |
| [23] | 国家林业局. LY/T 1229-1999森林土壤水解性氮的测定. 北京: 中国标准出版社, 1999. |
| [24] | 国家林业局. LY/T 1236-1999森林土壤速效钾的测定. 北京: 中国标准出版社, 1999. |
| [25] | 中华人民共和国农业部. NY/T 1121. 6-2006土壤检测第6部分: 土壤有机质的测定. 北京: 中国农业出版社, 2006. |
| [26] | 中华人民共和国农业部. NY/T 1676-2008食用菌中粗多糖含量的测定. 北京: 中国农业出版社, 2008. |
| [27] | 中华人民共和国农业部. NY/T 1746-2009甜菜中甜菜碱的测定比色法. 北京: 中国农业出版社, 2009. |
| [28] | 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 5009.83-2003食品中胡萝卜素的测定.北京:中国标准出版社, 2004. |
| [29] | Marschner P, Crowley D, Yang CH. Development of specific rhizosphere bacterial communities in relation to plant species, nutrition and soil type. Plant and Soil, 2004, 261(1/2): 199-208. DOI:10.1023/B:PLSO.0000035569.80747.c5 |
| [30] |
Li FX, Liang JX, Zhou T. Isolation and analysis on ability of phosphate dissolving bacteria in rhizosphere of Lycium barbarum in Ningxia. Journal of Plant Resources and Environment, 2006, 15(2): 29-32.
(in Chinese) 李凤霞, 梁锦绣, 周涛. 宁夏产枸杞根际溶磷菌分离及溶磷能力分析. 植物资源与环境学报, 2006, 15(2): 29-32. |
| [31] |
Bei ZL, Ren X, Lei Q, Han PJ. Study on isolating and selecting nitrogen fixation bacteria in rhizosphere of Lycium barbarum L. in Ningxia. Journal of Anhui Agricultural Sciences, 2010, 38(2): 582-583.
(in Chinese) 贝盏临, 任贤, 雷茜, 韩培杰. 宁夏产枸杞根际固氮菌分离筛选研究. 安徽农业科学, 2010, 38(2): 582-583. |
| [32] |
Bei ZL, Ren X, Lei Q, Han PJ. Isolation and slection on ability of nitrogen fixation bacteria and phosphate dissolving bacteria in rhizosphere of Lycium barbarum L. in Ningxia. Guangdong Agricultural Sciences, 2010, 37(5): 176-177.
(in Chinese) 贝盏临, 任贤, 雷茜, 韩培杰. 宁夏枸杞根际固氮解磷菌的分离研究. 广东农业科学, 2010, 37(5): 176-177. |
| [33] |
Luo Q, Li XY, He J, Wu PJ, Bei ZL, Qu L, Cao YL. Preliminary study on effect of the eco-fertilizer NutriSmart on the yield and quality of Lycium barbarum L.. Northern Horticulture, 2007, 9: 39-40.
(in Chinese) 罗青, 李晓莺, 何军, 巫鹏举, 贝盏临, 曲玲, 曹有龙. NutriSmart生态型肥料对枸杞产量与品质的影响. 北方园艺, 2007, 9(9): 39-40. |
| [34] | Yang HX, Guo SX, Liu RJ. Characteristics of arbuscular mycorrhizal fungal diversity and functions in saline-alkali land. Chinese Journal of Applied Ecology, 2015, 26(1): 311-320. |
| [35] | Shu B, Li WC, Liu LQ, Wei YZ, Shi SY. Transcriptomes of arbuscular mycorrhizal fungi and litchi host interaction after tree girdling. Front Microbiology, 2016, 7: 408. |
| [36] | Wang B, Qiu YL. Phylogenetic distribution and evolution of mycorrhizas in land plants. Mycorrhiza, 2006, 16(5): 299-363. DOI:10.1007/s00572-005-0033-6 |
| [37] | He XH, Duan YH, Chen YL, Xu MG. A 60-year journey of mycorrhizal research in China:past, present and future directions. Science China Life Sciences, 2010, 53(12): 1374-1398. DOI:10.1007/s11427-010-4096-z |
 2017, Vol. 57
2017, Vol. 57




