中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郑元博, 张秀娟, 许敏, 姜男, 彭向雷, 付远辉, 郑妍鹏, 洪涛, 何金生. 2017
- Yuanbo Zheng, Xiujuan Zhang, Min Xu, Nan Jiang, Xianglei Peng, Yuanhui Fu, Yanpeng Zheng, Tao Hong, Jinsheng He. 2017
- 可用于辅助蛋白功能研究的人呼吸道合胞病毒双顺反子微型基因组的构建及拯救
- Construction and application of dicistronic minigenome of human respiratory syncytial virus
- 微生物学报, 57(7): 1004-1013
- Acta Microbiologica Sinica, 57(7): 1004-1013
-
文章历史
- 收稿日期:2016-09-23
- 修回日期:2017-01-08
- 网络出版日期:2017-02-21
人呼吸道合胞病毒(human respiratory syncytial virus,RSV)是导致婴幼儿罹患下呼吸道疾病的重要原因,症状常表现为支气管炎和肺炎[1]。全球每年有340万儿童因RSV感染而住院治疗,6万-20万儿童死亡[2]。同时,RSV也可导致老年人及免疫力低下者发病甚至死亡[3]。在美国,每年用于治疗RSV相关疾病的直接花销超过10亿美元,而在发展中国家,患儿则易因得不到及时救治而死亡[4-5]。我国学者的研究表明,因感染而住院治疗的婴儿,人均治疗费用约为571.8美元[6]。因此,RSV感染在世界范围内带来了巨大的社会经济负担。
RSV属于副黏病毒科肺病毒属,病毒颗粒由病毒包膜包裹核衣壳,核衣壳则由核蛋白和病毒基因组紧密结合而成,病毒基因组为15.2 kb的单股负链RNA,携带10个亚基因组,编码11种蛋白,包括3种包膜糖蛋白(G、F和SH)、1种基质蛋白(M)、2种非结构蛋白(NS1和NS2)、1种RNA调节因子(M2-2) 以及4种在基因组的复制和转录过程起关键作用的核衣壳蛋白(N、P、L和M2-1)[7-8]。大聚合酶蛋白(large polymerase protein,L)是RSV的RNA聚合酶,并且其能够为mRNA加帽和加尾。核蛋白(nucleoprotein,N)与病毒基因组RNA特异性结合形成核衣壳,其C末端区域可释放出来,与磷蛋白(phosphoprotein,P)的C末端相互作用暴露病毒基因组,在P蛋白的牵引下,L蛋白得以结合RSV的基因组RNA,开始病毒mRNA合成的过程。转录延长因子(M2 ORF 1 protein,M2-1) 对于病毒基因组转录的起始不是必需的,但是它能够阻止在基因内部和基因间发生的转录终止现象,以形成完整的mRNA及各亚基因组mRNA[9]。因此,N、P、L和M2-1蛋白是RSV复制必需的4种功能蛋白,又称聚合酶蛋白,在RSV的反向遗传学操作中,常被称为辅助蛋白(helper proteins)。
负链RNA病毒反向遗传学技术是通过构建并拯救病毒基因组或反基因组感染性cDNA克隆,获得感染性病毒。在拯救感染性cDNA以获得重组RSV时,需要利用某些细胞株(如BSR T7/5细胞[10]或BHK-T7细胞[11]等)或痘苗病毒安卡拉株(MVA-T7)[12-14]提供T7 RNA聚合酶,特异性识别从感染性cDNA 5'端侧翼插入的T7启动子,转录产生病毒的基因组或反基因组RNA,并经转录产生的侧翼插入的锤头状核酶或丁型肝炎核酶(HDV ribozyme/HDV Rz)切割,得到具有准确末端的病毒基因组或反基因组RNA。在由共转染的辅助蛋白质粒表达的N、P、L和M2-1四种辅助蛋白的辅助下,像自然感染一样,完成mRNA转录、表达、基因组复制和包装等过程,产生重组病毒。因此,利用该技术和分子生物学技术的结合,使得改造或修饰RSV基因组及获得重组RSV成为现实[15]。已有多个实验室通过该技术成功获得了重组RSV,并成功应用于如减毒活疫苗开发和抗病毒药物筛选[16-17]等领域。
RSV微型基因组仅将RSV基因组的3'端前导区(Leader)和5'端尾随区(Trailer)保留,用编码报告基因的cDNA替换编码RSV病毒蛋白基因,并在编码报告基因的侧翼保留RSV的基因起始(GS,gene start)和基因终止(GE, gene end)序列[18]。在微型基因组的5'端侧翼插入T7启动子,3'端侧翼插入T7终止子,构建出微型基因组cDNA克隆。由于其结构相对简单,用于病毒基因组复制机制和抗病毒药物筛选等方面的研究具有很强的实用性[19-20]。
如果微型基因组中含有两个ORF,则称为双顺反子微型基因组,已用于RSV的基因间序列和NS1蛋白功能等的研究[21-24],尚未见以EGFP作为报告基因,开展RSV双顺反子微型基因组拯救的相关研究。
对含有上、下游2个基因的双顺反子微型基因组来说,如果报告基因位于下游,那么RSV的L聚合酶在识别位于下游的报告基因的GS序列开始转录之前,需先完成上游基因的转录,在上游基因转录结束后,多数L聚合酶会识别上游基因的GE序列中的终止信号而终止转录,仅会有少量的L聚合酶因随机结合下游基因的GS序列开始报告基因的转录,使得下游报告基因的转录效率大大降低。因此双顺反子微型基因组更接近像RSV病毒等含有多个亚基因组的病毒基因组复制时的真实情况,可以更好的模拟病毒基因组进行拯救或病毒拯救中聚合酶蛋白或辅助蛋白的功能研究(图 1)。

|
| 图 1 人呼吸道合胞病毒双顺反子微型基因组拯救及表达原理示意图 Figure 1 Schematic diagram of rescue and expression of RSV dicistronic minigenome. A: structure of RSV-EGFP dicistronic transcription cassette. The synthesized transcription cassette includes cDNA of RSV-EGFP dicsitronic minigenome and the flanking sequences of T7 promoter, Hammerhead Rz, HDV Rz and T7 terminator. The cDNA encoding RSV-EGFP dicistronic minigenome comprises leader region, GS (gene start sequence), NC1 (non-coding sequence of NS1 gene), ORF1 encoding nonfunctional pseudo-virus protein, NC2 (non-coding sequence of M gene), GE (gene end sequence), GS, NC3 (non-coding sequence of NS1 gene), EGFP gene, NC4 (non-coding sequence of L gene), GE and trailer region in 5' to 3' order; The encoding genes of EGFP and ORF1, respectively, in this transcription cassette are synthesized in reverse complementary copy; The cDNA encoding discistronic minigenome and the flanking ribozymes are transcribed by T7 RNP (T7 RNA polymerase). B: the resulting product of negative-sense RSV-EGFP dicistronic minigenome following the transfection of pBR322B-RSV-EGFP, plasmid encoding the transcription cassette, into BHK-T7 cells (not shown here) by T7 RNP. C: the transcribed mRNAs of ORF1 and EGFP by the co-transfected plasmids encoding helper proteins. D: the expressed nonfunctional pseudo-virus proteins and EGFP proteins. |
本研究基于T7启动子表达系统、以EGFP为报告基因的单顺反子微型基因组研究[25],通过插入一个可表达无生物活性的、由RSV NS1和M部分基因序列组成的ORF,获得以EGFP为报告基因的双顺反子微型基因组及其重组质粒,并分别与编码上述参与RSV复制的4种辅助蛋白的辅助质粒共转染至BHK-T7细胞,观察EGFP的表达并对EGFP mRNA转录水平进行定量分析,以期验证4种辅助蛋白在微型基因组拯救中的作用,尤其是M2-1抑制转录终止、促进亚基因组转录的功能。本研究也将有助于提高重组RSV的拯救效率,为成功拯救重组RSV病毒积累实践经验。
1 材料和方法 1.1 质粒与细胞质粒pBR322B、pcDNA3.1-N-OPT、pcDNA3.1-P-OPT、pcDNA3.1-M2-1-OPT和pcDNA3.1-L-OPT为本实验室保存。BHK-T7细胞由中国疾病预防控制中心病毒病预防控制所朱武洋教授馈赠。
1.2 实验试剂质粒小提试剂盒和胶回收试剂盒均购自Omega公司,EndoFree Plasmid Mega Kits购自Qiagen公司,转染试剂Lipo 2000购自Invitrogen公司,T4连接酶和GoScript反转录试剂盒购自Promega公司,限制性内切酶购自NEB公司。PrimeSTAR聚合酶和核酸电泳Marker均购自TaKaRa公司。DMEM培养基以及FBS (胎牛血清)购自Gibco公司,细胞培养用耗材均为Corning公司产品。SuperReal qPCR PreMix (SYBR Green)试剂盒购自天根公司。
1.3 可表达EGFP的RSV双顺反子微型基因组cDNA的构建及鉴定委托上海生工公司全基因合成编码EGFP的RSV-EGFP单顺反子微型基因组cDNA,从5'端至3'端分别是:5'-T7启动子-Hammerhead Rz (锤头核酶)-Trailer-GE(L)-NC4(L)-EGFP-NC3(NS1)-GS (NS1)-Leader-HDV Rz (丁型肝炎核酶)-T7终止子-3',并克隆至pUC57质粒,其中EGFP基因为其编码基因的反向互补序列,该重组质粒命名为pUC57-RSV-EGFP。利用EcoRⅠ和Hind Ⅲ酶切位点将RSV-EGFP微型基因组cDNA克隆至载体pBR322B上获得重组质粒pBR322B-RSV-EGFP。同时合成一段病毒假蛋白的基因序列ORF1 cDNA,以及在其3'端侧翼插入的Leader、HDV Rz序列和T7终止子,并克隆至pUC57载体上获得重组质粒pUC57-RSV-ORF1,其中ORF1由RSV的NS1基因靠近病毒基因组3'端的一部分和M基因靠近病毒基因组5'端的一部分融合而成,长度约为1000 bp。该段基因组从5'端至3'端的顺序是:5'-GE(M)-NC2(M)-ORF1(-)-NC1(NS1)-GS(NS1)-Leader-HDV Rz-T7终止子-3',其中ORF1基因为其编码基因的反向互补序列。利用HpaⅠ和Hind Ⅲ于37 ℃下双酶切pUC57-RSV-ORF1和pBR322BRSV-EGFP。体系如下:pUC57-RSV-ORF1/pBR322BRSV-EGFP 10 μL;10×CutSmart Buffer 5 μL;HpaⅠ 1 μL;Hind Ⅲ 1 μL;ddH2O 33 μL,反应总体积50 μL,混匀,37 ℃下温育4 h。经连接、转化等,获得质粒pBR322B-RSVⅡ-EGFP,即含有可表达EGFP的RSV双顺反子微型基因组转录盒的质粒(图 2)。送北京华大基因有限公司测序鉴定。
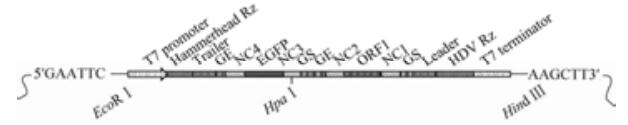
|
| 图 2 RSV-EGFP双顺反子微型基因组转录盒 Figure 2 Transcription cassette of RSV-EGFP dicistronic minigenome. |
1.4 拯救RSV双顺反子微型基因组并检测EGFP基因的表达
转染前1 d,转BHK-T7细胞至6孔板,次日,待丰度为80%左右时,换无血清培养液进行转染。加入pBR322B-RSVⅡ-EGFP和仅缺少M2-1辅助质粒的转染孔为实验组A,加入pBR322BRSVⅡ-EGFP和包含M2-1的4种辅助质粒的转染孔为实验组B,其余为对照孔,转染体系见表 1。37 ℃孵育,转染后24 h和48 h在荧光显微镜下观察EGFP表达情况。
| Group | Plasmid/μg | |||||
| pcDNA3.1-N-OPT | pcDNA3.1-P-OPT | pcDNA3.1-L-OPT | pcDNA3.1-M2-1-OPT | pBR322B-RSV Ⅱ-EGFP | Transfection reagent/μL | |
| Experimental Group A | 1 | 1 | 0.5 | - | 1.25 | 7.5 |
| Experimental Group B | 1 | 1 | 0.5 | 0.25 | 1.25 | 8.0 |
| Control Group C | 1 | 1 | - | 0.25 | 1.25 | 7.0 |
| Control Group D | 1 | - | 0.5 | 0.25 | 1.25 | 6.0 |
| Control Group E | - | 1 | 0.5 | 0.25 | 1.25 | 6.0 |
| Control Group F | - | - | - | - | 1.25 | 2.5 |
1.5 RT-qPCR定量分析RSV-EGFP双顺反子基因组EGFP的转录水平
转染方法和转染体系参考1.4和表 1。转染后24 h使用TRIzol试剂提取细胞总RNA,按PromegaGoScript反转录试剂盒说明进行RT-PCR。设计扩增EGFP mRNA的qPCR引物F1 (589-608 nt):5'-CCCGACAACCACTACCTGAG-3';R1 (705-686 nt):5'-GTCCATGCCGAGAGTGATCC-3'。设计扩增GAPDH mRNA的内参引物:F0 (83-103 nt):5'-AG GTCGGTGTGAACGGATTTG-3';R0 (183-205 nt):5'-TGTAGACCATGTAGTTGAGGTCA-3' (引物由北京华大基因有限公司合成)。设置qPCR体系:1个循环:95 ℃,15 min;40个循环:95 ℃,10 s,60 ℃,20 s。
1.6 统计学分析qPCR结束后,导出Ct值和Tm值等数据,使用2-(ΔΔCt)法处理数据,并通过双尾T检验进行统计分析。P < 0.05为差异有显著性。
2 结果和分析 2.1 全基因合成编码EGFP的RSV-EGFP单顺反子微型基因组cDNA及其重组质粒pBR322B-RSV-EGFP的构建和鉴定以EcoRⅠ和Hind Ⅲ酶切pUC57-RSV-EGFP和pBR322B质粒,经连接、转化及质粒提取,获得pBR322B-RSV-EGFP。用Bgl Ⅱ和HpaⅠ双酶切鉴定pBR322B-RSV-EGFP,得到4748 bp和749 bp的2条特异性条带,条带大小与预期一致(图 3-A)。阳性克隆经测序后证实。

|
| 图 3 pBR322B-RSV-EGFP和pBR322B-RSVⅡ-EGFP质粒的酶切鉴定 Figure 3 pBR322B-RSV-EGFP and pBR322B-RSVⅡ-EGFP identified by restriction endonuclease analysis. M: DL15000 marker; lane 1: pBR322B-RSV-EGFP digested by Bgl Ⅱand HpaⅠ; lane 2: pBR322B-RSVⅡ-EGFP digested by HpaⅠand Hind. Ⅲ. |
2.2 编码EGFP的RSV双顺反子微型基因组质粒pBR322B-RSVⅡ-EGFP的构建及鉴定
以HpaⅠ和Hind Ⅲ双酶切pUC57-RSV-ORF1和pBR322B-RSV-EGFP,经连接、转化及质粒提取,获得pBR322B-RSVⅡ-EGFP。经HpaⅠ和Hind Ⅲ双酶切鉴定,分别产生5197 bp的条带以及1013 bp的条带,各条带大小与预期一致(图 3-B)。阳性克隆经测序后证实。
2.3 可表达EGFP的双顺反子微型基因组的拯救及荧光表达为了解4种辅助蛋白与RSV双顺反子微型基因组中EGFP表达之间的关系,我们将RSV微型基因组质粒与4种辅助质粒进行共转染,并与仅缺少1种辅助质粒的共转染组开展比较研究。实验结果显示,在转染后24 h,pBR322B-RSVⅡ-EGFP与仅缺少M2-1辅助质粒的实验组出现极少量微弱荧光,pBR322B-RSVⅡ-EGFP与包含M2-1的4种辅助质粒的实验组出现大量荧光,其余各组均未观察到荧光;在转染后48 h,pBR322B-RSVⅡ-EGFP与仅缺少M2-1辅助质粒的共转孔中荧光表达数量未观察到明显变化,pBR322B-RSVⅡ-EGFP与包含M2-1的4种辅助质粒共转孔中的荧光表达数量持续增多,其余各组仍未观察到荧光(图 4)。
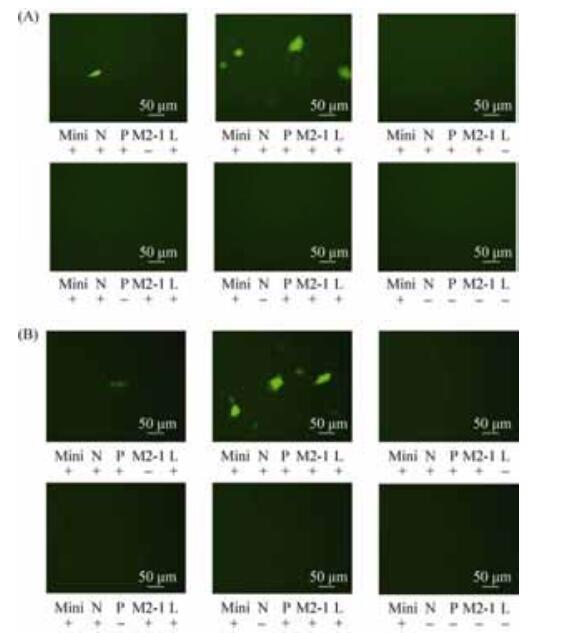
|
| 图 4 RSV双顺反子微型基因组的拯救与EGFP的表达(转染后24 h和48 h) Figure 4 EGFP expressed by co-tansfecting RSV dicistronic minigenome plasmid and helper plasmids in BHK-T7 cells at 24 h (A) and 48 h (B) post co-transfection, respectively (NIKON ECLIPSE TE 2000-S ×400). Mini representing minigenome, N, P, M2-1 and L representing helper plasmids encoding N, P, M2-1 and L proteins, respectively. |
从以上结果可以看出,表达N、P和L蛋白的辅助质粒在双顺反子微型基因组拯救过程中是不可缺少的。而缺少M2-1蛋白的辅助质粒,EGFP可以表达,但相对于包含M2-1的4种辅助质粒的实验组,其表达效率大幅降低。
2.4 RT-qPCR定量检测EGFP mRNA水平为了进一步分析M2-1蛋白对顺反子微型基因组中EGFP表达水平的影响,在上述实验的基础上,我们利用RT-qPCR检测了双顺反子微型基因组EGFP mRNA的水平。实验结果显示,pBR322B-RSV-EGFP与仅缺少M2-1的3种辅助质粒共转染的细胞中EGFP mRNA的表达量显著低于含M2-1的4种辅助蛋白质粒共转染组(P < 0.05) (图 5)。因此,从转录水平的分析表明M2-1蛋白确有促进转录的作用,该功能对RSV等含有多个亚基因组的病毒,顺利实现多个基因的连续转录具有重要作用。

|
| 图 5 RSV-EGFP双顺反子微型基因组的拯救与EGFP mRNA转录水平(转染后48 h) Figure 5 mRNA level of EGFP by co-transfecting RSV-EGFP dicistronic minigenome plamid and helper plasmids in BHK-T7 cells at 48 h post co-transfection. Mini: minigenome; N, P, M2-1 and L: helper plasmids encoding N, P, M2-1 and L proteins, respectively; NC: negative control group. *: P < 0.05. |
3 讨论
本研究通过构建基于T7启动子表达系统、以EGFP为报告基因的RSV双顺反子微型基因组质粒,并与编码4种辅助蛋白的质粒开展了双顺反子微型基因组拯救及EGFP表达水平研究,发现以EGFP为报告基因的RSV双顺反子微型基因组,可方便用于辅助蛋白在RSV拯救中的功能研究,如M2-1蛋白的抑制转录终止和促进亚基因组转录的功能。
RSV的L聚合酶通过基因组3'端的控制基因组转录和复制的前导区——Leader序列引导与基因组结合,启动转录或复制,然后识别每个基因前后的GS和GE序列,逐个转录RSV病毒多个亚基因组产生mRNA进而翻译表达。虽然N、P和L三种蛋白配合启动了转录,但是完成1个亚基因组的转录后,L聚合酶通过识别存在于亚基因组下游的GE中的转录终止信号,会终止转录并脱离基因组。M2-1蛋白是RSV的转录延长因子,它的作用是抑制这种转录终止,促进L蛋白与基因组的结合,使转录能够稳定地持续下去,使各亚基因组的mRNA能被连续地转录出来[13]。
我们曾经在单顺反子微型基因组的拯救实验中观察到转染体系中缺少表达M2-1蛋白的质粒时,拯救是可以成功的,但是拯救效率相对于五质粒共转染的情况有所下降。由于双顺反子微型基因组更贴近于RSV基因组的真实情况,如果把报告基因置于3'端Leader序列的远端,如本研究中的EGPF ORF位于一个编码无功能的病毒假蛋白ORF的下游,会把该下游亚基因组对M2-1蛋白的依赖性表现得更为突出,拯救效率下降的现象会更明显,因此我们构建了双顺反子微型基因组克隆。
结果表明,当使用双顺反子微型基因组质粒与4种辅助质粒共转染时,EGFP荧光表达比较高,而缺少表达M2-1蛋白的辅助质粒时,仅能观察到少量较暗的荧光,而且EGFP mRNA的转录水平明显降低,与4种质粒共转染相比,差异具有显著性。这提示双顺反子微型基因组在缺少M2-1蛋白的情况下,L蛋白确实可以转录到达第2个ORF区,但转录水平大大降低。
Fearns和Collins等曾使用Northern blot的方法对M2-1的功能从转录水平上进行过研究。他们发现,M2-1蛋白的促进转录的作用可以分为两个方面,即转录终止抑制(transcriptional antitermination)[22]和转录延长(transcriptional elongation)[9]。
转录终止抑制作用主要体现在M2-1蛋白使得L聚合酶识别GE的转录终止信号后能够继续转录下游基因,这是一种基因间的终止抑制作用;转录延长作用主要体现在M2-1防止L聚合酶在基因内部的转录过程中提前终止(基因长度越长,转录在基因内部终止的可能性越大),这是一种基因内部的终止抑制作用。对于包含2个ORF双顺反子微型基因组,M2-1不仅要抑制双顺反子微型基因组基因内部的转录终止还要抑制其基因间的转录终止以保证L聚合酶能转录下游基因,因此如果缺少M2-1,完整转录双顺反子微型基因组的下游报告基因是非常困难的。
本实验用携带EGFP报告基因的双顺反子微型基因组,从蛋白翻译和mRNA转录水平验证了辅助蛋白、尤其是M2-1在拯救过程中的重要作用,所构建的双顺反子微型基因组可进一步应用于RSV病毒基因组转录和复制机制的研究,并可为重组RSV拯救条件的优化提供帮助。
| [1] | Collins PL, Graham BS. Viral and host factors in human respiratory syncytial virus pathogenesis. Journal of Virology, 2008, 82(5): 2040-2055. DOI:10.1128/JVI.01625-07 |
| [2] | Nair H, Nokes DJ, Gessner BD, Dherani M, Madhi SA, Singleton RJ, O'Brien KL, Roca A, Wright PF, Bruce N, Chandran A, Theodoratou E, Sutanto A, Sedyaningsih ER, Ngama M, Munywoki PK, Kartasasmita C, Simões EA, Rudan I, Weber MW, Campbell H. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children:a systematic review and meta-analysis. The Lancet, 2010, 375(9725): 1545-1555. DOI:10.1016/S0140-6736(10)60206-1 |
| [3] | Falsey AR. Respiratory syncytial virus infection in elderly and high-risk adults. Experimental Lung Research, 2005, 31(Suppl 1): 77. |
| [4] | Johnson TR, Rangel D, Graham BS, Brough DE, Gall JG. Genetic vaccine for respiratory syncytial virus provides protection without disease potentiation. Molecular Therapy, 2014, 22(1): 196-205. DOI:10.1038/mt.2013.142 |
| [5] | Rodriguez R, Ramilo O. Respiratory syncytial virus:how, why and what to do. Journal of Infection, 2014, 68: S115-S118. DOI:10.1016/j.jinf.2013.09.021 |
| [6] | Zhang T, Zhu Q, Zhang X, Ding Y, Steinhoff M, Black S, Zhao G. Clinical characteristics and direct medical cost of respiratory syncytial virus infection in children hospitalized in Suzhou, China. The Pediatric Infectious Disease Journal, 2014, 33(4): 337-341. DOI:10.1097/INF.0000000000000102 |
| [7] | Collins PL, Melero JA. Progress in understanding and controlling respiratory syncytial virus:still crazy after all these years. Virus Research, 2011, 162(1/2): 80-99. |
| [8] | Yu Q, Hardy RW, Wertz GW. Functional cDNA clones of the human respiratory syncytial (RS) virus N, P, and L proteins support replication of RS virus genomic RNA analogs and define minimal trans-acting requirements for RNA replication. Journal of Virology, 1995, 69(4): 2412-2419. |
| [9] | Collins PL, Hill MG, Cristina J, Grosfeld H. Transcription elongation factor of respiratory syncytial virus, a nonsegmented negative-strand RNA virus. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(1): 81-85. DOI:10.1073/pnas.93.1.81 |
| [10] | Hotard AL, Shaikh FY, Lee S, Yan D, Teng MN, Plemper RK, Crowe JE Jr, Moore ML. A stabilized respiratory syncytial virus reverse genetics system amenable to recombination-mediated mutagenesis. Virology, 2012, 434(1): 129-136. DOI:10.1016/j.virol.2012.09.022 |
| [11] | Olivo PD, Collins PL, Peeples ME, Schlesinger S. Detection and quantitation of human respiratory syncytial virus (RSV) using minigenome cDNA and a Sindbis virus replicon:a prototype assay for negative-strand RNA viruses. Virology, 1998, 251(1): 198-205. DOI:10.1006/viro.1998.9419 |
| [12] | Bukreyev A, Camargo E, Collins PL. Recovery of infectious respiratory syncytial virus expressing an additional, foreign gene. Journal of Virology, 1996, 70(10): 6634-6641. |
| [13] | Collins PL, Hill MG, Camargo E, Grosfeld H, Chanock RM, Murphy BR. Production of infectious human respiratory syncytial virus from cloned cDNA confirms an essential role for the transcription elongation factor from the 5' proximal open reading frame of the M2 mRNA in gene expression and provides a capability for vaccine development. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(25): 11563-11567. DOI:10.1073/pnas.92.25.11563 |
| [14] | Yunus AS, Khattar SK, Collins PL, Samal SK. Rescue of bovine respiratory syncytial virus from cloned cDNA:entire genome sequence of BRSV strain A51908. Virus Genes, 2001, 23(2): 157-164. DOI:10.1023/A:1011888019966 |
| [15] | Walpita P, Flick R. Reverse genetics of negative-stranded RNA viruses:a global perspective. FEMS Microbiology Letters, 2005, 244(1): 9-18. DOI:10.1016/j.femsle.2005.01.046 |
| [16] | Karron RA, Wright PF, Belshe RB, Thumar B, Casey R, Newman F, Polack FP, Randolph VB, Deatly A, Hackell J, Gruber W, Murphy BR, Collins PL. Identification of a recombinant live attenuated respiratory syncytial virus vaccine candidate that is highly attenuated in infants. The Journal of Infectious Diseases, 2005, 191(7): 1093-1104. DOI:10.1086/jid.2005.191.issue-7 |
| [17] | Rameix-Welti MA, Le Goffic R, Hervé PL, Sourimant J, Rémot A, Riffault S, Yu Q, Galloux M, Gault E, Eléouët JF. Visualizing the replication of respiratory syncytial virus in cells and in living mice. Nature Communications, 2014, 5: 5104. DOI:10.1038/ncomms6104 |
| [18] | Collins PL, Mink MA, Stec DS. Rescue of synthetic analogs of respiratory syncytial virus genomic RNA and effect of truncations and mutations on the expression of a foreign reporter gene. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(21): 9663-9667. DOI:10.1073/pnas.88.21.9663 |
| [19] | Khattar SK, Yunus AS, Collins PL, Samal SK. Deletion and substitution analysis defines regions and residues within the phosphoprotein of bovine respiratory syncytial virus that affect transcription, RNA replication, and interaction with the nucleoprotein. Virology, 2001, 285(2): 253-269. DOI:10.1006/viro.2001.0960 |
| [20] | Noton SL, Cowton VM, Zack CR, McGivern DR, Fearns R. Evidence that the polymerase of respiratory syncytial virus initiates RNA replication in a nontemplated fashion. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(22): 10226-10231. DOI:10.1073/pnas.0913065107 |
| [21] | Atreya PL, Peeples ME, Collins PL. The NS1 protein of human respiratory syncytial virus is a potent inhibitor of minigenome transcription and RNA replication. Journal of Virology, 1998, 72(2): 1452-1461. |
| [22] | Fearns R, Collins PL. Role of the M2-1 transcription antitermination protein of respiratory syncytial virus in sequential transcription. Journal of Virology, 1999, 73(7): 5852-5864. |
| [23] | Kuo L, Fearns R, Collins PL. The structurally diverse intergenic regions of respiratory syncytial virus do not modulate sequential transcription by a dicistronic minigenome. Journal of Virology, 1996, 70(9): 6143-6150. |
| [24] | Kuo L, Grosfeld H, Cristina J, Hill MG, Collins PL. Effects of mutations in the gene-start and gene-end sequence motifs on transcription of monocistronic and dicistronic minigenomes of respiratory syncytial virus. Journal of Virology, 1996, 70(10): 6892-6901. |
| [25] |
Yuan R, Fu YH, He JS, Jiao YY, Jiang GY, Zhang M, Peng XL, Kan XT. Rescue of the minigenome of human respiratory syncytial virus based on T7 promoter expression system. China Biotechnology, 2013, 33(9): 1-9.
(in Chinese) 袁锐, 付远辉, 何金生, 焦月盈, 蒋桂云, 张梅, 彭向雷, 阚学通. 基于T7启动子表达系统的呼吸道合胞病毒微型基因组的拯救. 中国生物工程杂志, 2013, 33(9): 1-9. |
 2017, Vol. 57
2017, Vol. 57




