中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 许艳蕊, 方志军, 卢晓平, 郝鲁江. 2017
- Yanrui Xu, Zhijun Fang, Xiaoping Lu, Lujiang Hao. 2017
- 基于高通量测序技术分析使它隆对玉米土壤细菌多样性的影响
- Effects of starane on maize soil bacterial diversity analyzed by high-throughput sequencing technology
- 微生物学报, 57(7): 985-993
- Acta Microbiologica Sinica, 57(7): 985-993
-
文章历史
- 收稿日期:2016-09-02
- 修回日期:2016-12-28
- 网络出版日期:2017-01-03
2. 山东省农业科学院玉米研究所, 山东 济南 250100
2. Maize Research Institute, Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong Province, China
玉米是山东省的主要粮食作物,在粮食生产中一直占据着重要的地位。玉米生长期正是杂草生长的旺季,草害面积可达玉米种植面积的90%以上,玉米田施用化学除草剂已十分普遍,被广泛地用于农业生产中控制阔叶杂草和禾本科杂草[1]。由于除草剂具有持久性和高毒性,在土壤、沉积物、地下水等环境中经常发现一些除草剂残留物,不仅对后茬作物造成化学损伤,而且对土壤生态和环境健康构成了潜在的威胁[2]。土壤微生物作为土壤生态系统中的重要组成部分,在改良土壤肥力、维持土壤生态系统的物质循环等方面具有重要的意义[3]。李婉莹等[4]研究表明,除草剂对玉米主要土传病害发生呈现不同程度的影响。很多学者认为,土壤微生物群体可一定程度上抑制作物的土传病害,微生物群落结构越丰富,多样性越高,对抗病原菌的综合能力越强[5-6]。因此研究除草剂对土壤细菌群落的影响,了解除草剂对土壤细菌群落的动态变化,为初步探讨除草剂对玉米植株的健康生长状况、玉米产量及品质的影响奠定基础。
目前,关于除草剂对玉米土壤细菌群落影响的研究主要采用传统培养方法,采用高通量测序技术对其进行研究还未见报道。本研究采用近年来兴起的Illumina MiSeq第二代测序技术,可以提供更直接的检测微生物类群的方法,特别是低丰度物种的变化[7]。相对于传统的纯培养方法及16S rDNA为基础的非培养方法,其能获得大量的数据,检测到传统纯培养和16S rDNA为基础的非培养方法未能发现的低丰度土壤细菌种类。分析使它隆对土壤细菌的群落动态变化,为初步探讨使它隆对玉米植株的健康生长状况、玉米产量及品质的影响奠定基础。
1 材料和方法 1.1 试验材料 1.1.1 供药试剂: 供试除草剂为使它隆(江苏辉丰农化有限公司生产)。 1.1.2 土壤采集与处理: 采集地点是山东省农业科学院玉米研究所龙山试验基地,采集方法为5点取样法取样,土壤表层深度为0-15 cm,土壤样品采集后低温保存带回并置于-80 ℃冰箱备用。试验于玉米3-5叶期时施药,药剂用量参照说明书。药剂处理后的10 d (L2)、60 d (L3) 取样,对照组为L1CK、L2CK、L3CK。1.2 土壤总DNA的提取和16S rRNA基因V4-V5区PCR扩增土样经充分混匀后,各取0.50 g土样,使用OMEGA微生物基因组提取试剂盒(OMEGA公司,美国),按照说明书进行操作,用0.8%的琼脂糖凝胶电泳检测,并用紫外分光光度计检测DNA的浓度和纯度。
1.3 16S rRNA基因V4-V5区PCR扩增以稀释后的基因组DNA (20 ng/μL)为模板,采用16S rRNA基因V4-V5区引物进行扩增,引物序列为515F:5′-GTGCCAGCMGCCGCGG-3′和907R:5′-CCGTCAATTCMTTTRAGTTT-3′[8]。PCR扩增体系(25 μL):5× reaction buffer 5 μL,5× GC buffer 5 μL,dNTPs (100 mmol/L) 5 μL,515F (10 μmol/L) 1 μL,907R (10 μmol/L) 1 μL,DNA 2 μL,ddH2O 6 μL。扩增参数:95 ℃预变性2 min;95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃终延伸5 min,10 ℃保温。扩增PCR产物经琼脂糖电泳检测阳性后,送至上海派森诺生物科技有限公司,用Illumina Miseq高通量测序技术平台进行序列测序和分析。
1.4 数据分析首先对原始数据进行质量过滤和双端序列的连接,应用软件Qiime和Mothur对连接上的序列进行过滤和去除嵌合体[9-10]。然后对得到的优质序列基于97%的相似水平上进行OTU聚类,并利用Greengene数据库进行物种注释。利用Qiime软件绘制稀释曲线,应用软件Mothur中的summary.single命令,计算4种常用的生物多样性指数:Chao、ACE、Shanon和Simpson指数[11-12]。应用软件R对属水平上的分类及物种丰度进行主成分分析(PCA),绘制PCA图。并在各分类水平上进行群落结构的统计分析,得到微生物群落结构组成。
2 结果和分析 2.1 细菌基因组提取结果用OMEGA微生物基因组提取试剂盒提取的基因组DNA如图 1所示,大小为23 kb。并用紫外分光光度计检测DNA的浓度,结果见表 1。
|
| 图 1 土壤样品总DNA的琼脂糖凝胶电泳 Figure 1 Soil samples of total DNA agarose gel electrophoresis. M: λ-DNA/Hind Ⅲ; lane 1: L1CK; lane 2: L2; lane 3: L2CK; lane 4: L3; lane 5: L3CK. |
| Sample No. | Concentration/(ng/pL) |
| L1CK | 27.30 |
| L2 | 46.20 |
| L2CK | 30.90 |
| L3 | 30.90 |
| L3CK | 31.40 |
2.2 测序结果
本研究对5个土壤样品进行了Illumina MiSeq高通量测序,根据结果对序列进行统计,共得到有效序列260940条,过滤后得到167191条优质序列(每个土壤样品平均33438.2条)。通常在97%的相似水平下对序列进行OTU的聚类,统计得到所有样品在不同OTUs中的丰度信息,共产生12656个OTU,每个样品的有效序列数量和OTU数量如表 2所示。5个土壤样品的优质序列长度主要分布在393-400 bp,在396 bp的序列数最多为232476条。细菌16S rDNA V4-V5区的长度为400 bp左右,从序列长度的分布来看,与16S rDNA V4-V5区序列长度大致吻合。
| Simples | Effective numble | High quality sequence | Ratio/% | OTUs number |
| L1CK | 35125 | 21850 | 62.21 | 2171 |
| L2 | 36784 | 26080 | 70.90 | 2498 |
| L2CK | 119799 | 76275 | 63.67 | 3261 |
| L3 | 42130 | 25706 | 61.02 | 2576 |
| L3CK | 27102 | 17280 | 63.76 | 2150 |
2.3 土壤样品取样深度验证
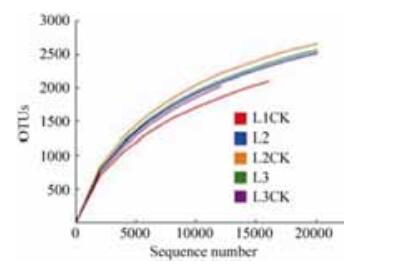
稀释曲线(rarefaction curve)反映了样品的取样深度,可以用来评价测序量是否足以覆盖所有类群[5]。由图 2可知,5个土壤样品的稀释曲线均趋于平缓,说明测序数据合理,能够比较真实地反映土壤样品的细菌群落,但仍有少量细菌种类未被发现。
|
| 图 2 样品稀释曲线 Figure 2 Rarefaction curves for samples. |
2.4 Alpha多样性分析
细菌群落丰富度用Chao指数和ACE指数表示,其值越高表明群落物种的丰富度越高;细菌群落多样性程度用Shannon指数和Simpson指数表示,Shannon指数和Simpson指数越大,说明群落多样性越高。
从表 3可以看出没有用使它隆处理的L1CK-L2CK-L3CK样品的Chao指数和Shannon指数先增后减,说明土壤细菌的丰富度和细菌群落的多样性是先增加后降低最后恢复到原来的水平。10 d后用使它隆处理过的土壤L2的Chao指数和Shannon指数均低于对照组L2CK,60 d后用使它隆处理过的土壤L3的Chao指数和Shannon指数均显著高于对照组L3CK;这一结果表明10 d后用使它隆处理的土壤样品中细菌群落的种群多样性和丰度降低;60 d后用使它隆处理的土壤样品中细菌群落的种群多样性和丰度提高。
| Sample | Chao | ACE | Simpson | Shannon |
| L1CK | 1340 | 1707.881041 | 0.991664943 | 8.563058541 |
| L2 | 1666 | 2223.978931 | 0.993964455 | 9.009622145 |
| L2CK | 1867 | 2934.117354 | 0.995035117 | 9.233419119 |
| L3 | 1727 | 2378.101612 | 0.992415239 | 8.96331966 |
| L3CK | 1287 | 1287 | 0.985202008 | 8.351334235 |
2.5 主成分分析
对PCA主成分分析表明,主成分1(PC1)、主成分2 (PC2) 和主成分3 (PC3) 的样品差异性贡献率分别达到58.42%、33.38%和6.48%,合计达到98.28%,是差异的主要来源。由图 3可知,L2和L2CK位于PC1和PC2的正值区域及PC3的正负两侧,且间隔较远,说明两样品间的主成分变异显著;L3和L3CK位于PC1的负值区域和PC2的正值区域及PC3的正负两侧,间隔较大的位置,说明两样品间的主成分变异显著。这一结果表明使它隆处理使土壤样品的细菌群落分布发生了显著变化。

|
| 图 3 基于属水平的主成分分析(3D-PCA) Figure 3 Based on the genus level of PCA figure. |
2.6 土壤细菌群落分布特征分析 2.6.1 细菌在门水平上的群落组成: 从门的分类水平看(图 4),5个土壤样本中共检测出34个细菌门,酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadete)、浮霉菌门(Planctomycetes)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)共9个细菌门相对丰度较大,其相对丰度之和在5个土壤样品中均占到土壤细菌总量的96%以上。5个土壤样品中的优势菌门均为酸酐菌门、变形菌门、放线菌门、绿弯菌门和芽单胞菌门,这些菌门在L1CK、L2、L2CK、L3和L3CK中分别占细菌总数的88.1%、86.3%、84%、88%和91.9%。对各样品中主要的优势细菌门分析发现,使它隆处理使土壤中细菌群落组成发生明显变化。使它隆处理10 d后酸杆菌门的相对丰度增加,增加了30.8%,放线菌门和绿弯菌门的相对丰度降低,分别降低了24.4%和25.6%;处理60 d后变形菌门的相对丰度降低,降低了17.2%,绿弯菌门的相对丰度增加,增加了4.69%。

|
| 图 4 门水平各样品菌群分布图 Figure 4 Frequence of phylum in microbial communities from samples. |
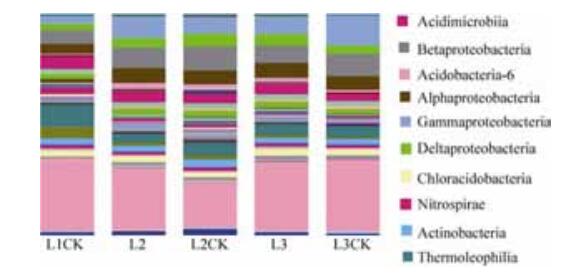
2.6.2 细菌在纲水平上的群落组成: 在纲的分类水平上,共得到95个已知的细菌纲,其中相对丰度较大的是6-酸酐菌纲、β-变形菌纲、γ-变形菌纲、嗜热油菌纲、α-变形菌纲、δ-变形菌纲、硝化螺旋菌纲、放线菌纲、Chloracidobacteria和酸微菌纲等,相对丰度之和在5个土壤样品中占到土壤细菌总量的70%以上。由图 5可以看出,6-酸酐菌纲在5个样品中分布比例最大,从L1CK-L2CK-L3CK,6-酸酐菌纲的分布先降低然后升高基本恢复到原来的水平。使它隆处理的样品与对照相比,优势菌纲(相对丰度>10%)的分布比例发生了变化,处理10 d后,6-酸酐菌纲和γ-变形菌纲的比例增加,分别增加了7.6%和2.3%;β-变形菌纲比例下降,下降了1.4%;处理60 d后,6-酸酐菌纲、β-变形菌纲和γ-变形菌纲的分布降低,分别降低了1.4%、2.3%和5.6%。
|
| 图 5 纲水平各样品菌群分布图 Figure 5 Frequence of class in microbial communities from samples. |
2.6.3 细菌在属水平上的群落组成: 在属的水平上,5个样品中共含有192个属,其中L1CK、L2、L2CK、L3、L3CK分别涉及120、145、170、138和117个属。由图 6可知,使它隆处理的样品和对照组相比,一些菌属的分布发生了变化。对属水平上相对丰度前10位的细菌属分析,由表 4可知,Rhodoplanes在5个样品中均占有较高的比例。使它隆处理10 d后L2中的Pseudomonas的比例明显增加,由0.5%增加到1.5%;60 d后L3中的Nitrospira明显比例增加,由0.4%增加到0.8%;Pseudomonas的比例下降,由0.7%减少到0.4%。对表 4中样品主要微生物菌落种属分析发现,5个样品中尚未被分类到属用unclassfied表示,分别占83.6%、85.2%、84.3%、85.6%和82.8%,这是由于数据库的限制所造成的。

|
| 图 6 属水平各样品菌群分布图 Figure 6 Frequence of genus in microbial communities from samples. |
| No. | L1CK | L2 | L2CK | L3 | L3CK | |||||||||
| Genus name | Ratio/% | Genus name | Ratio/% | Genus name | Ratio/% | Genus name | Ratio/% | Genus name | Ratio/% | |||||
| 1 | Rhodoplanes | 0.6 | Pseudomonas | 1.5 | Rhodoplanes | 1.2 | Rhodoplanes | 1.3 | Rhodoplanes | 1.3 | ||||
| 2 | Arthrobacter | 0.4 | Rhodoplanes | 1.0 | Nitrospira | 1.0 | Nitrospira | 0.8 | Pseudomonas | 0.7 | ||||
| 3 | Pseudomonas | 0.3 | Nitrospira | 0.8 | Steroidobacter | 0.7 | Lysobacter | 0.7 | Steroidobacter | 0.5 | ||||
| 4 | Burkholderia | 0.3 | Steroidobacter | 0.5 | Pseudomonas | 0.5 | Steroidobacter | 0.4 | Burkholderia | 0.4 | ||||
| 5 | Nitrospira | 0.3 | Kaistobacter | 0.5 | Allobaculum | 0.4 | Allobaculum | 0.4 | Nitrospira | 0.4 | ||||
| 6 | Bacillus | 0.2 | Arthrobacter | 0.4 | Arthrobacter | 0.4 | Pseudomonas | 0.4 | Acidovorax | 0.3 | ||||
| 7 | Methylibium | 0.2 | Bacillus | 0.3 | Kaistobacter | 0.3 | Arthrobacter | 0.3 | Bacillus | 0.2 | ||||
| 8 | Kaistobacter | 0.2 | Gemmata | 0.3 | Planctomyces | 0.3 | Gemmata | 0.3 | Rubrivivax | 0.2 | ||||
| 9 | Streptomyces | 0.2 | Planctomyces | 0.3 | Bacillus | 0.3 | Burkholderia | 0.3 | Arthrobacter | 0.2 | ||||
| 10 | Unclassfied | 83.6 | Unclassfied | 85.2 | Unclassfied | 84.3 | Unclassfied | 85.6 | Unclassfied | 82.8 | ||||
3 讨论
除草剂在农业生产中大量应用,近年来,关于农药对土壤微生物的影响已有一些报道。大量的研究表明,化学除草剂的长期使用会降低群落多样性、减少地表覆盖物和地下生物量,这种变化可能对土壤细菌群落的物种组成及其分布和丰富度产生影响[13]。由本实验分析结果可知,使它隆对土壤细菌群落组成及丰度有显著的影响。在本实验中,与对照相比,使它隆处理10 d后土壤细菌群落的多样性和丰度降低;60 d后土壤细菌群落多样性和丰度提高。孙淑清等[14]研究莠去津和烟嘧磺隆在玉米田施用后,对土壤微生物的数量具有一定影响,但经过一定时间后,随着土壤中除草剂含量的减少,微生物量能够逐渐恢复。此外,一些研究表明除草剂对农作物产量和品质有一定的影响。牛兴奎[15]研究表明使用除草剂降低了玉米籽粒脂肪的含量,降低了玉米株高、穗位高和茎粗。刘欢等[16-17]研究施用除草剂对燕麦的株高、穗长、千粒质量等影响较小,对小穗数、穗粒数、干草产量、种子产量有较显著的影响;还研究了除草剂处理对燕麦籽粒有增产作用。Lanoi等[18]也研究了燕麦使用除草剂后可使其出现生长缓慢、根部扭曲等药害现象。王克勤[19]研究除草剂对高油大豆品种的株高、油分含量、蛋白质含量的影响没有达到显著水平,对高油大豆的产量影响达极显著水平。因此研究除草剂施用后土壤中细菌群落的动态变化,了解除草剂对土壤细菌群落的影响,为初步探讨使它隆对玉米植株的健康生长状况、玉米产量及品质的影响奠定基础。
4 结论本研究利用Illumina Miseq高通量测序技术对16S rDNA V4-V5可变区序列进行测序,对喷施使它隆的土壤以及对照样品的细菌群落组成和多样性变化进行了研究。共获得260940条有效序列,167191条优质序列,12656个OTUs,共涉及34个细菌门,95个纲,192个属。多样性分析结果表明,与对照相比,处理10 d后土壤细菌多样性和丰度降低;处理60 d后土壤细菌多样性和丰度提高。对土壤细菌群落组成分析发现,5个土壤样品中的优势菌门均为酸酐菌门、变形菌门、放线菌门、绿弯菌门和芽单胞菌门。10 d后,药剂处理样品酸杆菌门的相对丰度增加,放线菌门和绿弯菌门的相对丰度降低;60 d后药剂处理样品的变形菌门的相对丰度降低,绿弯菌门的相对丰度增加。在属水平上,一些优势菌属的分布发生了变化。使它隆处理10 d后L2中的Pseudomonas的比例明显增加;60 d后L3中的Nitrospira比例明显增加,Pseudomonas的比例下降。5个样品中尚未被分类到属为主要菌群,说明土壤中存在大量的微生物资源有待发掘。
| [1] |
Li LX, Gao ZG, Yang RX. Effects of commonly used herbicides on maize rhizosphere soil microorganism. Liaoning Agricultural Sciences, 2015(2): 14-16.
(in Chinese) 李立鑫, 高增贵, 杨瑞秀. 常用除草剂对玉米根际土壤微生物的影响. 辽宁农业科学, 2015(2): 14-16. |
| [2] | Fang H, Lian JJ, Wang HF, Cai L, Yu YL. Exploring bacterial community structure and function associated with atrazine biodegradation in repeatedly treated soils. Journal of Hazardous Materials, 2015, 286: 457-465. DOI:10.1016/j.jhazmat.2015.01.006 |
| [3] |
Yao B, Xu JM, Shang H, Zhang CL. Study on ecological effect of atrazine on soil microbial activity. Journal of Soil and Water Conservation, 2005, 19(3): 46-49.
(in Chinese) 姚斌, 徐建民, 尚鹤, 张超兰. 阿特拉津除草剂对土壤微生物生态特征的影响. 水土保持学报, 2005, 19(3): 46-49. |
| [4] | 李婉莹, 高增贵, 刘限, 姚远, 王晓东, 苏家. 玉米田常用除草剂对土传病害及土壤微生物群落结构的影响//中国植物病理学会2014年学术年会论文集. 2014: 623. |
| [5] |
Zhang C, Zhu SR, Tian F, Dai LJ, Chen W. Effects of different green manure on bacterial community structure and diversity in tobacco-planting field in Xiangxi. Guizhou Agricultural Sciences, 2016, 44(5): 43-46.
(in Chinese) 张超, 朱三荣, 田峰, 戴林建, 陈武. 不同绿肥对湘西烟田土壤细菌群落结构与多样性的影响. 贵州农业科学, 2016, 44(5): 43-46. |
| [6] |
Jiang JC. Effects of four kinds of herbicides on the quantity of microorganisms in oats field. Gansu Animal and Veterinary Sciences, 2015, 45(10): 26-29.
(in Chinese) 姜佳昌. 四种除草剂对燕麦田土壤微生物数量的影响研究. 甘肃畜牧兽医, 2015, 45(10): 26-29. DOI:10.3969/j.issn.1006-799X.2015.10.014 |
| [7] | Hong C, Si YX, Xing Y, Li Y. Illumina MiSeq sequencing investigation on the contrasting soil bacterial community structures in different iron mining areas. Environmental Science and Pollution Research, 2015, 22(14): 10788-10799. DOI:10.1007/s11356-015-4186-3 |
| [8] | Vasileiadis S, Puglisi E, Arena M, Cappa F, Cocconcelli PS, Trevisan M. Soil bacterial diversity screening using single 16S rRNA gene V regions coupled with multi-million read generating sequencing technologies. PLoS One, 2012, 7(8): e42671. DOI:10.1371/journal.pone.0042671 |
| [9] | Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Peña AG, Goodrich JK, Gordon JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [10] | Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, Sahl JW, Stres B, Thallinger GG, van Horn DJ, Weber CF. Introducing mothur:open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [11] | Edgar RC, Haas BJ, Clemente JC, Quince C, Knight R. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [12] | Pitta DW, Parmar N, Patel AK, Indugu N, Kumar S, Prajapathi KB, Patel AB, Reddy B, Joshi C. Bacterial diversity dynamics associated with different diets and different primer pairs in the rumen of Kankrej cattle. PLoS One, 2014, 9(11): e111710. DOI:10.1371/journal.pone.0111710 |
| [13] |
Huang DC, You MS, Hou YM, Li ZS. Effects of chemical herbicides on bio-communities in agroecosystems. Acta Ecologica Sinica, 2005, 25(6): 1452-1458.
(in Chinese) 黄顶成, 尤民生, 侯有明, 李志胜. 化学除草剂对农田生物群落的影响. 生态学报, 2005, 25(6): 1452-1458. |
| [14] |
Sun SQ, Liu X, Yao Y, Gao ZG, Sun YQ, Li A. Effects of atrazine and nicosulfuron on soil microorganism. Agrochemicals, 2014, 53(4): 276-279.
(in Chinese) 孙淑清, 刘限, 姚远, 高增贵, 孙艳秋, 李安. 莠去津和烟嘧磺隆对玉米田土壤微生物的影响. 农药, 2014, 53(4): 276-279. |
| [15] | 牛兴奎. 除草剂、种衣剂对玉米产量、品质和根际环境的影响. 泰安: 山东农业大学硕士学位论文, 2007. |
| [16] |
Liu H, Mu P, Xu WC, Ji CD, Zhao GQ. Preliminary studies on effects of herbicides for control efficacy, yield and safety in naked oat. Grassland and Turf, 2015, 35(2): 1-8.
(in Chinese) 刘欢, 慕平, 许维诚, 姬承东, 赵桂琴. 10种除草剂对裸燕麦田杂草的药效、燕麦产量及安全性影响. 草原与草坪, 2015, 35(2): 1-8. |
| [17] |
Liu H, Mu P, Zhao GQ, Zhou XR. The impact of herbicides on production and antioxidant properties of oats. Acta Prataculturae Sinica, 2015, 24(2): 41-48.
(in Chinese) 刘欢, 慕平, 赵桂琴, 周向睿. 除草剂对燕麦产量及抗氧化特性的影响. 草业学报, 2015, 24(2): 41-48. DOI:10.11686/cyxb20150205 |
| [18] | Lanoie N, Vanasse A, Collin J, Reid JF, Pageau D, Lajeunesse J, Durand J. Covered grains in naked oat:environment and herbicide effects. Crop Science, 2010, 50(5): 2021-2029. DOI:10.2135/cropsci2009.06.0312 |
| [19] |
Wang KQ. Effects on yield and quality of high oil content soybean in different herbicide. Chinese Agricultural Science Bulletin, 2005, 21(11): 311-313.
(in Chinese) 王克勤. 除草剂对高油大豆产量及品质的影响. 中国农学通报, 2005, 21(11): 311-313. |
 2017, Vol. 57
2017, Vol. 57




