中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郎筱宇, 刘志媛, 徐梦, 谢灵玉, 李容珍. 2017
- Xiaoyu Lang, Zhiyuan Liu, Meng Xu, Lingyu Xie, Rongzhen Li. 2017
- 葡萄糖对小球藻 (Chloralla sp. HN08) 光合作用和生长的影响
- Effects of glucose on photosynthesis and growth of Chloralla sp. HN08 cells
- 微生物学报, 2017, 57(4): 550-559
-
文章历史
- 收稿日期:2016-08-16
- 修回日期:2016-10-31
- 网络出版日期:2016-12-08
微藻是一类富含油脂、聚不饱和脂肪酸、优质蛋白、多糖及多种特殊次级代谢物质的光合自养低等植物,其种类繁多,蕴藏着巨大的开发潜力,不但是水产养殖不可或缺的优质饵料,更被认为是解决未来人类能源、食品及环境问题的重要物种。近几十年来,随着微藻生物技术的迅速发展,以微藻为原料的水产饵料、多不饱和脂肪酸、叶黄素、叶绿素、虾青素、岩藻黄素、多糖、蛋白及生物柴油等相关产品开发成为新兴技术产业。
获得高密度、高品质的生物质是微藻产业化的重要前提[1]。成本相对较低的光合自养是目前小球藻、螺旋藻等商业化大规模培养所采取的主要模式。然而,在微藻自养培养过程中,随着细胞密度的升高,光和CO2的供给往往不能满足细胞生长的需求,导致单位水体中的生物产量过低,并增加了采收等过程的成本。
近几年,微藻高密度异养化培养受到关注。异养化微藻不利用光源,而是通过吸收有机碳源来获取能量,具有生长速度更快、单位产率高等优势[2-6]。工业化生产也有广泛应用,异养培养已应用于日本小球藻和雨生红球藻 (Haematococcus pluvialis 712) 的工业化培养[7-8]。
异养模式虽然可实现微藻高密度培养,但适应异养化培养的微藻种类较少。此外,异养的黑暗条件下会抑制一些光诱导的代谢产物如光合色素等的合成,影响微藻品质[9]。
许多在黑暗条件下不能利用有机碳源进行异养培养的微藻可以在光照条件下利用有机碳源,进行兼养并可获得比自养条件更高的生物量和比生长速率。如小球藻Chlorella protothecoides在添加葡萄糖的兼养条件下最大生长速率是自养条件下的10倍[10]。Nannochlorposis oculata CCMP 525、Dunaliella salina FACHB 435和Chlorella sorokiniana CCTCC M209220兼养条件下的生物量也分别达到自养条件下的1.4倍、2.2倍和4.2倍[11-12]。研究还表明,在光照条件下,添加葡萄糖不但提高微藻细胞的生长速率和生物质产量,对细胞内含物如油脂[13-14]、蛋白质或碳水化合物的积累也有促进作用[15-16]。Lee等在封闭式管道光生物反应器中,利用异养-兼养交替培养方式培养小球藻Chlorella sorokiniana,白天兼养模式细胞产率为10.2 g/(L·d),显著高于夜间异养模式的5.9 g/(L·d) (P < 0.05)[7]。此外,日本FUJI化学集团利用封闭光生物反应器两步法兼养培养雨生红球藻,虾青素年产量可以达到3000 kg[17]。
小球藻 (Chlorella vulagris) 是一类广泛分布于淡水和海水中的单细胞绿藻,由于其生长迅速、易培养,细胞内活性成分较多,因而是商业化大规模培养的主要微藻种类[18-19]。我们在热带海域分离获得1株耐高温富油小球藻Chlorella sp. HN08,为提高其培养密度,获得较高的生物质产量和油脂产量,我们研究了外加有机碳源葡萄糖对其生长、光合及主要光合产物含量的影响。本文报道这一结果。
1 材料和方法 1.1 材料与培养 1.1.1 藻种分离纯化: 海洋小球藻 (Chloralla sp. HN08) 分离自海南省海口近岸海域。抗生素平板分离法获得纯化藻种。: 1.1.2 藻种分子鉴定: 藻株基因组DNA的提取采用CTAB法[20]。以HN08的基因组DNA为模板,根据小球藻18S rRNA序列特征,合成引物For (5′-GGATCAGACTTCAATCTGGTTGATCCTGGAG-3′) 和Rev (5′-CTCAGTGAGCTTGATCCTTCG GCAGGTTGACC-3′),进行PCR扩增。其中PCR反应程序为:94 ℃ 4 min;94 ℃ 40 s,57 ℃ 40 s,72 ℃ 150 s,29个循环;72 ℃ 8 min;4 ℃保存。18S rRNA基因PCR产物纯化后进行测序分析,测序由上海生物公司完成。将HN08的核酸序列与GenBank中相关核酸序列进行BLAST比对,之后用MEGA 5软件构建系统发育树,确定HN08分类地位。: 1.1.3 藻种培养: 小球藻 (Chloralla sp. HN08) 培养基选用“宁波三号”培养液[21]。海水取自海口市白沙门,经过滤后高压灭菌。培养条件为 (27±1) ℃,光照强度为40 mol/(m2·s),光暗周期为14 h L:10 h D。: 将培养至对数生长期的小球藻HN08以25% (V/V) 接种于9个500 mL三角瓶中,每瓶400 mL培养液。小球藻生长至对数后期,通过添加葡萄糖 (10 g/L),分别进行异养 (加葡萄糖,黑暗培养)、兼养 (加葡萄糖,照光培养) 和自养 (不加葡萄糖,照光培养) 培养。每个处理3个重复。葡萄糖处理3 d后,测定光合放氧速率、光合色素、蛋白、碳水化合物和油脂等含量。: 1.2 藻细胞密度及相对生长速率将小球藻液按比例稀释成浓度梯度,用可见光分光光度计测定活体细胞在吸光度500 nm处的光密度值,血球计数板进行显微计数,将OD500与对应的细胞个数进行相关分析[22]。根据公式 (1) 计算相对生长速率µ。

|
公式(1) |
其中,t1、t2培养时间,N1和N2分别为t1、t2时期的细胞密度。
1.3 藻生物量的测定将混合纤维滤膜 (孔径0.45 µm) 置于105 ℃烘箱中烘干至恒重干燥器中冷却后记重W1,取10 mL藻液抽滤,滤膜烘干称重记为W2,根据公式 (2) 计算生物质浓度 (g/L)。

|
公式(2) |
90%丙酮萃取,按公式 (3)、(4)、(5) 计算提取液中色素含量 (mg/L)[23]。
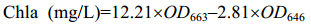
|
公式(3) |

|
公式(4) |

|
公式(5) |
将藻液分别稀释为细胞浓度4.82×106cells/mL (指数生长期浓度) 和9.46×106cells/mL (指数生长后期浓度) 的溶液,采用自制组装的溶解氧测定系统测定兼养与自养培养条件下藻细胞的光合放氧速率和光饱和点。系统由STDO11氧电极、1 L广口瓶、磁力搅拌器和多组荧光冷光源组成。
反应体系为1000 mL藻液,光源为LED灯、温度为 (27±1) ℃。磁力搅拌速率为1200 r/min,按公式 (6)、(7)、(8) 计算光合放氧速率、呼吸速率和净光合速率。

|
公式(6) |
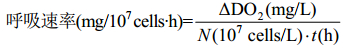
|
公式(7) |
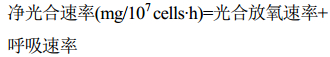
|
公式(8) |
式中ΔDO1为放氧过程中溶解氧浓度的变化 (mg/L),ΔDO2为呼吸过程中溶解氧浓度的变化 (mg/L),t为光合作用反应时间 (h),N为藻细胞浓度 (107 cells/mL)。
1.6 可溶性蛋白含量的测定考马斯亮蓝G-250染色法测定[24]。
1.7 可溶性糖和淀粉含量的测定蒽酮-硫酸比色法测定[25]。
1.8 油脂相对含量的鉴定以及测定尼罗红染色荧光分光光度法测定藻细胞的相对油脂含量[26]。
1.9 数据处理和分析采用DPS数据处理系统进行单因素方差分析[27]。图中标有*表示处理之间为显著差异 (P < 0.05)。
2 结果和分析 2.1 微藻HN08的分子鉴定藻株HN08经过PCR扩增获得18S rRNA基因,测序结果经BLAST比对,发现HN08的序列与小球藻属 (Chlorella sp.) 的相关序列 (GenBank登录号:X73992.1) 相似性达99% (图 1),因此将HN08鉴定为小球藻属 (Chlorella sp.) (GenBank登录号:KX943590)。

|
| 图 1. 基于藻株HN08 18S rRNA基因片段序列构建的系统发育树 Figure 1. Neighbour-joining phylogenetic tree of 18S rRNA sequences of HN08. Numbers in bracket represent the sequences accession number in GenBank. The number at each branch points is the percentage supported bootstrap. Bar, 0.001 sequence divergence. |
2.2 小球藻HN08细胞密度与OD500相关性
结果如图 2所示,OD500与小球藻细胞数有显著正相关 (P < 0.05),因此可以通过藻液在吸光度500的光密度值表示小球藻的细胞密度。

|
| 图 2. OD500与藻细胞数目线性关系 Figure 2. The linear relationship between the cell count and OD500. |
2.3 葡萄糖对小球藻HN08生长的影响
小球藻HN08分别进行自养、异养、兼养模式培养。结果表明,兼养小球藻细胞比生长速率和生物量均显著高于 (P < 0.05) 自养培养的细胞。添加葡萄糖3 d后,小球藻比生长速率为0.373/d,显著高于后3天的0.055/d (P < 0.05) (图 3)。添加葡萄糖6 d后,兼养藻生物量为0.426 g/L,是自养的1.24倍。异养方式培养的小球藻在黑暗条件下大量细胞死亡,迅速进入衰亡期,表明小球藻HN08不能进行异养生长。

|
| 图 3. 自养、异养、兼养培养条件下细胞密度 Figure 3. Cell density in culture under autotrophic, mixotrophic and heterotrophic conditions. |
2.4 葡萄糖对小球藻HN08细胞组分的影响 2.4.1 淀粉、蛋白质、可溶性糖:: 光照条件下添加葡萄糖后,显著促进了小球藻细胞中碳水化合物的积累 (P < 0.05)。兼养培养6 d后,细胞内淀粉、可溶性糖含量分别为自养条件下的3.47倍和1.26倍 (图 4)。而外源葡萄糖的添加显著降低了 (P < 0.05) 蛋白质含量,兼养细胞的可溶性蛋白含量是自养条件下的69%。:

|
| 图 4. 自养、兼养培养条件下生化组分含量 Figure 4. Contents of biochemical components in culture under autotrophic and mixotrophic conditions. *P < 0.05. |
2.4.2 相对油脂含量: 兼养培养6 d的小球藻藻液,经尼罗红染色后,在480 nm波长激发光下的荧光图谱表明,在585 nm波长处有一明显的油脂发射峰,相对荧光强度达到183.0 (图 5)。而自养条件下的小球藻细胞的油脂荧光发射峰在实验期间始终未出现。说明在光照条件下添加葡萄糖可促进小球藻HN08积累油脂。:

|
| 图 5. 自养、兼养培养条件下相对油脂含量 Figure 5. Relative fluorescence intensity in culture under autotrophic and mixotrophic conditions. *P < 0.05. |
2.4.3 光合色素: 添加葡萄糖后小球藻细胞的叶绿素含量显著降低 (P < 0.05) (图 6),叶绿素a和叶绿素b含量分别是自养条件下的53%和36%。但是,外源葡萄糖对小球藻类胡萝卜素含量无显著性影响 (P > 0.05)。:

|
| 图 6. 自养、兼养培养条件下光合色素含量 Figure 6. Contents of photosynthetic pigments in culture under autotrophic and mixotrophic conditions. *P < 0.05. |
2.5 葡萄糖对小球藻光合放氧速率和呼吸速率的影响
小球藻HN08光合放氧速率的变化曲线变化见图 7,结果表明,在小球藻达到光饱和点前,兼养细胞的光合放氧速率均显著低于 (P < 0.05) 自养细胞,在较低细胞密度条件下二者差距更明显。当藻细胞密度为4.81×106cells/mL时,在50 µmol/(m2·s) 光照条件下,兼养细胞光合放氧速率是自养条件下的1.5倍。
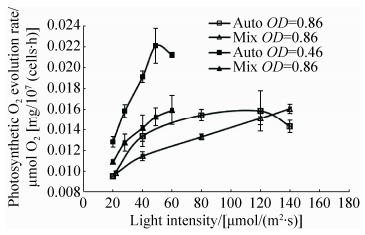
|
| 图 7. 自养、兼养培养条件下光合放氧速率 Figure 7. Photosynthetic O2 evolution rate in culture under autotrophic and mixotrophic conditions. |
无论是自养还是兼养模式,较低细胞密度的小球藻的净光合放氧速率均显著高于较高密度的小球藻 (P < 0.05)。此外,自养条件下,较低密度的藻液光饱和点为49 µmol/(m2·s),显著低于高密度光饱和点120 µmol/(m2·s) (P < 0.05),兼养小球藻的光饱和点在本实验中均未测到。
在光照强度40 µmol/(m2·s) 条件下,兼养小球藻HN08呼吸速率为0.0023 mg/107(cells·h),显著高于自养0.00075 mg/107(cells·h) (P < 0.05),因而计算得出,兼养细胞与自养细胞在40 µmol/(m2·s) (小球藻培养光强) 条件下的净光合速率无显著性差异 (P > 0.05)。
3 讨论结果表明,在光照条件下,外加葡萄糖可提高海洋小球藻HN08的比生长速率和细胞终密度,促进细胞淀粉和油脂等细胞贮藏物质的积累 (图 3–5)。但在黑暗条件下,小球藻不能利用葡萄糖进行异养生长。许多研究表明,多数小球藻可以利用有机碳源,添加外源葡萄糖等有机碳源可显著提高细胞的比生长速率和细胞密度 (P < 0.05)[10-12]。葡萄糖由培养基质进入细胞质后同化的第一步反应是氧化磷酸化,每1个分子葡萄糖需要消耗1个ATP。在兼养条件下,光反应过程中产生的ATP可为葡萄糖在细胞中的氧化磷酸化提供能量,同时葡萄糖的氧化分解释放的CO2又可提高[CO2]/[O2]比值,促进RuBisco羧化酶/加氧酶的羧化反应,促进光合碳固定反应。CO2的还原与葡萄糖的氧化2个过程为细胞的生长提供了更多的物质基础。因此,光合作用与葡萄糖的氧化作用协同运转可能是兼养条件下细胞生长迅速的主要原因。
小球藻属中的不同藻种的营养特性不同。多数文献报导的小球藻株如C. vulgaris、Chlorella sp. 484、Chlorella sp. 2003ZGHD23等,在光照和黑暗条件下均可利用外源葡萄迅速生长。同时,葡萄糖对小球藻生长代谢的作用研究也多是以可异养的微藻为材料[12, 28-31]。研究认为,小球藻细胞中负责葡萄糖吸收和跨膜转运的“己糖/H+”同向转运系统蛋白基因表达受黑暗诱导和光的抑制[32-34]。黑暗条件下,被吸收的葡萄糖主要通过磷酸戊糖途径 (PPP) 氧化分解,而光照条件下,细胞中的葡萄糖主要通过糖酵解 (EMP) 途径氧化分解。能量代谢通量分析 (MFA) 结果表明,葡萄糖通过PPP代谢途径转换效率高于糖酵解途径,所以异养条件下小球藻生长量显著高于自养 (P < 0.05)。但是,在光照条件下葡萄糖是如何转运吸收以及在细胞中的主要代谢途径尚不明确。
本实验所用小球藻HN08不具有异养特性,对葡萄糖的吸收和同化机制可能与前人已发表的具有异养特性的微藻不同。小球藻HN08在黑暗条件下不能利用葡萄糖,其原因可能是在黑暗条件下,细胞不能为葡萄糖同化的第1步反应氧化磷酸化提供充足的ATP。
大量研究表明,外加葡萄糖会改变微藻细胞碳分配代谢途径,以及贮藏物质如淀粉、脂肪和蛋白的含量[16]。小球藻HN08在添加10 g/L葡萄糖3 d后,可溶性糖、淀粉和油脂均显著高于自养条件的 (P < 0.05),尤其是淀粉积累明显。许多微藻在添加葡萄糖后,光合产物开始积累,并常以淀粉或脂的形式贮存,但几种积累物质的比例与藻细胞的种类和细胞生长状态、代谢有关。具有异养特性的小球藻C. protothecoides在添加葡萄糖的条件下,代谢倾向于脂的合成,而不是碳水化合物积累[12]。也有研究表明,小球藻C. kessleri吸收葡萄糖后,仅有1%以游离葡萄糖形式存在,85%的葡萄糖转变为寡糖 (以蔗糖为主) 和多糖 (主要为淀粉)[35]。Magali等研究衣藻,实验表明添加葡萄糖后,淀粉积累早于油脂,淀粉分解后,才进行脂质代谢[36]。对于蛋白质、光合色素等氮素化合物,外源有机碳不会影响异养条件下氮的吸收,但是会抑制兼养条件下氮的吸收[37]。
不同营养方式对藻细胞中光合色素也有显著影响。兼养方式下小球藻HN08藻细胞光合色素 (Chla、Chlb) 含量显著减少 (P < 0.05),仅为自养条件的50% (图 6)。兼养条件下的许多藻类,与自养藻相比,细胞色素含量普遍降低,前人对小球藻Chlorella sp. FC2和C. vulgaris的研究也表明,添加葡萄糖会降低叶绿素含量[11, 38]。
小球藻HN08在培养基中添加葡萄糖后,加速了小球藻的氧化呼吸作用,从而促进了培养基中氧气的消耗,而由于自养与兼养条件下净光合放氧速率[40 μmol/(m2·s)]并未有显著变化 (P > 0.05),因此导致表观光合放氧速率降低。说明虽然兼养条件下叶绿素含量下降,但对光合反应可能并无显著影响 (P > 0.05)。这与Xu等的研究结果一致:Nannochloropsis sp.在兼养条件下的呼吸速率增加,净光合速率与自养细胞无显著差异 (P > 0.05)[39]。但是也有研究表明,由于兼养条件下较低的叶绿素含量,导致净光合速率和光合放氧速率均下降[40]。
兼养条件下的小球藻HN08的光饱和点则显著高于自养细胞 (P < 0.05) (图 7)。植物出现光饱和点实质是强光下碳反应速率跟不上光反应从而限制了光合速率随着光强的增加而提高[41]。光合碳反应的限速酶RuBisco具有羧化和加氧双重特性,羧化反应与加氧反应的相对速率取决于CO2与O2的相对浓度。O2是羧化反应的竞争性抑制剂。兼养条件下,葡萄糖在体内的同化作用可降低介质中的氧气分压,使RuBisco羧化反应加强,提高耐受光强,延迟光抑制的产生。尤其是在较高细胞密度培养条件下,培养体系中的O2分压过高是微藻高密度培养的主要限制因子,添加葡萄糖可缓解这一问题,从而提高细胞培养的终密度。然而,也有研究认为外源葡萄糖会抑制RuBisco羧化活性。RuBisco羧化酶含量与活性显著低于自养条件 (P < 0.05),但自养下藻蓝蛋白含量却高于兼养以及异养[42]。在分子方面,小球藻C. sorokiniana CCTCC M209220在兼养条件下,调控rbcL基因表达量显著低于自养条件 (P < 0.05)[11]。因此,添加葡萄糖对微藻RuBisco酶的含量、活性以及基因表达均有影响作用。
此外,Zhang等认为,兼养模式更加适应弱光环境,而我们根据实验推测,兼养模式的小球藻的光饱和点高于自养模式,在高光下也具有优势。这可能是一方面因为葡萄糖的氧化分解可及时消耗光反应过程中产生的ATP,防止光氧化,另一方面,葡萄糖的氧化分解可释放CO2,为光合固碳过程提供原料,促进光合作用进行[43]。
因此,添加葡萄糖对小球藻的生长和光合产物积累具有积极意义,但由于藻种不同,以及藻细胞所处的生理状态不同,葡萄糖产生的生理效应也不同。利用本实验的初探结论,可以在生产应用上,针对藻种的特性优化培养和调控条件,降低成本,获得最佳生物量。
| [1] | Miao AJ, Wang WX, Juneau P. Comparison of Cd, Cu, and Zn toxic effects on four marine phytoplankton by pulse-amplitude-modulated fluorometry. Environmental toxicology and Chemistry, 2005, 24(10): 2603–2611 DOI:10.1897/05-009R.1 . |
| [2] | Wu QY, Kuang M, Grant NG. Growth, AEC and pigments of Chlorella protothecoides in two strains under the autotrophic and heterotrophic conditions. Acta Phytophysiologica Sinica, 1992, 18(3): 293–299 (in Chinese). 吴庆余, 匡梅, GrantNG. 小球藻两个品系在自养与异养条件下的生长、能荷与色素差异. 植物生理学报, 1992, 18(3): 293–299. |
| [3] | Yan JQ, Huang XX, Huang ZZ, Hu P, Lü WQ, Lin F. Effect of different trophic modes on the growth performance and nutrition of Chlorella sp.. Progress in Fishery Sciences, 2011, 32(4): 77–85 (in Chinese). 严佳琦, 黄旭雄, 黄征征, 胡盼, 吕为群, 林锋. 营养方式对小球藻生长性能及营养价值的影响. 渔业科学进展, 2011, 32(4): 77–85. |
| [4] | Li XW, Li YG, Shen GM, Yang D. Medium for culturing Chlorella vulgaris with sequential heterotrophic-autotrophic model. Chinese Journal of Process Engineering, 2006, 6(2): 277–280 (in Chinese). 李兴武, 李元广, 沈国敏, 杨东. 普通小球藻异养-光自养串联培养的培养基. 过程工程学报, 2006, 6(2): 277–280. |
| [5] | Xiong W, Li XF, Xiang JY, Wu QY. High-density fermentation of microalga Chlorella protothecoides in bioreactor for microbio-diesel production. Applied Microbiology and Biotechnology, 2008, 78(1): 29–36 DOI:10.1007/s00253-007-1285-1 . |
| [6] | Xiong W, Gao CF, Yan D, Wu C, Wu QY. Double CO2 fixation in photosynthesis-fermentation model enhances algal lipid synthesis for biodiesel production. Bioresource Technology, 2010, 101(7): 2287–2293 DOI:10.1016/j.biortech.2009.11.041 . |
| [7] | Lee YK. Commercial production of microalgae in the Asia-Pacific rim. Journal of Applied Phycology, 1997, 9(5): 403–411 DOI:10.1023/A:1007900423275 . |
| [8] | Zhang ZB, Zhou AF, Xu LJ, Wang QX. The nutrient requirement and culture conditions of a green alga Haematococcus pluvialis sp. 712. Journal of Shanghai Normal University (Natural Sciences), 2003, 32(4): 66–72 (in Chinese). 张在宝, 周爱芬, 徐琍佳, 王全喜. 雨生红球藻712株营养需求及其培养条件. 上海师范大学学报 (自然科学版), 2003, 32(4): 66–72. |
| [9] | Chen F, Johns MR. Heterotrophic growth of Chlamydomonas reinhardtii on acetate in chemostat culture. Process Biochemistry, 1996, 31(6): 601–604 DOI:10.1016/S0032-9592(96)00006-4 . |
| [10] | Heredia-Arroyo T, Wei W, Hu B. Oil accumulation via heterotrophic/mixotrophic Chlorella protothecoides. Applied Biochemistry and Biotechnology, 2010, 162(7): 1978–1995 DOI:10.1007/s12010-010-8974-4 . |
| [11] | Wan MX, Liu P, Xia JL, Rosenberg JN, Oyler GA, Betenbaugh MJ, Nie ZY, Qiu GZ. The effect of mixotrophy on microalgal growth, lipid content, and expression levels of three pathway genes in Chlorella sorokiniana. Applied Microbiology and Biotechnology, 2011, 91(3): 835–844 DOI:10.1007/s00253-011-3399-8 . |
| [12] | Ren XJ, Chen JK, Deschênes JS, Tremblay R, Jolicoeur M. Glucose feeding recalibrates carbon flux distribution and favours lipid accumulation in Chlorella protothecoides through cell energetic management. Algal Research, 2016, 14: 83–91 DOI:10.1016/j.algal.2016.01.004 . |
| [13] | Baldisserotto C, Popovich C, Giovanardi M, Sabia A, Ferroni L, Constenla D, Leonatdi P, Pancaldi S. Photosynthetic aspects and lipid profiles in the mixotrophic alga Neochloris oleoabundans as useful parameters for biodiesel production. Algal Research, 2016, 16: 255–265 DOI:10.1016/j.algal.2016.03.022 . |
| [14] | Sakurai T, Aoki M, Ju XH, Ueda T, Nakamura Y, Fujiwara S, Umemura T, Tsuzuki M, Minoda A. Profiling of lipid and glycogen accumulations under different growth conditions in the sulfothermophilic red algaGaldieria sulphuraria. Bioresource Technology, 2016, 200: 861–866 DOI:10.1016/j.biortech.2015.11.014 . |
| [15] | Rohit MV, Mohan SV. Tropho-metabolic transition duringChlorella sp. cultivation on synthesis of biodiesel. Renewable Energy, 2016, 98: 84–91 DOI:10.1016/j.renene.2016.03.041 . |
| [16] | Yan RM, Zhang ZB, Zeng QG, Zhu D, Chu J. Carbon metabolism and energetic utilization of Synechococcus sp. PCC7942 under mixotrophic condition. Chinese Journal of Biotechnology, 2010, 26(9): 1239–1248 (in Chinese). 颜日明, 张志斌, 曾庆桂, 朱笃, 储炬. 聚球藻7942混养培养中碳代谢与能量利用. 生物工程学报, 2010, 26(9): 1239–1248. |
| [17] | 章真. 雨生红球藻异养细胞光诱导积累虾青素工艺的优化与放大. 华东理工大学博士学位论文, 2016. |
| [18] | Costache TA, Fernández FGA, Morales MM, Fernández-Sevilla JM, Stamatin I, Molina E. Comprehensive model of microalgae photosynthesis rate as a function of culture conditions in photobioreactors. Applied microbiology and Biotechnology, 2013, 97(17): 7627–7637 DOI:10.1007/s00253-013-5035-2 . |
| [19] | Ouyang ZR, Wen XB, Geng YH, Mei H, Hu HJ, Zhang GY, Li YG. The effects of light intensities, temperatures, pH and salinities on photosynthesis of Chlorella. Journal of Wuhan Botanical Research, 2010, 28(1): 49–55 (in Chinese). 欧阳峥嵘, 温小斌, 耿亚红, 梅洪, 胡鸿钧, 张桂艳, 李夜光. 光照强度、温度、pH、盐度对小球藻 (Chlorella) 光合作用的影响. 武汉植物学研究, 2010, 28(1): 49–55. |
| [20] | 任洁. 氮限制条件下小球藻的油脂代谢研究. 海南大学硕士学位论文, 2015. |
| [21] | 成永旭. 生物饵料培养学. 第2版. 北京: 中国农业出版社, 2005. |
| [22] | Liu ZY, Wang GC. Dynamics of lipid accumulation in marine microalga Chlorella vulgaris promoted by iron. Marine Sciences, 2008, 32(11): 56–59, 73 (in Chinese). 刘志媛, 王广策. 铁促进海水小球藻油脂积累的动态过程. 海洋科学, 2008, 32(11): 56–59, 73. |
| [23] | Arnon DI. Copper enzymes in isolated chloroplasts. Polyphenoloxidase inBeta vulgaris. Plant Physiology, 1949, 24(1): 1–15 DOI:10.1104/pp.24.1.1 . |
| [24] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248–254 . |
| [25] | Fairbairn NJ. A modified anthrone reagent. Chemistry & Industry, 1953(4): 86 . |
| [26] | Liu ZY, Wang GC, Zhou BC. Effect of iron on growth and lipid accumulation inChlorella vulgaris. Bioresource Technology, 2008, 99(11): 4717–4722 DOI:10.1016/j.biortech.2007.09.073 . |
| [27] | Tang QY, Zhang CX. Data Processing System (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research. Insect Science, 2013, 20(2): 254–260 DOI:10.1111/j.1744-7917.2012.01519.x . |
| [28] | Woodworth BD, Mead RL, Nichols CN, Kolling DRJ. Photosynthetic light reactions increase total lipid accumulation in carbon-supplemented batch cultures ofChlorella vulgaris. Bioresource Technology, 2015, 179: 159–164 DOI:10.1016/j.biortech.2014.11.098 . |
| [29] | Muthuraj M, Palabhanvi B, Misra S, Kumar V, Sivalingavasu K, Das D. Flux balance analysis of Chlorella sp.FC2 IITG under photoautotrophic and heterotrophic growth conditions. Photosynthesis Research, 2013, 118(1/2): 167–179 . |
| [30] | Yan RM, Zhu D, Zhang ZB, Zeng QG, Chu J. Carbon metabolism and energy conversion of Synechococcussp. PCC 7942 under mixotrophic conditions: comparison with photoautotrophic condition. Journal of Applied Phycology, 2012, 24(4): 657–668 DOI:10.1007/s10811-011-9683-2 . |
| [31] | Yang C, Hua Q, Shimizu K. Energetics and carbon metabolism during growth of microalgal cells under photoautotrophic, mixotrophic and cyclic light-autotrophic/ dark-heterotrophic conditions. Biochemical Engineering Journal, 2000, 6(2): 87–102 DOI:10.1016/S1369-703X(00)00080-2 . |
| [32] | Komor E, Tanner W. The determination of the membrane potential of Chlorella vulgaris. European Journal of Biochemistry, 1976, 70(1): 197–204 DOI:10.1111/ejb.1976.70.issue-1 . |
| [33] | Komor E. Proton-coupled hexose transport in Chlorella vulgaris. FEBS Letters, 1973, 38(1): 16–18 DOI:10.1016/0014-5793(73)80501-0 . |
| [34] | Komor E, Tanner W. The hexose-proton cotransport system of Chlorella: pH-dependent change in Km values and translocation constants of the uptake system. The Journal of General Physiology, 1974, 64(5): 568–581 DOI:10.1085/jgp.64.5.568 . |
| [35] | Tanner W. TheChlorella hexose/H+-symporters. International Review of Cytology, 2000, 200: 101–141 DOI:10.1016/S0074-7696(00)00003-6 . |
| [36] | Siaut M, Cuiné S, Cagnon C, Fessler B, Nguyen M, Carrier P, Beyly A, Beisson F, Triantaphylidès C, Li-Beisson Y, Peltier G. Oil accumulation in the model green alga Chlamydomonas reinhardtii: characterization, variability between common laboratory strains and relationship with starch reserves. BMC Biotechnology, 2011, 11(1): 7 DOI:10.1186/1472-6750-11-7 . |
| [37] | Combres C, Laliberté G, Reyssac JS, de la Noüe J. Effect of acetate on growth and ammonium uptake in the microalgaScenedesmus obliquus. Physiologia Plantarum, 1994, 91(4): 729–734 DOI:10.1111/ppl.1994.91.issue-4 . |
| [38] | Giovanardi M, Ferroni L, Baldisserotto C, Tedeschi P, Maietti A, Pantaleoni L, Pancaldi S. Morphophysiological analyses of Neochloris oleoabundans(Chlorophyta) grown mixotrophically in a carbon-rich waste product. Protoplasma, 2013, 250(1): 161–174 DOI:10.1007/s00709-012-0390-x . |
| [39] | Xu F, Hu HH, Cong W, Cai ZL, Ouyang F. Growth characteristics and eicosapentaenoic acid production by Nannochloropsissp. in mixotrophic conditions. Biotechnology Letters, 2004, 26(1): 51–53 DOI:10.1023/B:BILE.0000009460.81267.cc . |
| [40] | Yu HF, Jia SR, Dong YS, Lin YX. Effects of organic carbon sources on growth and photosynthesis of Nostoc flagelliforme cells. Journal of Chemical Engineering of Chinese Universities, 2008, 22(2): 277–281 (in Chinese). 于海峰, 贾士儒, 董永胜, 林永贤. 有机碳源对发状念珠藻单体细胞生长和光合作用的影响. 高校化学工程学报, 2008, 22(2): 277–281. |
| [41] | 潘瑞炽. 植物生理学. 第6版. 北京: 高等教育出版社, 2008. |
| [42] | Steinmüller K, Zetsche K. Photo-and metabolite regulation of the synthesis of ribulose bisphosphate carboxylase/oxygenase and the phycobiliproteins in the alga Cyanidium caldarium. Plant Physiology, 1984, 76(4): 935–939 DOI:10.1104/pp.76.4.935 . |
| [43] | Zhang L, Li BP, Wu ZQ, Gu L, Yang Z. Changes in growth and photosynthesis of mixotrophic Ochromonas sp. in response to different concentrations of glucose. Journal of Applied Phycology, 2016, 28(5): 2671–2678 DOI:10.1007/s10811-016-0832-5 . |
 2017, Vol. 57
2017, Vol. 57