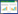中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 陈学情, 蒋家璇, 任志鸿, 李娟, 张红英, 徐建国, 杜华茂. 2017
- Xueqing Chen, Jiaxuan Jiang, Zhihong Ren, Juan Li, Hongying Zhang, Jianguo Xu, Huamao Du. 2017
- 纳米银的抗菌特性及对多重耐药菌株的抗菌作用
- Antibacterial activity of silver nanoparticles against multiple drug resistant strains
- 微生物学报, 2017, 57(4): 539-549
-
文章历史
- 收稿日期:2016-08-08
- 修回日期:2016-12-09
- 网络出版日期:2017-01-19
2. 中国疾病预防控制中心传染病预防控制所, 北京 102206
2. National Institute for Communicable Diseases Control and Prevention Chinese Center for Disease Control and Prevention, Beijing 102206, China
金属银、硝酸银和磺胺嘧啶银曾广泛用于治疗烧伤、伤口和细菌感染性疾病[1-3],但抗生素的发明使银在抗菌中的应用大幅下降[4]。近年来,细菌耐药问题日趋严重并威胁人类健康,比如耐甲氧西林金葡菌 (MRSA)、耐万古霉素的金葡菌 (VRSA)、耐药结核分支杆菌[5-6],全球每年因感染耐药菌株无药可医而死亡的人数达70万之多。与此同时,研发新 (型) 抗生素已呈乏力之势,经美国食品药品监督总局审批通过的抗生素逐年递减,1983年至1987年审批了14种,而2003年至2007年仅审批了3种[7]。因此,科学家迫切地寻找新的抗菌物质,包括天然植物化合物、抗菌肽和纳米材料。
传统银制剂用于抗菌防腐的历史悠久,具有广谱强效的抗菌性能,结合纳米技术的发展,纳米银成为研究热点[8-9]。纳米银具有巨大的比表面积和较高的价态,相对于银离子不易被氧化和沉淀,能持续地发挥抗菌作用[10];纳米银很容易与多种高分子材料嫁接形成新的抗菌材料。纳米银现已应用于医疗器械[11]、植入支架的表面抗菌涂层[12],烧伤敷料[13]以及水净化材料[14]等。近年环境友好型合成纳米银的技术备受关注,用多种植物叶片提取物、不同细菌和真菌提取物合成纳米银[15-16],将推动纳米银产业的升级换代。在纳米银的抗菌机制研究方面,目前尚存争议,多认为是纳米银释放出的银离子发挥抗菌作用[17-18],但新研究显示纳米银与胞内的过氧化氢反应生成毒性最强的活性氧—羟基自由基[19]。
本研究用一株真菌的提取物合成纳米银,分别以大肠杆菌、金黄色葡萄球菌和白色念珠菌测定纳米银的“时间-杀菌曲线”和“抗生素后效应” (post-antibiotic effect,PAE),了解纳米银的抗菌特性,并检测其对临床分离的多重耐药菌株的抗菌作用,对临床与日常生活中科学地应用纳米银抗菌有指导意义。
1 材料和方法 1.1 主要材料大肠杆菌CVCC2081,金黄色葡萄球菌CVCC1882,白色念珠菌CMCC (F)98001为中国兽药所保存菌株,由黄伟博士惠赠。大肠杆菌EC-SN F2,EC-CS6 F4,SDHZ及沙门氏菌SDHZ分离自病死鹅,由黄伟博士惠赠。3株耐药菌大肠埃希氏菌R17,肺炎克雷伯菌肺炎亚种R36,金黄色葡萄球菌BJ0151由中国疾病预防控制中心传染病预防控制所耐药菌室分离、鉴定和保存。10株产毒性大肠杆菌 (ETEC) 由中国疾病预防控制中心传染病预防控制所新病原室分离、鉴定和保存[20],由熊衍文博士惠赠。2, 3-N-吗啡啉丙磺酸 (MOPS),LB Broth Agar培养基购买于Sangon Biotech。Mueller-Hinton Broth培养基购买于上海瑞楚生物有限公司。RPMI-1640,沙氏琼脂培养基购买于Thermo scientific。96孔板购买于BeaverBioTM。
1.2 纳米银的制备与表征用专利菌株 (CTCCM2012524, 专利号:ZL:2012 1 0579134.4) 合成纳米银[21],主要过程为:将菌株培养于PDA培养基,收集菌丝,按10 mL/g加去离子水,37 ℃放置24 h,过滤去除菌丝,将滤液经0.22 μm滤膜,加1 μg/mL硝酸银,于37 ℃反应48 h。将合成的纳米银用去离子水洗涤3次,离心速度为12000 r/min,30 min。
用NanoDrop-2000 (Thermo Scientific) 检测纳米银的光学性质。用zen3600激光粒度仪 (Malvern) 检测纳米银的粒径和Zeta电位。纳米银经浓硝酸-双氧水降解成银离子后,用Z-5000偏振塞曼原子吸收分光光度计 (Hitachi Limited) 测量其浓度。
1.3 纳米银中和剂为测定纳米银在规定时间内的抗菌效果,用中和剂终止纳米银的杀菌作用。参照《一次性使用卫生用品标准》(GB15979-2002) 附录C3.1检测Na2S对纳米银抗菌的中和作用[22-23]。准备106 CFU/mL的金黄色葡萄球菌CVCC1882菌液,分5组进行试验:① 0.1 mL菌+1 mL ddH2O;② 0.5 mL中和剂+0.6 mL ddH2O;③ 0.1 mL菌+1 mL中和剂;④ (0.1 mL菌+1 mL纳米银)+ ddH2O;⑤ (0.1 mL菌+ 1 mL纳米银)+中和剂。④、⑤中纳米银与菌作用2.5 min后分别用ddH2O、中和剂稀释。GB15979-2002规定合格的中和剂需符合以下条件:(1) 第①、③组有相似量试验菌生长,其组间菌落数误差率应不超过15%;(2) 第②组无菌生长;(3) 第④组无试验菌,或仅有极少数试验菌菌落生长;(4) 第⑤组有较第④组为多,但较第①、③组为少的试验菌落生长;(5) 连续3次试验结果一致。
1.4 MIC与MBC的测定大肠杆菌CVCC2081和金黄色葡萄球菌CVCC1882 MIC、MBC值的测定按美国临床实验室标准CLSI M7-A7中微量稀释法进行[24],主要步骤为:大肠杆菌和金黄色葡萄球菌在LB固体平板上经35 ℃培养24 h,取5个直径大于1 mm的菌落接种于5 mL双倍浓度Mueller-Hinton培养基中,振荡15 s制成菌悬液,用比浊法将其浓度调至菌浓度为1×106CFU/mL (OD600=0.1时菌浓度为1×108 CFU/mL)。将纳米银溶液加入96孔培养板中,1–10孔浓度为128.00、64.00、32.00、16.00、8.00、4.00、2.00、1.00、0.50、0.25 μg/mL,每孔50 μL,第11和第12孔各加50 μL生理盐水。在1–11孔每孔加50 μL菌悬液,第12孔加50 μL双倍浓度Mueller-Hinton Broth培养基,平行做3排重复。轻微振动微量板使混合均匀,37 ℃培养24 h后肉眼观察培养基不混浊的最低纳米银浓度孔代表其MIC值。试验重复3次。
白色念珠菌CMCC (F)98001 MIC值测定参考美国临床实验室标准CLSI M27-A2中微量稀释法进行[25],培养基为RPMI-1640,37 ℃培养48 h,其他操作同大肠杆菌和金黄色葡萄球菌。
判定MIC后,从最低抑菌浓度孔和最低抑菌浓度以上的3孔各取50 μL溶液加入450 μL中和剂中,混合均匀后取100 μL进行涂板,37 ℃培养12 h。以无菌生长孔中的纳米银浓度作为纳米银对该菌的MBC值。MBC值的测定也重复3次。
1.5 时间-杀菌曲线的测定按照抗生素的方法测定纳米银的时间-杀菌曲线,以此反映在不同时间不同浓度纳米银杀灭细菌的效果。设6个纳米银浓度:0.5、1.0、2.0、4.0、8.0、16.0 MIC,大肠杆菌和金黄色葡萄球菌菌液终浓度为5×105 CFU/mL,白色念珠菌菌液终浓度为2.5×103 CFU/mL。将两者混合后在37静止培养,大肠杆菌和金黄色葡萄球菌组在作用后第1、3、5、7、9、11 h,各取50 μL反应液,加入450 μL 1 mol/L Na2S终止纳米银的杀菌作用,然后进行平板计数。白色念珠菌组在作用后第3、7、11、15、19、23 h取样计数。实验重复3次,求平均值。以作用时间为横坐标,以活菌数的自然对数值为纵坐标,绘制杀菌曲线。
1.6 “抗生素后效应”的测定为了解纳米银对细菌和真菌的杀菌作用,我们按抗生素评价指标测定其“抗生素后效应”[26]。将3株标准菌株培养至对数生长期,用2倍浓度培养液 (细菌用Mueller-Hinton Broth,真菌用RPMI-1640 Broth) 稀释菌液,使菌浓度为1×106 CFU/mL。同时准备浓度为0、2、8、32 MIC的纳米银溶液。将3种菌液分别与不同浓度的纳米银等体积混合,于37 ℃处理1 h后用相应的培养液 (细菌用Mueller-Hinton Broth,真菌用RPMI-1640 Broth) 稀释1000倍 (此时作为“抗生素后效应”测定的零时刻),于37 ℃继续静态培养。每隔一段时间取样进行菌落计数。重复3次,求平均值,绘制细菌的生长曲线。
PAE的计算公式:PAE=T–C,式中T、C分别为纳米银组和对照组菌浓度增加10倍 (1个对数级) 所需要的时间[27]。
1.7 对耐药菌的杀灭作用大肠埃希氏菌R17分离自病人的痰液,对氨苄西林、头孢唑啉、头孢吡肟、氨曲南、阿米卡星、庆大霉素、环丙沙星、左旋氟沙星耐药。肺炎克雷伯菌肺炎亚种R36分离自病人的痰液,对氨苄西林、哌拉西林、头孢唑啉、头孢他啶、头孢吡肟、庆大霉素、环丙沙星、左旋氟沙星耐药。金黄色葡萄球菌BJ0151分离自健康人,对红霉素,四环素,庆大霉素,克林霉素,甲氧磺胺耐药。CQ1,CQ2,CQ3,CQ4,CQ5,CQ6,CQ7,CQ8,CQ9,CQ10等10株ETEC的耐药谱见文献[20]。由于生物安全的原因,本阶段实验在生物安全II级实验室中进行,检测方法同1.4所述。
2 结果和分析 2.1 纳米银的表征用菌株CCTCC M2012524合成的纳米银溶胶在420 nm处有最大吸收峰 (图 1-A),经激光粒度仪测定,纳米银的粒径在5–30 nm之间 (图 1-B),Zeta电位为–19.5 mV。经原子吸收分光光度计测定,纳米银储备液浓度为166.8 μg/mL。
|
| 图 1. 纳米银的表征 Figure 1. Characterization of AgNPs. A: UV-visible spectra of AgNPs; B: size distribution of AgNPs. a: 166.8 μg/mL AgNPs; b: 83.4 μg/mL AgNPs; c: 166.8 μg/mL AgNO3. |
2.2 纳米银中和剂
按GB15979-2002附录C3.1进行了纳米银的中和剂试验,表 1显示Na2S符合中和剂的全部条件,纳米银处理2.5 min后加入1 mmol/L Na2S,还有105 CFU/mL金黄色葡萄球菌CVCC1882存活,约为原菌液的十分之一,而不加入Na2S实验组中没有菌存活,表明Na2S可做纳米银杀菌作用的中和剂。
| Number | Concentration/(CFU/mL) |
| ① Positive control | 3.38×106 |
| ② Negative control | 0 |
| ③ S. aureus+Na2S | 3.80×106 |
| ④ S. aureus+AgNPs | 0 |
| ⑤ S. aureus+AgNPs+Na2S | 3.02×105 |
2.3 MIC与MBC
将106 CFU/mL大肠杆菌CVCC2081和金黄色葡萄球菌CVCC1882,105 CFU/mL白色念珠菌CMCC (F)98001分别与系列浓度的纳米银作用48 h后肉眼观察判定MIC值。结果表明纳米银对大肠杆菌、金黄色葡萄球菌、白色念珠菌的MIC值依次为1.0、1.5、4.0 μg/mL。经1 mmol/L Na2S中和后进行平板活菌检测,测定纳米银对3种菌的MBC值分别为1.0、2.5、4.0 μg/mL,MBC/MIC值分别是1.00、1.67、1.00 (表 2)。
| Microorganism | MIC/(μg/mL) | MBC/(μg/mL) | MBC/MIC | Source of strains |
| *E. coli CVCC2081 | 1.00 | 1.00 | 1.00 | China's veterinary supervision |
| *S. aureus CVCC1882 | 1.50 | 2.50 | 1.70 | China's veterinary supervision |
| *C. albicans CMCC (F)98001 | 4.00 | 4.00 | 1.00 | China's veterinary supervision |
| **E. coli R17 | 6.00 | 10.00 | 1.70 | Human, CDC |
| **S. aureus BJ0151 | 26.70 | 26.70 | 1.00 | Human, CDC |
| **K. pneumoniae R36 | 26.70 | 32.00 | 1.20 | Human, CDC |
| **ETEC CQ1 | 8.00 | 10.67 | 1.33 | Swine[20] |
| **ETEC CQ2 | 8.00 | 12.00 | 1.50 | Swine[20] |
| **ETEC CQ3 | 9.33 | 10.67 | 1.14 | Swine[20] |
| **ETEC CQ4 | 9.33 | 12.00 | 1.29 | Swine[20] |
| **ETEC CQ5 | 8.00 | 11.20 | 1.40 | Swine[20] |
| **ETEC CQ6 | 8.00 | 9.33 | 1.17 | Swine[20] |
| **ETEC CQ7 | 8.00 | 8.00 | 1.00 | Swine[20] |
| **ETEC CQ8 | 8.00 | 13.33 | 1.66 | Swine[20] |
| **ETEC CQ9 | 4.67 | 8.00 | 1.71 | Swine[20] |
| **ETEC CQ10 | 8.00 | 12.00 | 1.50 | Swine[20] |
| **E. coli EC-SN F2 | 8.00 | 16.00 | 2.00 | Goose |
| **E. coli EC-CS6 F4 | 8.00 | 8.00 | 1.00 | Goose |
| **E. coli SDHZ | 8.00 | 16.00 | 2.00 | Goose |
| ** S. enterica SDHZ | 8.00 | 14.67 | 1.83 | Goose |
| *: model microbe; **: drug resistant bacteria. | ||||
2.4 时间–杀菌曲线
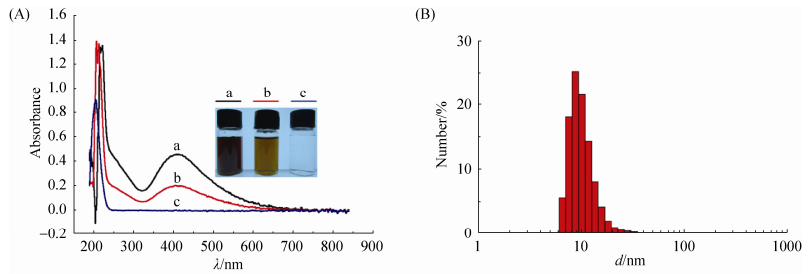
用终浓度为0.5–16.0 MIC纳米银在12 h和24 h内对3种菌的时间–杀菌曲线见图 2。对于大肠杆菌而言,高于1.0 MIC的纳米银对大肠杆菌保持持续的杀灭作用,随时间的延长杀灭的细菌越多,随纳米银浓度升高杀菌作用略有增强;0.5 MIC和1.0 MIC的纳米银在短时间内有部分杀灭作用,大肠杆菌分别于6 h和8 h恢复生长,但1.0 MIC值纳米银处理组到12 h活菌总量还没有达到初始水平 (图 2-A)。由图 2-B可知,0.5 MIC的纳米银对金黄色葡萄球菌仅表现出微弱的抑制作用,1.0 MIC的纳米银在12 h内能很好地抑制金葡菌的生长;2.0–16.0 MIC的纳米银能杀灭金黄色葡萄球菌,随时间的延长杀灭的细菌数越多。3次重复试验发现,在8 h内,2.0 MIC,4.0 MIC的纳米银杀灭金黄色葡萄球菌的作用强于8.0 MIC和16.0 MIC。与大肠杆菌和金黄色葡萄球菌相比,白色念珠菌的浓度较低,仅为103 CFU/ mL,0.5 MIC的纳米银对其有一定程度的抑制作用,1.0–16.0 MIC的纳米银能完全抑制其生长,但无显著杀灭作用,24 h内活菌数未降低一个数量级 (图 2-C)。综上,纳米银浓度在2.0–16.0 MIC范围内,纳米银的杀菌效果并没有随浓度的增加而明显增加,因此纳米银对于3种标准菌株是时间依赖性抗菌剂。

|
| 图 2. 不同浓度纳米银对3株标准菌株的时间-杀菌曲线 Figure 2. The time-kill curve of AgNPs on three model microbe. A: E. coli CVCC2081; B: S. aureus CVCC1882; C: C. albicans CMCC (F)98001. |
2.5 “抗生素后效应”
把浓度为1.0、4.0、16.0 MIC的纳米银与1×106 CFU/mL的菌液孵育1 h后,用液体培养基稀释1000倍,绘制生长曲线 (图 3),再根据生长曲线和“抗生素后效应”计数公式,计算出不同浓度下纳米银对3种标准菌株的“抗生素后效应”时间 (表 3)。结果表明大肠杆菌经3个不同浓度的纳米银处理后,“抗生素后效应”时间分别为1、2、3 h,白色念珠菌的“抗生素后效应”时间分别为0、3.10、5.40 h,两者都表现出浓度依赖性。与此不同的是,金黄色葡萄球菌对纳米银的“抗生素后效应”时间分别为1.30、–1.90、–0.90。换而言之,4.0 MIC、16.0 MIC的纳米银对金黄色葡萄球菌短时间处理后能不同程度地刺激其生长。
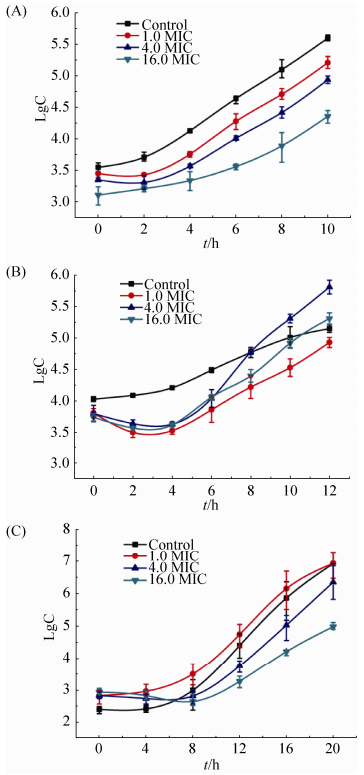
|
| 图 3. 不同浓度纳米银对3株标准菌株的“PAE”期生长曲线 Figure 3. PAE time curve of AgNPs on three model microbe. A: E. coli CVCC2081; B: S. aureus CVCC1882; C: C. albicans CMCC (F)98001. |
| Strains | PAE/h | ||
| 1.00 MIC | 4.00 MIC | 16.00 MIC | |
| C. albicans | 0 | 3.10 | 5.40 |
| E. coli | 1.08 | 2.08 | 3.22 |
| S. aureus | 1.30 | –1.90 | –0.90 |
2.6 纳米银对耐药菌的抗菌作用
在生物安全Ⅱ级实验室测定了纳米银对分离自临床的17株广谱耐药菌株的MIC值和MBC值 (表 2)。结果表明大肠杆菌和沙门氏菌相对敏感,MIC值为4.67–9.33 µg/mL,MBC值为10.00–16.00 µg/mL;人源性金黄色葡萄球菌BJ0151和肺炎克雷伯菌肺炎亚种R36的MIC值和MBC值达到26.70–32.00 µg/mL,是大肠杆菌的3–4倍。MBC/MIC值均小于或等于2。
3 讨论纳米银是一种广谱的抗菌材料,对多种革兰氏阳性菌、革兰氏阴性菌以及真菌有较强的杀灭作用,也对乙肝病毒、流感病毒和人获得性免疫缺陷综合征病毒等病毒有杀灭作用。纳米银虽受到关注和研究,但也得到很多抵制,原因在于因大规模生产和广泛使用纳米银必然导致进入自然水体和土壤中的纳米银剧增,这将改变水体和土壤中的微生物的数量和组成;也有学者关注纳米银对高等生物的安全性问题,比如真核细胞的基因毒性,鼠及鱼类的血清学及组织学变化。因实验对象和实验条件的差异在这方面并未得到一致的实验结果和认识。因此要科学使用纳米银,有必要认识其抗菌特性,避免滥用。
本研究以大肠杆菌CVCC2081、金黄色葡萄球菌CVCC1088和白色念珠菌CMCC (F)98001为对象,分别测定了纳米银的MBC/MIC值、时间–杀菌曲线和“抗生素后效应”。药物耐受性是指药物的最小杀菌浓度显著大于其最小抑菌浓度的现象,一般认为MBC/MIC≥32时,细菌对该药物具有耐受性[28-30]。本文结果显示纳米银对3种模式菌和17株多重耐药菌的MBC/MIC值均小于或等于2,说明纳米银对它们具有强烈的杀灭作用。
根据药效学特点,可将抗菌物质分为浓度依赖型和时间依赖型两类,浓度依赖型抗菌物质随其浓度增加杀菌作用增强,如氨基糖甙类和喹诺酮类抗生素;时间依赖性抗菌物质不会随其浓度增加杀菌作用增强,其杀菌作用主要与高于最低抑菌浓度 (MIC) 的时间相关,如β-内酰胺类抗生素[31]。图 3显示,纳米银浓度在2.0–16.0 MIC范围内,纳米银的杀菌效果并没有随浓度的增加而明显增加,因此纳米银对于3种模式菌株是时间依赖性抗菌剂。应用时间依赖型抗菌剂,应该争取使感染部位纳米银浓度持续地大于最小抑菌浓度,避免不断增加纳米银浓度,可以通过持续给药或者多次给药的方式达到最好的治疗效果。纳米银在一定浓度下对真核细胞也有毒性作用,相关研究者报道纳米银对鼠肝细胞IC50=24.0 μg/mL,人肺上皮细胞IC50 > 100.0 μg/mL,人牙龈上皮细胞IC50=39.5 μg/mL[32-34]。在本研究中,纳米银对革兰氏阴/阳性菌及白色念珠菌的MIC值在1.00–4.00 μg/mL间,17株临床分离的多重耐药菌株最高的MIC值为26.00 μg/mL。所以,按时间依赖性抗菌剂用药,纳米银可以杀灭细菌,又不会对真核细胞造成严重的细胞毒性。本研究结果是首次把纳米银定性为时间依赖性抗菌剂,对科学应用纳米银抗菌极其重要。
抗生素后效应 (PAE) 是评价抗生素疗效的一个重要指标。PAE系指细菌与抗生素短暂接触,当药物浓度下降低于MIC或消除后,细菌的生长仍受到持续抑制的效应。本文参照抗生素后效应理论,测量了纳米银对3株模式菌株的“抗生素后效应”。表 2显示,纳米银对白色念珠菌和大肠杆菌的“PAE”时间与纳米银浓度有关,在4.0 MIC值浓度下,生长分别被延迟2–3 h,16.0 MIC值浓度下延迟3–5 h。1.0 MIC值纳米银对白色念珠菌没有PAE效应,大肠杆菌延迟1 h。具有PAE效应的药物在临床应用时可以适当增加给药时间间隔,所以这样既可以有效杀灭细菌,又可以减少不良反应。但值得注意的是,金黄色葡萄球菌对纳米银作用的PAE效应异常。4.0、16.0 MIC的纳米银对金黄色葡萄球菌不仅没有表现出“抗生素后效应”,反而是促进其生长,尤其是在4.0 MIC时 (图 3-B);在时间杀菌曲线实验中,在前8 h内8.0 MIC和16.0 MIC的纳米银对金黄色葡萄杀菌作用弱于2.0 MIC和4.0 MIC的杀菌作用 (图 2-B)。Zong ming Xiu和Zhi Guo也独立地观察到这种现象[17, 35]。这种现象可能与金黄色葡萄球菌不同的基因应对策略有关,即药物在一定浓度范围内可以激活细菌修复机制来抵抗药物毒性,导致细菌代偿性生长[36]。这个问题值得今后深入研究,金黄色葡萄球菌依赖一种什么分子机制应对纳米银的处理?是否有其他细菌存在类似的反应?这对指导临床用药很重要。
在本次研究中,我们注意到纳米银对不同种类的微生物MIC值、MBC值上的差异,特别是耐药菌株有更高的MIC值和MBC值,这与Panacek的结果相似[37],但Humberto的研究结果显示纳米银对普通菌株和耐药菌株的抗菌效果无差异[38],这可能与不同实验室研究的样品种类的差异有关。我们发现在耐药菌株中,大肠杆菌相比于金黄色葡萄球菌和肺炎克雷伯菌对纳米银更敏感。现在学界普遍认为抗菌机制是纳米银或其释放出的银离子诱导细胞产生活性氧损伤质膜和DNA;另一方面,纳米银在细胞中释放的银离子结合酶的巯基基团,进而使酶失活[39],这些酶包括呼吸链中的丙酮酸脱氢酶和三羧酸循环中的顺乌头酸酶等[40-41]。因此,纳米银抗菌、抗病毒表现为广谱性,MIC值上的差异一方面是因为微生物的表面结构上差异,比如革兰氏阳性细菌细胞壁一般含有90%肽聚糖和10%磷壁酸,厚度大约为20–80 nm;而革兰氏阴性细菌细胞壁由10%的肽聚糖和外膜构成,厚度大约为8–11 nm,所以革兰氏阳性细菌细胞膜机械强度远大于革兰氏阴性细菌。另一方面,不同微生物对纳米银刺激后基因水平的响应能力和响应种类不同。我们曾用1.0 MIC值的纳米银处理E. coli BW3511至5 min后,E. coli无氧酵解的相关基因的转录水平上调,个别基因表达上调20倍以上[42]。Gordon用0.12 mol/L AgNO3处理金黄色葡萄球菌90 min后,糖酵解的相关基因部分表达上调 (如fruK和pyk),部分表达下调 (如pdhA和gapA-2),值得注意的是抗氧相关的基因大部分表达上调 (如gpxA-2和ahpF)[41]。最后,就是耐银离子的菌株。Guptake分离到耐纳米银的大肠杆菌 (如K-12和O157:H7),分析发现耐受原因是其能编码并组装出将银离子、铜离子等外排出菌体的蛋白质泵,这些基因存在于细菌基因组中,短时间内不会发生大量的水平传播,但也要引起足够的重视[43]。
致谢:本文动物源性耐药菌株由西南大学黄伟博士和中国疾病控制中心传染病预防控制所熊衍文博士惠赠,在此深表谢意。
| [1] | Klasen HJ. Historical review of the use of silver in the treatment of burns. Ⅰ. Early uses. Burns, 2000, 26(2): 117–130 DOI:10.1016/S0305-4179(99)00108-4 . |
| [2] | Klasen HJ. A historical review of the use of silver in the treatment of burns. Ⅱ. Renewed interest for silver. Burns, 2000, 26(2): 131–138 DOI:10.1016/S0305-4179(99)00116-3 . |
| [3] | Lansdown ABG. Silver Ⅰ: its antibacterial properties and mechanism of action. Journal of Wound Care, 2002, 11(4): 125–130 DOI:10.12968/jowc.2002.11.4.26389 . |
| [4] | Chopra I. The increasing use of silver-based products as antimicrobial agents: a useful development or a cause for concern?. Journal of Antimicrobial Chemotherapy, 2007, 59(4): 587–590 DOI:10.1093/jac/dkm006 . |
| [5] | Taubes G. The bacteria fight back. Science, 2008, 321(5887): 356–361 DOI:10.1126/science.321.5887.356 . |
| [6] | Caminero JA, Sotgiu G, Zumla A, Migliori GB. Best drug treatment for multidrug-resistant and extensively drug-resistant tuberculosis. The Lancet Infectious Diseases, 2010, 10(9): 621–629 DOI:10.1016/S1473-3099(10)70139-0 . |
| [7] | Rizzello L, Pompa PP. Nanosilver-based antibacterial drugs and devices: mechanisms, methodological drawbacks, and guidelines. Chemical Society Reviews, 2014, 43(5): 1501–1518 DOI:10.1039/C3CS60218D . |
| [8] | Jones SA, MPhil PGB, Walker M, Parsons D. Controlling wound bioburden with a novel silver-containing Hydrofiber® dressing. Wound Repair and Regeneration, 2004, 12(3): 288–294 DOI:10.1111/wrr.2004.12.issue-3 . |
| [9] | Albrecht MA, Evans CW, Raston CL. Green chemistry and the health implications of nanoparticles. Green Chemistry, 2006, 8(5): 417–432 DOI:10.1039/b517131h . |
| [10] | Kim JS, Kuk E, Yu KN, Kim JH, Park SJ, Lee HJ, Kim SH, Park YK, Park YH, Hwang CY, Kim YK, Lee YS, Jeong DH, Cho MH. Antimicrobial effects of silver nanoparticles. Nanomedicine: Nanotechnology, Biology, and Medicine, 2007, 3(1): 95–101 DOI:10.1016/j.nano.2006.12.001 . |
| [11] | Cohen MS, Stern JM, Vanni AJ, Kelley RS, Baumgart E, Field D, Libertino JA, Summerhayes IC. In vitro analysis of a nanocrystalline silver-coated surgical mesh. Surgical Infections, 2007, 8(3): 397–403 DOI:10.1089/sur.2006.032 . |
| [12] | Furno F, Morley KS, Wong B, Sharp BL, Arnold PL, Howdle SM, Bayston R, Brown PD, Winship PD, Reid HJ. Silver nanoparticles and polymeric medical devices: a new approach to prevention of infection?. Journal of Antimicrobial Chemotherapy, 2004, 54(6): 1019–1024 DOI:10.1093/jac/dkh478 . |
| [13] | Maneerung T, Tokura S, Rujiravanit R. Impregnation of silver nanoparticles into bacterial cellulose for antimicrobial wound dressing. Carbohydrate Polymers, 2008, 72(1): 43–51 DOI:10.1016/j.carbpol.2007.07.025 . |
| [14] | Jain P, Pradeep T. Potential of silver nanoparticle-coated polyurethane foam as an antibacterial water filter. Biotechnology and Bioengineering, 2005, 90(1): 59–63 DOI:10.1002/(ISSN)1097-0290 . |
| [15] | Iravani S. Green synthesis of metal nanoparticles using plants. Green Chemistry, 2011, 13(10): 2638–2650 DOI:10.1039/c1gc15386b . |
| [16] | Park TJ, Lee KG, Lee SY. Advances in microbial biosynthesis of metal nanoparticles. Applied Microbiology and Biotechnology, 2016, 100(2): 521–534 DOI:10.1007/s00253-015-6904-7 . |
| [17] | Xiu ZM, Zhang QB, Puppala HL, Colvin VL, Alvarez PJJ. Negligible particle-specific antibacterial activity of silver nanoparticles. Nano Letters, 2012, 12(8): 4271–4275 DOI:10.1021/nl301934w . |
| [18] | Yang XY, Gondikas AP, Marinakos SM, Auffan M, Liu J, Hsu-Kim H, Meyer JN. Mechanism of silver nanoparticle toxicity is dependent on dissolved silver and surface coating in Caenorhabditis elegans. Environmental Science & Technology, 2012, 46(2): 1119–1127 . |
| [19] | Yan L, Qin TC, Ingle T, Yan J, He WW, Yin JJ, Chen T. Differential genotoxicity mechanisms of silver nanoparticles and silver ions. Archives of Toxicology, 2016: 1–11 . |
| [20] | Bai L, Hurley D, Li J, Meng Q, Wang J, Fanning S, Xiong YW. Characterisation of multidrug-resistant Shiga toxin-producing Escherichia coli cultured from pigs in China: co-occurrence of extended-spectrum β-lactamase-and mcr-1-encoding genes on plasmids. International Journal of Antimicrobial Agents, 2016, 48(4): 445–448 DOI:10.1016/j.ijantimicag.2016.06.021 . |
| [21] | Qin GQ, Xiong YX, Tang S, Zhao P, Doering JA, Beitel SC, Hecker M, Wang M, Liu HL, Lu HL, Du HM. Impact of predator cues on responses to silver nanoparticles in Daphnia carinata. Archives of Environmental Contamination and Toxicology, 2015, 69(4): 494–505 DOI:10.1007/s00244-015-0165-4 . |
| [22] | 中华人民共和国国家质量监督检验检疫总局. GB 15979-2002一次性使用卫生用品卫生标准. 北京: 中国标准出版社, 2002. |
| [23] | Xiong XH, Hu YY, Hong XS, Yang Y. Study on bactericidal capability of silver nanoparticles to Escherichia coli in water. Industrial Water & Wastewater, 2014, 45(3): 39–43 (in Chinese). 熊旭华, 胡勇有, 洪学森, 杨杨. 纳米银对水中大肠杆菌的杀菌性能研究. 工业用水与废水, 2014, 45(3): 39–43. |
| [24] | CLSI. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard-seventh edition. M7-A7. Wayne, Pennsylvania: The Clinical and Laboratory Standards Institute, 2006. |
| [25] | CLSI. Reference method for broth dilution antifungal susceptibility testing of yeasts; approved standard-second edition. M27-A2. Wayne, Pennsylvania: The Clinical and Laboratory Standards Institute, 2002. |
| [26] | Bundtzen RW, Gerber AU, Cohn DL, Craig WA. Postantibiotic suppression of bacterial growth. Clinical Infectious Diseases, 1981, 3(1): 28–37 DOI:10.1093/clinids/3.1.28 . |
| [27] | Horgen L, Legrand E, Rastogi N. Postantibiotic effect of amikacin, rifampin, sparfloxacin, clofazimine and clarithromycin against Mycobacterium avium. Research in Microbiology, 1997, 148(8): 673–681 DOI:10.1016/S0923-2508(99)80066-7 . |
| [28] | Tuomanen E, Durack DT, Tomasz A. Antibiotic tolerance among clinical isolates of bacteria. Clinical Infectious Diseases, 1985, 7(3): 368–386 DOI:10.1093/clinids/7.3.368 . |
| [29] | May J, Shannon K, King A, French G. Glycopeptide tolerance in Staphylococcus aureus. Journal of Antimicrobial Chemotherapy, 1998, 42(2): 189–197 DOI:10.1093/jac/42.2.189 . |
| [30] | Dore MP, Osato MS, Realdi G, Mura I, Graham DY, Sepulveda AR. Amoxycillin tolerance in Helicobacter pylori. Journal of Antimicrobial Chemotherapy, 1999, 43(1): 47–54 DOI:10.1093/jac/43.1.47 . |
| [31] | Tan SY, Liu Y. Pharmacodynamic index of antibiotics and optimization of medication. Inner Mongolia Medical Journal, 2004, 36(2): 129–131 (in Chinese). 谭守印, 刘莹. 抗生素的药效学指标与给药方案优化. 内蒙古医学杂志, 2004, 36(2): 129–131. |
| [32] | Hussain SM, Hess KL, Gearhart JM, Geiss KT, Schlager JJ. In vitro toxicity of nanoparticles in BRL 3A rat liver cells. Toxicology in Vitro, 2005, 19(7): 975–983 DOI:10.1016/j.tiv.2005.06.034 . |
| [33] | Suliman Y AO, Ali D, Alarifi S, Harrath AH, Mansour L, Alwasel SH. Evaluation of cytotoxic, oxidative stress, proinflammatory and genotoxic effect of silver nanoparticles in human lung epithelial cells. Environmental Toxicology, 2015, 30(2): 149–160 DOI:10.1002/tox.v30.2 . |
| [34] | Taleghani F, Yaraii R, Sadeghi R, Haghgoo R, Rezvani MB. Cytotoxicity of silver nanoparticles on human gingival epithelial cells: an in vitro study. Journal of Dental School, 2014, 32(1): 30–36 . |
| [35] | Guo Z, Chen GQ, Liu LZ, Zeng GM, Huang ZZ, Chen AW, Hu L. Activity variation of phanerochaete chrysosporium under nanosilver exposure by controlling of different sulfide sources. Scientific Reports, 2016, 6: 20813 DOI:10.1038/srep20813 . |
| [36] | Calabrese EJ. Overcompensation stimulation: a mechanism for hormetic effects. Critical Reviews in Toxicology, 2001, 31(4/5): 425–470 . |
| [37] | Panáček A, Kvítek L, Prúcek R, Kolár M, Večeřová R, Pizúrová N, Sharma VK, Nevěčná T, Zbořil R. Silver colloid nanoparticles: synthesis, characterization, and their antibacterial activity. The Journal of Physical Chemistry B, 2006, 110(33): 16248–16253 DOI:10.1021/jp063826h . |
| [38] | Lara HH, Ayala-Núñez V, del Carmen Ixtepan Turrent L, Rodríguez-Padilla C. Bactericidal effect of AgNPs against multidrug-resistant bacteria. World Journal of Microbiology and Biotechnology, 2009, 26(4): 615–621 . |
| [39] | Liau SY, Read DC, Pugh WJ, Furr JR, Russell AD. Interaction of silver nitrate with readily identifiable groups: relationship to the antibacterialaction of silver ions. Letters in Applied Microbiology, 1997, 25(4): 279–283 DOI:10.1046/j.1472-765X.1997.00219.x . |
| [40] | Li WR, Xie XB, Shi QS, Zeng HY, Ouyang YS, Chen YB. Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli. Applied Microbiology and Biotechnology, 2010, 85(4): 1115–1122 DOI:10.1007/s00253-009-2159-5 . |
| [41] | Gordon O, Vig Slenters T, Brunetto PS, Villaruz AE, Sturdevant DE, Otto M, Landmann R, Fromm KM. Silver coordination polymers for prevention of implant infection: thiol interaction, impact on respiratory chain enzymes, and hydroxyl radical induction. Antimicrobial Agents and Chemotherapy, 2010, 54(10): 4208–4218 DOI:10.1128/AAC.01830-09 . |
| [42] | Du HM, Lo TM, Sitompul J, Chang MW. Systems-level analysis of Escherichia coli response to silver nanoparticles: the roles of anaerobic respiration in microbial resistance. Biochemical and Biophysical Research Communications, 2012, 424(4): 657–662 DOI:10.1016/j.bbrc.2012.06.134 . |
| [43] | Gupta A, Phung LT, Taylor DE, Silver S. Diversity of silver resistance genes in IncH incompatibility group plasmids. Microbiology, 2001, 147(12): 3393–3402 DOI:10.1099/00221287-147-12-3393 . |
 2017, Vol. 57
2017, Vol. 57