中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 常鑫园 , 谢占玲 , 张凤梅 , 雷洁琼 , 崔荣伟 , 聂守一 . 2017
- Xinyuan Chang, Zhanling Xie, Fengmei Zhang, Jieqiong Lei, Rongwei Cui, Shouyi Nie . 2017
- 镰刀菌Q7-31T内切葡聚糖酶Egn21的分离纯化及酶学性质
- Purification and characterization of endoglucanase Egn21 from Fusarium sp. Q7-31T
- 微生物学报, 2017, 57(1): 33-42
- Acta Microbiologica Sinica, 2017, 57(1): 33-42
-
文章历史
- 收稿日期:2016-04-11
- 修回日期:2016-06-20
- 网络出版日期:2016-07-19
真菌作为自然界分布最广,种类最多的分解者,是降解天然纤维素的重要成员,其具有很强的分泌纤维素及半纤维素酶的能力。纤维素是高等植物细胞壁的主要成分,占植物总干重的30%-50%,是地球上分布最广、含量最丰富的可再生性碳源化合物,占地球总生物量的40%[1]。据统计,植物每年通过光合作用使光能转化成生物能的生成量大约有1000亿吨,每年作物秸杆、稻梗等含纤维素较丰富的物质就有5亿吨之多,其中有89%能源未被人们利用[2-3]。大量的秸杆含丰富的纤维素物质,但其利用率很低,大多采用燃烧的方法来处理,这样就造成了环境污染,破坏了土壤的理化性质和丧失了有机质成分。所以,纤维素的充分利用与有效的转化对于解决当前的能源危机,粮食短缺,环境污染等具有重大的意义[1]。
天然的纤维素由排列整齐而规则的结晶区和相对不规则、松散的无定形区组成。纤维素链之间存在着氢键,通过氢键的缔合作用,形成纤维束,分子密度大的区域,成平行排列,形成结晶区;分子密度小的区域,分子间隙小,定向差,形成无定形区[4]。在自然界,纤维素分子一般均包埋或嵌合在半纤维素和木质素里,三者以复合体形式存在,并且木质素包围着纤维素且和半纤维素有着共价关系,共同形成较复杂的网状结构。
根据纤维素酶降解底物时不同的作用方式可将其分成3类:(1)内切纤维素酶又称之为内切葡聚糖酶(EG);(2)外切纤维素酶又称之为纤维二糖水解酶(CBH);(3) β-葡萄糖苷酶(BGL)。根据蛋白质结构域中氨基酸序列的相似性,将不同物种来源的碳水化合物活性酶类分成不同的蛋白质家族。其中糖苷水解酶现已有131个家族,纤维素酶类分布在至少17个GH家族中,是糖苷水解酶数据库中家族数目最多的一类水解酶类[5]。从其家族分布来看,内切纤维素酶分布最广,外切纤维素酶分布于内切纤维素酶家族之中,β-葡萄糖苷酶仅在GH5和GH9家族与内切/外切纤维素酶相关家族有交叠[6]。
镰刀菌属(Fusarium)为真菌中较大的一属。它广泛分布于自然界中,兼寄生或腐生生活。它是人类发现的最重要的植物病原菌之一[6]。田飞等发现,从青藏高原分离鉴定1株具有降解植物细胞壁的镰刀菌Q7-31T,提取其发酵液的胞外蛋白,经双向电泳和串联质谱鉴定,确定了6个超家族的葡萄糖苷水解酶(GH5,GH7,GH10,GH13,GH18和PL1),它们都参与了植物细胞壁的降解[7]。所有鉴定的酶中,内切葡聚糖酶是被鉴定频率最高的功能蛋白。鉴定的蛋白大部分为内切葡聚糖酶,包括GH10、GH7和GH5[6]。GH7家族主要的内切葡聚糖酶Egn20的相关信息已被研究[5]。本研究是以镰刀菌Q7-31T为实验材料,分离纯化鉴定了GH5家族的内切葡聚糖酶Egn21并研究其酶学性质。丰富和完善了Q7-31T对植物细胞壁降解酶组分的内容;对研究其降解机理具有重要的理论意义。
1 材料和方法 1.1 材料 1.1.1 菌种 镰刀菌Q7-31T由青海大学微生物实验室于2007年5月从青海湖地区分离得到现保藏在中国普通微生物菌种保藏管理中心(CGMCC,No. 3.17610)。 1.1.2 试剂 木聚糖(Birch Xylan)、木糖(Xylose)、羧甲基纤维素(CMC)、蛋白胨、十二烷基硫酸钠(SDS)购自Sigma公司,三羟甲基氨基甲烷(Tris)、低分子量蛋白Marker购自北京索莱宝科技有限公司,Sephacry S-100、DEAE-Sepharose Fast Flow购自Pharmacia公司。 1.1.3 仪器设备 数显恒温水浴锅HH-M8 (上海赫田科学仪器有限公司);TS-200恒温培养摇床(上海仪纯实业有限公司);250D光照培养箱(吉特实验仪器厂);LDZX-40Ⅱ立式自动压力蒸汽灭菌器(上海申安医疗器械厂);UGP-VCY-1000-WxDxH生物超净工作台(统钜净化设备上海有限公司);Adventurer TM天平(奥豪斯国际贸易(上海)有限公司);UV-9200紫外可见分光光度计(北京瑞利分析仪器公司);TDL-40B型台式低速离心机(上海安亭仪器厂);MD44透析袋(北京索莱宝科技有限公司)。 1.2 菌株培养从液体石蜡封存的菌种中挑取直径0.5 cm的琼脂块,接种到PDA平板培养基(马铃薯200 g,蔗糖20 g,琼脂15-20 g,蒸馏水1000 mL)中心,25 ℃恒温培养箱中活化5 d;从菌落边缘切下直径1 cm的琼脂块,转接至液体种子培养基(葡萄糖20 g/L,蛋白胨3 g/L,Mendels营养盐:(NH4)2SO4 1.4 g/L、KH2PO4 2.0 g/L、尿素0.3 g/L、CaCl2 0.3 g/L、MgSO4 0.3 g/L、FeSO4 5.0 mg/L、MnSO4 1.6 mg/L、ZnSO4 1.4 mg/L、CoCl2 2.0 mg/L,pH自然,装液量60 mL/150 mL),60 r/min摇床培养72 h;将液体种子培养基按10%的量接种至产酶液体发酵培养基(燕麦秸秆5 g/L、蛋白胨7 g/L、Mendels营养盐,pH自然,三角瓶装液量100 mL/ 250 mL),20 ℃、120 r/min摇床培养72 h。发酵液经8层无菌纱布过滤,得到粗酶液,4 ℃保存备用。
1.3 内切葡聚糖酶活力的测定采用DNS法(3’, 5’-二硝基水杨酸法)测定内切葡聚糖酶的活力及还原性糖的产量[8]。底物采用0.5%羧甲基纤维素(CMC),反应时间为30 min、40 ℃;在40 ℃下每分钟产生1 μmol还原糖所需的酶液量为一个酶活力单位(U)。
1.4 蛋白含量的测定蛋白含量的测定采用Bradford法[9],标准曲线是以牛血清白蛋白为标准绘制。在1.5 mL离心管中加入适当稀释的牛血清白蛋白200 μL,在加入1 mL G-250考马斯亮蓝染液5-30 min内在595 nm下测定光吸收值。
1.5 分离纯化内切葡聚糖酶 1.5.1 硫酸铵分级沉淀 将固体硫酸铵研磨细,缓慢加入粗酶液中,调节饱和度到10%-50%,充分混匀后,4 ℃静置2 h,随后4 ℃、12000×g离心20 min收集沉淀;沉淀以pH 6.5的Tris-HCl缓冲液重悬,重悬液经透析袋(MD透析袋,北京索莱宝科技有限公司,截留分子量为10 kDa)脱盐,4 ℃备用。 1.5.2 Sephacry S-100葡聚糖凝胶层析 硫酸铵分级沉淀后的样品加入到Sephacry S-100葡聚糖凝胶层析柱(26 mm×700 mm)[10],以Tris-HCl缓冲液(0.02 mol/L、pH 7.5)洗脱、流速为1.5 mL/min,用核酸蛋白检测仪检测蛋白的分布,DNS法测定酶的分布(方法如前面所描述)。 1.5.3 DEAE弱阴离子交换层析 取凝胶层析柱收集的内切葡聚糖酶活性部分,添加到DEAE琼脂糖凝胶弱阴离子交换柱(15 mm×50 mm)上,用含有NaCl (0.02-1.00 mol/L,pH 7.5)的缓冲液进行线性梯度洗脱(1.8 mL/min),用核酸蛋白检测仪检测蛋白分布;样品经MD44透析袋透析脱盐后,检测内切葡聚糖酶的分布(方法如前所述)。 1.6 SDS-PAGE用SDS-PAGE法检测每一步实验蛋白质分子量和分离纯化过程中蛋白纯度[11]。分离胶的浓度是10%,电泳电压是120 V;浓缩胶的浓度是3%,电泳电压是80 V[12]。
1.7 酶学性质研究 1.7.1 最适温度、pH及稳定性测定 最适温度测定:将底物处于pH 7.0的缓冲溶液中,在20-70 ℃ (Δt=5 ℃)进行酶促反应,之后测定CMC酶的最适反应温度;在同上温度温水浴30 min后测定酶的稳定性;最适pH测定:将底物处于不同pH的缓冲液pH 1-14 (Δt=1) 40 ℃条件下反应,然后测定CMC酶活力,确定最适反应pH;将样品分别在同上pH处理30 min,40 ℃,最适pH条件下测定酶的pH稳定性。 1.7.2 底物特异性测定 分别采取浓度均为0.5%的羧甲基纤维素钠、桦木木聚糖、可溶性淀粉、燕麦秸秆粉、麸皮、滤纸和果胶作为底物,酶活力测定方法参考上述内容。 1.7.3 米氏常数的测定 米氏常数Km用Michaelis-Menten方程计算出固定酶的浓度,在酶量不变的情况下确定酶反应速度与CMC底物浓度之间的定量关系。 1.7.4 金属离子对酶活力的影响 酶液中分别加入各种金属离子化合物:Fe2+、Co2+、Zn2+、Mg2+、Ca2+、K+、Na+、Mn2+、Cu2+和Hg2+,各种金属离子在反应体系中的终浓度达到4 mmol/L。40 ℃作用30 min后测定CMC酶活力。没有加入金属离子的酶活力作为100%。 1.8 蛋白鉴定蛋白鉴定是由北京华大基因完成,具体实验方法参照田飞等的研究[5, 13]。
1.9 数据处理与误差分析采用SPSS 19.0数据处理软件进行误差分析:采用两样本(测定管与对照管)平均数t检验法进行显著性检验(P < 0.01,线性相关性极显著;0.05>P>0.01,线性相关性显著;P>0.05,线性相关性不显著)[14]。
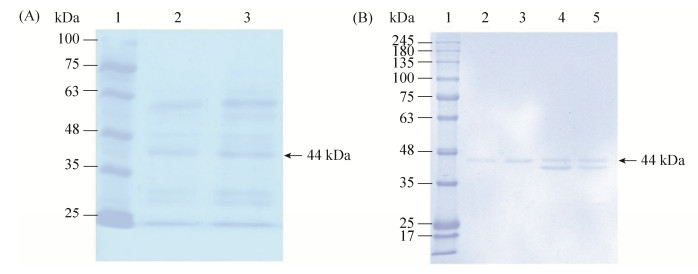
2 结果和分析 2.1 内切葡聚糖酶分离纯化发酵液经8层无菌纱布过滤,得到粗酶液。内切葡聚糖酶活性的蛋白样品在硫酸铵为10%-50%的饱和度条件下沉淀下来,蛋白样品在Tris-HCl (0.02 mol/L,pH 7.5)缓冲液中重悬,脱盐,取20 mL重悬液加入到SephacryS-100葡聚糖凝胶柱进行分级分离。对具有内切葡聚糖酶的酶活力的蛋白样品收集起来浓缩后上样到DEAE琼脂糖凝胶弱阴离子交换柱上进行二次分离纯化,洗脱图谱如图 1所示,有一个穿透峰P1和一个洗脱峰P2,酶活力检测发现有明显内切葡聚糖酶活力的酶样品主要集中在P2处,P1处蛋白样品无明显酶活力。分别对粗酶液、硫酸铵沉淀后重悬液、经过葡聚糖凝胶柱后及DEAE琼脂糖凝胶弱阴离子交换柱的蛋白进行SDS-PAGE检测。最终得到单一条带,经凝胶成像系统分析,分子量为44 kDa左右,将该蛋白命名为Egn21 (图 2)。

|
| 图 1. DEAE弱阴离子交换层析洗脱图谱 Figure 1. Elution profile of the DEAE ion-exchange column chromatography. p1, p2, protein peaks. |
|
| 图 2. 分离纯化蛋白过程的SDS-PAGE电泳图 Figure 2. SDS-PAGE of protein samples during separation and purification. A: lane 1: protein marker; lane 2: ammonium sulphate precipitation; lane 3: crude extract. B: lane 1: protein marker; lane 2, 3: protein samples after ion exchange chromatograph; lane 4, 5: protein samples after gel filtration. |
以600 mL发酵液开始,内切葡聚糖酶Egn21从粗酶液到最后的纯化产物共纯化了11.8倍,回收率为5%,酶纯化后的比活力为127.3 U/mg,分离纯化结果如表 1所示。
| Purification step | Total protein/mg |
Total activity/U | Specific activity/(U/mg) | Purification (fold) |
Yield/% |
| Crude extract | 26.70 | 288.0 | 10.8 | 1.0 | 100 |
| Ammonium sulphate precipitation | 5.20 | 145.0 | 27.9 | 2.6 | 50 |
| Sephacryl S-100 gel filtration | 0.33 | 32.1 | 106.7 | 10.0 | 11 |
| DEAE-sepharose ion-exchange column Chromatography |
0.11 | 14.0 | 127.3 | 11.8 | 5 |
2.2 酶学性质分析 2.2.1 最适温度、pH及稳定性测定 Egn21的最适反应温度、pH及其稳定性情况如图 3、4所示。该酶的最适反应温度是40 ℃,最适pH是6;纯化的该酶在温度为45 ℃以下恒温水浴30 min仍然可以保持原有酶活力的80%以上,温度高于40%酶活开始降低;该酶在pH 5.0-8.0范围内酶活力可以保持70%以上,与相关文献研究结果类似[15-16]。

|
| 图 3. Egn21最适温度和温度稳定性检测 Figure 3. Effects of temperature on the activity and stability of Egn21. A: enzyme activity; B: thermal stability. |

|
| 图 4. Egn21最适pH和pH耐受性检测 Figure 4. Effects of pH on the activity and stability of Egn21. A: enzyme activity; B: pH stability. |
2.2.2 底物特异性检测 该酶对降解羧甲基纤维素钠具有较高酶活力,对于降解木聚糖、燕麦秸秆、滤纸和果胶具有不明显酶活力,对于淀粉和麸皮没有降解活力,结果如表 2所示。
| Substrates | Specific activity/(U/mg protein) |
| Carboxymethylcellulose | 105.95 |
| Xylan | 8.75 |
| Starch | 0 |
| Pectin | 0 |
| Filter paper | 0.42 |
| Oat straw | 1.83 |
| Bran | 0.64 |
2.2.3 Egn21米氏常数测定 经过双倒数法计算,Egn21降解CMC的Km值为13.79 mg/mL,Vmax为14.03 μg/(min·mL)。 2.2.4 金属离子对酶活力影响的测定 对金属离子检测结果显示:Co2+、Zn2+和Mg2+对酶活力没有明显影响,有研究表明Co2+可能对稳定酶蛋白结构起到一定作用[17],其他金属离子对Egn21酶活性有着不同程度的抑制作用,与相关文献结果类似[18](图 5)。

|
| 图 5. 金属离子对Egn21的CMC酶活力的影响 Figure 5. Effect of metal ions on CMCase activity of Egn21, each value in the panel represents the means (n=3). |
2.3 Egn21的鉴定
首先对Egn21的蛋白样品进行双向电泳检测结果显示:Egn21的分子量为44.25 kDa、等电点为4.91(电泳图未给出);进行串联质谱分析先通过一级质谱获得蛋白的肽指纹图谱(PMF),再选取有代表性的肽段,进一步破碎后进行二级质谱检测,质谱图如图 6所示,二级质谱获得1段多肽序列:KGAYAIIDPHNYGR。二级质谱结果结合母离子信息和PMF的结果进行搜库(NCBI)比较,经Mascot搜索引擎检索,Egn21对应结果为GH5家族内切葡聚糖酶,与Rosellinianecatrix (Sequence ID:dbj| GAP83786.1|) 93%相似。该蛋白的分子量和等电点与双向电泳检测显示的Egn21分子量和等电点有一定差异;根据其酶学性质与报道的内切葡聚糖酶不同[22]、质谱信息与GH5家族的内切葡聚糖酶相似,分子量和等电点与质谱结果对应的蛋白存在明显差异,综合上述研究结果,我们将Egn21鉴定为一种新型的GH5家族的内切葡聚糖酶。

|
| 图 6. Egn21质谱鉴定图谱 Figure 6. Identification of Egn21 by MADIL-TOF-TOF. |
3 讨论
国内外已经报道了许多关于来源不同的纤维素酶分离、纯化及酶学特性的研究,但是对于镰刀菌的研究大多局限于其致病性的防治或对病虫害的防治方面[19],而对利用镰刀菌产酶方面的研究甚少。镰刀菌侵染植物首先分泌各种酶破坏细胞壁,前期实验发现与其他产植物细胞壁降解酶的镰刀菌相比,菌株Q7-31T粗酶液降解植物细胞壁的能力最高[18]。实验室早前进行了比较蛋白组学研究,2015年本团队发现胞外酶系主要为糖苷水解酶类,占到整个胞外蛋白分泌量的40%,其中GH5家族的内切葡聚糖酶占到了13%,在降解植物细胞壁时起到了重要的作用[7];Marx等研究发现GH5家族,在纤维素酶、半纤维素酶、碳水化合物转移酶等不同酶类家族中占核心地位[20]。
田飞等在研究镰刀菌Q7-31T所产的纤维素酶系统中发现,内切葡聚糖酶主要有两大家族GH5和GH7。GH7家族主要的酶为Egn20[14],其产酶培养基蛋白浓度为0.3%。在我们前期研究中发现不同蛋白浓度的培养基中产酶组分和活性都有明显的差异,因此,本研究我们选用1%蛋白浓度培养基来研究不同纤维素酶组分,并且分离纯化到GH7家族的Egn21(本研究的工作)。
两种酶是存在差异的:Egn20发酵培养基蛋白质浓度是0.3%,分级硫酸铵浓度40%-90%;Egn21发酵培养基蛋白质浓度是1%;分级硫酸铵浓度是10%-50%。酶学性质分析,Egn20与Egn21最适温度、pH及稳定性相同;纯化的两种酶对于羧甲基纤维素(CMC)有较高的降解活力,对于其他底物有不明显的降解活力,Egn20与Egn21均可以降解天然燕麦秸秆粉,并最终产生还原性糖,这与天然混合底物中存在两种酶特异性识别的底物位点而糖苷酶的专一性普遍不高有着必然的联系[21]。经双倒数法计算,Egn21与Egn20降解CMC的Km值分别为13.79 mg/mL和16.35 mg/mL,Egn21在降解CMC时吸附底物的能力强于Egn20,田飞等研究蛋白组学时发现GH5家族内切酶的分泌量是Egn20的2倍[7]。由此推断,在降解植物细胞壁时GH5家族的内切葡聚糖酶起到关键作用,这与刘晶晶等在木酶属中蛋白组学研究结果一致[16]。
纯化的Egn21在高于50 ℃时,降解羧甲基纤维素钠的酶活力不足原有酶活力40%,温度耐受力低,对于工业应用比较不利。其原因是Q7-31T在海拔3200 m的青海湖生长,年均温度0.3-11.0 ℃之间,所以培养出不耐高温的菌株。纯化的Egn21可以降解天然混合底物产生还原性糖,并且对木聚糖也存在较弱的降解活力,这可能与天然混合底物中存在Egn21特异性识别的底物位点以及糖苷酶的专一性普遍不高有关[17]。
Egn21的二级质谱鉴定对应结果为与注册号为gi︱345566250的糖苷水解酶相似,得分为36。根据Mascot的鉴定结果显示得分大于45才能说明为同一个蛋白(P < 0.05),此外,其分子量(44.25 kDa)和等电点(4.91)与质谱结果对应的蛋白的分子量(45.41 kDa)和等电点(6.91)存在一定差异,根据上述推测它们的序列相似但并不完全一致。Egn21的酶学性质与报道的内切葡聚糖酶一致、质谱信息与GH5家族的内切葡聚糖酶相似,而分子量和等电点与质谱结果对应的蛋白存在一定差异,综合上述研究结果,我们将Egn21鉴定为一种新的GH5家族的内切葡聚糖酶。
| [1] | Gao HY, Xie ZL, Tang YL, Wang H. Synergistic and antagonistic effects of fungi mixed cultivation from four different genus strains on degradability towards oat straw degradation. Journal of Qinghai Normal University (Natural Science Edition) , 2011 (1) : 57–62 (in Chinese). 高海燕, 谢占玲, 汤易兰, 王欢. 混菌发酵降解燕麦秸秆及不同属真菌间的协同和拮抗作用研究. 青海师范大学学报(自然科学版) , 2011 (1) : 57–62. |
| [2] | Zhang PP, Liu XH. Current situation and progress of biodegradation of cellulose. Journal of Tianjin Agricultural College , 2004, 11 (3) : 48–54 (in Chinese). 张平平, 刘宪华. 纤维素生物降解的研究现状与进展. 天津农学院学报 , 2004, 11 (3) : 48–54. |
| [3] | Wang WY, Zhu JH, Wu SY. Research progress of cellulose science and cellulase. Journal of Jiangsu University of Science and Technology , 1998, 19 (3) : 20–28 (in Chinese). 汪维云, 朱金华, 吴守一. 纤维素科学及纤维素酶的研究进展. 江苏理工大学学报 , 1998, 19 (3) : 20–28. |
| [4] | Gu FY, Chen ZY, Shi JJ, Qian SJ. Advances in cellulase and its development tendency. Journal of Microbiology , 2008, 28 (1) : 83–87 (in Chinese). 顾方媛, 陈朝银, 石家骥, 钱世均. 纤维素酶的研究进展与发展趋势. 微生物学杂志 , 2008, 28 (1) : 83–87. |
| [5] | Tian F, Xie ZL, Guo J, Zhao LZ, Han XB, Chang XY. Purification, identification and characterization of an endoglucanase Egn20 from Fusarium sp. Q7-31T. Acta Microbiologica Sinica , 2015, 55 (8) : 1042–1049 (in Chinese). 田飞, 谢占玲, 郭璟, 赵联正, 韩兴宝, 常鑫园. 镰刀菌Q7-31T内切葡聚糖酶Egn20的分离纯化鉴定及酶学特性. 微生物学报 , 2015, 55 (8) : 1042–1049. |
| [6] | 田飞. 镰刀菌Q7-31T植物细胞壁降解酶协同作用研究. 2015 . |
| [7] | Tian F, Xie ZL, Zhao LZ, Guo J, Han XB, Xie LF, Wang Y, Chang XY. Comparative secretome analysis of Fusarium sp. Q7-31T during liquid fermentation using oat straw as a carbon source. Annals of Microbiology , 2015, 65 (4) : 2131–2140 DOI:10.1007/s13213-015-1051-z . |
| [8] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry , 1959, 31 (3) : 426–428 DOI:10.1021/ac60147a030 . |
| [9] | Kruger NJ. The Bradford method for protein quantitation//Walker JM. The Protein Protocols Handbook. Totowa, NJ:Humana Press Inc., 1996:15-20. |
| [10] | Chandra M, Kalra A, Sangwan NS, Sangwan RS. Biochemical and proteomic characterization of a novel extracellular β-glucosidase from Trichoderma citrinoviride. Molecular Biotechnology , 2013, 53 (3) : 289–299 DOI:10.1007/s12033-012-9526-7 . |
| [11] | Yang XZ, Shi PJ, Huang HQ, Luo HY, Wang Y, Zhang W, Yao B. Two xylose-tolerant GH43 bifunctional β-xylosidase/α-arabinosidases and one GH11 xylanase from Humicola insolens and their synergy in the degradation of xylan. Food Chemistry , 2014, 148 : 381–387 DOI:10.1016/j.foodchem.2013.10.062 . |
| [12] | Hu JG, Arantes V, Pribowo A, Saddler JN. The synergistic action of accessory enzymes enhances the hydrolytic potential of a "cellulase mixture" but is highly substrate specific. Biotechnology for Biofuels , 2013, 6 : 112 DOI:10.1186/1754-6834-6-112 . |
| [13] | Terova G, Pisanu S, Roggio T, Preziosa E, Saroglia M, Addis MF. Proteomic profiling of sea bass muscle by two-dimensional gel electrophoresis and tandem mass spectrometry. Fish Physiology and Biochemistry , 2014, 40 (1) : 311–322 DOI:10.1007/s10695-013-9855-x . |
| [14] | Brown JR, Dinu V. High performance computing methods for the integration and analysis of biomedical data using SAS. Computer Methods and Programs in Biomedicine , 2013, 112 (3) : 553–562 DOI:10.1016/j.cmpb.2013.07.003 . |
| [15] | Huang Y, Ling M, Qin YL, Liang ZQ. Cloning and expression of endoglucanase of Ⅰ T. Knoningii. Biotechnology , 2008, 18 (2) : 10–13 (in Chinese). 黄艳, 凌敏, 覃拥灵, 梁智群. 康氏木霉内切葡聚糖酶(EGI)基因的克隆及表达. 生物技术 , 2008, 18 (2) : 10–13. |
| [16] | Liu JJ, Cao XJ. Biodegradation of cellulose by β-glucosidase and cellulase immobilized on a pH-responsive copolymer. Biotechnology and Bioprocess Engineering , 2014, 19 (5) : 829–837 DOI:10.1007/s12257-013-0716-3 . |
| [17] | Karnchanatat A, Petsom A, Sangvanich P, Piapukiew J, Whalley AJS, Reynolds CD, Gadd GM, Sihanonth P. A novel thermostable endoglucanase from the wood-decaying fungus Daldinia eschscholzii (Ehrenb.:Fr.) Rehm. Enzyme and Microbial Technology , 2008, 42 (5) : 404–413 DOI:10.1016/j.enzmictec.2007.11.009 . |
| [18] | Xie ZL, Gao HY, Zhang Q, Wang H, Liu Y. Cloning of a novel xylanase gene from a newly isolated Fusarium sp. Q7-31 and ITS expression in Escherichia coli. Brazilian Journal of Microbiology , 2012, 43 (1) : 405–417 DOI:10.1590/S1517-83822012000100049 . |
| [19] | Zhang YP. The research advance of biosynthesis and regulation mechanism on Fusarium mycotoxins. Chinese Bulletin of Life Sciences , 2011, 23 (3) : 311–316 (in Chinese). 张岳平. 镰刀菌真菌毒素产生与调控机制研究进展. 生命科学 , 2011, 23 (3) : 311–316. |
| [20] | Marx IJ, van Wyk N, Smit S, Jacobson D, Viljoen-Bloom M, Volschenk H. Comparative secretome analysis of Trichoderma asperellum S4F8 and Trichoderma reesei Rut C30 during solid-state fermentation on sugarcane bagasse. Biotechnology for Biofuels , 2013, 6 : 172 DOI:10.1186/1754-6834-6-172 . |
| [21] | Wang LS, Zhang YZ, Gao PJ, Shi DX, Liu HW, Gao HJ. Changes in the structural properties and rate of hydrolysis of cotton fibers during extended enzymatic hydrolysis. Biotechnology and Bioengineering , 2006, 93 (3) : 443–456 DOI:10.1002/(ISSN)1097-0290 . |
| [22] | Ghatge SS, Telke AA, Kang SH, Arulalapperumal V, Lee KW, Govindwar SP, Um Y, Oh DB, Shin HD, Kim SW. Characterization of modular bifunctional processive endoglucanase Cel5 from Hahella chejuensis KCTC 2396. Applied Microbiology and Biotechnology , 2014, 98 (10) : 4421–4435 DOI:10.1007/s00253-013-5446-0 . |
 2017, Vol. 57
2017, Vol. 57




