中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 吕杰 , 吕光辉 , 马媛 . 2016
- Jie Lv, Guanghui Lv, Yuan Ma . 2016
- 新疆艾比湖沉积物中免培养放线菌的多样性
- Actinobacterial diversity in sediments of Ebinur lake, Xinjiang, China
- 微生物学报, 2016, 56(9): 1426-1433
- Acta Microbiologica Sinica, 2016, 56(9): 1426-1433
-
文章历史
- 收稿日期:2015-11-21
- 修回日期:2016-03-19
- 网络出版日期:2016-04-26
2. 绿洲生态重点实验室, 新疆 乌鲁木齐 830046
2. Xinjiang Key Laboratory of Oasis Ecology, Urumqi 830046, Xinjiang Uygur Autonomous Region, China
新疆境内有大于1 km2的天然湖泊139个,水域面积约5500 km2,属我国湖泊重要分布区之一,仅次于西藏、青海、江苏,居全国第4位。新疆境内的湖泊多形成于构造作用形成的断陷盆地或山间盆地,古河谷改道或淤塞而形成的汇水洼地或小盆地,以及风蚀作用形成的丘间洼地或低地。盆地边缘山区基岩的风化和淋滤以及地史上古盐的淋溶,不断对湖泊盐分进行补给。因此,新疆境内的天然湖泊中有近半数已演化到盐湖发展阶段,是我国盐湖主要的分布区之一。根据湖水含盐量的大小,而将湖泊划分为淡水湖、微咸水湖(半咸水湖)、咸水湖和盐湖(卤水湖)4大类型。此外,新疆湖泊多为河流的终点湖、面积随气候变化大,新疆干旱的气候,是现代盐湖形成和成盐作用的主要条件之一[1]。新疆盐湖成盐期虽然不长,但成盐作用强烈,近半个世纪上游大量引水灌溉、造成补给逐年减少,加剧了盐湖的演化过程。许多盐湖发展到自析盐阶段,形成了包括碳酸盐、硫酸盐、硼酸盐、氯化物和硝酸盐类多类型蒸发盐类的沉积,特别是硝酸盐类沉积矿物,是新疆盐湖所独有的[2-3]。
不同盐类型的盐湖中含有丰富且种类不同的耐盐及嗜盐微生物资源,但目前针对高盐环境中微生物资源多样性的研究报道较少,研究成果中大多都是微生物纯培养多样性调查工作[4-5]。而近些年利用免培养技术针对我国不同盐湖微生物多样性进行的研究已有了越来越多的报道,但针对盐湖免培养放线菌多样性的研究仅有少数的报道。
艾比湖(E 81°39′83-°36′,N 44°44′45-°08′)位于新疆准噶尔盆地西南缘的最低汇水中心。艾比湖盆地三面环山,南面是天山支脉婆罗科努山,西面是阿拉套山,北面是玛依力山,西北是著名的风区阿拉山口,东部与准噶尔盆地相连[6]。该地区为中温带大陆性气候,降水稀少、蒸发强烈,常年多风。20世纪以来,在区域气候波动和人类活动的双重影响下,艾比湖湖面急剧萎缩,湖水盐浓度日趋增加,已演化到盐湖发展阶段[7]。因此针对艾比湖湖底沉积物中放线菌多样性进行免培养研究,对丰富盐湖微生物研究及新疆盐湖发展不同阶段对微生物多样性的影响都颇具意义。
1 材料和方法 1.1 材料2013年7月进行样品采集,采样地点位于新疆艾比湖西北部正对阿拉山口的湖面部分(E 82°36′13″,N 45°05′03″),该部分湖面常年有水,非间歇性干涸湖底。分别采集该区域5份样本(W型取样,每个样点彼此间隔均超过50 m),采样深度湖底0–30 cm,沉积物装入无菌聚丙烯折角袋中车载冰箱4 ℃暂时保存,运回实验室后-80 ℃冻存备用。
1.2 试剂和仪器ZR Soil Microbe DNA KitTM (Zymo Research Cor- poration,USA),LA Taq DNA聚合酶(TaKaRa大连宝生物),pCR2.1T vector (Invitrogen,上海),DNA 凝胶回收试剂盒(Axygen,杭州),Hha Ⅰ (NEB,USA)、DNA Marker (TaKaRa大连宝生物),其他试剂均为国产分析纯。PCR扩增仪(Biometra,GER),电泳仪(六一,北京),凝胶成像仪(UVP,USA)。
1.3 沉积物理化因子测定将土样60 ℃烘干,分别过100目筛用于理化因子测定,等量混合5个不同的土样。Na+、K+、Mg2+、Ca2+离子采用火焰光度计法测定,Cl-、SO42-、CO32-、HCO3-采用滴定法测定[8]。
1.4 沉积物总DNA的提取将不同沉积物充分混匀,再等量混合5份沉积物样本,采用ZR土壤基因组DNA提取试剂盒对艾比湖湖底沉积物中总DNA进行提取,操作步骤按照试剂盒说明书进行。
1.5 16S rRNA基因的PCR扩增采用放线菌的特异性引物(S-C-Act-235-a-S-20:5′-CGCGGCCTATCAGCTTGTTG-3′;S-C-Act-0878-a-A-19:5′-CCGTACTCCCCAGGCGG GG-3′)[9]对艾比湖底沉积物中放线菌16S rRNA基因部分序列进行扩增。PCR反应条件参照文献报道的方法进行Touchdown PCR[10],调整PCR扩增循环数,保证扩增结果在指数扩增期内。扩增体系为25 μL,平行扩增3个重复,混合扩增产物进行凝胶回收,以避免单次PCR扩增的偏向性。
1.6 克隆文库构建凝胶回收产物与pCR2.1T vector连接,转E. coli DH5α感受态细胞,并进行蓝白斑筛选。随机挑取192个白斑进行培养,构建艾比湖湖底沉积物中放线菌16S rRNA基因序列的克隆文库。
1.7 阳性克隆子筛选与RFLP分型利用碱裂解法提取克隆文库质粒DNA,稀释50倍后作为模板,用T载体通用引物M13-20和M13 R对插入片段进行PCR扩增。反应条件为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min。PCR扩增产物进行1%的琼脂糖凝胶电泳检测,筛选后将阳性克隆子PCR产物,用限制性内切酶Hha Ⅰ 37 ℃过夜酶切,酶切产物用2.5%的琼脂糖凝胶电泳检测,不同RFLP条带类型所对应的克隆子送英骏公司进行测序,所得放线菌16S rRNA基因序列利用在线提交方式剔除嵌合子(http://comp-bio.anu.edu.au/bellerophon/bellerophon.pl)[11],去除嵌合子后将所得放线菌序列信息提交至GenBank数据库。
1.8 稀有度及系统发育分析为了检测所构建艾比湖放线菌16S rRNA基因序列文库是否可以涵盖沉积物中绝大多数放线菌类群,利用EstimateS 8.0软件进行稀有度分析并构建稀释度曲线,并运用公式C=1-ni/N 计算文库覆盖率C,(N代表克隆文库库容量,ni 代表在克隆文库中仅出现一次OTU的克隆子数量)。
将测序获得的放线菌16S rRNA基因序列在GenBank中进行BLAST相似性比对,16S rRNA基因序列相似性比对分析后,首先下载相似性较高有明确分类地位的放线菌16S rRNA基因序列,如果没有则下载相似性较高利用免培养技术获得相关菌株的16S rRNA基因序列,作为标准序列。随后用MEGA 5.0 (Molecular Evolutionary Genetics Analysis)软件采用邻接法(Neighbor-Joining)进行聚类分析及系统进化树构建[12]。进化树构建时辅以Ribosomal Database Project (RDP-II,http://rdp.cme.msu.edu/)在线分析工具的分析结果。不同克隆子16S rRNA基因序列相似性大于99%的归于同一个OTU (Operational Taxonomic Unit),相似性低于99%作为不同的分类单元[13]。
2 结果和分析 2.1 艾比湖湖底沉积物理化因子测定艾比湖湖水无色、无嗅稍浑浊,实验采样区域湖水pH为6.58,沉积物理化因子见表 1。沉积物中含有较高浓度的Na+和Ca2+,Mg2+和K+含量相对较少;阴离子中Cl-和SO42-含量很高,几乎不含CO32-和HCO3-。根据实验结果,艾比湖属于高矿化度卤水。新疆盐湖以浅水湖居多[1],艾比湖湖水深度也较小。20世纪以来,在区域气候波动和人类活动的双重影响下,艾比湖湖面急剧萎缩,湖水盐浓度日趋增加,已演化到盐湖发展阶段。根据实验的结果,艾比湖已发展为盐湖(卤水湖),如果补给再得不到缓解,正向自析盐阶段发展[2-3]。
| Organic matter/% | Concentration/(g/kg) | |||||||
| K+ | Ca2+ | Na+ | Mg2+ | Cl- | SO42- | CO32- | HCO3- | |
| 1.45 | 18.8 | 64.4 | 44.2 | 22.7 | 51.7 | 44.2 | 0.07 | 0.27 |
2.2 16S rRNA基因序列的PCR扩增
采用放线菌的特异性引物对艾比湖底沉积物中放线菌16S rRNA基因序列进行扩增,按照文献报道采用Touchdown PCR。PCR扩增出了3条特异性条带,分别是640 bp、800 bp和1400 bp (图 1),其中只有640 bp条带为目标片段,其余2条为非特异扩增片段,此PCR扩增产物的电泳结果与文献报道不相符合。因此本实验针对640 bp的目标基因片段进行了特异的回收,回收后进行电泳检测,观察回收效果。

|
| 图 1. 放线菌16S rRNA 基因PCR扩增结果 Figure 1. PCR results of actinobacterial 16S rRNA gene using primers S-C-Act-235-a-S-20 and S-C-Act-0878-a-A-19. M, DNA marker DL2000; lane1–3, different 16S rRNA amplicons of samples. |
2.3 16S rRNA基因序列文库构建及多样性指数分析
连接产物转化大肠杆菌感受态细胞进行的蓝白斑筛选所获白色克隆超过600个,随机挑选192个白色克隆分析。利用限制性内切酶Hha Ⅰ进行酶切分型,共挑选51个阳性克隆进行测序分析。测序后针对测序结果进行比对以及Chimera Check检测,结果显示文库中共含有166个阳性克隆,分别归于36个OTUs,GenBank注册号为KR182090-KR182131。
利用公式计算艾比湖沉积物中放线菌文库覆盖度,C值为0.904。同时将获得的放线菌16S rRNA基因文库数据绘制稀有度曲线,稀有度曲线如图 2所示。从稀有度曲线来看,本实验所获放线菌OTUs数随着克隆子数的增加而增加,但增幅较小,虽未明显达到饱和,但曲线已接近平台期,文库覆盖度结果表明克隆文库涵盖了本环境中90.4 %的放线菌类群。
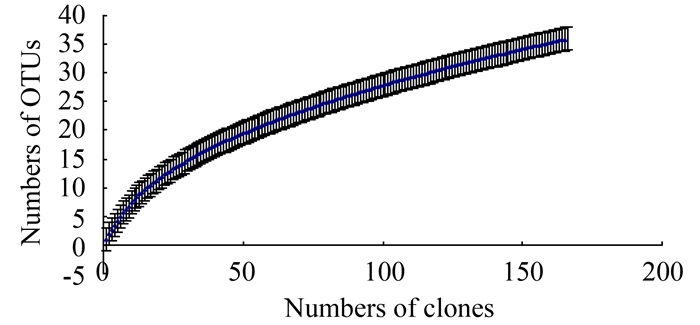
|
| 图 2. 艾比湖沉积物中放线菌16S rRNA基因克隆文库稀有度曲线 Figure 2. Rarefaction curves for Actinobacterial 16S rRNA gene clone library of sediments from Ebinur lake. |
2.4 基于免培养放线菌16S rRNA基因的系统发育分析
将获得36个放线菌16S rRNA基因序列在GenBank中进行BLAST相似性比对,将相似性较高的序列作为标准序列,利用MEGA 5.0软件采用邻接法聚类分析构建系统发育树(图 3),系统发育树聚类结果与利用RDP-II在线分析工具分类结果一致。聚类结果显示,采用免培养技术从艾比湖湖底沉积物中分离的放线菌类群分为2个部分,第1个类群经过比对有明确的分类地位,全部属于放线菌门(Actinobacteria)的放线菌纲(Actinobacteria),该类群占克隆文库18.1%;另外1个类群属于Unclassified Actinobacteria的类群,与已鉴定发表的放线菌菌株无较近的亲缘关系,该类群占整个克隆文库的81.9%,为艾比湖底沉积物中放线菌的主要类群。

|
| 图 3. Neighbor-Joining法构建艾比湖沉积物放线菌16S rRNA基因克隆文库系统发育树 Figure 3. Neighbor-Joining phylogenetic tree constructed showing the phylogenetic relationships among acinobacterial 16S rRNA gene sequences obtained from the sediment sample of Ebinur lake and their closely related sequences downloaded from GenBank. The numbers at nodes indicate the bootstrap values based on Neighbor-Joining analyses of 1000 resamples date sets. Bar, 0.01 sequence divergence. The numbers in parentheses are accession numbers of sequences. |
第1个类群仅包含放线菌纲,其中包含放线菌目(Actinomycetales)、丙酸杆菌目(Propionibacteriales)、微球菌目(Micrococcales)和棒杆菌目(Corynebacteriales) 4个目。其中放线菌目中含有1个放线菌科(Actinomycetaceae)的1个放线菌属(Actinomyces),占克隆文库0.6%;丙酸杆菌目中含有1个丙酸杆菌科(Propionibacteriaceae)的1个丙酸杆菌属(Propionibacterium),占克隆文库3.6%;微球菌目中含有3个放线菌的科,其中纤维素单胞菌科(Cellulomonadaceae) 含纤维素单胞菌属(Cellulomonas)(0.6%) 1个属,微杆菌科(Microbacteriacee)含微杆菌属(Microbacterium)(1.2%) 1个属,微球菌科(Micrococcaceae) 含节杆菌属(Arthrobacter) (1.8%)、考克氏菌属(Kocuria) (2.4%)、罗氏菌属(Rothia) (2.4%) 3个属,共占克隆文库8.4%;棒杆菌目中也含有3个放线菌的科,束村氏菌科(Tsukamurellaceae)含束村氏菌属(Tsukamurella) (0.6%) 1个属、诺卡氏菌科(Nocardiaceae)含戈登氏菌属(0.6%) (Gordonia)和红球菌属(Rhodococcus) (0.6%) 2个属、分枝杆菌科(Mycobacteriaceae)含分枝杆菌属(Mycobacterium)(4.2%) 1个属,共占克隆文库6.0%。而第2个类群通过系统发育分析分为3个不同的group,group 1 占0.6%,group 2占21.8%,group 3占57.1%。
3 讨论采用纯培养技术只能分离获得环境中少于10%以下的菌株,这极大限制了人们对环境中微生物资源的认识,而目前对于盐湖环境中放线菌资源的研究也多集中在纯培养菌株的获得方面[14]。近些年随分子生态学技术的发展,已有多位学者采用免培养技术来研究新疆盐湖当中的放线菌种类[15-16]。20世纪以来,艾比湖已从淡水湖发展为盐湖,并正向自析盐阶段发展,因此针对艾比湖湖底沉积物中放线菌多样性进行免培养初步研究,为我们进一步开发耐盐碱放线菌基因资源提供必要的信息,也为我们了解盐湖中放线菌菌群的生态学功能提供了必要的前期研究结果。
本研究结果中可进行明确分类的放线菌类群均属于放线菌纲,而有文献报道采用相同免培养技术对云南江城、黑井盐矿[17]和于田盐池[18]进行放线菌多样性研究,结果显示放线菌在酸微菌纲也有少量分布,多个研究结果表明在盐湖环境中放线菌纲为放线菌的主要类群。此外文库中占有82.5%的克隆序列是不能进行明确分类的,这些放线菌与已发表放线菌16S rRNA基因序列相似性低于97%。这些不能分类的放线菌可分为3个group,从系统发育树聚类结果看,group 2和group 3类群以极高的自展值形成了一个独立的分支,相对于group 1而言极有可能代表 1个新的目或者更高的分类单元,这说明艾比湖盐湖环境中存在着许多尚未为人所知的放线菌类群。
本研究中获得的多个科的放线菌(如纤维单孢菌科)至今在其它高盐环境中还没有获得其纯培养菌株,但克隆xjeb-act93(束村氏菌科)在进行BLAST相似性比对时与在其它高盐环境中所获得的放线菌纯培养有很高的相似性[19],该比对结果表明耐盐菌株纯培养分离技术还有待于发展。此外另一些部分不能进行分类的放线菌与新疆其它盐湖沉积物中获得的放线菌种类具有相对较高的相似性。如克隆xjeb-act40与新疆硝尔库勒湖沉积物中免培养放线菌(EU417736)相似性为98%[16];克隆xjeb-act1和xjeb-act5与艾丁湖沉积物中免培养放线菌(HQ718735)相似性分别为96%和97%[15],有些相似性虽未高于97%,但在相似性比对结果中为最高。而且以上克隆均在group 3类群中,从目前有限的放线菌资料比对结果表明新疆艾比湖中可能孕育了其独特的未知放线菌资源。
本文采用免培养法的方法对新疆艾比湖湖底沉积物中放线菌多样性进行了研究,比对结果表明,艾比湖高盐的环境孕育了多种未知的放线菌种类,此外新疆独特的极端环境可能蕴含着独特、丰富的放线菌品种。目前国内外关于极端环境微生物资源的研究正在火热的开展,新疆具有很多极端的生境,孕育了丰富的、特殊的极端微生物资源,有很多有意义的问题有待于去研究。例如在本研究中占克隆文库81.9%的未知放线菌,其在这一极端环境中的生物学和生态学功能是怎样的?新疆湖泊在从淡水湖演化到盐湖、干盐湖过程中,所含有的微生物菌群种类是如何变化,以及与环境因子的关系需要我们进一步的研究,这些研究对我们全面了解新疆湖泊演化过程中微生物群落结构变化规律具有重要的意义。
| [1] | Zheng XY. The formation and evolution of the environment of salt lakes in Xinjiang, China. Journal of Salt Lake Science , 1993, 1 (1) : 1–10 (in Chinese). 郑喜玉. 新疆盐湖的形成演化环境. 盐湖研究 , 1993, 1 (1) : 1–10. |
| [2] | Zhang MG. Research on the hydrochemical feature of the brine of salt lakes in Xinjiang. Journal of Salt Lake Science , 1993, 1 (1) : 17–32 (in Chinese). 张明刚. 新疆盐湖卤水水化学特征研究. 盐湖研究 , 1993, 1 (1) : 17–32. |
| [3] | Zheng XY, Liu JH. The composition and origin of salt lake brines in Xinjiang. Scientia Geographica Sinica , 1996, 16 (2) : 115–123 (in Chinese). 郑喜玉, 刘建华. 新疆盐湖卤水成分及其成因. 地理科学 , 1996, 16 (2) : 115–123. |
| [4] | Cui HL, Yang Y, Tohty D, Zhou PJ, Liu SJ. Biodiversity of halophilic archaea isolated from two salt lakes in Xinjiang region of China. Acta Microbiologica Sinica , 2006, 46 (2) : 171–176 (in Chinese). 崔恒林, 杨勇, 迪丽拜尔·托乎提, 周培瑾, 刘双江. 新疆两盐湖可培养嗜盐古菌多样性研究. 微生物学报 , 2006, 46 (2) : 171–176. |
| [5] | Xu XW, Wu M, Wu YH, Zhang HB. Culturable halophilic archaea of Ayakekumu lake located in Xinjiang. Acta Ecologica Sinica , 2007, 27 (8) : 3119–3123 (in Chinese). 许学伟, 吴敏, 吴月红, 张会斌. 新疆阿牙克库木湖可培养嗜盐古菌的种群结构. 生态学报 , 2007, 27 (8) : 3119–3123. DOI:10.1016/S1872-2032(07)60066-3 |
| [6] | Liu DW, Abuduwaili J, Lei JQ, Wu GY, Gui DW. Wind erosion of saline playa sediments and its ecological effects in Ebinur lake, Xinjiang, China. Environmental Earth Sciences , 2011, 63 (2) : 241–250 DOI:10.1007/s12665-010-0690-4 . |
| [7] | Zhang F, Tiyip T, Johnson VC, Kung H, Ding JL, Zhou M, Fan YH, Kelimu A, Nurmuhammat I. Evaluation of land desertification from 1990 to 2010 and its causes in Ebinur lake region, Xinjiang China. Environmental Earth Sciences , 2015, 73 (9) : 5731–5745 DOI:10.1007/s12665-014-3830-4 . |
| [8] | 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000 : 89 -96. |
| [9] | Stach JEM, Maldonado LA, Ward AC, Goodfellow M, Bull AT. New primers for the class Actinobacteria:application to marine and terrestrial environments. Environmental Microbiology , 2003, 5 (10) : 828–841 DOI:10.1046/j.1462-2920.2003.00483.x . |
| [10] | Schfer J, Jckel U, Kmpfer P. Development of a new PCR primer system for selective amplification of Actinobacteria. FEMS Microbiology Letters , 2010, 311 (2) : 103–112 DOI:10.1111/fml.2010.311.issue-2 . |
| [11] | Huber T, Faulkner G, Hugenholtz P. Bellerophon:a program to detect chimeric sequences in multiple sequence alignments. Bioinformatics , 2004, 20 (14) : 2317–2319 DOI:10.1093/bioinformatics/bth226 . |
| [12] | Saitou N, Nei M. The neighbor-joining method:a new method for reconstructing phylogenetic trees. Molecular Biology and Evolution , 1987, 4 (4) : 406–425 . |
| [13] | Stach JEM, Maldonado LA, Masson DG, Ward AC, Goodfellow M, Bull AT. Statistical approaches for estimating actinobacterial diversity in marine sediments. Applied and Environmental Microbiology , 2003, 69 (10) : 6189–6200 DOI:10.1128/AEM.69.10.6189-6200.2003 . |
| [14] | Li WJ, Tang SK, Wang D, Xu LH, Jiang CL. A primary study on biodiversity of moderately halophilic Actinomycetes in Xinjiang and Qinghai Area. Acta Microbiologica Sinica , 2004, 44 (1) : 1–7 (in Chinese). 李文均, 唐蜀昆, 王栋, 徐丽华, 姜成林. 新疆青海中度嗜盐放线菌生物多样性初步研究. 微生物学报 , 2004, 44 (1) : 1–7. |
| [15] | Xia ZF, Guan TW, Ruan JS, Huang Y, Zhang LL. Studies on the Actinobacterial diversity in Aiding lake sediments. Acta Microbiologica Sinica , 2011, 51 (8) : 1023–1031 (in Chinese). 夏占峰, 关统伟, 阮继生, 黄英, 张利莉. 艾丁湖沉积物放线菌多样性. 微生物学报 , 2011, 51 (8) : 1023–1031. |
| [16] | Guan TW, Wu JY, Zhi XY, Tang SK, Xu LH, Li WJ, Zhang LL. Actinobacterial diversity of a sediments sample from Xiaoerkule lake. Acta Microbiologica Sinica , 2008, 48 (7) : 851–856 (in Chinese). 关统伟, 吴晋元, 职晓阳, 唐蜀昆, 徐丽华, 李文均, 张利莉. 硝尔库勒湖沉积物中非培养放线菌多样性. 微生物学报 , 2008, 48 (7) : 851–856. |
| [17] | Wu JY, Zhi XY, Li Y, Guan TW, Tang SK, Xu LH, Li WJ. Comparison of Actinobacterial diversity in Jiangcheng and Heijing saline mines in Yunnan by using culture-independent approach. Microbiology China , 2008, 35 (10) : 1550–1555 (in Chinese). 吴晋元, 职晓阳, 李岩, 关统伟, 唐蜀昆, 徐丽华, 李文均. 云南江城和黑井盐矿沉积物未培养放线菌多样性比较. 微生物学通报 , 2008, 35 (10) : 1550–1555. |
| [18] | Guan TW, Zhao K, Xia ZF, Sun HZ, Zhang LL. Actinobacterial community structure of a soil sample from Yutian pit in Xinjiang revealed by culture-independent method. Microbiology China , 2009, 36 (4) : 515–521 (in Chinese). 关统伟, 赵珂, 夏占峰, 孙红专, 张利莉. 新疆于田盐池放线菌群落结构. 微生物学通报 , 2009, 36 (4) : 515–521. |
| [19] | Ulanova D, Goo KS. Diversity of actinomycetes isolated from subseafloor sediments fter prolonged low-temperature storage. Folia Microbiologica , 2015, 60 (3) : 211–216 DOI:10.1007/s12223-014-0361-z . |
 2016, Vol. 56
2016, Vol. 56