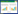中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 万慧 , 康振 , 李江华 , 周景文 . 2016
- Wan Hui, Kang Zhen, Li Jianghua, Zhou Jingwen . 2016
- 高浓度2-KLG对氧化葡萄糖酸杆菌WSH-003中2-KLG合成途径关键基因表达的影响
- Effect of high 2-KLG concentration on expression of pivotal genes involved in 2-KLG synthesis in Gluconobacter oxydans WSH-003
- 微生物学报, 2016, 56(10): 1656-1663
- Acta Microbiologica Sinica, 2016, 56(10): 1656-1663
-
文章历史
- 收稿日期:2016-01-19
- 修回日期:2016-02-27
- 网络出版日期:2016-01-08
2-酮基-L-古龙酸(2-Keto-L-gulonic acid,2-KLG)是合成维生素C的重要前体[1]。维生素C具有抗氧化性,是人类和脊椎动物不可缺少的营养素,被广泛地应用于医药、化妆品、饮料、食品、保健品等行业[2-3]。我国是维生素C生产大国,发酵总产值约占全球的90%以上。目前工业生产维生素C大多采用两步发酵法,即以山梨醇为底物,先利用氧化葡萄糖酸杆菌(Gluconobacter oxydans)将其转化为山梨糖,再经过由普通生酮基古龙酸(Ketogulonicigenium vulgare)和巨大芽孢杆菌(Bacillus megaterium)组成的混菌发酵体系将山梨糖最终氧化成2-KLG[4]。
由于混菌发酵体系存在控制难、发酵周期长、设备利用率低等问题,利用代谢工程手段构建一步法菌株成为研究热点[5-6]。氧化葡萄糖酸杆菌中不仅含有2-KLG第一步合成所需的山梨醇脱氢酶还含有脱氢酶辅酶PQQ的合成和转运系统,故氧化葡萄糖酸杆菌成为目前最合适的一步生产菌株的出发菌株[7]。一步法菌株构建的基本思路为,将氧化葡萄糖酸杆菌中的山梨醇脱氢酶基因(sldh)和普通生酮基古龙酸中的山梨酮脱氢酶(SDH)和山梨糖脱氢酶(SNDH)基因(sdh和sndh)整合到1个菌株中。这3个关键脱氢酶均以吡咯喹啉醌(Pyrroloquinoline quinone,PQQ)为辅酶[8]。PQQ是20世纪70年代末发现的一种氧化还原酶的新辅酶,是继黄素核苷酸(FMN、FAD)和烟酰胺核苷酸(NAD、NADP)之后发现的第3种辅酶[9]。在此前的研究中,通过脱氢酶异位重构和PQQ合成途径的强化,实验室规模一步法生产2-KLG产量达到44.5 g/L。随着研究的不断深入,高浓度的2-KLG对生产菌株氧化葡萄糖酸杆菌的生长及2-KLG合成关键基因表达的影响,将成为进一步提高2-KLG产量的瓶颈,相关研究目前未见报道。
本文以1株工业菌株氧化葡萄糖酸杆菌WSH-003为研究对象,对高浓度2-KLG条件下的菌体生长及与2-KLG合成相关的关键基因表达进行了研究。首先考察了不同浓度2-KLG对菌体生长的影响,结果表明高浓度2-KLG对生长中期菌体的生长无明显抑制。选取3个不同浓度的2-KLG对氧化葡萄糖酸杆菌进行胁迫,采用实时定量PCR技术,分析山梨醇脱氢酶合成基因sldAB,辅酶PQQ的合成基因簇pqqABCDE和5个潜在的PQQ转运蛋白基因的表达情况。结果显示高浓度2-KLG会抑制PQQ的合成以及PQQ依赖型脱氢酶的表达。此次研究为2-KLG高产对维生素C生产菌株的影响提供了一定的借鉴作用。
1 材料和方法 1.1 材料1.1.1 菌株:氧化葡萄糖酸杆菌WSH-003,系江苏江山制药有限公司维生素C工业生产菌株[8]。
1.1.2 引物:表 1为本研究使用的引物,均由Beacon Designer 7软件设计。
| Genes | Production of Gene | Sequences (5′→3′) |
| 16S rRNA | 16S rRNA | F: GCGGTTGTTACAGTCAGATG |
| R: GCCTCAGCGTCAGTATCG | ||
| pqqA | PqqA | F: TTGGAACACGCCGAAAGT |
| R: TACTTCTTCTCGCCGCAGA | ||
| pqqB | PqqB | F: ATATCACAGCAGACATCATC |
| R: AGCACGGATCATTTCATC | ||
| pqqC | PqqC | F: CACTACGACTTCATTTCC |
| R: CATTCTCACGCACATAAG | ||
| pqqD | PqqD | F: TTGGCAGTGTCATTGAGA |
| R: TCCGTCAGATCAGAAAGAA | ||
| pqqE | PqqE | F: TTACACCAATCTTATCACATCC |
| R: ATCCAGACCAGCCTTATC | ||
| sldA | Large subunit of sorbitol dehydrogenase SldA | F: CGCATTATGATGGTGAGT |
| R: CAGTTCGCAATCAGGATG | ||
| sldB | Small subunit of sorbitol dehydrogenase SldB | F: GAACCTCACCTTTTACAG |
| R: CACGAGAAGAATAACGAT | ||
| gcd | Membrane-bound glucose dehydrogenase (PQQ) | F: AGTTCGTGGTCACCTATG |
| R: AGCGAGTAAGCAATCAGA | ||
| ompA | Outer membrane protein OmpA | F: GTTGAAGTTGAGGGTGTAT |
| R: TTGACGAAACCGCCATAA | ||
| ompW | Outer membrane protein OmpW | F: ACTTCTTTACGGATCATATCTC |
| R: CCCAGAGCAGTATCTTCT | ||
| B932_2186 | Putative ABC transprter permease | F: AATGGTGAAGAGCATACG |
| R: CTCAGGAACCTTGATGTC | ||
| B932_0755 | Putative membrane protein | F: GCCGATCTGAAACTTATACC |
| R: ATTCCGTTCTAGCTGACA | ||
| B932_1930 | Putative transporter | F: AATCCAGACTGTTCAGAA |
| R: CCATACAATCCGAAATCA |
1.1.3 主要试剂和仪器:LightCycler 480 II实时定量PCR扩增仪,瑞士Roche公司;Nanodrop ND-2000分光光度计,美国Thermo公司;PCR仪,美国BioRad公司;离心机,美国Eppendorf公司;溶菌酶,上海生工生物工程有限公司;细菌总RNA提取试剂盒RNeasy Mini Kit,德国QIAGEN公司;反转录试剂盒PrimeScript RT reagent Kit、SYBR Premix Ex Taq试剂盒、DNA Marker;大连TaKaRa公司。
1.1.4 培养基:山梨醇培养基(g/L):山梨醇 150,酵母粉10,自然pH,培养时添加50 μg/L头孢西丁钠。
1.2 耐受性试验挑取氧化葡萄糖酸杆菌单菌落于山梨醇培养基中,48 h达到稳定期后,按10% (V/V)转接于新鲜培养基,30 ℃、220 r/min培养,12 h后达到对数期中前期时添加不同量的2-KLG粉末,使2-KLG终浓度分别达到0、20、40、60、80、100和120 g/L,将pH调成与0添加样品的pH一致后再培养4 h。每1 h取样在600 nm处测定光密度OD。每个样品3个平行。
1.3 2-KLG刺激实验将氧化葡萄糖酸杆菌培养至对数生长中期OD600=1.0,将所有培养液混合后分成等量培养液,以确保所有刺激条件前的初始菌浓度一致,再外源添加不同量的2-KLG粉末,调节pH后,使培养液中2-KLG终浓度分别达到0、80和120 g/L 2-KLG,刺激培养2 h后收集菌液[10],离心后使用液氮保存菌体。
1.4 反转录实时定量PCR(RT-PCR)1.4.1 RNA提取:加入200 μL 5 g/L溶菌酶液37 ℃反应5 min破碎细胞,RNA提取按照RNA提取试剂盒RNA Mini Kit操作说明进行。
1.4.2 cDNA制备:按照PrimerScript RT reagent Kit操作说明,先去除基因组DNA,再将RNA反转录成cDNA,-20 ℃保存。
1.4.3 RT-PCR扩增:RT-PCR反应体系为20 μL,各组分为SYBR Green Master 10 μL、正向引物(10 μmol/μL) 0.4 μL、反向引物(10 μmol/μL) 0.4 μL、cDNA模板1.2 μL、ddH2O 8 μL。PCR反应参数:95 ℃ 20 s;95 ℃ 3 s,55 ℃ 30 s,40个循环。延伸阶段收集荧光信号,反应结束后对获得的信号进行处理。以16S rRNA编码基因为参比,0 g/L 2-KLG添加处理的样品为对照进一步分析。每个样品3个平行。
2 结果和分析 2.1 氧化葡萄糖酸杆菌对2-KLG耐受性分析目前实验室小型发酵罐未经补料后2-KLG产量可达到40 g/L以上,工业上2-KLG产量达到100 g/L以上。为了研究高浓度2-KLG对氧化葡萄糖酸杆菌生长的影响,选定0-120 g/L每20 g/L一个梯度作为初步的添加梯度,未添加2-KLG的作为对照组。采用在生长中期的添加不同浓度梯度2-KLG进行刺激培养,以未添加的样品作为对照。经过检测光密度OD600来观察高浓度2-KLG对菌体生长的影响,结果如图 1所示。根据以上结果所示,120 g/L 2-KLG不会抑制氧化葡萄糖酸杆菌的生长,故我们选定0、40、80及120 g/L作为添加浓度来考察高浓度2-KLG对氧化葡萄糖酸杆菌产2-KLG过程一些关键基因表达的影响。
|
图 1.
不同浓度2-KLG条件下氧化葡萄糖酸杆菌WSH-003生长情况
Figure 1.
Effect of 2-KLG concentrations on the cell growth of Gluconobacter oxydans WSH-003.       |
2.2 高浓度2-KLG对山梨醇脱氢酶基因表达的影响
根据上述实验得出的合适的添加梯度,在氧化葡萄糖酸杆菌对数中期分别添加了不同量的2-KLG,使2-KLG终浓度分别达到0 (K0)、40 g/L (K40)、80 g/L (K80)及120 g/L (K120),刺激培养2 h后取样提取RNA,经检测,提取的RNA质量合格。以未添加2-KLG的样品K0作为对照组,进行RT-PCR分析。
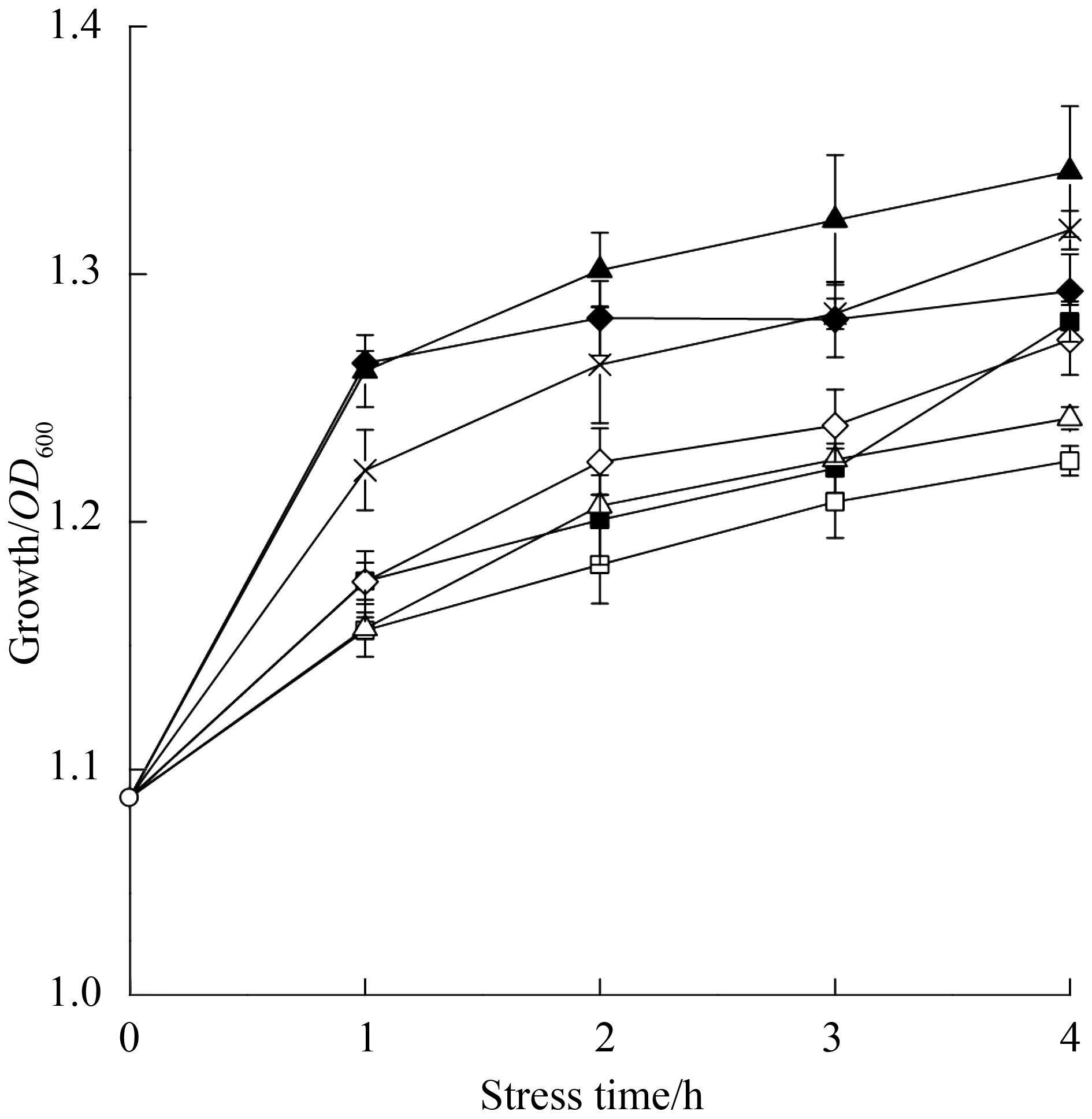
氧化葡萄糖酸杆菌中的山梨醇脱氢酶是2-KLG的合成途径第一步关键的酶,其结合辅酶PQQ将底物山梨醇转化成山梨糖。采用RT-PCR检测山梨醇脱氢酶大小亚基编码基因sldA及sldB在不同浓度2-KLG条件下的基因表达情况,如图 2所示。山梨醇脱氢酶SLDH大亚基编码基因sldA显著下调,在120 g/L 2-KLG压力下sldB下调了5.5倍,山梨醇脱氢酶SLDH小亚基编码基因sldB在2-KLG压力下也有下调,这说明随着2-KLG浓度的增大,山梨醇脱氢酶基因抑制越明显。
|
| 图 2. 不同浓度2-KLG条件下山梨醇脱氢酶基因的表达情况 Figure 2. Effects of 2-KLG concentration on the sorbitol dehydrogenase genes. K40: strains stimulated by 40 g/L 2-KLG (white bars); K80: strains stimulated by 80 g/L 2-KLG (light grey bars); K120: strains stimulated by 120 g/L 2-KLG (dark grey bars). Each value represents the average value and standard deviation of three parallel samples. |
2.3 高浓度2-KLG对PQQ合成基因表达的影响
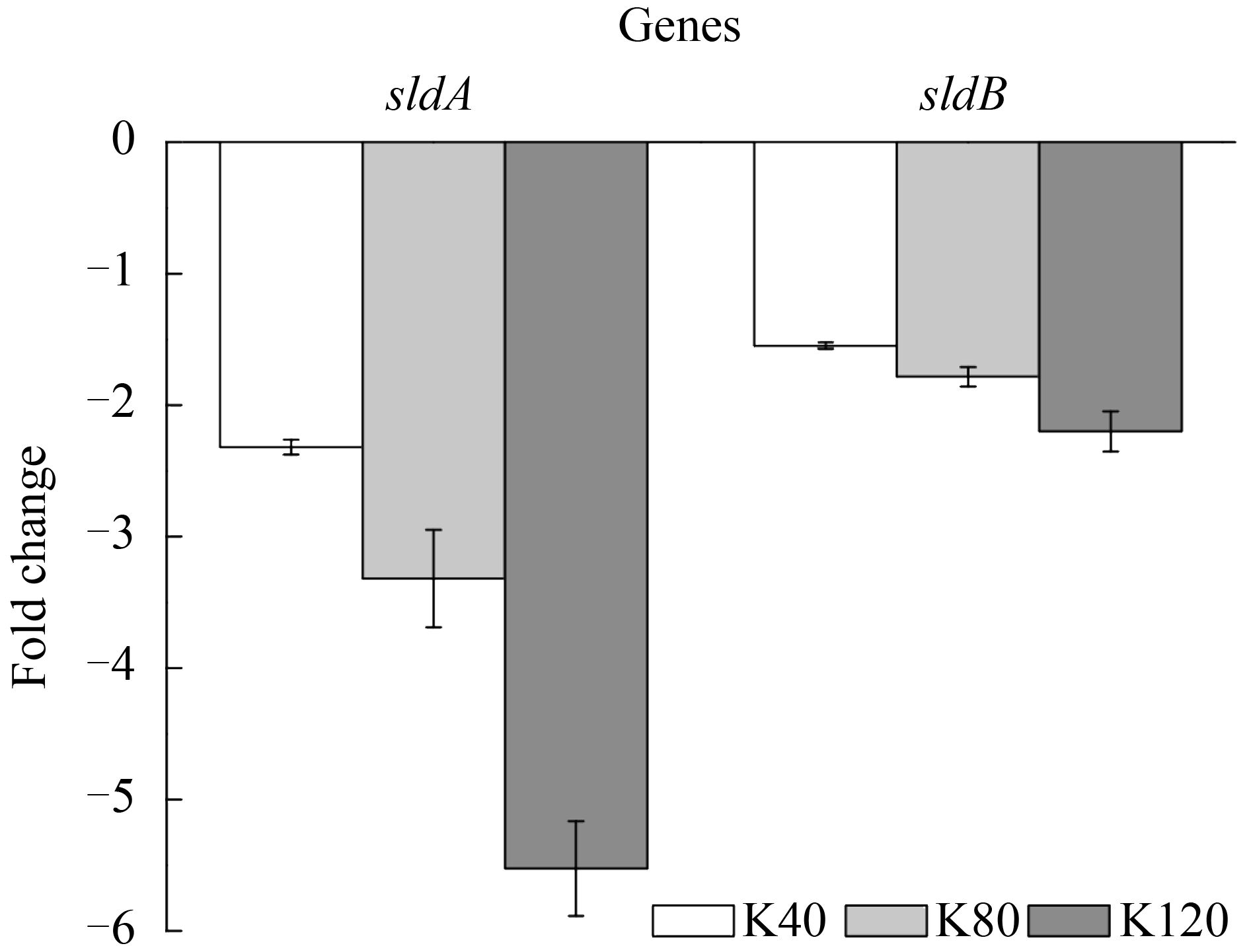
PQQ做为2-KLG合成关键脱氢酶的辅酶,其表达量对2-KLG的合成具有重要影响。据报道,PQQ的合成基因由pqqABCDEFN基因簇组成,不同菌株中PQQ基因簇组成不同。本研究使用的氧化葡萄糖酸杆菌已完成基因组测序,结果显示其PQQ合成基因簇为pqqABCDE。本文研究了高浓度2-KLG对PQQ单个合成基因pqqA、pqqB、pqqC、pqqD、pqqE的影响。如图 3所示,在高浓度2-KLG胁迫下,pqqABCDE的变化量在2倍内浮动,说明高浓度2-KLG并未显著影响PQQ的合成。
|
| 图 3. PQQ合成基因在不同高浓度2-KLG压力下表达情况 Figure 3. The expression of PQQ synthesis genes under different high 2-KLG stress. K40: strains stimulated by 40 g/L 2-KLG (white bars); K80: strains stimulated by 80 g/L 2-KLG (light grey bars); K120: strains stimulated by 120 g/L 2-KLG (dark grey bars). Each value represents the average value and standard deviation of three parallel samples. |
2.4 高浓度2-KLG对潜在转运蛋白编码基因表达的影响
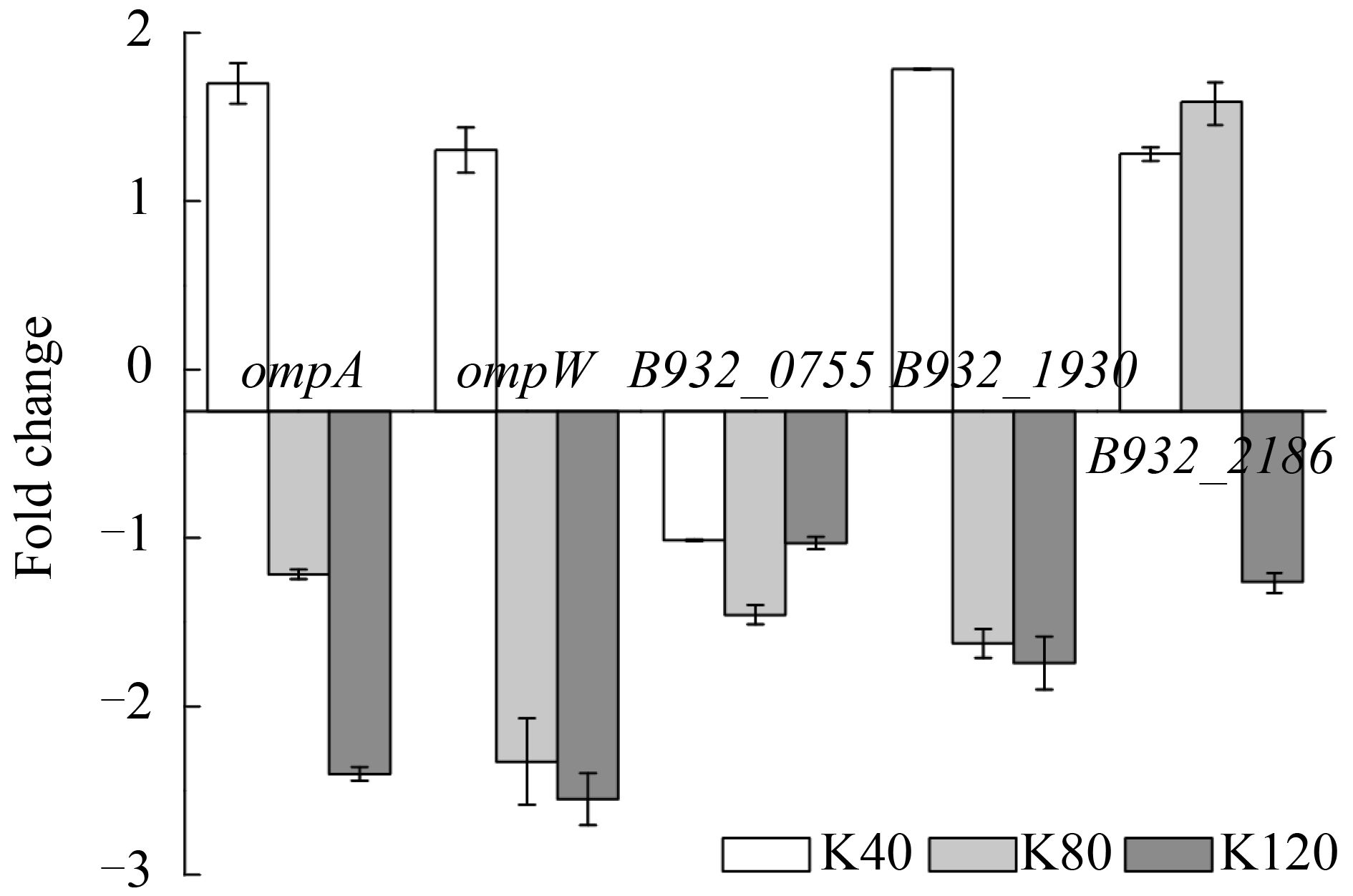
2-KLG合成过程中,山梨醇脱氢酶与辅酶PQQ在膜间质中转化底物[11],推测PQQ的转运对2-KLG合成也有很大影响。据报道,OmpA、OmpW、B932_2186、B932_0755、B932_1930可能为PQQ转运相关蛋白[12-13]。本文考察这5个潜在的PQQ转运蛋白编码基因在高浓度2-KLG压力下的表达情况,结果如图 4所示。结果显示,在潜在的PQQ转运蛋白编码基因中,在40 g/L 2-KLG压力下变化量在2倍以内,但随着2-KLG的增加,这些基因呈下调趋势,其中ompA和ompW在120 g/L 2-KLG压力下显著下调。这说明较低浓度2-KLG对PQQ转运蛋白没有显著影响,但在随着2-KLG浓度的增加,部分转运蛋白的表达可能会受到抑制。
|
| 图 4. 潜在转运蛋白编码基因在高浓度2-KLG压力下的表达情况 Figure 4. The expression of potential transport protein encode genes under different high 2-KLG stress. K40: strains stimulated by 40 g/L 2-KLG (white bars); K80: strains stimulated by 80 g/L 2-KLG (light grey bars); K120: strains stimulated by 120 g/L 2-KLG (dark grey bars). Each value represents the average value and standard deviation of three parallel samples. |
3 讨论
2-KLG是维生素C的重要前体物质,目前工业生产中两步发酵法是生产2-KLG的主要方法,但该方法存在诸多弊端,如混菌发酵体系难以调控、设备占用率高等。近年来一步发酵法生产维生素C的研究已取得一定成绩,主要集中在改造氧化葡萄糖酸杆菌生产2-KLG[7],但是高浓度的2-KLG对氧化葡萄糖酸菌株的生长的影响一直没有系统研究。Gao等将氧化葡萄糖酸杆菌涂布在不同浓度2-KLG平板上培养,通过群落计数发现100 g/L 2-KLG对菌体生长没有显著抑制,而140 g/L 2-KLG会抑制菌体生长[14],与我们的实验结果120 g/L 2-KLG对菌体生长无显著抑制相吻合。目前尚未见2-KLG合成过程中关键酶及辅因子相关影响的研究。本文利用RT-PCR技术分析了在高浓度2-KLG压力下,2-KLG合成途径中关键的脱氢酶基因、关键的辅因子PQQ的合成基因以及一些关键潜在的转运蛋白编码基因的表达情况。
山梨醇脱氢酶负责2-KLG合成中的第一步,结合辅酶PQQ转化底物山梨醇,在氧化葡萄糖酸杆菌中过表达山梨醇脱氢酶基因sldAB能够提高山梨酮的产量[15-16]。在氧化葡萄糖酸杆菌IFO3255中敲除sldA后山梨醇不能被转化为山梨糖[17],山梨醇脱氢酶小亚基SldB作为伴侣结合到膜上从而激活酶的活性[18]。这些都说明山梨醇脱氢酶基因是转化底物的必须基因。RT-PCR结果显示,高浓度2-KLG压力下,PQQ依赖型的SLDH基因受到了显著的抑制,这表明采用一步发酵氧化葡萄糖酸杆菌生产过程中,随着2-KLG在发酵罐中的积累会影响2-KLG进一步合成。要得到更高产量的2-KLG,要解决这个问题可考虑采用发酵控制技术将产物控制在一定浓度以内,同时进一步研究2-KLG对山梨醇脱氢酶的影响过程,找出关键控制因素以解除产物抑制。PQQ作为2-KLG合成途径中关键的辅酶,其合成、转运与再生过程对2-KLG合成至关重要,PQQ单个合成基因的功能正被逐渐解析[19],但其转运与再生过程目前仍未被阐明。在氧化葡萄糖酸杆菌中,pqqACDE编码的蛋白主要负责PQQ的合成,少了其中的任何一个基因都会导致PQQ量少甚至没有[20-21],而pqqB编码的蛋白不直接参与PQQ的合成,而是与PQQ分泌有关[22]。RT-PCR实验显示在2-KLG刺激pqqABCDE的表达量并未受到显著影响,这说明高浓度的2-KLG不会影响PQQ的合成。此外,PQQ潜在转运蛋白的编码基因也未受到在较高浓度2-KLG的影响,但是120 g/L高浓度2-KLG压力下,部分膜蛋白的基因表达受到抑制。这些结果表明,高浓度的2-KLG对PQQ的合成没有显著影响,但有可能会影响PQQ的转运。本研究为构建高效一步发酵法产维生素C菌株提供了一定的参考意义。
| [1] | Chen KJ, Zhou JW, Liu LM, Liu J, Du GC, Chen J. Enhancing 2-keto-L-gulonic acid production under hyperosmotic stress by adding sucrose. Chinese Journal of Biotechnology , 2010, 26 (11) : 1507–1513 (in Chinese). 陈克杰, 周景文, 刘立明, 刘杰, 堵国成, 陈坚. 高渗条件下利用蔗糖提升2-酮基-L-古龙酸生产效率. 生物工程学报 , 2010, 26 (11) : 1507–1513. |
| [2] | Bhatt A. Evolution of clinical research: a history before and beyond james lind. Perspectives in Clinical Research , 2010, 1 (1) : 6–10 . |
| [3] | Fossati T, Solinas N, Porro D, Branduardi P. L-ascorbic acid producing yeasts learn from plants how to recycle it. Metabolic Engineering , 2011, 13 (2) : 177–185 DOI:10.1016/j.ymben.2010.12.007 . |
| [4] | Zhu YB, Liu J, Du GC, Zhou JW, Chen J. Sporulation and spore stability of Bacillus megaterium enhance Ketogulonigenium vulgare propagation and 2-keto-L-gulonic acid biosynthesis. Bioresource Technology , 2012, 107 : 399–404 DOI:10.1016/j.biortech.2011.12.080 . |
| [5] | Hancock RD, Viola R. The use of micro-organisms for L-ascorbic acid production: current status and future perspectives. Applied Microbiology and Biotechnology , 2001, 56 (5/6) : 567–576 . |
| [6] | Zhang L, Wang ZN, Xia Y, Kai GY, Chen WS, Tang KX. Metabolic engineering of plant L-ascorbic acid biosynthesis: recent trends and applications. Critical Reviews in Biotechnology , 2007, 27 (3) : 173–182 DOI:10.1080/07388550701503626 . |
| [7] | Xia ZX, Dai WW, He YN, White SA, Mathews FS, Davidson VL. X-ray structure of methanol dehydrogenase from Paracoccus denitrificans and molecular modeling of its interactions with cytochrome c-551i. JBIC Journal of Biological Inorganic Chemistry , 2003, 8 (8) : 843–854 DOI:10.1007/s00775-003-0485-0 . |
| [8] | Gao LL, Zhou JW, Liu J, Du GC, Chen J. Draft genome sequence of Gluconobacter oxydans WSH-003, a strain that is extremely tolerant of saccharides and alditols. Journal of Bacteriology , 2012, 194 (16) : 4455–4456 DOI:10.1128/JB.00837-12 . |
| [9] | Misra HS, Rajpurohit YS, Khairnar NP. Pyrroloquinoline-quinone and its versatile roles in biological processes. Journal of Biosciences , 2012, 37 (2) : 313–325 DOI:10.1007/s12038-012-9195-5 . |
| [10] | Park J, Lee HH, Youn K, Kim S, Jung B, Lee J, Seo YS. Transcriptome analyses to understand effects of the Fusarium deoxynivalenol and nivalenol mycotoxins on Escherichia coli. Journal of Biotechnology , 2014, 192 : 231–239 DOI:10.1016/j.jbiotec.2014.10.018 . |
| [11] | Hancock RD, Viola R. Biotechnological approaches for L-ascorbic acid production. Trends in Biotechnology , 2002, 20 (7) : 299–305 DOI:10.1016/S0167-7799(02)01991-1 . |
| [12] | Confer AW, Ayalew S. The OmpA family of proteins: roles in bacterial pathogenesis and immunity. Veterinary Microbiology , 2013, 163 (3/4) : 207–222 . |
| [13] | Zhou JW, Wang K, Xu S, Wu JJ, Liu PR, Du GC, Li JH, Chen J. Identification of membrane proteins associated with phenylpropanoid tolerance and transport in Escherichia coli BL21. Journal of Proteomics , 2015, 113 : 15–28 DOI:10.1016/j.jprot.2014.09.012 . |
| [14] | Gao LL, Hu YD, Liu J, Du GC, Zhou JW, Chen J. Stepwise metabolic engineering of Gluconobacter oxydans WSH-003 for the direct production of 2-keto-L-gulonic acid from D-sorbitol. Metabolic Engineering , 2014, 24 : 30–37 DOI:10.1016/j.ymben.2014.04.003 . |
| [15] | Hu YD, Wan H, Li JH, Zhou JW. Enhanced production of L-sorbose in an industrial Gluconobacter oxydans strain by identification of a strong promoter based on proteomics analysis. Journal of Industrial Microbiology & Biotechnology , 2015, 42 (7) : 1039–1047 . |
| [16] | Xu S, Wang XB, Du GC, Zhou JW, Chen J. Enhanced production of L-sorbose from D-sorbitol by improving the mRNA abundance of sorbitol dehydrogenase in Gluconobacter oxydans WSH-003. Microbial Cell Factories , 2014, 13 : 146 DOI:10.1186/s12934-014-0146-8 . |
| [17] | Hoshino T, Sugisawa T, Shinjoh M, Tomiyama N, Miyazaki T. Membrane-bound D-sorbitol dehydrogenase of Gluconobacter suboxydans IFO 3255-enzymatic and genetic characterization. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics , 2003, 1647 (1/2) : 278–288 . |
| [18] | Shinjoh M, Tomiyama N, Miyazaki T, Hoshino T. Main polyol dehydrogenase of Gluconobacter suboxydans IFO 3255, membrane-bound D-sorbitol dehydrogenase, that needs product of upstream gene, sldB, for activity. Bioscience, Biotechnology, and Biochemistry , 2002, 66 (11) : 2314–2322 DOI:10.1271/bbb.66.2314 . |
| [19] | Puehringer S, Metlitzky M, Schwarzenbacher R. The pyrroloquinoline quinone biosynthesis pathway revisited: a structural approach. BMC Biochemistry , 2008, 9 : 8 DOI:10.1186/1471-2091-9-8 . |
| [20] | Latham JA, Iavarone AT, Barr I, Juthani PV, Klinman JP. PqqD is a novel peptide chaperone that forms a ternary complex with the radical S-adenosylmethionine protein PqqE in the pyrroloquinoline quinone biosynthetic pathway. Journal of Biological Chemistry , 2015, 290 (20) : 12908–12918 DOI:10.1074/jbc.M115.646521 . |
| [21] | Xu JH, Deng P, Showmaker KC, Wang H, Baird SM, Lu SE. The pqqC gene is essential for antifungal activity of Pseudomonas kilonensis JX22 against Fusarium oxysporum f. sp. lycopersici. FEMS Microbiology Letters , 2014, 353 (2) : 98–105 DOI:10.1111/fml.2014.353.issue-2 . |
| [22] | Hölscher T, Görisch H. Knockout and overexpression of pyrroloquinoline quinone biosynthetic genes in Gluconobacter oxydans 621H. Journal of Bacteriology , 2006, 188 (21) : 7668–7676 DOI:10.1128/JB.01009-06 . |
 2016, Vol. 56
2016, Vol. 56