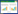中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郎剑锋 , 石明旺 , 冉隆贤 . 2016
- Lang Jianfeng, Shi Mingwang, Ran Longxian . 2016
- 反复冻融对枯草芽孢杆菌St-zn-34抑制链格孢菌活性的影响
- Effect of repeated freeze-thaw on inhibition of Bacillus subtilis strain St-zn-34 to Alternaria alternata
- 微生物学报, 2016, 56(10): 1616-1625
- Acta Microbiologica Sinica, 2016, 56(10): 1616-1625
-
文章历史
- 收稿日期:2015-12-30
- 修回日期:2016-02-21
- 网络出版日期:2016-03-02
2. 河南科技学院植保系, 河南 新乡 453003 ;
3. 河北省林木种质资源与森林保护重点实验室, 河北 保定 071000
2. Department of Plant Protection, Henan Institute of Science and Technology, Xinxiang 453003, Henan Province, China ;
3. Hebei Key Laboratory of Forest Germplasm Resources and Protection, Hebei Agricultural University, Baoding 071000, Hebei Province, China
芽孢杆菌种类丰富,生物学功能各异,适应环境能力强,目前对该菌的研究集中在分类和鉴定[1]、生理与机制[2]、营养体细胞以及代谢物质[3]、防治以及功能发掘[4-5]、发酵条件优化[6]等方面。该菌菌体在裂殖生长的过程中会产生枯草菌素、杆菌肽等许多种抗菌活性物质,这些活性物质能对多种病原物起到显著的抑制作用。由于芽孢杆菌可以产生抗逆性较强的芽孢,因此,芽孢杆菌制剂目前在植物病害生物防治中应用广泛。芽孢杆菌的发酵培养是工业化大规模生产芽孢杆菌制剂的前提,其主要受培养基营养成分与发酵条件的影响,但在发酵过程中pH值、活菌量、芽孢量及抑菌活性等变化规律尚未见报道。
反复冻融主要用于细胞的破碎研究[7-8]和对生物制品的稳定性研究[9],国内外许多研究也利用反复冻融来促进胞内物质的释放。如Sode等[10]、Zhang等[11]利用反复冻融法分别提取聚球藻、铜绿微囊藻的藻蓝蛋白;王雪青等[12]利用反复冻融法提取微藻中的活性物质;Berks等[13]、刘立新等[14]利用反复冻融法分别提取绿脓假单胞菌和金黄葡萄球菌内的β-内酰胺酶;Rovati等[15]利用反复冻融法评估真菌的蛋白水解活性;Weibel等[16]利用反复冻融优化酵母细胞抽提物。但是反复冻融作为一种可以促进胞内产物释放的常用方法,是否影响枯草芽孢杆菌胞内产物的释放而影响抑菌物质活性,以及反复冻融后枯草芽孢杆菌形态的变化均未见报道。
枯草芽孢杆菌(Bacillus subtilis) St-zn-34菌株是本课题组在冬枣体内分离到的1株内生菌,经前期试验在离体条件下该菌对多种植物病原菌有拮抗活性。本研究拟采用分批发酵法,研究枯草芽孢杆菌St-zn-34随发酵时间pH值、活菌量、芽孢量与发酵滤液抑菌活性的变化规律,以此为基础,研究发酵后反复冻融对发酵滤液抑菌活性的影响,并利用环境扫描电镜观察菌体反复冻融前后形态的变化。本研究旨在了解枯草芽孢杆菌发酵过程中的生长规律,为今后能否利用反复冻融提取枯草芽孢杆菌胞内活性产物提供理论依据。
1 材料和方法 1.1 试验菌株枯草芽孢杆菌(Bacillus subtilis) St-zn-34,为本课题组在枣树体内分离所得,经前期试验对多种植物病原菌有抑菌活性。
活性指示菌:链格孢菌(Alternaria alternata) CN193,由河北农业大学林木病理实验室提供。
抑菌谱试验所用菌株:茎点霉菌(Phoma spp.)由河北农业大学林木病理实验室提供,梨黑斑病菌(Alternaria kikuchiana)、玉米小斑病菌(Bipolaris maydis)、番茄灰霉病菌(Botrytis cinerea)、蒜苔炭疽病菌(Colletotrichum gloeosporioides)、玉米大斑病菌(Exserohilum turcicum)、禾谷镰刀菌(Fusarium graminearum)、棉花褐斑病菌(Phyllosticta gossypina) 、水稻纹枯病菌(Rhizoctonia solani)、苹果腐烂病菌(Valsa mali)、白菜软腐病菌(Erwinia carotovora)及水稻白叶枯病菌(Xanthomonas campestris)均由河南科技学院资源与环境学院植物病理实验室提供。
1.2 培养基种子培养基采用LB培养基,配方为胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1000 mL。发酵培养基配方为:马铃薯30 g,葡萄糖10 g,蛋白胨6 g,硫酸镁0.6 g,蒸馏水1000 mL,pH值自然。病原菌培养和拮抗试验采用PDA培养基。
1.3 种子培养液的制备用灭菌后的接种环取2环已活化的枯草芽孢杆菌接种于盛有80 mL已灭菌的PD培养基250 mL三角瓶中,置摇床振荡培养,28 ℃、150 r/min条件下培养1 d作为种子液。
1.4 发酵培养按5%的接菌量从种子培养液加入发酵培养基中,28 ℃、150 r/min振荡培养。
1.4.1 不同发酵时间培养液pH值、活菌量和芽孢量的测定:分别从发酵培养基中取培养0、12、24、48、60、72、84、96 h的发酵液,测定其pH值、活菌含量、活芽孢含量。pH测定用精确pH试纸,活菌含量测定采用梯度稀释计数法[17],活芽孢含量测定参考Pabakaran等[18]的方法,具体做法为:将发酵液用无菌蒸馏水稀释10倍,于80 ℃加热15 min,冷却到室温后用平板菌落计数法测定活菌含量,平板上长出的菌落全部视为由芽孢形成。
1.4.2 不同发酵时间培养液抑菌活性的变化:发酵滤液提取方法。将发酵液于4 ℃下10000 r/min离心20 min,取上清液,用0.22 μm微孔滤膜过滤,得发酵滤液。抑菌活性测定采用滤纸片法,具体做法为:在PDA平板中央接种链格孢菌,生长1 d后,把灭菌滤纸圆片 (直径为5 mm)沾取发酵滤液后放置与离菌落边缘20 mm处,以无菌水作为空白对照,28 ℃培养3 d后测量抑菌带宽度 (mm),根据抑菌带宽度判断抑菌活性的高低。
1.5 反复冻融对枯草芽孢杆菌St-zn-34的活菌量及抑菌活性的影响采用反复冻融法,即取培养60 h的培养液在-40 ℃冰箱中冷冻2 h,融化1 h为一个循环,冻融5次。每次冻融后,测定活菌量和抑菌活性。同时测定60 h培养液在-40 ℃冰箱中冷冻24 h和48 h后再融化1 h,然后测活菌量和抑菌活性。
1.6 反复冻融对枯草芽孢杆菌形态的影响每个冻融循环后取样,做相应处理,然后在环境扫描电镜下观察细菌形态。样品处理方法为:取培养60 h的枯草芽孢杆菌菌液1 mL,4000 r/min离心20 min,取沉淀,加5%的戊二醛固定,过夜。4000 r/min离心3 min,去上清,用10%、20%、30%、50%、70%、90%乙醇梯度脱水,每次脱水10 min,4000 r/min离心3 min。最后用无水乙醇脱水2次后放于4 ℃冰箱中备用。用毛笔蘸取少许,点在载玻片大小的载物台上,喷金,电镜观察。
1.7 发酵滤液抑菌生物活性检测1.7.1 发酵滤液抑菌谱的测定:对真菌的抑菌谱测定方法同1.4。对不同细菌的抑菌谱测定参考马桂珍等[19]的方法。
1.7.2 不同温度对发酵滤液抑菌活性的影响:取5 mL除菌后的发酵滤液于试管中,放置于40、60、80、100、121 ℃条件下处理30 min,冷却至室温后采用滤纸片法测定处理液对活性指示菌的抑菌活性,以未经处理过的发酵滤液为对照组。
1.7.3 蛋白酶处理对发酵滤液抑菌活性的影响:将发酵滤液与浓度为l mg/mL的蛋白酶K等量混合,37 ℃水浴保温1 h,然后放置于100 ℃水浴中处理5 min使酶灭活,冷却至室温后测定处理液对指示菌的抑制能力,以未经处理过的发酵滤液为对照组。
1.8 数据处理活菌量、芽孢量的数据进行对数转换,其余为实际值采用SPSS 16.0软件Duncan氏新复极差法进行多重比较。
2 结果和分析 2.1 不同发酵时间培养液的pH值、活菌量、芽孢量及抑菌活性变化由图 1可知,随枯草芽孢杆菌发酵时间的增加,发酵液中活菌量、pH值、芽孢量和抑菌活性均有先升高后降低的过程,其中活菌量在发酵48 h时最大,达到(692.00±7.48)×108 CFU/mL (图 1-A),其后迅速降低,说明此时大量营养细胞死亡。发酵96 h后其含量与芽孢量相差不大,由于活菌含量统计的为活的营养细胞和芽孢数量的总和,可以认定此时营养细胞全部转化为芽孢。pH值、芽孢量和抑菌活性均为发酵60 h时达到最大值,pH值初始为5.5,偏酸性,随发酵时间延长慢慢升高,60 h时发酵液pH 7,呈中性,随后pH值又逐渐降低(图 1-B)。芽孢量随发酵时间升高,发酵60 h时达到最大值 (1.37±0.09)×108 CFU/mL,其后芽孢量与60 h时差异不显著(图 1-C)。抑菌活性由表中抑菌带宽度表示,数据显示抑菌活性60 h达到最高(11.97±0.12) mm,然后逐步下降(图 1-D)。
|
| 图 1. 不同时间培养液活菌量、pH值、芽孢量及抑菌活性的变化规律 Figure 1. The changing pattern of the living bacteria count (A) pH value (B) bacterial endospore count (C) and inhibitory activity (D) of filtrate at differenttime. The data are the average of three replicates and presented as the $\bar x \pm s$ error. Different lowercase letters means significant difference at 0.05 level. |
2.2 反复冻融法对枯草芽孢杆菌活菌数量的影响
枯草芽孢杆菌在发酵培养60 h时抑菌活性最大,因此,我们选用发酵60 h的发酵液进行反复冻融试验。由表 1可知,随冻融次数的增加,活菌量逐步减少,每冻融1次其活菌含量降低为前一次菌量的7.22%,22.3%,2.20%,85.6%,89.1%。说明冻融3次对细菌活菌数影响很大,3次以后活菌数较稳定,可能此时已大多为芽孢。发酵滤液的抑菌活性随冻融次数的增加而降低,冻融3次后抑菌活性降为原来的79.9%,但冻融4次及5次与冻融3次差异不显著。发酵滤液直接冷冻24 h和48 h融化后测量其抑菌活性结果与冻融一次的结果差异不显著,说明冷冻时间对抑菌活性影响不大,主要在于冻融的次数。
| Treatment | Control | Freeze-thaw times | 24 h | 48 h | ||||
| 1 | 2 | 3 | 4 | 5 | ||||
| Living bacteria count/(CFU/mL) | (3.88±0.25)×1010 | (2.80±0.37)×109 | (6.23±0.17)×108 | (1.37±0.12)×107 | (1.20±0.08)×107 | (1.07±0.05)×107 | (3.1±0.12)×109 | (2.83±0.09)×109 |
| Logarithmic transformation | 10.59 a | 9.44 b | 8.79 c | 7.13 d | 7.08 de | 7.04 e | 9.49 b | 9.45 b |
| Width of inhibition band/mm | 11.97±0.05 a | 11.43±0.17 b | 10.37±0.12 c | 9.57±0.12 d | 9.50±0.08 d | 9.33±0.05 d | 11.47±0.12 b | 11.47±0.09 b |
| The data are the average of three replicates and presented as the means±standard error. Different lowercase letters in the same row means significant difference at 0.05 level. | ||||||||
2.3 反复冻融对枯草芽孢杆菌形态的影响
枯草芽孢杆菌发酵60 h后,扫描电镜观察其形态,发现此时大部分枯草芽孢杆菌表面较光滑,呈杆状,大小为2.447 μm×0.6416 μm,菌量较多,可明显看到有菌体正在裂殖生成相同的子细胞,部分菌体表面不光滑,有消融迹象(图 2-A)。冻融1次后,发现菌体形态开始变为不规则,菌体长度差异较大,部分菌体细胞表面出现凹陷,菌体有消融现象,已有少量芽孢产生,菌体长度变短,为1.2600 μm × 0.6825 μm (图 2-B)。冻融2次后,菌体表面凹陷增多,部分菌体扭曲,视野内芽孢增多,菌体大小为1.2530 μm × 0.5990 μm (图 2-C)。冻融3次后,已经看到菌体破损,流出胶状物,大量芽孢产生(图 2-D)。冻融4次后,发现菌体极少量存在,几乎完全变成芽孢(图 2-E)。冻融5次后,菌量稀少,和冻融4次时差别不明显(图 2-F)。直接冷冻24 h融化后,菌体变短,菌体凹陷少,芽孢较少,大小为1.2500 μm × 0.6304 μm (图 2-G);冻融48 h后,菌体大小为1.1200 μm × 0.6429 μm,其余特征与冻融24 h差别不明显(图 2-H)。

|
| 图 2. 反复冻融对枯草芽孢杆菌St-zn-34菌株形态的影响 Figure 2. Effect of repeated freeze-thaw cycles on the shape of Bacillus subtilis strain St-zn-34. A: the shape of cells with non freeze-thaw (Bar=3 μm); B: the shape of cells after freeze-thaw one time (Bar=2 μm); C: the shape of cells after freeze-thaw two times (Bar=2 μm); D: the shape of cells after freeze-thaw three times (Bar=4 μm); E: the shape of cells after freeze-thaw four times (Bar=4 μm); F: the shape of cells after freeze-thaw five times (Bar=4 μm); G: the shape of cell after being freezed for 24 h (Bar=4 μm); H: the shape of cells after being freezed for 48 h (Bar=2 μm). |
2.4 枯草芽孢杆菌St-zn-34发酵滤液抑菌生物活性检测
由表 2可知,枯草芽孢杆菌St-zn-34发酵滤液对12种植物病原菌(其中Erwinia carotovora和Xanthomonas campestri为细菌,其余为真菌)均有抑制效果,说明其具有广谱抑菌能力,但对不同病菌的抑制效果有差异,对番茄灰霉病菌的抑制作用最强,抑菌带宽度达到(10.33 ± 0.09) mm,对禾谷镰刀菌的抑制作用最弱,为(1.30 ± 0.06) mm。
| Plant pathogen | Width of inhibition band/mm |
| Alternaria kikuchiana | 7.87±0.15 d |
| Bipolaris maydis | 6.93±0.09 e |
| Botrytis cinerea | 10.33±0.09 a |
| Colletotrichum gloeosporioides | 7.20±0.06 e |
| Exserohilum turcicum | 6.03±0.19 f |
| Fusarium graminearum | 1.30±0.06 g |
| Phyllosticta gossypina | 7.13±0.12 e |
| Phoma spp. | 9.20±0.06 b |
| Rhizoctonia solani | 9.33±0.09 b |
| Valsa mali | 6.33±0.09 f |
| Erwinia carotovora | 8.33±0.09 c |
| Xanthomonas campestris | 9.03±0.19 b |
| Different lowercase letters means significant difference at 0.05 level. | |
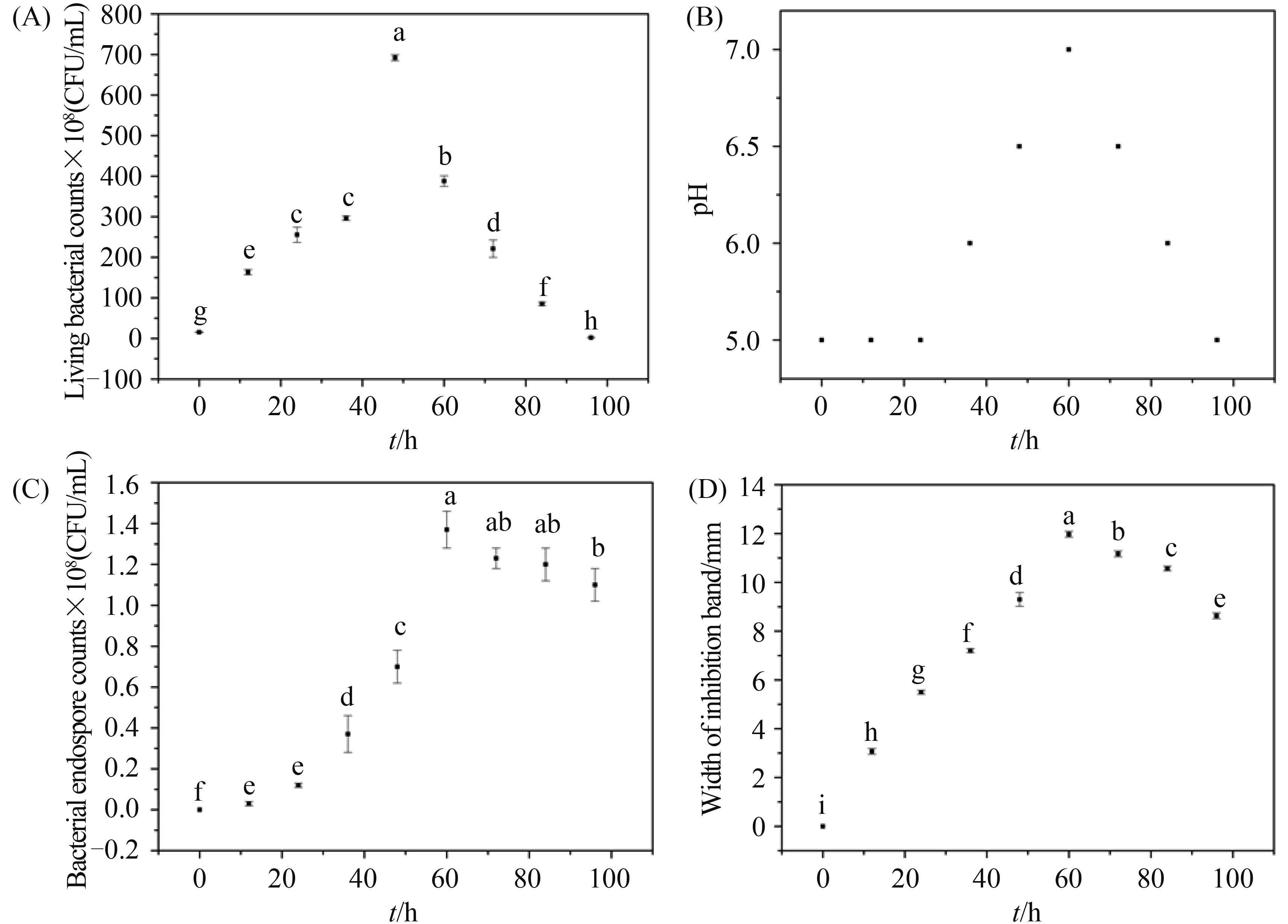
枯草芽孢杆菌发酵60 h后,采用滤纸片法测定不同温度处理发酵滤液后的抑菌效果。由图 3-A可知,40 ℃和60 ℃处理与对照相比差异不显著,80 ℃以上抑菌活性随温度上升而下降,与对照相比差异显著,121 ℃抑菌活性较对照降低18.13%。
|
| 图 3. 不同温度和蛋白酶处理对发酵滤液抑菌活性的影响 Figure 3. Effect of different temperature (A) and proteinase (B) treatment on the inhibition activity of filtrate. Different lowercase letters means significant difference at 0.05 level. |
枯草芽孢杆菌发酵60 h后,采用滤纸片法测定蛋白酶K处理发酵滤液后的抑菌效果。由图 3-B可知,蛋白酶K处理后抑菌活性与对照相比差异显著,抑菌活性降低11.47%。
3 结论和讨论本研究以枯草芽孢杆菌为目标,研究了其在发酵过程中pH值、活菌量、芽孢量和抑菌活性的变化规律,并且研究了反复冻融对活菌量和抑制枣缩果病菌活性的影响,以及反复冻融后菌体形态的变化。在发酵过程中,发酵液的pH值是不断变化的,总体是一种先上升后下降的趋势,活菌量在发酵48 h达到最大,pH值、芽孢量和抑菌活性均为发酵60 h时达到最大值。发酵液反复冻融研究得出,反复冻融3次对活菌量和抑菌活性有较大的影响,冷冻时间对活菌量和抑菌活性的影响不显著,主要在于冻融的次数。对其形态的扫描电镜观察发现,菌体表面较光滑,可以看到在进行正常的裂殖繁殖,随着反复冻融次数的增加,菌体表面出现的凹陷和扭曲向内翻卷的状态也越来越严重,活菌量越来越少,芽孢量越来越多,菌体表面不平整,有胶状物质流出。
本研究中发酵液的pH值由酸性缓慢升高为中性,然后再缓慢下降,这与巨向红[20]的研究结果不一致,这是由于其并未测定发酵前期pH值,仅测定了发酵第5 d和7 d的pH值,后期pH值下降,分析应为后期产生酸导致。本研究发现,pH 7时发酵滤液的抑菌活性最强,这与Li和Xu[6]对枯草芽孢杆菌发酵条件优化的结果是一致的,但不同的是,本研究发酵滤液初始pH值自然,随发酵时间延长变为7,而Li和Xu的研究中初始pH为7时抑菌活性最大,分析可能在中性时可以使抑菌物质达到最大值。徐慧等[21]研究了枯草芽孢杆菌HB-32产3-羟基丁酮分批发酵动力学,发现产3-羟基丁酮在80 h内一直在增长,但趋于平稳,80 h后产量如何并未研究,这与本研究是不一致的,该文得出3-羟基丁酮的合成与葡萄糖的消耗成正比,出现差异的原因可能是培养基成分不一致,尤其是葡萄糖含量的不一致有关。而培养基成分不同对代谢产物的影响是较大的[22]。本研究60 h后发酵液抑菌活性降低,分析因为长时间发酵泡沫产生,抑菌物质流失有关[23-24]。
芽孢杆菌产生的代谢产物很多,可用来抑制病原菌的生长从而获取营养和空间而倍受关注[25]。本文所用枯草芽孢杆菌发酵产生的抗菌物质,经研究抑菌谱广,对热较稳定,符合脂肽类抗生素抑菌耐热的特性[26];蛋白酶K处理会降低其抑菌活性,说明其具有蛋白质的性质。因此,该抑菌物质应是抑菌蛋白和脂肽类抗生素的混合物,从中纯化出关键抑菌物质,将是今后研究的重点。许多学者就反复冻融对抗生物质抑菌活性的影响做了有益的探索,如郝晓娟等[27]和Maxwell等[28]发现反复冻融对抗生物质活性无显著影响,而司钊等[29]利用反复冻融对油松毛虫血淋巴粗提液抗菌活性的影响,发现反复冻融1-5次抗菌物质的活性降低4.3%-14.9%。出现这些情况的原因,分析可能是由于不同菌株产生的抑菌物质不同导致。本研究发现反复冻融对枯草芽孢杆菌的活性是有影响的,反复冻融3次活菌量与抑菌活性减少,与对照相比差异显著,说明其对抑菌物质(抑菌蛋白)有破坏作用,这与Asadishad等[30]和Eilertsen等[31]的发现是一致的,但抑菌活性并未完全丧失,说明抑菌物质应不限于一种,或者在反复冻融的逆境胁迫下产生了一类特殊的物质而抑制了活性。而反复冻融4-5次后,活菌量与冻融3次后差异不显著,因为此时已全为芽孢所致,而芽孢对反复冻融具有较高的抗性[32]。冻融4-5次后,抑菌活性与冻融3次同样差异不显著,分析应为剩下的抑菌物质(脂肽类抗生素)对冻融不敏感,结合活菌量数据分析,芽孢数量与抑菌活性是否具有一定相关性有待进一步的研究。本试验仅冻融5次,继续增加冻融次数对抑菌活性的影响是否依旧如此有待进一步的试验研究。而张帅[33]用反复冻融法对嗜酸乳杆菌分离细菌素显示,反复冻融可以增加抑菌活性,与本研究结果不同,可能与菌株不同有关。
供试菌株形态的电镜观察结果说明反复冻融有助于加速细菌的消融和裂解,可能是因为环境剧烈变化,其细胞内部产生溶解酶之类的物质,让其细胞壁形变和破裂,但结合活菌量与抑菌活性的数据,并不能得出胞内产物是否可以增加抑菌活性的结论。具体在这些过程中细胞内部化学物质成分的变化及其作用,有待将来进一步试验和观察。
| [1] | Wang DW, Liu YJ, Lin ZP, Yang ZY, Hao CL. Isolation and identification of surfactin producing Bacillus subtilis strain and its effect of surfactin on crude oil. Acta Microbiologica Sinica , 2008, 48 (3) : 304–311 (in Chinese). 王大威, 刘永建, 林忠平, 杨振宇, 郝春雷. 一株产生脂肽的枯草芽孢杆菌的分离鉴定及脂肽对原油的作用. 微生物学报 , 2008, 48 (3) : 304–311. |
| [2] | Wang XJ, Bu CY, Jin YS, Liang W, Tong BS, Shi GL, Wang YN. Identification and inhibitory effects of antagonistic bacteria against strawberry root rot (Fusarium oxysporum). Acta Horticulturae Sinica , 2011, 38 (9) : 1657–1666 (in Chinese). 汪雪静, 卜春亚, 靳永胜, 梁为, 仝宝生, 师光禄, 王有年. 草莓根腐病菌拮抗细菌的分离与鉴定. 园艺学报 , 2011, 38 (9) : 1657–1666. |
| [3] | Hu XD, Wang JW, Li XJ, Ji F, Shi JR, Xu JH. Study of antagonistic substance from Bacillus subtilis AF0907 against Fusarium graminearum. Chinese Journal of Biological Control , 2015, 31 (3) : 378–385 (in Chinese). 胡晓丹, 王建伟, 李孝敬, 祭芳, 史建荣, 徐剑宏. 赤霉病菌拮抗菌Bacillus subtilisAF0907抗菌物质研究. 中国生物防治学报 , 2015, 31 (3) : 378–385. |
| [4] | Jia SJ, Ceng DX, Wu XL, Tu GQ. Inhibitory of an antifungal protein produced by Bacillus subtilis C-D6 against Magnaporthe oryzae. Chinese Journal of Biological Control , 2011, 27 (3) : 364–365 (in Chinese). 贾书娟, 曾大兴, 吴小丽, 涂国全. 枯草芽孢杆菌C-D6抗菌蛋白对稻瘟病菌的抑菌作用. 中国生物防治学报 , 2011, 27 (3) : 364–365. |
| [5] | Qiao JQ, Xia YF, Liu YZ, Liang XJ, Du Y. Impact on tomato root and rhizosphere microbial community exerted by Bacillus subtilis PTS-394. Jiangsu Journal of Agricultural Science , 2014, 30 (6) : 1304–1308 (in Chinese). 乔俊卿, 夏彦飞, 刘邮洲, 梁雪杰, 杜艳. Bacillus subtilis PTS-394对番茄根系及根围微生态的影响. 江苏农业学报 , 2014, 30 (6) : 1304–1308. |
| [6] | Li RF, Xu Y. Fermentation optimization to improve production of antagonistic metabolites by Bacillus subtilis strain BS501a. Journal of Central South University of Technology , 2011, 18 (4) : 1047–1053 DOI:10.1007/s11771-011-0802-7 . |
| [7] | Yuan HN, Huang DY, Zhang H, Qian HF, Wang L, Qi XG. Breaking of brewer yeast with repeated freezing and thawing combined with ultrasound treatment. Food and Fermentation Industries , 2013, 39 (12) : 62–67 (in Chinese). 苑华宁, 黄冬云, 张晖, 钱海峰, 王立, 齐希光. 反复冻融和超声协同作用破碎酵母细胞. 食品与发酵工业 , 2013, 39 (12) : 62–67. |
| [8] | Cartwright SJ, Waley SG. Purification of β-lactamases by affinity chromatography on phenylboronic acid-agarose. Biochemical Journal , 1984, 221 (2) : 505–512 DOI:10.1042/bj2210505 . |
| [9] | Cecchini G, Bekele T, Kasali OB. The effect of repeated freezing and thawing of serum on the activity of antibodies. Veterinary Research Communications , 1992, 16 (6) : 425–428 DOI:10.1007/BF01839019 . |
| [10] | Sode K, Horikoshi K, Takeyama H, Nakamura N, Matsunaga T. On-line monitoring of marine cyanobacterial cultivation based on phycocyanin fluorescence. Journal of Biotechnology , 1992, 21 (3) : 209–217 . |
| [11] | Zhang J, Wei YC, Wang GX, Yang F, Cheng CM, Xia XR. Influential factors of the phycocyanin extraction from the Taihu water samples. Journal of Safety and Environment , 2012, 12 (3) : 111–115 (in Chinese). 张静, 韦玉春, 王国祥, 杨飞, 程春梅, 夏晓瑞. 太湖水体中藻蓝蛋白提取的影响因素分析. 安全与环境学报 , 2012, 12 (3) : 111–115. |
| [12] | Wang XQ, Miao H, Zhai Y. Study on the methods of alga cells fragmentation. Journal of Tianjin University of Science & Technology , 2007, 22 (1) : 21–25 (in Chinese). 王雪青, 苗惠, 翟燕. 微藻细胞破碎方法的研究. 天津科技大学学报 , 2007, 22 (1) : 21–25. |
| [13] | Berks M, Redhead K, Abraham EP. Isolation and properties of an inducible and a constitutive β-lactamase from Pseudomonas aeruginosa. Journal of General Microbiology , 1982, 128 (1) : 155–159 . |
| [14] | Liu LX, Gao YL, Wang CX, Zhang YN. Effect of the flavonoids on the activity of β-lactamase from Staphylococcus aureus. Journal of Northeast Agricultural University , 2013, 44 (3) : 119–122 (in Chinese). 刘立新, 高月林, 王朝兴, 张羽男. 黄酮化合物对金黄葡萄球菌β-内酰胺酶活性影响. 东北农业大学学报 , 2013, 44 (3) : 119–122. |
| [15] | Rovati JI, Delgado OD, Figueroa LIC, Fariña JI. A novel source of fibrinolytic activity: Bionectria sp, an unconventional enzyme-producing fungus isolated from Las Yungas rainforest (Tucumán, Argentina).. World Journal of Microbiology & Biotechnology , 2010, 26 (1) : 55–62 . |
| [16] | Weibel KE, Mor JR, Fiechter A. Rapid sampling of yeast cells and automated assays of adenylate, citrate, pyruvate and glucose-6-phosphate pools. Analytical Biochemistry , 1974, 58 (1) : 208–216 DOI:10.1016/0003-2697(74)90459-X . |
| [17] | Fang ZD. Methodology for plant pathology. The 3rd edition, Beijing: China Agricultural Press, 1998 : 46 -47 (in Chinese) . 方中达. 植病研究方法. 北京: 中国农业出版社, 1998 : 46 -47. |
| [18] | Prabakaran G, Hoti SL. Optimization of spray-drying conditions for the large-scale preparation of Bacillus thuringiensis var. israelensis after downstream processing.. Biotechnology and Bioengineering , 2008, 100 (1) : 103–107 DOI:10.1002/(ISSN)1097-0290 . |
| [19] | Ma GZ, Fu HR, Wang SF, Bao ZH, Wu SJ, Qian JH. Antimicrobial spectrum and stability determination for marine Paenibacillus polymyxa strain L1-9. Marine Science Bulletin , 2013, 32 (3) : 316–320 (in Chinese). 马桂珍, 付泓润, 王淑芳, 暴增海, 吴少杰, 钱俊晖. 海洋多粘类芽孢杆菌L1-9菌株发酵液抗菌谱及稳定性测定. 海洋通报 , 2013, 32 (3) : 316–320. |
| [20] | Ju XH, Ye XM, Zhang JY, Xu ZW, Sun JH, Yong YH. Study on the feed performance of a strain of Bacillus subtilis. China Herbivores Science , 2015, 35 (4) : 32–35 (in Chinese). 巨向红, 叶小妹, 张金燕, 徐中文, 孙建华, 雍艳红. 一株枯草芽孢杆菌的饲料学特性研究. 中国草食动物科学 , 2015, 35 (4) : 32–35. |
| [21] | Xu H, Liu JJ. Kinetics of acetoin production by Bacillus subtilis HB-32 in batch fermentation. Food Science , 2013, 34 (13) : 209–212 (in Chinese). 徐慧, 刘建军. 枯草芽孢杆菌HB-32产3-羟基丁酮分批发酵动力学. 食品科学 , 2013, 34 (13) : 209–212. |
| [22] | Li XY, Mao ZC, Wu YX, He YQ. Effects of different media on cyclic lipopeptides produced by Bacillus subtilis XF-1. Journal of Inner Mongolia Agricultural University (Natural Science Edition) , 2014, 35 (6) : 49–53 (in Chinese). 李兴玉, 毛自朝, 吴毅歆, 何月秋. 不同培养基对Bacillus subtilisXF-1产脂肽抗生素的影响. 内蒙古农业大学学报(自然科学版) , 2014, 35 (6) : 49–53. |
| [23] | Chen L, Mao JJ, Yu GH, Wang JS, Bian K. Optimization of fermentation conditions for enhanced antimicrobial lipopeptide production by Bacillus subtilis LM2303 using response surface methodology. Food Science and Technology , 2015, 40 (4) : 17–21 (in Chinese). 陈亮, 毛晶晶, 宇光海, 王金水, 卞科. 响应面法优化Bacillus subtilis抗菌脂肽发酵工艺条件. 食品科技 , 2015, 40 (4) : 17–21. |
| [24] | Coutte F, Lecouturier D, Yahia SA, Leclère V, Béchet M, Jacques P, Dhulster P. Production of surfactin and fengycin by Bacillus subtilis in a bubbleless membrane bioreactor. Applied Microbiology & Biotechnology , 2010, 87 (2) : 499–507 . |
| [25] | Ongena M, Jacques P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol. Trends in Microbiology , 2008, 16 (3) : 115–125 DOI:10.1016/j.tim.2007.12.009 . |
| [26] | Yang QY, Suo YL, Guo RJ, Li SD, Xu XH. Antifungal activities and principal component analysis of Bacillus subtilis B006 against Fusarium oxysporum f. sp. cucumerinum and Phytophthora capsici.. Chinese Journal of Biological Control , 2012, 28 (2) : 235–242 (in Chinese). 杨琦瑶, 索雅丽, 郭荣君, 李世东, 许修宏. 枯草芽孢杆菌B006对黄瓜枯萎病菌和辣椒疫霉病菌的抑制作用及其抗菌组分分析. 中国生物防治学报 , 2012, 28 (2) : 235–242. |
| [27] | Hao XJ, Liu B, Xie GL, Ge CB, Lin J. Detection of antagonistic substance produced by Brevibacillus brevis JK-2 strain. Journal of Zhejiang University (Agric.&.Life Sci.) , 2007, 33 (5) : 484–489 (in Chinese). 郝晓娟, 刘波, 谢关林, 葛慈斌, 林娟. 短短芽孢杆菌JK-2菌株抑菌物质特性的研究. 浙江大学学报(农业与生命科学版) , 2007, 33 (5) : 484–489. |
| [28] | Maxwell PW, Chen G, Webster JM, Dunphy GB. Stability and activities of antibiotics produced during infection of the insect Galleria mellonella by two isolates of Xenorhabdus nematophilus. Applied & Environmental Microbiology , 1994, 60 (2) : 715–721 . |
| [29] | Si Z, Xue JL, Xie YP, Fan JH, Li YF. Antibacterial activity substance in Dendrolimus tabulaeformis larvae and their antibacterial activity. Journal of Environmental Entomology , 2008, 30 (4) : 318–324 (in Chinese). 司钊, 薛皎亮, 谢映平, 樊金华, 李永福. 油松毛虫幼虫抗菌物质及其抗菌活性研究. 环境昆虫学报 , 2008, 30 (4) : 318–324. |
| [30] | Asadishad B, Olsson ALJ, Dusane DH, Ghoshal S, Tufenkji N. Transport, motility, biofilm forming potential and survival of Bacillus subtilis exposed to cold temperature and freeze-thaw. Water Research , 2014, 58 (3) : 239–247 . |
| [31] | Eilertsen HC, Huseby S, Degerlund M, Eriksen GK, Ingebrigtsen RA, Hansen E. The effect of freeze/thaw cycles on reproducibility of metabolic profiling of marine microalgal extracts using direct infusion high-resolution mass spectrometry (HR-MS). Molecules , 2014, 19 (10) : 16373–16380 DOI:10.3390/molecules191016373 . |
| [32] | Deng K, Plaza-Garrido A, Torres JA, Paredes-Sabja D. Survival of Clostridium difficile spores at low temperatures. Food Microbiology , 2015, 46 : 218–221 DOI:10.1016/j.fm.2014.07.022 . |
| [33] | Zhang S. Study on bacteriocin extracted by different cell disruption methods. Journal of Harbin University of Commerce (Natural Sciences Edition) , 2013, 29 (4) : 432–434 (in Chinese). 张帅. 不同破碎方法提取嗜酸乳杆菌细菌素的研究. 哈尔滨商业大学学报(自然科学版) , 2013, 29 (4) : 432–434. |
 2016, Vol. 56
2016, Vol. 56