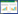中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 田飞, 谢占玲, 郭璟, 赵联正, 韩兴宝, 常鑫园. 2015
- Fei Tian, Zhanling Xie, Jing Guo, Lianzheng Zhao, Xingbao Han, Xinyuan Chang. 2015
- 镰刀菌Q7-31T内切葡聚糖酶Egn20的分离纯化鉴定及酶学特性
- Purification, identification and characterization of an endoglucanase Egn20 from Fusarium sp.Q7-31T
- 微生物学报, 2015, 55(8): 1042-1049
- Acta Microbiologica Sinica, 2015, 55(8): 1042-1049
-
文章历史
- 收稿日期:2014-11-07
- 修回日期:2015-02-14
木质纤维素蕴含着世界上最丰富的生物质能源,将生物质转化为液态燃料被认为是取代化石燃料的最有前景的技术[1]。然而一些生物化学处理过程中的关键技术阻碍还没有被有效地解决,使之不能成为一个产业。其中一个明显的瓶颈就是植物细胞壁降解酶的造价太高,主要原因是纤维素酶的活性太低[2]。在纤维素糖化或者同步糖发酵过程中,纤维素酶的组分往往需要进行优化,以改进混合酶中不同组分之间的比例,补充不足的酶组分,以提高纤维素的水解效率。但该方向的研究尚无明显的突破,主要原因是天然木质纤维素的生物降解机制没有被完全研究清楚。
真菌酶在降解木质纤维素底物时,各类酶在表达顺序、组成比例、水解方式上相互协调,互相提供新的可及位点,逐步实现底物的有效降解。内切葡聚糖酶(EG)作用于纤维素链的内部,随机地切断纤维素链,形成还原性的葡聚糖末端,为酶系中的其它酶不断提供新的可及位点,通过与其它酶的协同作用影响着纤维素降解的整体速率。因此,内切葡聚糖酶在植物细胞壁降解的整个过程中都起着非常重要的作用。
现在已经有大量的降解植物细胞壁的真菌酶被应用于工业生产中,其中,Trichoderma sp.的真菌因其无毒害作用和强大的蛋白分泌系统,成为了目前木质纤维素降解研究最广泛的真菌[3]。但是为了更好地满足工业对高效木质纤维素降解酶的需求,新的植物细胞壁降解菌株的发现及其酶系的研究仍然有着很重要的意义[4]。镰刀菌作为人类发现最早的植物病原菌之一,广泛分布于自然界中,兼寄生或腐生生活。镰刀菌在自然界中可以分解纤维素、降解有机物,对自然界的物质循环起着重要作用。由于镰刀菌属于病原菌,对镰刀菌的研究多集中在对致病性镰刀菌的防治或利用其病原性对病虫害的防治方面,对利用镰刀菌产酶方面的研究较少。本课题组通过筛选,获得了多株产植物细胞壁降解酶的镰刀菌。产酶情况的分析比较发现,菌株Q7-31T粗酶液降解植物细胞壁的效率要明显高于其它菌株[5]。为了进一步探究镰刀菌侵染植物细胞壁的机理和更有效地提高植物细胞壁降解酶系的水解效率,我们选取镰刀菌Q7-31T为试验材料,分离纯化其内切葡聚糖酶,并分析研究其酶学性质。
1 材料和方法 1.1 材料 1.1.1 菌种:镰刀菌Q7-31T由青海大学微生物实验室于2007年5月从青海湖地区分离得到。 1.1.2 试剂:木聚糖(Birch Xylan)、木糖(Xylose)、羧甲基纤维素(CMC)、蛋白胨、十二烷基硫酸钠(SDS)购自Sigma公司,三羟甲基氨基甲烷(Tris)、低分子量蛋白Marker购自上海生工生物工程有限公司,Sephacry S-100、DEAE-Sepharose Fast Flow购自Pharmacia公司。 1.1.3 仪器设备:数显恒温水浴锅HH-6(国华电器有限公司);HYG-A全温摇瓶柜(太仓市实验设备厂);GXZ-300型智能光照培养箱(宁波东南仪器有限公司);LDZX-40Ⅱ立式自动压力蒸汽灭菌器(上海申安医疗器械厂);SW-CJ-ZFD型双人单面净化工作台(苏州净化设备有限公司);AdventurerTM天平(奥豪斯国际贸易(上海)有限公司);UV-9200紫外可见分光光度计(北京瑞利分析仪器公司); TDL-40B型台式低速离心机(上海安亭仪器厂);Mb18透析袋(北京索莱宝科技有限公司)。 1.2 菌株培养将液体石蜡封存的菌种转接至PDA固体培养基(马铃薯200 g,蔗糖20 g,琼脂15-20 g,蒸馏水1000 mL),25℃恒温培养,对菌种进行活化;将PDA固体培养基上菌落转接约直径1.0 cm大小的菌块至液体种子培养基(葡萄糖20 g/L、蛋白胨3 g/L、(NH4)2SO4 1.4 g/L、KH2PO4 2.0 g/L、尿素0.3 g/L、CaCl2 0.3 g/L、MgSO4 0.3 g/L、FeSO4 5.0 mg/L、MnSO4 1.6 mg/L、ZnSO4 1.4 mg/L、CoCl2 2.0 mg/L),pH自然;装液量为60 mL/150 mL,60 r/min室温振荡培养;将液体种子按10%接种量转接至产酶液体发酵培养基(葡萄糖20 g/L改为燕麦秸秆5 g/L,其它同液体种子培养基),pH自然,装液量100 mL/250 mL,20℃、120 r/min室温振荡培养。
1.3 酶活力的测定采用3′,5′-二硝基水杨酸(DNS)测定还原糖的方法测定植物细胞壁降解相关酶的活力[6]。分别采用1%木聚糖、0.5%羧甲基纤维素(CMC)为底物测定木聚糖酶和内切纤维素酶的活力,反应时间分别为10 min和30 min;分别采用0.5%燕麦秸秆、0.5%滤纸、0.5%麸皮、0.5%棉花和0.5%淀粉为底物测定样品对于上述底物的酶活力,反应时间为60 min。以在40℃下每分钟产生1 μmol还原糖所需的酶液量为一个酶活力单位(U)。
1.4 蛋白质含量测定蛋白总浓度采用Bradford法[7],以牛血清白蛋白(BSA)为标准绘制标准曲线。在2 mL离心管中加入适当稀释的蛋白样品200 μL,加入1 mL考马斯亮蓝G-250染液,在595 nm下测定光吸收值。
1.5 内切葡聚糖酶的分离纯化 1.5.1 硫酸铵分级沉淀:取发酵培养72 h的发酵液,6000×g离心15min去除菌体,得到粗酶液;将固体硫酸铵研细加入到粗酶液中,调节至不同的饱和度(10%-90%,每隔10%作为一个梯度),待硫酸铵全部溶解后,4℃静置2 h,10000×g离心20 min,取沉淀,样品经Mb18透析袋(截留分子量为10 kDa)透析脱盐后进行酶活力和蛋白含量的测定。 1.5.2 Sephacry S-100葡聚糖凝胶层析:取硫酸铵分级沉降后获得的内切葡聚糖酶活性部分,添加到Sephacry S-100葡聚糖凝胶层析柱(26 mm×700 mm),以0.02 mol/L pH7.5的Tris-HCl缓冲液洗脱,流速为1.3 mL/min,用核酸蛋白检测仪检测蛋白分布,用DNS法检测内切葡聚糖酶分布(方法如前所述)。 1.5.3 DEAE弱阴离子交换层析:取Sephacry S-100葡聚糖凝胶层析收集的内切葡聚糖酶活性部分,添加到DEAE琼脂糖凝胶弱阴离子交换柱(15×50 mm)上,用含有0.02-1.00 mol/L NaCl的缓冲液进行线性梯度洗脱,用核酸蛋白检测仪检测蛋白分布;样品经Mb18透析袋透析脱盐后,检测内切葡聚糖酶的分布(方法如前所述)。 1.6 SDS-PAGE 分析以SDS-PAGE法检测蛋白质的分子量和分离纯化过程中每一步的蛋白纯度[8]。浓缩胶浓度为5%,电泳电压为80 V;分离胶浓度为12%,电泳电压为120 V。
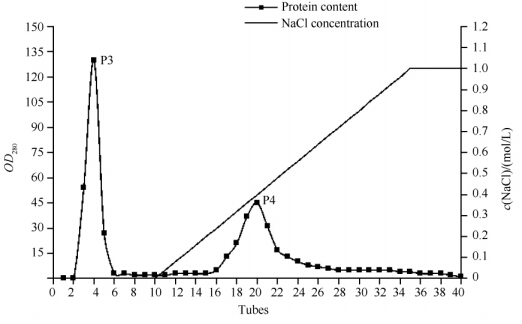
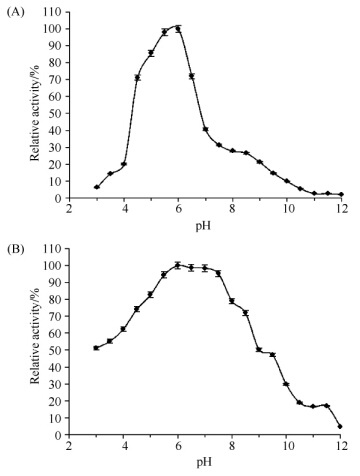
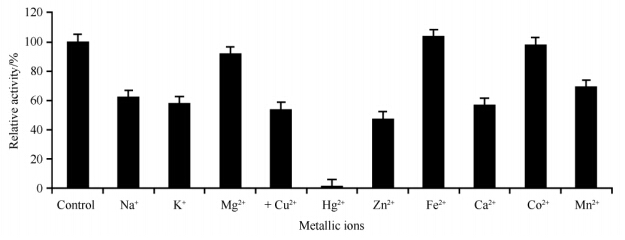
1.7 酶学性质分 1.7.1 最适温度、pH及稳定性测定:最适温度测定:将底物处于pH6.8的缓冲液中,在4-80℃范围中进行酶促反应,确定酶(CMC酶)的最适反应温度;在上述不同温度下恒温水浴1 h测定酶的稳定性;最适pH测定:将底物处于不同pH的缓冲液中,pH范围为3.0-12.0,在45℃条件下反应并测定酶(CMC酶)活力,确定最适反应pH;将样品分别在pH3.0-12.0处理24 h,45℃,最适pH下测定酶的pH稳定性。 1.7.2 底物特异性测定:分别选取1%木聚糖、0.5%羧甲基纤维素(CMC)、0.5%秸秆粉、0.5%淀粉、0.5%麸皮、0.5%滤纸、0.5%棉花纤维作为底物,酶活力的测定方法如前文所示。 1.7.3 米氏常数的测定:米氏常数Km的测定采用双倒数法:固定酶浓度,在酶量不变的情况下改变底物CMC的浓度,测定酶活力随底物浓度的改变而变化的情况。 1.7.4 金属离子对酶活力影响:分别在酶液中加入各种金属离子化合物:Na+、K+、Mn2+、Mg2+、Cu2+、Hg2+、Zn2+、Fe2+、Ca2+、Co2+,各种金属离子在反应体系中的终浓度达到0.001 mol/L。40℃处理30 min后测定残余的CMC酶活力。以未加金属离子的酶活力作为100%。 1.8 蛋白鉴定蛋白的鉴定由华大基因(北京)完成。首先对蛋白样品进行双向电泳检测,然后切下的目的蛋白凝胶位点,加入50 mmol/L NH4HCO3振荡至无色;加入乙腈100 μL放置30 min。通过1 μg/mL胰蛋白酶37℃水浴16 h;加入100 μL提取液(50%乙腈,5%TFA),40℃水浴1 h后真空干燥除去乙腈,再加入5 μL0.1%三氟乙酸。蛋白样品用串联质谱仪系统进行检测:首先进行一级质谱获得蛋白的肽指纹图谱(PMF),然后在一级质谱的基础上再选择部分肽段做进一步地破碎并对碎片进行深入分析和比较,鉴定出该肽段的序列并结合PMF的结果进行搜库(NCBI)比较,找出与之对应的蛋白,从而实现蛋白质的鉴定。由于二级质谱能够得到部分肽段的序列,因此具有更高的可靠性[9]。
1.9 数据处理与误差分析采用SPSS 19.0数据处理软件进行误差分析:测定管与对照管之间采用两样本平均数t检验法进行显著性检验(P<0.01,线性相关性极显著;0.05>P>0.01,线性相关性显著;P>0.05,线性相关性不显著)[10]。
2 结果和分析 2.1 内切葡聚糖酶分离纯化内切葡聚糖酶活性的蛋白样品在硫酸铵为40%-90%的饱和度条件下沉淀下来。蛋白样品以0.02 mol/L pH7.5 Tris-HCl缓冲液重悬,Mb18透析袋脱盐,取20 mL重悬液添加到Sephacry S-100葡聚糖凝胶柱进行初步分级分离,洗脱图谱如图1所示。主要有2个蛋白峰(P1,P2),内切葡聚糖酶的酶活力主要集中在P1处,P2处的主要酶活力为木聚糖酶活。对P1处的蛋白样品进行SDS-PAGE检测,在图谱中发现2条条带,分子量分别在55 kDa和35 kDa左右(图3,1-2)。
|
| 图1. Sephacryl S-100(26×700 mm)凝胶过滤洗脱图谱 Figure 1. Elution profile of the gel filtration on Sephacryl S-100(26×700 mm). |

|
| 图3. 分离纯化蛋白SDS-PAGE电泳图 Figure 3. SDS-PAGE of protein samples during separation and purification. Lane 1-2, protein samples after gel filtration; Lane 3-4, protein samples after ion exchange chromatograph; M, protein marker. |
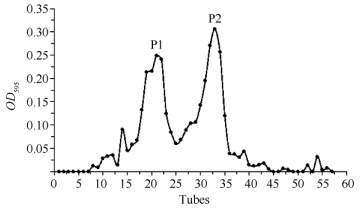
将P1处的样品收集、浓缩,上样到DEAE琼脂糖凝胶弱阴离子交换柱进一步分离纯化,洗脱图谱如图2所示,包括一个穿透峰(P3)和一个洗脱峰(P4),酶活力检测发现P3处的蛋白样品有明显的内切葡聚糖酶活,而P4处的蛋白样品无酶活力。对P3处样品进行SDS-PAGE检测(图3,3-4),发现为单一条带,经凝胶成像系统分析,分子量为55 kDa左右,将该蛋白命名为Egn20(图2)。以600 mL发酵液开始,内切葡聚糖酶Egn20从粗酶液到最后的纯化产物共纯化了13.4倍,回收率为4%,酶纯化后的比活力为127.5 U/mg,分离纯化结果如表1所示。
|
| 图2. DEAE弱阴离子交换层析洗脱图谱 Figure 2. Elution profile of the DEAE ion-exchange column chromatography. |
| Purification step | Total protein/mg | Total activity/U | Specific activity/ (U/mg) | Purification (fold) | Yield/ % |
| Crude extract | 26.68 | 253.74 | 9.51 | 1.00 | 100 |
| Ammonium sulphate precipitation | 5.79 | 136.21 | 23.52 | 2.47 | 53 |
| Sephacryl S-100 gel filtration | 0.18 | 14.45 | 80.27 | 8.44 | 6 |
| DEAE-sepharose ion-exchange column chromatography | 0.09 | 10.20 | 127.50 | 13.41 | 4 |

|
| 图4. Egn20最适温度和温度稳定性检测 Figure 4. Effects of temperature on the activity and stability of Egn20. A: enzyme activity; B: thermal stability. |
|
| 图5. Egn20最适pH和pH耐受性检测 Figure 5. Effects of pH on the activity and stability of Egn20. A: enzyme activity; B: pH stability. |
| Substrate | Specific activity/(U/mg Protein) |
| Carboxymethylcellulose | 127.50 |
| Xylan | 3.71 |
| Oat straw | 0.88 |
| Starch | 0 |
| Bran | 9.28 |
| Filter paper | 1.77 |
| Cotton | 0 |
|
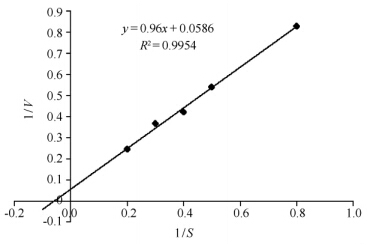
| 图6. Egn20的双倒数曲线图 Figure 6. Double reciprocal diagram of Egn20, each value in the panel represents the means (n=3). |
|
| 图7. 金属离子对Egn20的CMC酶活力的影响 Figure 7. Effect of metal ions on CMCase activity of Egn20. Each value in the panel represents the means (n=3). |
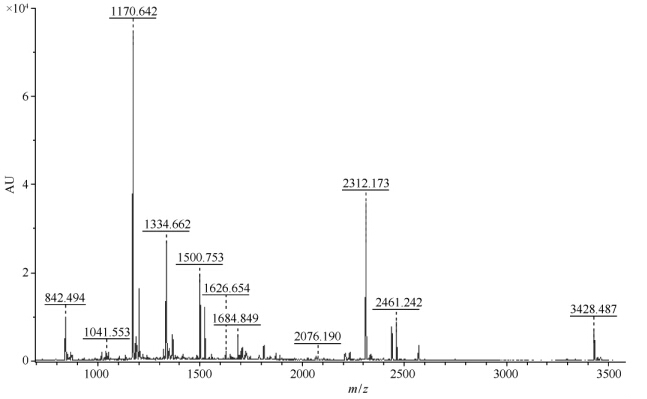
首先对Egn20的蛋白样品进行双向电泳检测,结果显示Egn20的分子量为55.37 kDa、等电点为7.44(电泳图未给出);随后,蛋白样品经胰蛋白酶酶切,进行串联质谱分析:先通过一级质谱获得蛋白的肽指纹图谱(PMF),再选取有代表性的肽段,进一步破碎后进行二级质谱检测,质谱图如图8所示,二级质谱获得2段多肽序列:RLQQLINNQLVSPR以及VQPNPEVTFSNIR。二级质谱结果结合母离子信息和PMF的结果进行搜库(NCBI)比较,经Mascot搜索引擎检索,检索最高得分39分,对应结果为GH7家族内切葡聚糖酶,NCBI注册号为gi︱1170138(分子量为47.46 kDa,等电点为8.32)。该蛋白的分子量和等电点与双向电泳检测显示的Egn20分子量和等电点差异明显,推测Egn20与该蛋白的序列相似但并不完全一致。
|
| 图8. Egn20质谱鉴定图谱 Figure 8. Identification of Egn20 by MADIL-TOF-TOF. |
Egn20的酶学性质与报道的内切葡聚糖酶一致、质谱信息与GH7家族的内切葡聚糖酶相似,而分子量和等电点与质谱结果对应的蛋白存在明显差异,综合上述研究结果,我们将Egn20鉴定为一种新的GH7家族的内切葡聚糖酶。
3 讨论国内外已报道了不同来源的纤维素酶的分离纯化及酶学性质研究,但是关于镰刀菌EG的报道较少。本文基于前期对镰刀菌研究的基础之上,对筛选得到的植物细胞壁高效降解菌株Q7-31T胞外酶系中EG进行了分离纯化及酶学性质研究。酶纯化后的比酶活力为127.5 U/mg,该值与Golovehenko等[15]报道的Clostridium thermocellum内切葡聚糖酶活力(125 U/mg)持平,略低于王艳凤[16]报道的Amylomycesrouxii内切葡聚糖酶活力(140 U/mg)。纯化得到的内切葡聚糖酶Egn20分子量为55.37 kDa,与Merja等[17]报道的Trichoderma reesei内切葡聚糖酶分子量存在一定差别。
纯化的Egn20可以降解天然混合底物产生还原性糖,并且对木聚糖也存在较弱的降解活力,这可能与天然混合底物中存在Egn20特异性识别的底物位点以及糖苷酶的专一性普遍不高有关[13]。Egn20降解麸皮的酶活力要明显高于降解其它天然混合底物时的酶活力,可能是由于麸皮主要成分为低聚的戊聚糖、葡聚糖和纤维素,葡聚糖之间的联接相对不紧密,导致它相对更易被水解。
根据蛋白质谱鉴定的一般标准,一级质谱得分超过60分(P<0.05)说明成功鉴定,但是二级质谱,最少一条肽段得分超过30分即可认为成功鉴定。在我们的实验中,蛋白Egn20的二级质谱鉴定对应结果为注册号为gi︱1170138的GH7家族的内切葡聚糖酶,得分为39分,可以认定为该类蛋白。而根据Mascot的鉴定标准,得分大于45才能说明为同一个蛋白(P<0.05),此外,其分子量(55.37 kDa)和等电点(7.44)与质谱结果对应的蛋白的分子量(47.46 kDa)和等电点(8.32)也存在明显差异,据此推测它们的序列相似但并不完全一致。Egn20的酶学性质与报道的内切葡聚糖酶一致、质谱信息与GH7家族的内切葡聚糖酶相似,而分子量和等电点与质谱结果对应的蛋白存在明显差异,综合上述研究结果,我们将Egn20鉴定为一种新的GH7家族的内切葡聚糖酶。GH7家族既包含CBH(EC 3.2.1.176,也被称作纤维二糖水解酶)又包含EG(EC 3.2.1.4)。其中EG作用在纤维素链内部,随机的水解β-1,4-糖苷键,将长的纤维素链截短,产生大量末端为还原性或非还原性的小分子纤维素[18],可以加快外切酶催化的以纤维素末端为起点的酶解作用。Pastor等的研究发现,内切葡聚糖酶可以增加纸浆纤维的储水能力进而影响纸张的机械强度,喻示出内切葡聚糖酶的预处理,可以对纤维素链的三维结构造成影响[19];Gunnar等的研究发现,用少量的内切葡聚糖酶处理,即可使亚硫酸盐处理的软木纸浆产生大量的丝状绒毛和纤维素降解的中间产物,并显著降低纸浆纤维的黏性[20]。
本试验从燕麦秸秆诱导发酵的镰刀菌Q7-31T粗酶液中分离纯化到GH7家族内切葡聚糖酶Egn20,并对Egn20进行了酶学性质的研究。为丰富和完善镰刀菌的酶系信息提供理论支持,为植物细胞壁高效降解酶系的研究提供了基础数据。
| [1] | Nicolai O, Lutz N. Hemicelluloses and Cell Expansion. Plant Cell Monographs, 2007, 6: 57-88 |
| [2] | Alicia LM, María GZ. Biotechnological potential of pectinolytic complexes of fungi. Biotechnology Letters, 2011, 33(5): 859-868. |
| [3] | Druzhinina IS, Shelest E, Kubicek CP. Novel traits of Trichoderma predicted through the analysis of its secretome. FEMS Microbiology Letters, 2012, 337: 1-9. |
| [4] | Ravalason H, Grisel S, Chevret D, Favel A, Berrin JG, Sigoillot JC, Herpoël GI. Fusarium verticillioides secretome as a source of auxiliary enzymes to enhance saccharification of wheat straw. Bioresource Technology, 2012, 114: 589-596. |
| [5] | Xie ZL, Gao HY, Zhang Q, Wang H, Liu Y. Cloning of a novel xylanase gene from a newly isolated Fusarium sp. Q7-31 and ITS expression in Escherichia coli. Brazilian Journal of Microbiology, 2012, 405-417. |
| [6] | Miller GH. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, 1959, 31: 426-428. |
| [7] | Nicholas JK. The Bradford Method for Protein Quantitation. The Protein Protocols Handbook, Methods in Molecular Biology, 1994, 32:9-15. |
| [8] | Yang XZ, Shi PG, Huang HQ, Luo HY, Wang Y, Zhang W, Yao B. Two xylose-tolerant GH43 biofunctional β-xylosidase/α-arabinosidases and one GH11 xylanase from Humicolainsolens and their synergy in the degradation of xylan. Food Chemistry, 2014, 148: 381-387. |
| [9] | Genciana T, Salvatore P, Tonina R, Elena P, Marco S, Maria FA. Proteomic profiling of sea bass muscle by two-dimensional gel electrophoresis and tandem mass spectrometry. Fish Physiology and Biochemistry, 2013, 40(1): 311-322. |
| [10] | Brown JR, Dinu V. High performance computing methods for the integration and analysis of biomedical data using SAS. Computer Methods & Programs in Biomedicine, 2013, 112(3): 553-562 |
| [11] | Huang Y, Ling M, Qin YL, Liang ZQ. Cloning and expression of endoglucanaseⅠof T. Knoningii. Biotechnology, 2008, 18(2): 10-13. (in Chinese) 黄艳, 凌敏, 覃拥灵, 梁智群. 康氏木霉内切葡聚糖酶(EGⅠ)基因的克隆及表达. 生物技术, 2008, 18(2): 10-13. |
| [12] | Wang LS, Zhang YZ, Gao PJ, Shi D, Liu H, Gao H. Changes in the structural properties and rate of hydrolysis of cotton fibers during extended enzymatic hydrolysis. Biotechnology and Bioengineering, 2006, 93:443-456. |
| [13] | Karnchanatat A, Petsom A, Sangvanich P, Piapukiew J. A novel thermostableendoglucanase from the wood-decaying fungus Daldiniaeschscholzii (Ehrenb.:Fr.) Rehm. Enzyme Microbiology Technology, 2008, 42: 404-413. |
| [14] | Gao KX, Guo RF, Yu HW, Jia YM, Ma W, Lin Y, Zhou S. Production and characterization of thermo tolerant endoglucanase from Streptomyces xylophagus KX6. China Biotechnology, 2009, 29(5): 83-87. (in Chinese) 高克学, 郭润芳, 于宏伟, 贾英民, 马雯, 林杨, 周硕. 蚀木链霉菌 KX6耐热内切葡聚糖酶的产生及酶学性质研究. 中国生物工程杂志, 2009, 29(5): 83-87. |
| [15] | Golovehenko NP, Singh RN, Velikodvorskaya GA, Akimenko VK. Isolation and characterization of a lichenan-degrading hydrophobic endoglucanase of Clostridium thermocellum. Applied Microbiology and Biotechnology, 1993, 39: 74-79. |
| [16] | 王艳凤. 毛霉Amytomyces rooxii HN0512内切葡聚糖酶的分离纯化、性质分析以及基因克隆的初步研究. 暨南大学硕士学位论文, 2009. |
| [17] | Merja E, Penttila M, Andre L, Saloheimo M, Lehtovaara P, Knowles J. Expression of two Trichoderma reesei endoglucanases in the yeast Saccharomyces cerevisiae. Yeast, 1987, 3: 175-185. |
| [18] | Lynd LR, Weimer PJ, Van Zyl WH. Pretorius IS. Microbial cellulose utilization: fundamentals and biotechnology. Microbiology and Molecular Biology Reviews, 2002, 66: 506-577. |
| [19] | Pastor FIJ, Pujio X, Blanco A, Vidal T, Torres AL, Diaz P. Molecular coning and characterization of multidomain endoglucanase from Paenibacillus BP-23: evaluation of its performance in pulp refining. Applied Microbiology and Biotechnology, 2001, 55: 61-68. |
| [20] | Gunnar H, Maria C, Roland A. Monocomponent endoglucanase treatment increases the reactivity of softwood sulphite dissolving pulp. Microbiology and Biotechnology, 2005, 32: 211-214. |
 2015, Vol. 55
2015, Vol. 55