中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 谢娜娜, 张乙平, 陈福生. 2015
- Nana Xie, Yiping Zhang, Fusheng Chen. 2015
- 红色红曲菌M7中色素聚酮合酶基因敲除突变体的鉴定
- Identification of a pigment-polyketide synthase gene deleted mutant of Monascus ruber M7
- 微生物学报, 201555(7): 863-872
- Acta Microbiologica Sinica, 201555(7): 863-872
-
文章历史
- 收稿日期:2014-12-03
- 修回日期:2015-02-08
2. 华中农业大学食品科技学院, 湖北 武汉 430070
2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, Hubei Province, China
聚酮化合物(Polyketides,PKs)是一大类具有类似合成途径的次级代谢产物的总称,主要包括很多抗生素、真菌毒素和部分色素[1]。在植物、真菌和细菌中已经发现1万多种PKs[2],一些PKs具有有益的生物学活性,如能够降血脂(洛伐他汀,Lovastatin)[3]和抑制真菌(灰黄霉素,Griseofulvin)[4]等,因此被广泛应用于农业、医药和食品领域中;还有很多PKs具有毒性,如黄曲霉(Aspergillus flavus)分泌的黄曲霉毒素具有强致癌性[5]。研究发现,参与聚酮化合物合成的基因通常连接在一起,以基因簇的形式存在,在簇中均至少存在一个编码聚酮合酶(Polyketide synthase,PKS)的基因[6, 7]。PKS是控制聚酮合成途径的限速酶,按照结构和催化机理,PKS可以分为模块型(Ⅰ型)、重复型(Ⅱ型)、查尔酮型(Ⅲ型)和重复Ⅰ型4类[1, 8, 9]。真菌中的PKS大多属于重复Ⅰ型PKS[10]。重复Ⅰ型PKS是多功能蛋白,拥有多个具有不同催化功能的结构域,根据PKS中结构域的种类,这类PKS又进一步被划分为8类,分别是4种非还原型PKS(非还原Ⅰ型、Ⅱ型、Ⅰ&Ⅱ型、Ⅲ型)和4种还原型PKS(还原Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型)[12]。虽然不同的重复Ⅰ型PKS拥有的结构域种类和数目不同,但是它们都有3个必需的保守结构域,即β-酮酯酰基合成酶(β-ketosynthase,KS)、酰基载体蛋白(Acyl carrier protein,ACP)和酰基转移酶(Acyltransferase,AT)[11]。
丝状真菌——红曲菌(Monascus spp.)是我国及东南亚国家传统的发酵微生物,主要用于红曲的生产。红曲菌可以产生多种有益的次级代谢产物,如降血脂药物莫纳可林K[12]、降血压药物γ-氨基丁酸[13]和食品着色剂红曲色素(Monascus pigments,MPs)等,同时还可以分泌一种肾脏毒素——桔霉素[14],导致红曲产品受到污染。
MPs是红曲菌产生的最主要的次级代谢产物之一,是具有类似结构(嗜氮酮)的一类化合物的总称,主要有红、橙和黄3类色素组分,现在已经有超过50种MPs被鉴定[15, 16]。除了着色功能外,部分MPs还具有抗氧化、消炎和抗癌等生物学活性[17, 18, 19]。研究表明,桔霉素、莫纳可林K和MPs均是聚酮化合物,在2005年和2008年分别成功地从红曲菌中克隆得到控制桔霉素和莫纳可林K合成的PKS基因[12, 20]。基于此,桔霉素和莫纳可林K在分子水平上的研究得到迅猛发展。本实验室早在2010年已经通过基因组测序技术获得红色红曲菌(M. ruber)M7中控制红曲色素合成的PKS基因簇,并通过敲除簇内调节基因证实了该基因簇是控制MPs合成的PKS基因簇[21];2013年,Balakrishnan 等也从丛毛红曲菌(M. pilosus)中克隆得到该基因簇[22]。本研究对M. ruber M7中色素PKS基因(pksPT)进行了详尽的生物信息学分析,并构建了色素PKS基因缺失突变菌株(ΔpksPT),着重分析了红曲菌不产红曲色素时,桔霉素和红曲菌生长速度上的差异,以探讨红曲色素合成途径与桔霉素合成途径、红曲菌生长的关系。
1 材料和方法 1.1 材料 1.1.1 菌株和质粒:野生菌株M. ruber M7是一株高产MPs和桔霉素的菌株,由本实验室鉴定和保藏[23];根癌农杆菌(Agrobacterium tumefaciens)EHA105为转化供体,本实验室保藏;质粒 pCAMBIA3300为双元载体,由华中农业大学植物科技学院姜道宏教授惠赠;质粒pSKH提供潮霉素抗性标记基因,本实验室保藏。1.1.2 培养基:马铃薯葡萄糖固体培养基(PDA)[21]、马铃薯葡萄糖液体培养基(PDB)[21]、米饭培养基[17]和YES培养基(Yeast extract sucrose)[14]。1.1.3 主要试剂和仪器:TransTaq DNA Polymerase HiFi Fidelity(HiFi)和Trans 2K plus marker(全式金生物有限公司,北京);限制性内切酶和T4连接酶(宝生物工程有限公司,大连);潮霉素B(Hygromycin B)(Amresco);桔霉素标准品(美国Sigma公司); DIG-High Prime DNA Labeling & Detection Starter kitⅠ (瑞士Roche公司)。PCR仪(德国Biometra公司);凝胶成像系统(北京六一仪器厂);相差显微镜(BH-2)(日本Olympus公司);Water e2695高效液相色谱仪(Waters 1525泵,2998PDA检测器,270进样器,美国Waters公司)。1.1.4 相关引物:敲除pksPT的相关引物及pksPT敲除突变体的验证引物如表 1所示。所有引物由金斯瑞生物科技公司(南京)合成。| Primer | Sequence (5′→3′) | Function |
| Bold italic letters indicate Kpn I and Xba I,respectively; Underlined letters are a portion of hph. | ||
| p1 | GGGGTACCACATCCAAGTCGAGATGGTCAGTC | For amplification of the 5′ flanking region of KS domain (828 bp) |
| p2 | AGTGCTCCTTCAATATCATCTTCTGTCGAC ATGATGCCAGCTGAACGGAGT | |
| p3 | CACTTGTTTAGAGGTAATCCTTCTTTCTAG GGGCGAGCTGGAACAGAAGT | For amplification of the 3′ flanking region of KS domain (878 bp) |
| p4 | CGCTCTAGAGCACGGCGTGATTGAAATAGA | |
| hphf | GTCGACAGAAGATGATATTG | For amplication of hph cassette (2137 bp) from plasmid pSKH and the amplification of probes for Southern blot |
| hphr | CTAGAAAGAAGGATTACCTC | |
| p5 | TCAGCGCACAGGTTGTCAATATG | For the identification of mutants and the amplification of probes for Southern blot |
| p6 | GTCTTGGACTGGATGAAGCGTAGG | |
| pksPT-F | CCAACCTCCGTAGCGATGAT | For RT-PCR |
| pksPT-R | GCAAACCGTGCCACAGTAAC | |
| GAPDH-F | GTCTATGCGTGTGCCTACTTCC | For RT-PCR |
| GAPDH-R | GAGTTGAGGGCGATACCAGC | |
采用Softberry(http://linux1.softberry.com/berry.phtml)预测基因的结构及其编码的氨基酸序列。采用Pfam(http://pfam.sanger.ac.uk/)预测基因编码蛋白的活性结构域。采用NCBI的BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行基因功能预测。采用Model_3D_PKS(http://www.nii.ac.in/~swadha/prog_htmls/try2.html)模拟色素PKS的AT三维结构。聚酮合成酶结构域保守氨基酸比对所用到的序列均从NCBI获得。
1.3 红曲菌基因组的抽提将红曲菌涂布在铺有玻璃纸的PDA平板上,28℃培养7 d,揭取菌丝体,采用十六烷基三乙基溴化铵(CTAB)法从菌丝体中提取基因组[24]。
1.4 敲除载体的构建 1.4.1 敲除盒的构建:分别采用引物对p1/p2和p3/p4从M7基因组中扩增待敲除区域的5′-同源臂(828 bp)和3′-同源臂(878 bp);采用引物对hphf/hphr从质粒pSKH中扩增潮霉素抗性基因(hph);采用Double-joint PCR[25]将5′-同源臂和3′-同源臂分别连接在hph的两侧,获得敲除盒。1.4.2 敲除载体的构建:采用Kpn I和Xba I分别双酶切敲除盒和双元载体pCAMBIA3300,在T4 DNA连接酶作用下将敲除盒连入双元载体多克隆位点之间,获得敲除载体。 1.5 红曲菌转化采用根癌农杆菌介导的红曲菌转化技术[24]将敲除载体转入M7中;以潮霉素作为抗性筛选标记,对转化子进行初步筛选。
1.6 转化子的PCR和Southern杂交验证提取不产色素的转化子基因组进行PCR验证,验证引物为p1/p4、hphf/hphr和p5/p6。采用限制性内切酶 Bgl II、Cla I、Nco I和Nde I分别酶切M7的基因组,引物p5/p6的扩增产物使用地高辛标记后作为探针(Probe1),检测pksPT在红曲菌中的拷贝数。采用地高辛标记的hph基因(Probe2)和Probe1杂交Bgl II酶切的转化子基因组,鉴定pksPT缺失突变体。
1.7 pksPT表达量检测将50 μL红曲菌孢子悬浮液(105个孢子/mL)接种至盛有50 mL PDB培养基的100 mL三角烧瓶中,28℃、120 r/min培养7 d,过滤收集菌丝体,抽提RNA,以GAPDH基因(扩增引物:GAPDH-F/GAPDH-R)作为内参基因,采用反转录PCR(Reverse transcription PCR)测定pksPT的表达量。
1.8 形态观察和显微观察在PDA平板上分别接种0.5 μL M7和突变体孢子悬浮液(105个孢子/mL),28℃静置培养14 d,观察菌落大小和颜色,并观察突变子是否产闭囊壳和分生孢子。
1.9 MPs检测将2 mL红曲菌孢子悬浮液(105个孢子/mL)接种至米饭培养基中,28℃静置培养14 d。每个样品作3个平行。14 d后40℃烘干红曲米,粉碎成粉末。取0.5 g红曲米粉末加入3 mL 70% (V/V) 乙醇,37℃、220 r/min孵育2 h, 9724 ×g离心10 min,取上清,70% (V/V) 乙醇稀释后(5倍稀释M7提取液,突变体提取物为原液)采用HPLC分析乙醇提取液中的色素。色谱条件是:Agilent C18 column(Zorbax eclipse XDB-C18,4.6 mm×250 mm,5 μm);流动相是甲醇(A)/酸水(B,甲酸调pH值至3.0)/纯水(C);流速0.5 mL/min;进样体积 10 μL;柱温38℃;PDA检测器;采用梯度洗脱,程序是起始流动相比例50% A/45% B/5% C (V/V/V), 40 min内A升至75%,B降至20%,C保持不变。分别观察390、470和500 nm下的色谱图,以检测黄、橙和红色素的种类[15, 26]。
1.10 生物量和桔霉素产量测定将400 μL红曲菌孢子悬浮液(105个孢子/mL)接种至盛有20 mL YES培养基的50 mL三角烧瓶中,28℃静置培养15 d。第7、9、11、13和15天取样,每个样品取3个平行。滤纸过滤分离滤液和菌丝体,滤液用于桔霉素产量测定,菌丝体用于生物量测定。
1.10.1 生物量测定:使用蒸馏水冲洗菌丝体至无色,真空冷冻干燥。称量冻干的菌丝体重量,用于衡量生物量变化。1.10.2 桔霉素产量测定:测定培养7、11和13 d的发酵液中桔霉素的产量。取500 μL发酵液,加入等量的甲苯/乙酸乙酯/甲酸 (7∶3∶1,V/V/V)混合液,剧烈振荡混匀,9724×g离心10 min,取上层,甲醇稀释后采用HPLC测定浓度,具体参考Xie等建立的色谱条件[21]。 2 结果和分析 2.1 pksPT的生物信息学分析pksPT (GenBank ID:JF832916)全长8687 bp,与丛毛红曲菌(M. pilosus)中控制MPs合成的PKS基因(KC148521.1)[22]表现出96%的相似度,基因覆盖度达100%;编码2690个氨基酸,编码的蛋白(PKSPT)与紫色红曲菌(M. purpureus)中控制桔霉素合成的PKS(BAD44749)表现出50%的相似度,基因覆盖度达98%。采用Pfam进行结构域预测,发现PKSPT含有5个结构域,分别是KS(388-756)、AT(912-1202)、ACP(1661-1727)、ACP(1772-1834)和ME(甲基转移酶)(2086-2186),拥有“KS-AT-ACP-ACP-ME”的结构域组合形式(图 1),属于非还原Ⅲ型PKS(Non-reduced PKS clade Ⅲ)。使用ClustalW对PKSPT和几株非还原Ⅲ型PKS进行各结构域的比对,如图 1所示,在PKSPT中找到了KS、AT和ACP保守氨基酸序列,分别是DTACSSS、GHSFG 和 GVDSL[27, 28],ME结构域中保守的氨基酸序列是GAGTGG[29](黑点标注的氨基酸为活性氨基酸)。在PKS中,AT结构域负责识别和运输低级羧酸,因此它的结构决定了聚酮化合物碳链延伸过程中装载的延伸单元[30]。AT结构域的三维结构(图 1)显示,Q918Q972G998H999S1000F1001G1002R1025F1114H1115S1150H1162V1167是AT的活性氨基酸序列,其中S1000是AT结构域的催化位点,这种AT结构域能特异性识别丙二酸(Malonate),所以丙二酸是MPs生物合成途径的延伸单元。

|
| 图 1. PKSPT结构域和相应的活性氨基酸预测 Figure 1. Domains and activities amino acids analysis of putative PKSPT. |
采用Southern杂交技术检测了pksPT在M7中的拷贝数。杂交结果显示在各酶切基因组中均只有1条杂交条带 (图 2-B,泳道2-5),并且条带大小和预期的一致。说明pksPT在M7的基因组中只有1个拷贝数存在。

|
| 图 2. 转化子的PCR和Southern杂交及pksPT表达量分析 Figure 2. PCR and Southern blot analysis of ΔpksPT and analysis of pksPT expression. A: PCR identification of ΔpksPT. PCR products of M7 (Lane 1,3,5) and ΔpksPT (Lane 2,4,6) with different primers; M: Trans 2K plus marker. B: Southern hybridization analysis. Lane 1: Bgl II-digested genomic DNA of ΔpksPT; Lane 2-5: Bgl II,Cla I,Nco I,and Nde I-digested the genome of M7,respectively; M: λDNA/Hind III marker. C: pksPT expression in M7 and ΔpksPT were determined by RT-PCR. The two tested strains were incubated in PDA medium on a 120 r/min rotary shaker for 7 days at 28℃ for analysis of the transcriptional level of pksPT. The GAPDH gene was used as control. |
基于同源重组的原理,如图 3所示,拟采用潮霉素抗性基因(hph)替换pksPT中编码色素聚酮合成酶KS结构域的关键序列,构建pksPT功能缺失突变株。经过一次转化共获得16株白化菌株,经过3次传代培养,它们性状稳定。随机抽取一株进行PCR和Southern杂交验证。

|
| 图 3. pksPT基因敲除策略及其限制性内切酶酶切图谱 Figure 3. Strategy to disrupt pksPT gene and restriction map of pksPT. |
采用3对引物hphf/hphr、p1/p4和p5/p6对转化子进行PCR验证,如图 2-A所示,从M7基因组中分别克隆到0(泳道1,即没有产物)、1480 bp (泳道3)和3608 bp (泳道5)的条带,而从转化子基因组中分别扩增出2137 bp (泳道2)、0(泳道4)和 3837 bp (泳道6),条带大小和预期一致,初步证明这株转化子是pksPT敲除突变体。
进一步采用Southern杂交检验转化子。如图 2-B所示,以Probe1为探针,在Bgl II酶切的转化子基因组中未出现Probe1的杂交带(泳道1),但是以Probe2为探针时出现了预期大小的杂交带(泳道 1),说明在转化子(ΔpksPT)中pksPT的KS结构域编码序列被hph替换。
2.4 突变体中pksPT表达量分析采用RT-PCR比较了M7和ΔpksPT中pksPT的表达量,如图 2-C所示,在M7中pksPT能正常表达,但是在ΔpksPT中检测不到pksPT的表达量。
2.5 突变体菌落形态和显微形态观察将M7和ΔpksPT点接到PDA平板上培养,观察菌落形态和显微形态的差异。如图 4所示,Δ pksPT的生长速度均稍快于M7,其直径比野生菌株大约6%;随着培养时间的延长,ΔpksPT菌落中央出现自溶现象,而M7未出现;与M7相比,Δ pksPT菌落颜色发生明显变化,M7正反面均呈现橙红色,而ΔpksPT为白色;ΔpksPT能正常产生闭囊壳和分生孢子。
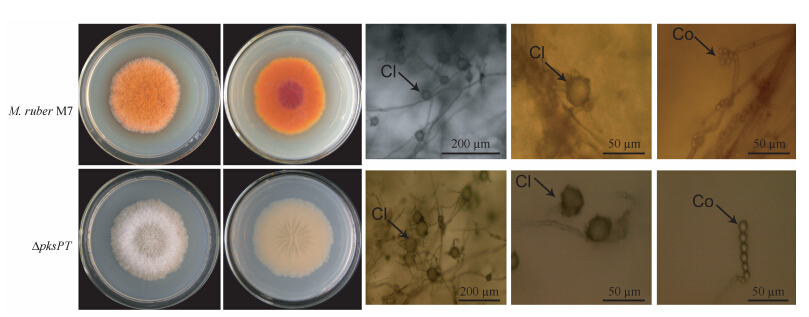
|
| 图 4. 不同菌株的菌落表型和形态比较 Figure 4. Colony phenotype and morphology of different strains. The tested strains were inoculated on PDA plate and cultivated at 28℃ for 14 days. Cl: cleistothecum; Co: conidum. |
在HPLC分析中,红曲黄、橙、红色素有其各自的特征光谱图[21],在进行HPLC分析时,根据色谱图中各物质的光谱图确定其是否是MPs。如图 5所示,在米饭培养基上,M7可以产生5种黄色素、1种橙色素和8种红色素;ΔpksPT不能产生这些色素,证明pksPT的敲除导致红曲菌丧失产MPs的能力。

|
| 图 5. HPLC分析红曲米中色素种类 Figure 5. Analysis of the type of pigment in fermented rice by HPLC method. Absorbance was monitored at 390 nm,470 nm,and 500 nm,the maximal absorption of yellow (Y),orange (O),and red pigment (R),respectively. Arrows indicate the position for these pigments. |
将野生菌株和突变体接种到YES液体培养基中培养,收集菌丝体冷冻干燥后测定其重量用以表示菌株生长速率。从图 6-A可以看出,pksPT的敲除导致红曲菌生长速度加快,并且总的生物积累量也比M7高,在培养第9天时,ΔpksPT的生物量达到0.3631 ± 0.0028 g,而M7只有0.2862 ± 0.0001 g,证明MPs的合成能够显著影响红曲菌生长。
2.8 产桔霉素能力的比较如图 6-B所示,ΔpksPT产桔霉素能力远远高于出发菌株,在培养13 d时,ΔpksPT的桔霉素产量是578.12 ± 9.60 μg/mL,而M7只产生了150.45 ± 10.42 μg/mL的桔霉素,说明MPs代谢合成途径的中断能够显著提高桔霉素的产量。

|
| 图 6. 不同菌株菌丝体干重和产桔霉素产量比较 Figure 6. Dry weight of mycelia and citrinin production from different strains. |
大量的研究发现,红曲色素和桔霉素相伴产生,红曲色素产量的升降同时伴随桔霉素产量的升降,因此,一直以来认为红曲色素和桔霉素拥有一段相同的合成途径,即以乙酰CoA为起始单元,丙二酰CoA为延伸单元,在PKS催化作用下形成聚酮骨架,后期分别合成红曲色素和桔霉素[31]。然而,目前已经分别获得控制红曲色素和桔霉素合成的PKS基因簇[22, 32],说明两者在红曲菌中拥有各自的合成途径。本研究发现敲除红曲色素PKS基因后桔霉素产量提高了约3倍(图 6-B),说明红曲色素合成途径会显著影响桔霉素的合成途径。这一结论在对色素簇内调节基因(pigR)的研究中也得到证实:敲除pigR基因后获得不产色素的突变体(ΔpigR),ΔpigR中桔霉素产量提高了1.3倍;另一方面,过表达的回复突变体中色素产量得到明显提高,无法检测出桔霉素产量[21]。而Shimizu等(2005)发现敲除桔霉素PKS基因对红曲色素产量的影响不明显[20],由此可见,桔霉素产量的高低对色素产量影响不明显,色素产量的高低对桔霉素的合成有非常显著的影响,介于它们拥有各自的合成途径,我们推测这一原因是色素合成和桔霉素合成竞争性的利用小分子羧酸原料。为什么桔霉素的合成竞争不过色素合成呢?Hajjaj等(1999)通过同位素标记的方法研究发现红曲色素和桔霉素合成的原料均是乙酰CoA和丙二酰CoA[31],目前已经发现至少50种具有类似结构的红曲色素[16],那么在红曲菌中相当于50多种色素类物质与桔霉素竞争性地利用原料,这些色素类物质共用一套PKS基因簇,按照相同的合成途径合成,色素聚酮合酶的催化作用位于该合成途径的顶端,当pksPT被破坏后,这50种物质的合成被中断,此时,有大量的乙酰CoA和丙二酰CoA供桔霉素合成使用,桔霉素产量得到显著提高;反之,桔霉素合成中断所积累的原料被50多种色素合成瓜分,每种色素产量的提高便不明显。这一发现对于从分子水平提高红曲色素产量降低桔霉素产量具有重要的意义,同时对阐明红曲色素和桔霉素合成途径上的关系也有一定的帮助。
此外,从图 6-A可以看出色素缺失突变体的生长速率明显快于野生菌株,说明红曲色素的合成途径也会影响红曲菌的生长。初级代谢途径合成的长链脂肪酸是微生物细胞膜的重要组成成分,它的合成的中断将显著抑制微生物菌体的生长[1, 33]。长链脂肪酸是在脂肪酸合成酶的催化作用下合成,原料也是低级羧酸——乙酰CoA和丙二酰CoA,由此推测,红曲色素合成途径与长链脂肪酸合成途径竞争性地利用乙酰CoA和丙二酰CoA。这一现象并没有在其他聚酮合成途径的研究中被发现,可能是由于其他聚酮合成途径合成的聚酮化合物的种类远远没有红曲色素的种类多,长链脂肪酸合成受到的影响不明显。
MPs是我国重要的食品级天然着色剂,为了提高其产量,研究者对红曲菌的培养条件如氧气、pH、碳源、氮源、不同培养基质等进行了大量的研究,并通过优化这些条件使MPs产量在一定程度上得到提高[34, 35, 36]。本研究结果显示pksPT对MPs合成至关重要,因此,在此基础上,借助分子手段采用强启动子驱动pksPT的表达将很可能使色素产量得到显著提高,这也是下一步的工作重点,对于MPs的工业化生产具有一定的指导作用。
| [1] | Chan YA, Podevels AM, Kevany BM, Thomas MG. Biosynthesis of polyketide synthase extender units.Natural Product Reports, 2009, 26(1):90-114. |
| [2] | Carreras CW, Santi DV.Engineering of modular polyketide synthases to produce novel polyketides.Current Opinion Biotechnology, 1998, 9(4):403-411. |
| [3] | Lai L, Pan C, Tzeng B.The influence of medium design on lovastatin production and pellet formation with a high-producing mutant of Aspergillus terreus in submerged cultures.Process Biochemistry, 2003, 38(9):1317-1326. |
| [4] | Chooi Y H, Cacho R, Tang Y.Identification of the viridicatumtoxin and griseofulvin gene clusters from Penicillium aethiopicum.Chemistry and Biology, 2010, 17(5):483-494. |
| [5] | Yu J, Bhatnaga D, Cleveland TE.Completed sequence of aflatoxin patywaygene cluster in Aspergillus parasiticus.FEBS Letters, 2004, 564(1-2):126-130. |
| [6] | Hutchinson CR, Kennedy J, Park C, Kendrew S, Auclair K, Vederas J.Aspects of the biosynthesis of non-aromatic fungal polyketides by iterative polyketide synthases.Antonie van Leeuwenhoek, 2000, 78(3-4):287-295. |
| [7] | Keller NP, Hohn TM.Metabolic pathway gene clusters in filamentous fungi.Fungal Genetics Biology, 1997, 21(1):17-29. |
| [8] | John U, Beszteri B, Derelle E, de Peer YV, Read B, Moreau H, Cembella A.Novel insights into evolution of protistan polyketide synthases through phylogenomic analysis.Protist, 2008, 159(1):21-30. |
| [9] | Shen B.Polyketide biosynthesis beyond the type I, II and III polyketide synthase paradigms.Current Opinion in Chemical Biology, 2003, 7(2):285-295. |
| [10] | Fujii I, Watanabe A, Sankawa, U, Ebizuka Y.Identification of Claisen cyclase domain in fungal polyketide synthase WA, a naphthopyrone synthase of Aspergillus nidulans.Chemistry and Biology, 2001, 8(2):189-197. |
| [11] | Kroken S, Glass NL, Taylor JW, Yoder OC, Turgeon BG.Phylogenetic analysis of typeⅠpolyketide synthase genes in pathogenic and saprobic ascomycetes.Proceedings of the National Academy of Sciences, 2003, 100(26):15670-15675. |
| [12] | Chen YP, Tseng CP, Liaw LL, Wang CL, Chen IC, Wu WJ, Wu MD, Yuan GF.Cloning and characterization of monacolin K biosynthetic gene cluster from Monascus pilosus.Journal of Agricultural and Food Chemistry, 2008, 56(14):5639-5646. |
| [13] | Su YC, Wang JJ, Lin TT, Pan TM.Production of the secondary metabolites γ-aminobutyric acid and monacolin K by Monascus.Journal of Industrial Microbiology and Biotechnology, 2003, 30(1):41-46. |
| [14] | Blanc PJ, Laussac JP, Bars JL, Bars PL, Loret MO, Pareilleux, A, Prome D, Prome JC, Santerre AL, Goma G.Characterization of monascidin A from Monascus as citrinin. International Journal of Food Microbiology, 1995, 27:201-213. |
| [15] | Campoy S, Rumbero A, Martin, JF, Liras P.Characterization of a hyperpigmenting mutant of Monascus purpureus IB1: identification of two novel pigment chemical structures.Applied Microbiology and Biotechnology, 2006:70(4):488-496. |
| [16] | Feng Y, Shao Y, Chen F.Monascus pigments.Applied Microbiology Biotechnology, 2012, 96(6):1421-1440. |
| [17] | Qu J, Wang B, Wu JJ, Xu C, Zhu SM, Chen FS.Study on separation of Monascus pigments and their antioxidative properties.Modern Food Science and Technology, 2008, 24(6):527-531.(in Chinese) 屈炯, 王斌, 吴佳佳, 徐驰, 朱胜梅, 陈福生.红曲色素组分分离及其抗氧化活性研究.现代食品科技, 2008, 24(6):527-531. |
| [18] | Hsu LC, Hsu YW, Liang TH, Kuo YH, Pan TM.Anti-tumor and anti-inflammatory properties of ankaflavin and monaphilone A from Monascus purpureus NTU 568.Journal of Agricultural and Food Chemistry, 2011, 59(4):1124-1130. |
| [19] | Zheng Y, Xin Y, Shi X, Guo Y.Anti-cancer effect of rubropunctatin against human gastric carcinoma cells BGC-823.Applied Microbiology Biotechnology, 2010, 88(5):1169-1177. |
| [20] | Shimizu T, Kinoshita H, Ishihara S, Sakai K, Nagai S, Nihira T.Polyketide synthase gene responsible for citrinin biosynthesis in Monascus purpureus.Applied and Environmental Microbiology, 2005, 71(7):3453-3457. |
| [21] | Xie NN, Liu QP, Chen FS.Deletion of pigR gene in Monascus ruber leads to loss of pigment production.Biotechnology Letters, 2013, 35(9):1425-1432. |
| [22] | Balakrishnana B, Karki S, Chiu SH, Kim HJ, Suh JW, Nam B, Yoon YM, Chen CC, Kwon HJ.Genetic localization and in vivo characterization of a Monascus azaphilone pigment biosynthetic gene cluster.Applied Microbiology and Biotechnology, 2013, 97(14):6337-6345. |
| [23] | Chen FS, Hu XQ.Study on red fermented rice with high concentration of monacolin K and low concentration of citrinin.International Journal of Food Microbiology, 2005, 103(3):331-337. |
| [24] | Shao YC, Ding Y, Zhao Y, Yang S, Xie, BJ, Chen FS.Characteristic analysis of transformants in T-DNA mutation library of Monascus ruber.World Journal of Microbiology and Biotechnology, 2009, 25(6):989-995. |
| [25] | Yu JH, Hamari Z, Han KH, Seo JA, Reyes-Dominuguez Y, Scazzocchio C.Double-joint PCR: a PCR-based molecular tool for gene manipulations in filamentous fungi.Fungal Genetics and Biology, 2004, 41(11):973-981. |
| [26] | Mukherjee G, Singh SK.Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation.Process Biochemistry, 2011, 46(1): 188-192. |
| [27] | Aparicio JF, Molnár I, Schwecke T, Kǒnig A, Haydock SF, Khaw LE, Staunton J, Leadlay F.Organization of the biosynthetic gene cluster for rapamycin in Streptomyces hygroscopicus: analysis of the enzymatic domains in the modular polyketide synthase.Gene, 1996, 169(1):9-16. |
| [28] | Mathur M, Kolattukudy PE.Molecular cloning and sequencing of the gene for mycocerosic acid synthase, a novel fatty acid elongating multifunctional enzyme, from Mycobacterium tuberculosis var.bovis Bacillus Calmette-Guerin.Journal of Biological Chemistry, 1992, 267(27):19388-19395. |
| [29] | Seshime Y, Juvvadi PR, Tokuoka M, Koyama Y, Kitamoto K, Ebizuka Y, Fujii I.Function expression of the Aspergillus flavus PKS-NRPS hybrid CpaA involved in the biosynthesis of cyclopiazonic acid. Bioorganic and Medicinal Chemistry Letters, 2009, 19(12):3288-3292. |
| [30] | Musiol EM, Hartner T, Kulik A, Moldenhauer J, Piel J, Wohlleben W, Weber T.Supramolecular templating in kirromycin biosynthesis: the acyltransferase KirC II loads enthylmalonyl-Coa extender onto a specific ACP of the trans-AT PKS.Chemistry and Biology, 2011, 18(4):438-444. |
| [31] | Hajjaj H, Klaébé A, Loret MO, Goma G, Blanc PJ, Francois J.Biosynthetic pathway of citrinin in the filamentous fungus Monascus ruber as revealed by13C nuclear magnetic resonance.Applied and Environmental Microbiology, 1999, 65(1):311-314. |
| [32] | Shimizu T, Kinoshita H, Nihira T.Identification and in vivo functional analysis by gene disruption of ctnA, an activator gne involved in citrinin biosynthesis in Monascus purpureus.Applied and Environmental Microbiology, 2007, 73(16):5097-5103. |
| [33] | Brown DW, Adams TH, Keller NP.Aspergillus has distinct fatty acid synthases for primary and secondary metabolism.Proceedings of the National Academy of Sciences, 1996, 93(25):14873-14877. |
| [34] | Nimnoi P, Lumyong S.Improving solid-state fermentation of Monascus purpureus on agricultural products for pigment production.Food Bioprocess Technol, 2009, 4(8):1384-1390. |
| [35] | Babitha S, Soccol CR, Pandey A.Effect of stress on growth, pigment production and morphology of Monascus sp. in solid cultures. Journal of Basic Microbiology, 2007, 47(2):118-126. |
| [36] | Zhou B, Zhu MJ, Wang JF, Wu ZQ, Liang SZ.Effect of ammonium salts on Monascus yellow and red pigments and citrinin production.Journal of Chongqing Institutes of Technology (Natural Science), 2009, 23(1):46-53.(in Chinese) 周波, 朱明军, 王菊芳, 吴振强, 梁世中.铵盐对红曲黄色素、红色素及桔霉素代谢形成的影响.重庆工学院学报:自然科学, 2009, 23(1):46-53. |
 2015, Vol. 55
2015, Vol. 55




