中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 孙红敏, 余利岩, 张玉琴
- Sun Hongmin, Yu Liyan, Zhang Yuqin
- 地嗜皮菌科放线菌的研究进展
- Recent advance in Geodermatophilaceae- A review
- 微生物学报, 2015,55(12): 1521-1529
- Acta Microbiologica Sinica, 2015,55(12): 1521-1529
-
文章历史
- 收稿日期:2015-03-23
- 修回日期:2015-05-14
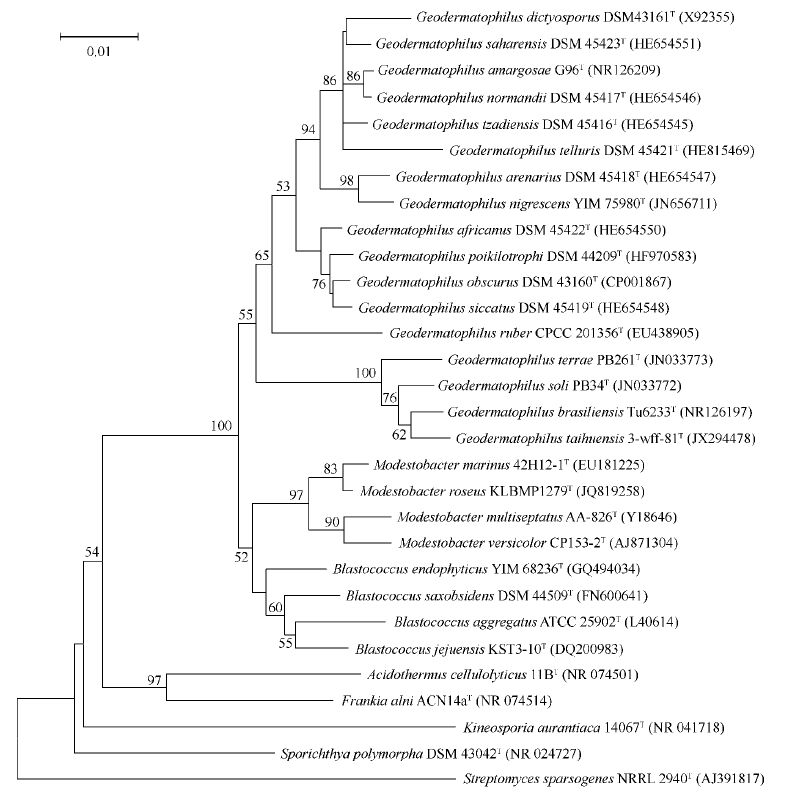
极端微生物是指适于在极端环境生存的微生物,包括嗜热、嗜冷、嗜酸、嗜碱、嗜压、嗜金属、抗辐射、耐干燥和极端厌氧等多种类型[1]。地嗜皮菌科 (Geodermatophilaceae)被视为极端环境的先锋生物之一,是细菌域——放线菌门(Actinobacteria)——放线菌纲(Actinobacteria)——放线菌亚纲(Actinobacteridae)——放线菌目(Actinomycetales)——弗兰克氏菌亚目(Frankineae)的一个科,包含了地嗜皮菌属(Geodermatophilus)、芽生球菌属(Blastococcus)和贫养杆菌属(Modestobacter)等3个属共25个种(图1),地嗜皮菌属是其模式属。该科微生物为革兰氏染色阳性、化能有机异养、好氧或微好氧、嗜中温菌,虽然该科属于放线菌目,但在形态上不具有经典放线菌的典型特征,只有退化的菌丝,具有游动的孢子,在多数培养基上形成红色或者黑色菌落。
|
| 图1 基于地嗜皮菌科菌株及其近源菌的16S rRNA基因序列构建的系统进化树 Figure 1 Phylogenetic dendrogram obtained by neighbor-joining based on the analysis of 16S rRNA gene sequences of members of the family Geodermatophilaceae and the related taxa. Numbers on branch nodes are bootstrap values. Bar,1.0% sequence divergence. |
地嗜皮菌科成员大多分离自干旱土壤、岩石表面和海洋基质等相对极端的环境中[2, 3, 4]。因纯培养的困难曾经一度阻碍了广大学者对其进行深入研究[5]。随着现代纯培养方法的不断改进,越来越多的地嗜皮菌科新成员被分离获得。分子生物学技术的引入,进一步加速了研究者对其相关特性特别是耐逆性的深入探索。研究发现,地嗜皮菌不仅与石灰岩退化过程密切相关,甚至能够腐蚀岩石;而且该类群微生物对干旱、高温、离子辐射和低营养等恶劣环境普遍具有较强的耐受性[3]。
1 地嗜皮菌科(Geodermatophilaceae)的建立和研究现状 1.1 地嗜皮菌科的建立1989年,Lechevalier等将地嗜皮菌属(Geodermatophilus)、弗兰克氏菌属(Frankia)和嗜皮菌属(Dermatophilus)归类为“具有多分隔腔囊结构的放线菌”,它们共有的形态特征是形成直径为100 μm的三面体腔囊结构。同年,Hahn等在研究弗兰克氏菌科(Frankineae)内成员的亲缘关系时发现,当时包含在该科的嗜皮菌属与地嗜皮菌属的16S rRNA基因序列同源性较低,而地嗜皮菌属、芽生球菌属(Blastococcus)和弗兰克氏菌属菌株的16S rRNA基因序列同源性较高,据此,提出将弗兰克氏菌科的描述修订为包含以上近缘三属[6]。
1996年,Normand等通过对弗兰克氏菌科、地嗜皮菌科、热酸菌科(Acidothermaceae)、鱼孢菌科(Sporichthyaceae)代表菌株的16S rRNA基因序列分析,并与GenBank数据库中的相似序列构建系统进化树,通过对菌株进化距离进行矩阵计算和分析结果显示,虽然弗兰克氏菌属与地嗜皮菌属的成员在形态上都是由多腔的腔囊组成,但是在系统进化关系上并没有形成一个相关的类群,因此,Normand提议将地嗜皮菌属和芽生球菌属从弗兰克氏菌科划分出来,归入一个新的分类单元——地嗜皮菌科(Geodermatophilaceae)。但是由于未能提供地嗜皮菌科的正式描述,也没有指定该科的模式属,因此地嗜皮菌科这一分类单元未能生效发表[7]。1997年,Stackebrandt等[8]根据Normand等的研究成果以及对16S rRNA基因的分析,进一步梳理了弗兰克氏亚目内各科的系统进化关系。该亚目包括弗兰克氏菌科(Frankiaceae)、地嗜皮菌科(Geodermatophilaceae)、中村氏菌科(Nakamurellaceae)、鱼孢菌科(Sporichthyaceae)、热酸菌科(Acidothermaceae)等5个科,其中地嗜皮菌科包括地嗜皮菌属和芽生球菌属,但由于当时地嗜皮菌科尚为无效描述分类单元,此次修订也未得到广泛认可。直到2006年,Normand重新以地嗜皮菌属为代表,归纳了地嗜皮菌属、芽生球菌属和贫养杆菌属等3个属的共同特征,再次提议建立地嗜皮菌科(Geodermatophilaceae)并概述了该科的特征[9]。至此,以地嗜皮菌属(Geodermatophilus)为模式属,包含了地嗜皮菌属(Geodermatophilus)、芽生球菌属(Blastococcus)和贫养杆菌属(Modestobacter)的地嗜皮菌科(Geodermatophilaceae)才正式成为生效的分类单元。
1.2 地嗜皮菌科内各属研究进展1968年,Luedemann建立地嗜皮菌属(Geodermatophilus)[2],1980年,Skerman等将其正式收入《核准的细菌名录》。培养技术上的困难导致地嗜皮菌属在很长一段时间内,只包含有唯一的1个种以及4个命名无效的亚种,即Geodermatophilus obscures和Geodermatophilus obscurus subsp. amargosae、Geodermatophilus obscurus subsp. utahensis、Geodermatophilus obscurus subsp. dictyosporus[2]、Geodermatophilus obscurus subsp. everesti[10]。直至近几年,研究者不断克服分离、培养技术上的局限性,越来越多的新成员从各种不同环境中分离获得,如Geodermatophilus ruber[11]分离自药用植物根际、Geodermatophilus soli和Geodermatophilus terrae[12]分离于草地土壤等。最近,Montero-Calasanz等又综合了多相分类研究数据,将G. obscurus subsp. amargosae与G. obscures subsp. dictyosporus重新划分为“种”级分类单元[13, 14],即Geodermatophilus amargosae和Geodermatophilus dictyosporus。到目前为止,地嗜皮菌属内共有17个有效描述种,即Geodermatophilus africanus、G. amargosae、Geodermatophilus arenarius、Geodermatophilus brasiliensis、G. dictyosporus、Geodermatophilus nigrescens、Geodermatophilus normandii、G. obscures、Geodermatophilus poikilotrophi、G. ruber、Geodermatophilus saharensis、Geodermatophilus siccatus、G. soli、Geodermatophilus taihuensis、Geodermatophilus telluris、G. terrae、Geodermatophilus tzadiensis,昏暗地嗜皮菌(G. obscures)为其模式种。这些菌主要是从撒哈拉沙漠[15, 16, 17, 18, 19, 20, 21]、干热河谷[22]、植物根际土壤[11]、草地土壤[12]、湖水沉积物表面[23]、白云石大理岩[24]等环境分离获得,其中沙漠生境来源的居多。
芽生球菌属(Blastococcus)由Ahrens等于1970年建立[25],2004年Urzì等根据Ahrens的描述以及Blastococcus saxobsidens多相分类研究实验数据对其进行了修订[26],Lee于2006年建立Blastococcus jejuensis,并对芽生球菌属再次进行了描述修订[27]。至今,芽生球菌属内共有4个有效描述种,即Blastococcus aggregates、Blastococcus endophyticus、B. jejuensis、B. saxobsidens;聚生出芽球菌(B. aggregates)为其模式种。这些菌分别分离自海洋沉积物[25]、植物体内[28]、沙滩[27]以及石灰岩表面[26]。
2000年,Mevs等提出并建立贫养杆菌属(Modestobacter)[29]。2006年,Normand将其归入地嗜皮菌科[9]。贫养杆菌属内共有4个有效描述种,即Modestobacter marinus、Modestobacter multiseptatus、Modestobacter roseus、Modestobacter versicolor,多分隔贫养杆菌(M. multiseptatus)为其模式种。这些菌分别分离自深海沉积物[30]、极地土壤[29]、植物体内[31]以及生物土壤结皮[32]。
最近,本实验室在对腾格尔沙漠沙坡头地区不同微生态环境微生物多样性研究中分离获得一批放线菌菌株,16S rRNA基因分析结果显示,地嗜皮菌科为沙坡头沙土中的优势放线菌类群(相关研究结果将另文发表)。
2 地嗜皮菌科的分类学特征地嗜皮菌科成员为革兰氏染色阳性、化能有机异养微生物,某些成员具有棒状或退化的菌丝,腔囊产生游动孢子,在多数培养基上菌落呈现红色或者黑色。细胞壁肽聚糖含meso-DAP,细胞呼吸醌型主要为MK-9(H4),基因组DNA(G+C)含量在68-75 mol%之间。
2.1 形态和生理生化特征地嗜皮菌属是好氧、化能有机异养微生物;无气生菌丝,由球形细胞纵横分隔形成立方体腔囊结构,腔囊释放游动孢子或能游动的细胞,游动孢子具有长鞭毛;孢子萌发,纵横分隔,形成不规则菌体。
芽生球菌属菌株细胞呈球状或棒状、单个或成对,通过出芽和多分裂方式进行繁殖,导致细胞呈多种形态,单个棒状细胞可能具有运动性,成对的细胞呈弧形且不具有运动性、趋于聚集成团,菌株可能具有运功性的游动孢子;绝大多数好氧、少数微好氧,具有过氧化氢酶活性,氧化酶活性呈阴性。
贫养杆菌属菌株无孢子形成,短棒状或球形细胞趋于聚集成团,形成短的多分隔细丝;细胞大小为(1.0-2.8)μm ×(1.0-3.0)μm,通过出芽和蜂拥形式增殖;菌落薄而不规则,浅褐色到粉红色,不产生孢子;好氧异养菌,可以生长在贫养培养基上,可以在 0-35 ℃下生长,生长pH范围比较宽泛,既可以在pH3-4的酸性环境中生存,又可以在pH11-12酸碱环境生长;可利用D-半乳糖、乳糖、蔗糖、甘露醇为碳源,蛋白胨和酵母提取物为氮源;厌氧或好氧还原硝酸盐;在胱氨酸或硫酸盐培养条件下,不产生H2S。
2.2 细胞化学分类特征地嗜皮菌科各属成员的细胞壁肽聚糖都含有meso-DAP、主要甲基萘醌组分都是MK-9(H4)。此外,各属还具有各自的化学分类特征(表1):地嗜皮菌属全细胞糖型为C(不含特征性糖组分);磷酸类脂PⅡ型(磷脂酰乙醇胺);芽生球菌属细胞脂肪酸主要含分支型的异脂肪酸:iso-C16:0、iso-C16:1、C18:1ω9c,部分菌株脂肪酸为C17:1ω8c、iso-C15:0和C17:0;极性脂组分为双磷脂酰甘油、磷脂酰甘油、磷脂酰肌醇、以及磷脂酰乙醇胺,还可能含有磷脂酰胆碱和两个未知磷脂成分;而贫养杆菌属细胞壁组分中丙氨酸、谷氨酸与meso-DAP呈2:1:1的比例;主要的脂肪酸组分为iso-C16:0 和iso-C15:0;极性脂组分为双磷脂酰甘油、磷脂酰甘油、磷脂酰乙醇胺、磷脂酰肌醇、含甘露糖的磷脂酰肌醇、未知的氨基磷脂及磷脂。
| Characteristic | Geodermatophilus | Blastococcus | Modestobacter |
| Morphology: | |||
| Hyphae | Rudimentary | - | - |
| Spores | Motile | Motile | Motile |
| Sporangia | + | - | - |
| Buds | - | + | + |
| Colony color | White,red,black | Pink,orange | White,pink,black |
| Physiology: | |||
| O2 requirements | Aerobic | Aerobic/microaerophilic | Aerobic |
| Temperature range/℃ | 18-37 | 3-40 | 0-35 |
| Temperature optimum/℃ | 24-28 | 25 | 19-21 |
| Tolerance to 3% NaCl | - | + | + |
| Hydrolysis of starch | + | - | - |
| Hydrolysis of d-glucose | + | - | + |
| Chemotaxonomic properties: | |||
| Phospholipids | DPG,PE,PI | DPG,PE,PI | DPG,PG,PE,PI,PIM |
| DNA G+C contents/(mol%) | 73-75 | 72.3-74.0 | 68-73 |
| Sources | Desert sands,soil,rhizosphere,deteriorated stones | Marine sediments,limestone | Regolith,beach sands,rock surfaces |
| DPG,diphosphatidylglycerol; PE,phosphatidylethanolamine; PG,phosphatidylglycerol; PI,phosphatidylinositol; PIM,phosphatidylinositol mannoside. :The main phospholipids of Geodermatophilus ruber were diphosphatidylglycerol,phosphatidylethanolamine and two unknown phospholipids. The polar lipids of Geodermatophilus nigrescens consisted of diphosphatidylglycerol,phosphatidylglycerol,ysophosphatidylglycerol,phosphatidylcholine,phosphatidylethanolamine,phosphatidylinositol mannoside and an unknown glycolipid. | |||
地嗜皮菌科的16S rRNA 特征性核苷酸包括:139-224(C-G),157-164(A-U),158-163(A-U),186-191(C-G),263(G),293-304(G-U),986-1219(U-A),987-1218(A-U),1059-1198(U-A)及1308-1329(U-A)。地嗜皮菌属、芽生球菌属和贫养杆菌属基因组DNA的(G+C)含量分别为 (73-75)mol%、(72.3-74.0)mol%和(68-73)mol%。在基于16S rRNA基因序列分析的系统进化树上,地嗜皮菌科在弗兰克氏菌亚目内与弗兰克氏菌科(Frankiaceae)、鱼孢菌科(Sporichthyaceae)、热酸菌科(Acidothermaceae)、隐孢囊菌科(Cryptosporangiaceae)、中村氏菌科(Nakamurellaceae)和矿生菌属(Fodinicola)为邻。
3 地嗜皮菌科的应用研究进展与前景展望极端环境微生物经过长期的自然选择,必然进化形成一套能适应相应的极端环境的生理代谢机制。通过对极端环境微生物的生态和生理特性的研究,不仅有助于阐明生物对环境的适应机制,更有助于我们进一步开发利用这类特殊的微生物资源。
3.1 生理特性与适应机制的研究地嗜皮菌科成员大多分离自干旱、岩石表面和海水环境中,干旱、贫营养及高辐射等环境压力促使他们形成了一些特有的适应机制。研究发现,地嗜皮菌属与贫养杆菌属成员具有显著的抗氧化能力,而芽生球菌属的一些菌株对某些重金属及类金属物质的耐受性较强。地嗜皮菌科成员具有抑制活性氧产生的特性,从而可以对抗多重不断变化的恶劣环境因素,例如,Gtari等[33]报道的菌株G. obscures G-20T与Montero-Calasanz等[24]分离获得菌株G. poikilotrophi G18T,对丝裂霉素C、重金属、类金属、过氧化氢、干旱、电离辐射及UV辐射均具有一定的耐受能力,而且,对过氧化氢与丝裂霉素C的抗性暗示其具有高效的氧化应激和DNA双链断裂修复系统[24]。
2005年,Rainey等通过研究发现,地嗜皮菌属菌株具有抵抗γ射线的能力,在经过30 kGy的高强度电离辐射照射后,通过自我修复而继续存活,并证明这种抗辐射的表型源于自身DNA修复系统的进化过程,用以保护细胞对抗严酷的生存困境如干燥、电离辐射等[34]。1987年,Hungate等通过研究证实地嗜皮菌属具有使金属锰氧化的能力,并且与不同环境下岩石表面“光泽”——黑棕色外壳的形成相关[35],Urzì等也发现地嗜皮菌属与石质文物的衰退过程有着密不可分的关系[8]。
我们最近对分离自沙坡头的地嗜皮菌科的34株菌进行了唯一碳源的利用、同化碳源产酸、酶学特性以及抗生素敏感性测试。结果显示,34株菌对单糖和二糖的利用率最高,对酸类、醇类、多糖、氨基酸等的利用率次之; 60%以上的菌株都能利用以下底物作为唯一碳源和能源:糊精、麦芽糖、海藻糖、海藻糖、蔗糖、松二糖、葡萄糖、甘露糖、果糖、半乳糖、葡糖醛酰胺、α-酮戊二酸、苹果酸、溴代丁二酸、6-磷酸-果糖。在API ZYM实验中,34株菌的碱性磷酸酶、酯酶(C4)、类脂酯酶(C8)、类脂酶(C14)、白氨酸芳胺酶、缬氨酸芳胺酶、酸性磷酸酶均呈现阳性。在API 50 CH实验中,都能同化七叶灵和5-酮基-葡萄糖酸盐并产酸。大多数菌株对氨曲南(1500 μg/mL)、磺胺(15000 μg/mL)与磺胺甲恶唑/甲氧苄啶(1187.5 μg/mL /62.5 μg/mL)具有抗性。另外,我们观察发现,地嗜皮菌科的多数菌落都呈现出红色至黑色。色素也在一定程度上增强了菌株对沙漠环境的高强度的紫外辐射的防御能力。
我们认为,地嗜皮菌科菌株的基因组高G+C含量、多数菌株表现出的丰富的酶活性、菌落产生深色系的色素、以及多数菌株能形成游动孢子等一系列的基因型和表型特征,既是他们适应环境的进化产物,也是它们能够在这类极端环境中广泛存在的根本原因。
3.2 极端酶的发现与研究在长期的进化和自然选择过程中,极端环境微生物产生了适应极端条件的酶类——极端酶(extremozyme)。2009年,Essoussi等多位学者对分离自岩石表面的多株地嗜皮菌科菌株的酯酶性能分析时发现,地嗜皮菌科具有丰富且独特的酯酶活性,并且酶活特性与其所处的严酷生态环境的特点(如极度干旱、高温、强电离辐射及营养供给匮乏等)相关,即使在120 ℃加热20 min或pH12的高碱性条件下,地嗜皮菌属菌株仍能保持30%、20%的酯酶活性,较芽生球菌属与贫养杆菌属的成员显示出更强的耐高温与碱性环境特性[3]。
2012年,Jaouani等从G. obscures G20中纯化出一种极其耐高温酯酶(约55 kDa),其最适催化条件为80 ℃、pH8.0-9.0,并且表现出高度的热稳定性,80 ℃加热10 h后仍保持90%以上的催化活性,并经过一系列实验证实该耐高温酶属于丝氨酸水解酶类。由于其在高温条件下极其稳定,在碱性pH值范围发挥活性,以及对甲醇、各种金属离子等多种蛋白变性剂及有害因子的耐受性,使之成为新型生物催化剂资源,应用于清洁剂工业、食品行业、酿酒工业、纸浆造纸工业以及手性药物的解析等领域,显示出了巨大的研究价值和开发潜力[36]。
3.3 基因组分析极端环境微生物的基因,是基因资源宝库。鉴于地嗜皮菌科菌株的独特生物学特性,人们对这些菌株基因组的研究也更加重视。2010年,Ivanova等完成了G. obscures G-20T的全基因组测序工作,全长5322497 bp,包含5161个编码基因。这是地嗜皮菌科首个被测定全基因组序列的菌株,并被收录入细菌与古生菌基因组百科全书[4]。地嗜皮菌属菌株基因组(G+C)含量为73.98 mol%,基因多拷贝,包括cox基因、trwC释放酶基因、arsR基因、copR基因、uvrD基因等,此外还具有某些地嗜皮菌属特有的基因,以及易位酶编码基因、噬菌体基因、质粒DNA基因等。法国国家基因测序中心(Genoscope)于2009年开展了一项集中于B. saxobsidens DD2和M. marinus BC501的全基因组测序工程,旨在从基因序列中获取大量有开发价值的信息。2012年,Chouaia与Normand等研究者分别公布了B. saxobsidens DD2[37]和M. marinus BC501[38]的全基因组序列信息。菌株B. saxobsidens DD2基因组全长为4875340 bp,(G+C)含量为72.95 mol%,由5078个基因组成的单环状染色体,其中4845个基因可编码蛋白,多拷贝基因普遍存在,如arsBC(亚砷酸盐抗性基因)、copC(铜抗性基因)、coxSML(一氧化碳脱氢酶基因)、czcD(钴-锌-镉抗性基因)、dnaG(DNA诱导酶基因)、recQ(DNA解旋酶基因)、soxABDG(肌氨酸氧化酶基因)、trwC(共轭释放酶基因)、uvrA和uvrD(UV抗性基因)等。M. marinus BC501基因组亦为环状染色体,全长为5.57 Mb,(G+C)含量为74.13 mol%,包含5445个编码基因,48个tRNAs编码基因和3个核糖体操纵子基因,基因多拷贝,如coxSML(一氧化碳脱氢酶基因)、dnaJ(分子伴侣Hsp40)、katA(锰-过氧化氢酶基因)、mcrA(丝裂霉素自由基氧化酶基因)、ohrR(过氧化氢及高氯酸抗性转录调节因子,MarR家族)、recQ(DNA 解旋酶基因)、soxABDG(肌氨酸氧化酶基因)、trxAB(硫氧还蛋白还原酶)、trwC(共轭释放酶基因)和uvrACD(UV抗性基因)等。通过翔实的结构基因和相关功能信息结合分析,运用现代生物技术手段,相信不久就可以实现将这些生物信息转变成对人类有价值的新资源、新途径。
4 结语近些年,随着纯培养技术与放线菌分类学研究手段的不断改进,地嗜皮菌科的新成员也在陆续被发现,2006年至今,已经有21个新物种被发现、描述[14],而且,Salazar等研究者通过设计不同科16S rRNA基因序列特点设计引物,应用实时定量PCR技术检测到了地嗜皮菌科新成员[39],我们近期的研究也显示,环境中确实存在着大量潜在新物种尚待发掘。因此,结合环境基因组学等分子生物学技术,不断改进现有的纯培养方法、设计更为有效的分离方案,进一步完善现有的分类学方法,将有利于我们更加快速、高效、全面地收集和开发利用地嗜皮菌科菌种资源。
极端微生物代表了生命的极限适应能力,所处的生态环境及生态多样性赋予了它们独特而又丰富的代谢类型,是一类宝贵的战略资源。地嗜皮菌科是极端环境的先锋生物之一,是分子生物学、生理学等研究的绝佳材料。通过和近邻科、属的物种的基因组信息对比分析,解析地嗜皮菌科菌株特有的功能基因,诠释其抗干燥、耐盐、抗辐射机制。通过它们对环境的适应机制的剖析,进一步发挥它们在沙漠结皮、重金属污染治理等方面的生态学作用,而且有望将这些机制应用于工业、医药、食品等行业中,推动生物技术产业的发展。
| [1] | Demirjian DC, Morís-Varas F, Cassidy CS. Enzymes from extremophiles. Current Opinion in Chemical Biology, 2001, 5(2): 144-151. |
| [2] | Luedemann GM. Geodermatophilus, a new genus of the Dermatophilaceae (Actinomycetales). Journal of Bacteriology, 1968, 96(5): 1848-1858. |
| [3] | Essoussi I, Ghodhbane-Gtari F, Amairi H, Sghaier H, Jaouani A, Brusetti L, Daffonchio D, Boudabous A, Gtari M. Esterase as an enzymatic signature of Geodermatophilaceae adaptability to Sahara desert stones and monuments. Journal of Applied Microbiology, 2010, 108(5): 1723-1732. |
| [4] | Ivanova N, Sikorski J, Jando M, Munk C, Lapidus A, Del Rio TG, Copeland A, Tice H, Cheng JF, Lucas S, Chen F, Nolan M, Bruce D, Goodwin L, Pitluck S, Mavromatis K, Mikhailova N, Pati A, Chen A, Palaniappan K, Land M, Hauser L, Chang YJ, Jeffries CD, Meincke L, Brettin T, Detter JC, Rohde M, Göker M, Bristow J, Eisen JA, Markowitz V, Hugenholtz P, Hugenholtz NC, Klenk HP. Complete genome sequence of Geodermatophilus obscures type strain (G-20T). Standards in Genomic Sciences, 2010, 2(2): 158-167. |
| [5] | Urzì C, La Cono V, Stackebrandt E. Design and application of two oligonucleotide probes for the identification of Geodermatophilaceae strains using fluorescence in situ hybridization (FISH). Environmental Microbiology, 2004, 6(7): 678-685. |
| [6] | Hahn D, Lechevalier MP, Fischer A, Stackebrandt E. Evidence for a close phylogenetic relationship between members of the genera Frankia, Geodermatophilus, and “Blastococcus” and emendation of the family Frankiaceae. Systematic and Applied Microbiology, 1989, 11(3): 236-242. |
| [7] | Normand P, Orso S, Cournoyer B, Jeannin P, Chapelon C, Dawson J, Evtushenko L, Misra AK. Molecular phylogeny of the genus Frankia and related genera and emendation of the family Frankiaceae. International Journal of Systematic Bacteriology, 1996, 46(1): 1-9. |
| [8] | Stackebrandt E, Rainey FA, Ward-Rainey NL. Proposal for a new hierarchic classification system, Actinobacteria classis nov. International Journal of Systematic Bacteriology, 1997, 47(2): 479-491. |
| [9] | Normand P. Geodermatophilaceae fam. nov., a formal description. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(10): 2277-2278. |
| [10] | Ishiguro EE, Fletcher DW. Characterization of Geodermatophilus strains isolated from high altitude Mount Everest soils. Mikrobiologika, 1975, 12(2): 99-108. |
| [11] | Zhang YQ, Chen J, Liu HY, Zhang YQ, Li WJ, Yu LY. Geodermatophilus ruber sp. nov., isolated from rhizosphere soil of a medicinal plant. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(1): 190-193. |
| [12] | Jin L, Lee HG, Kim HS, Ahn CY, Oh HM. Geodermatophilus soli sp. nov. and Geodermatophilus terrae sp. nov., two novel actinobacteria isolated from grass soil. International Journal of Systematic Bacteriology, 2013, 63(7): 2625-2629. |
| [13] | Montero-Calasanz MC, Göker M, Rohde M, Spröer C, Schumann P, Mayilraj S, Goodfellow M, Klenk HP. Description of Geodermatophilus amargosae sp. nov., to accommodate the not validly named Geodermatophilus obscurus subsp. amargosae (Luedemann, 1968). Current Microbiology, 2014, 68(3): 365-371. |
| [14] | Montero-Calasanz MC, Hezbri K, Göker M, Sghaier H, Rohde M, Spröer C, Schumann P, Klenk HP. Description of gamma radiation-resistant Geodermatophilus dictyosporus sp. nov. to accommodate the not validly named Geodermatophilus obscurus subsp. dictyosporus (Luedemann, 1968). Extremophiles, 2015, 19(1): 77-85. |
| [15] | Montero-Calasanz MC, Göker M, Pötter G, Rohde M, Spröer C, Schumann P, Gorbushina AA, Klenk HP. Geodermatophilus africanus sp. nov., a halotolerant actinomycete isolated from Saharan desert sand. Antonie van Leeuwenhoek, 2013, 104(2): 207-216. |
| [16] | Montero-Calasanz MC, Göker M, Pötter G, Rohde M, Spröer C, Schumann P, Gorbushina AA, Klenk HP. Geodermatophilus saharensis sp. nov., isolated from sand of the Saharan desert in Chad. Archives of Microbiology, 2013, 195(3): 153-159. |
| [17] | Montero-Calasanz MC, Göker M, Pötter G, Rohde M, Spröer C, Schumann P, Gorbushina AA, Klenk HP. Geodermatophilus normandii sp. nov., isolated from Saharan desert sand. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(9): 3437-3443. |
| [18] | Montero-Calasanz MC, Göker M, Pötter G, Rohde M, Spröer C, Schumann P, Gorbushina AA, Klenk HP. Geodermatophilus telluris sp. nov., an actinomycete isolated from Saharan desert sand. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(6): 2254-2259. |
| [19] | Montero-Calasanz MC, Göker M, Broughton WJ, Cattaneo A, Favet J, Pötter G, Rohde M, Spröer C, Schumann P, Klenk HP, Gorbushina AA. Geodermatophilus tzadiensis sp. nov., a UV radiation-resistant bacterium isolated from sand of the Saharan desert. Systematic and Applied Microbiology, 2013, 36(3): 177-182. |
| [20] | Montero-Calasanz MC, Göker M, Pötter G, Rohde M, Spröer C, Schumann P, Gorbushina AA, Klenk HP. Geodermatophilus arenarius sp. nov., a xerophilic actinomycete isolated from Saharan desert sand in Chad. Extremophiles, 2012, 16(6): 903-909. |
| [21] | Montero-Calasanz MC, Göker M, Rohde M, Schumann P, Pötter G, Spröer C, Gorbushina AA, Klenk HP. Geodermatophilus siccatus sp. nov., isolated from arid sand of the Saharan desert in Chad. Antonie van Leeuwenhoek, 2013, 103(3): 449-456. |
| [22] | Nie GX, Ming H, Li S, Zhou EM, Cheng J, Yu TT, Zhang J, Feng HG, Tang SK, Li WJ. Geodermatophilus nigrescens sp. nov., isolated from a dry-hot valley. Antonie van Leeuwenhoek, 2012, 101(4): 811-817. |
| [23] | Qu JH, Hui M, Qu JY, Wang FF, Li HF, Hu YS, Luo Y, Cai JP. Geodermatophilus taihuensis sp. nov., isolated from the interfacial sediment of a eutrophic lake. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(11): 4108-4112. |
| [24] | Montero-Calasanz MC, Hofner B, Göker M, Rohde M, Spröer C, Hezbri K, Gtari M, Schumann P, Klenk HP. Geodermatophilus poikilotrophi sp. nov., a multi-tolerant actinomycete isolated from dolomitic marble. BioMed Research International, 2014, Article ID 914767, doi: 10.1155/2014/914767. |
| [25] | Ahrens R, Moll G. Ein neues knospendes bakterium aus der Ostsee. Archiv für Mikrobiologie, 1970, 70(3): 243-265. (in German) |
| [26] | Urzì C, Salamone P, Schumann P, Rohde M, Stackebrandt E. Blastococcus saxobsidens sp. nov., and emended descriptions of the genus Blastococcus Ahrens and Moll 1970 and Blastococcus aggregatus Ahrens and Moll 1970. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(1): 253-259. |
| [27] | Lee SD. Blastococcus jejuensis sp. nov., an actinomycete from beach sediment, and emended description of the genus Blastococcus Ahrens and Moll 1970. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(10): 2391-2396. |
| [28] | Zhu WY, Zhang JL, Qin YL, Xiong ZJ, Zhang DF, Klenk HP, Zhao LX, Xu LH, Li WJ. Blastococcus endophyticus sp. nov., an actinobacterium isolated from Camptotheca acuminate. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(9): 3269-3273. |
| [29] | Mevs U, Stackebrandt E, Schumann P, Gallikowski CA, Hirsch P. Modestobacter multiseptatus gen. nov., sp. nov., a budding actinomycete from soils of the Asgard Range (Transantarctic Mountains). International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 337-346. |
| [30] | Xiao J, Luo YX, Xu J, Xie SJ, Xu J. Modestobacter marinus sp. nov., a psychrotolerant actinobacterium from deep-sea sediment, and emended description of the genus Modestobacter. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(7): 1710-1714. |
| [31] | Qin S, Bian GK, Zhang YJ, Xing K, Cao CL, Liu CH, Dai CC, Li WJ, Jiang JH. Modestobacter roseus sp. nov., an endophytic actinomycete isolated from the coastal halophyte Salicornia europaea Linn., and emended description of the genus Modestobacter. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(6): 2197-2202. |
| [32] | Reddy GSN, Potrafka RM, Garcia-Pichel F. Modestobacter versicolor sp. nov., an actinobacterium from biological soil crusts that produces melanins under oligotrophy, with emended descriptions of the genus Modestobacter and Modestobacter multiseptatus Mevs et al. 2000. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(9): 2014-2020. |
| [33] | Gtari M, Essoussi I, Maaoui R, Sghaier H, Boujmil R, Gury J, Pujic P, Brusetti L, Chouaia B, Crotti E, Daffonchio D, Boudabous A, Normand P. Contrasted resistance of stone-dwelling Geodermatophilaceae species to stresses known to give rise to reactive oxygen species. FEMS Microbiology Ecology, 2012, 80(3): 566-577. |
| [34] | Rainey FA, Ray K, Ferreira M, Gatz BZ, Nobre MF, Bagaley D, Rash BA, Park MJ, Earl AM, Shank NC, Small AM, Henk MC, Battista JR, Kämpfer P, da Costa MS. Extensive diversity of ionizing-radiation-resistant bacteria recovered from Sonoran desert soil and description of nine new species of the genus Deinococcus obtained from a single soil sample. Applied and Environmental Microbiology, 2005, 71(9): 5225-5235. |
| [35] | Hungate B, Danin A, Pellerin NB, Stemmler J, Kjellander P, Adams JB, Staley JT. Characterization of manganese-oxidizing (MnII-MnIV) bacteria from the Negev Desert rock varnish: implications in desert varnish formation. Canadian Journal of Microbiology, 1987, 33(10): 939-943. |
| [36] | Jaouani A, Neifar M, Hamza A, Chaabouni S, Martinez MJ, Gtari M. Purification and characterization of a highly thermostable esterase from the actinobacterium Geodermatophilus obscurus strain G20. Journal of Basic Microbiology, 2012, 52(6): 653-660. |
| [37] | Chouaia B, Crotti E, Brusetti L, Daffonchio D, Essoussi I, Nouioui I, Sbissi I, Ghodhbane-Gtari F, Gtari M, Vacherie B, Barbe V, Médigue C, Gury J, Pujic P, Normand P. Genome sequence of Blastococcus saxobsidens DD2, a stone-inhabiting bacterium. Journal of Bacteriology, 2012, 194(10): 2752-2753. |
| [38] | Normand P, Gury J, Pujic P, Chouaia B, Crotti E, Brusetti L, Daffonchio D, Vacherie B, Barbe V, Médigue C, Calteau A, Ghodhbane-Gtari F, Essoussi I, Nouioui I, Abbassi-Ghozzi I, Gtari M. Genome sequence of radiation-resistant Modestobacter marinus strain BC501, a representative actinobacterium that thrives on calcareous stone surfaces. Journal of Bacteriology, 2012, 194(17): 4773-4774. |
| [39] | Salazar O, Valverde A, Genilloud O. Real-time PCR for the detection and quantification of Geodermatophilaceae from stone samples and identification of new members of the genus Blastococcus. Applied and Environmental Microbiology, 2006, 72(1): 346-352. |
 2015, Vol. 55
2015, Vol. 55