中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 刘晶晶, 杨富裕, 王小芬, 刘晋欢, 袁旭峰, 崔宗均
- Jingjing Liu, Fuyu Yang, Xiaofen Wang, Jinhuan Liu, Xufeng Yuan, Zongjun Cui
- 柳枝稷青贮用乳酸菌复合系的组成多样性及其代谢特性
- Composition diversity and metabolic characters of lactic acid bacteria community SGL
- 微生物学报, 2015, 55(11): 1475-1484
- Acta Microbiologica Sinica, 2015, 55(11): 1475-1484
-
文章历史
- 收稿日期:2015-01-12
- 修回日期:2015-02-12
2 中国农业大学动物科技学院,北京 100193
2 College Animal Science and Technology, China Agricuttural University, Beijing 100193, China
近年来,随着我国畜牧业结构由耗粮型向节粮型的转变,草地禾本科牧草产业开始蓬勃发展。柳枝稷(Panicum virgatum, L.)原产北美,为大型丛生多年生C4 禾本科牧草,生物质产量高,生态适应性强,纤维素和半纤维素含量较高,木质素含量相对较低,整株植株的蛋白质含量达7.0%-13.6%,高于玉米和大豆,具有优良牧草的特性。
青贮是牧草保藏的理想措施。研究证实,柳枝稷青草的营养成分可以通过青贮方式得到很好的保存,并且青贮料的体外消化率和采食量均比干草料高[1, 2, 3]。C4类型的牧草可溶性糖含量低,青贮容易失败[4]。许多研究表明,向青贮料中添加足量的乳酸菌,可加速pH值降低,从而有效地抑制梭菌的活动,保证青贮饲料的安全和质量。现有的青贮菌剂多为纯培养的单一菌种或由几种单菌按一定比例组配而成的混合菌剂,也有少数是针对秸秆或苜蓿等特殊材料自然驯化的乳酸菌复合系。单菌对生长条件的适应范围窄,接种效果时好时坏;简单混合菌剂中所含的菌种之间是否具有协同关系,是否产生拮抗作用还有待证实,自然驯化的复合菌系组成稳定、功能强大、并对温度和酸碱环境的耐性强,产酸能力和接种效果显著优于单菌[5, 6]。至今,未发现有针对柳枝稷这一特定材料的乳酸菌复合菌系的研究和报道。
为了更好的培养乳酸菌,就必须更深入地了解它们的营养需求和代谢特性,以便创造一个有利于它们生长和产生代谢产物的最适生理条件。Arasaratnam等[7]和Nancib等[8]分别研究了向乳清和枣汁中补充有机或无机氮源对乳酸菌生长和产酸的影响,至今未发现不同氮源对复合系生长和产乳酸的影响。
笔者等以柳枝稷青贮料为菌源,筛选出一组菌种组成稳定、pH下降迅速、乳酸产量高的乳酸菌复合系SGL,研究了该复合系微生物组成多样性及其对不同氮源的代谢性质。本研究报告了该复合系的筛选过程和代谢性质,通过PCR-DGGE技术和高通量测序技术分别分析了其微生物组成稳定性和多样性。
1 材料和方法 1.1 菌群筛选筛选菌种SGL所用的柳枝稷来源于中国农业大学上庄实验站牧草种质繁育区,品种为低地型,2013年6月中旬收割。将柳枝稷切碎成1-2 cm长,填装于100 mL的螺口瓶,装3瓶,压实密封后置于30 ℃恒温下自然发酵。发酵60天后,将发酵物取出混匀,pH值为4.8,以此作为筛选菌群来源。取12 mL MRS培养液装入15 mL的螺口离心管,加入1.0 g 柳枝稷青贮料,30℃静置培养,3个重复。培养24 h后,按1%(体积分数比)的接种量转接培养物连续继代培养20代,获得性质和菌种组成稳定的乳酸菌复合系。
菌群的筛选和培养均用MRS培养基 (蔗糖20 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母浸粉5 g/L,乙酸钠5 g/L,柠檬酸铵2 g/L,K2HPO4 2 g/L,MgSO4·7H2O 0.58 g/L,MnSO4·4H2O 0.25 g/L,吐温80 1.0 mL/L,pH调至6.2-6.4,115℃灭菌20 min),培养条件均为30℃静置培养。
1.2 生长培养基中添加不同氮源对复合系产酸的影响生长培养基:MgSO4·7H2O 0.58 g/L,MnSO4·4H2O 0.25 g/L,K2HPO4 2 g/L,KH2PO4 2 g/L,FeSO4 0.02 g/L,吐温80 1 mL/L,葡萄糖 30 g/L,CaCO3 20 g/L。
添加酵母浸粉:生长培养基中添加不同质量的酵母浸粉,使酵母浸粉的最终浓度分别达到5、10、20和30 g/L,以添加20 g/L CaCO3、葡萄糖浓度为30 g/L的MRS培养基作为对照,115℃灭菌20 min。冷却后接种SGL,接种量为5%。30℃静置培养,每隔12 h取样测定总糖、乳酸和细胞浓度。每个处理3个重复。
添加不同氮源:生长培养基中添加蛋白胨(12.50 g/L)、酵母浸粉(20 g/L)、脲(3.86 g/L)或(NH4)2SO4(8.50 g/L),115℃灭菌20min。实验过程同上,每个处理3个重复。
添加不同比例的 (NH4)2SO4和酵母浸粉:生长培养基中添加不同比例的 (NH4)2SO4和酵母浸粉(表1),实验过程同上,每个处理3个重复。
| Ratio of elemental nitrogen (NH4)2SO4: yeast extract | (NH4)2SO4 | Yeast extract | |||
| Weight /(g/L) | Elemental nitrogen /(g/L) | Weight /(g/L) | Elemental nitrogen /(g/L) | ||
| 5∶0 | 8.49 | 1.80 | 0.00 | 0.00 | |
| 4∶1 | 6.79 | 1.44 | 4.00 | 0.36 | |
| 3∶2 | 5.09 | 1.08 | 8.00 | 0.72 | |
| 2.5∶2.5 | 4.25 | 0.90 | 10.00 | 0.90 | |
| 2∶3 | 3.40 | 0.72 | 12.00 | 1.08 | |
| 1∶4 | 1.70 | 0.36 | 16.00 | 1.44 | |
| 0∶5 | 0.00 | 0.00 | 20.00 | 1.80 | |
pH值的测定使用HORIBAB.212微量pH计。吸光值 OD600 的测定仪器为BioSpec-mini DNA/RNA/PROTEIN Analyzer(Shimadzu,Japan),样品统一稀释5倍。可溶性糖的测定使用3,5-二硝基水杨酸(DNS)法。将培养液过0.22 μm滤膜后,使用日本岛津的LC-20A液相色谱仪测定挥发性脂肪酸的含量。分析柱为Aminex HPX-87H (300 mm×7.8 mm,Bio-Rad Company,USA)。流动相为0.005 mol/L H2SO4(pH2.2),流速为0.6 mL/min,柱温箱和进样温度分别为40 ℃和90 ℃,柱压为1.3 MPa,进样量为20 μL。
1.4 DNA的提取SGL在MRS培养液中培养24 h后,取8 mL发酵液8000×g离心15 min,弃上清收集菌体细胞,采用CTAB法提取总DNA[9]。
1.5 PCR-DGGE及DGGE条带序列分析PCR:选用引物357F-GC (GCclamp-5′-CCTACGGGAGGCAGCAG-3′,其中GC-clamp序列为5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCA CGGGGGG-3′)和517R (5′-GTGCCAGC(A/C)GCCGCGG-3′)扩增细菌16S rRNA 的V3区域。PCR反应体反应体系(50 μL):10×PCR Buffer(不含MgCl2)5 μL;dNTPs mix(2.5 mmol/L)4 μL;MgCl2(25 mmol/L)3 μL;前引物和后引物(45 μmol/L)各0.5 μL;TaKaRa Taq (5 U/μL;TaKaRa,Japan)0.2 μL;模板DNA(10 ng)1 μL;ddH2O 35.8 μL。程序:95 ℃ 10 min;93 ℃ 1 min,48 ℃ 1 min,72 ℃ 70 s,30个循环,产物最终72 ℃延伸5 min。每个样品3个重复,混合浓缩至20 μL后供DGGE分析。
DGGE分析:使用DcodeTM Universal Mutation Detector System(Bio-Rad Laboratories,hercules,CA,USA)进行双变性梯度凝胶电泳。聚丙烯酰胺(polyacrylamide)浓度梯度为6%-12%,变性剂(尿素,Urea)梯度为20%-60%。电泳仪设定电压为200 V,电泳体系温度为61 ℃,电泳时间5 h。具体步骤参照文献[10]。DGGE图谱运用Quantity One 软件,建立并校正条带,最后自动生成泳道比较图像。
1.6 Miseq高通量测序将样品DNA送至上海美吉生物医药科技有限公司(Majorbio Co.,Ltd.,China)进行测序和后期数据分析。PCR扩增区域为16S rRNA的V4和V5区,使用的引物是515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)。PCR反应采用TransGenAP221-02(TransStart Fastpfu DNA Polymerase),在ABI GeneAmp9700型PCR仪上进行。体系(20 μL)如下:5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,Forward 引物 (5 μmol/L) 0.8 μL,Reverse Primer (5 μmol/L) 0.8 μL,FastPfu Polymerase 0.4 μL,模板DNA 10 ng,ddH2O补至20 μL。PCR反应参数:95 ℃3 min;95 ℃30 s,55 ℃30 s,72 ℃45 s 27个循环;72 ℃10 min。每个样品3个重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。将回收的PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样品的测序量要求,进行相应比例的混合;利用Illumina的Miseq 测序仪完成测序分析。Miseq测序得到的PE300 reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,去杂后生成分类操作单元 (operational taxonomic units,OTU)。根据OTU聚类分析结果,采用Chao、Ace和Simpson、Shannon评估指数分别对样本进行多样性分析。其中Ace和Chao指数是对菌群丰度进行评估,Simpson、Shannon指数对菌群多样性进行评估。为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。采用Qiime平台(http://qiime.org/scripts/assign_taxonomy.html)将OTU中全部序列与silva 库(http://www.arb-silva.de/)中的aligned (16S,SSU) 核糖体序列比对,找出其最相近且可信度达80%以上的种属信息。
2 结果 2.1 SGL的筛选将发酵60 d的柳枝稷青贮料(pH4.8)接种到MRS培养液,进行连续继代培养获得了一组功能和组成稳定的乳酸菌复合系SGL。筛选过程中,第1、5、8、12、15、18和20代菌群发酵液的pH值、挥发性脂肪酸的含量和菌体浓度如表2所示。发酵液的pH值和菌体浓度均从第8代开始趋于稳定,乳酸和乙酸含量分别于第15代后趋于稳定。发酵24 h,SGL可将MRS培养基的pH降至3.7,且发酵产物以乳酸为主,高达26 g/L。
| Generations | pH | Lactic acid | Acetic acid | Propionic acid | OD600 |
| g/L | |||||
| 1 | 4.0 | 16.70±0.81 | 3.50±0.15 | 0.52±0.14 | 1.58±0.03 |
| 5 | 3.8 | 20.99±0.13 | 4.01±0.31 | 0.48±0.08 | 1.70±0.01 |
| 8 | 3.7 | 22.79±0.08 | 4.94±0.19 | 0.53±0.06 | 1.95±0.04 |
| 12 | 3.7 | 25.12±0.41 | 5.83±0.55 | 0.51±0.11 | 1.93±0.02 |
| 15 | 3.7 | 26.68±0.25 | 5.96±0.42 | 0.54±0.09 | 1.96±0.00 |
| 18 | 3.7 | 26.31±0.14 | 5.96±0.53 | 0.54±0.15 | 1.94±0.01 |
| 20 | 3.7 | 26.47±0.27 | 5.91±0.62 | 0.49±0.18 | 1.95±0.00 |
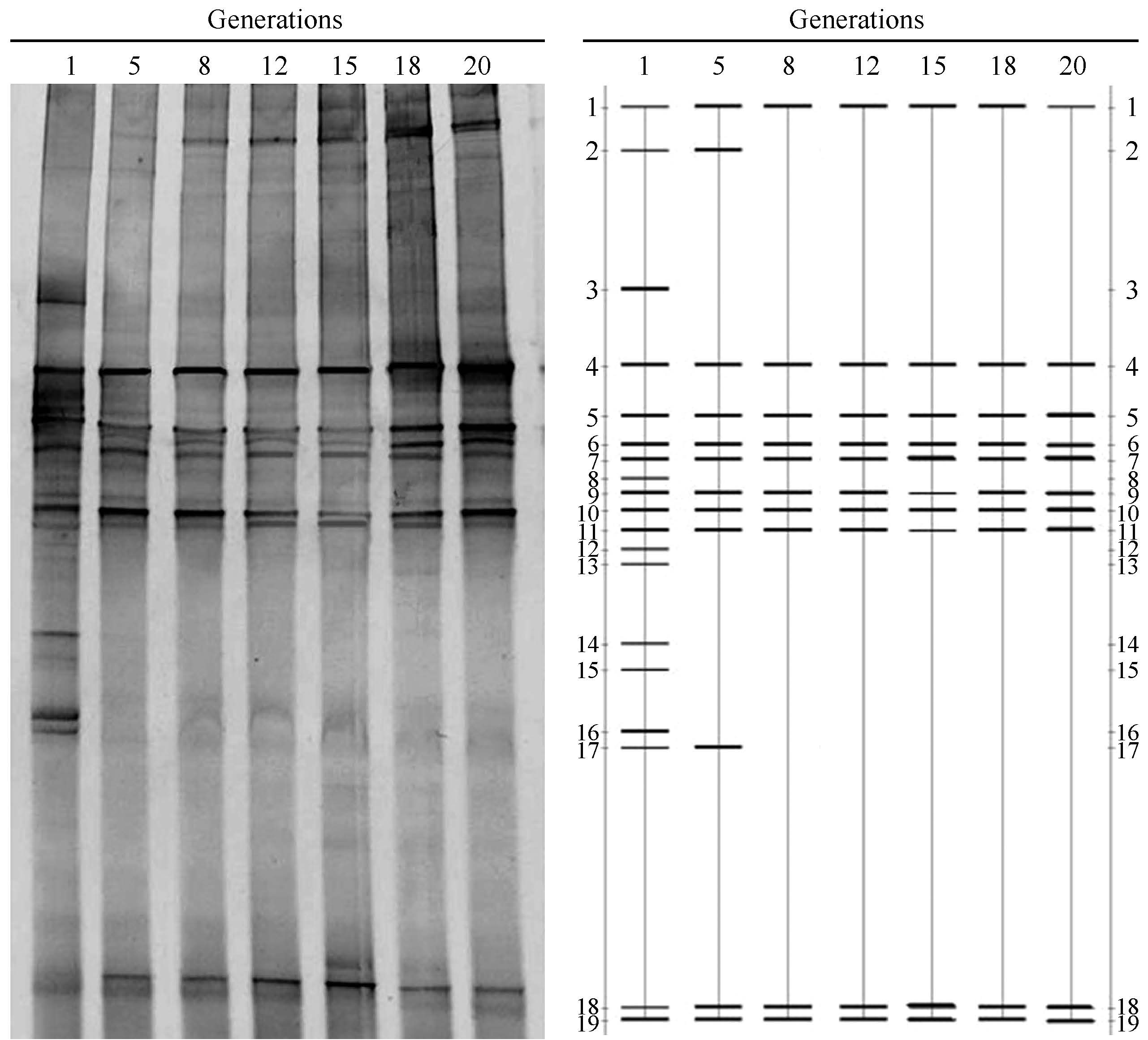
收集第1、5、8、12、15、18、20代的24 h培养物中的菌体细胞提取总DNA,通过PCR扩增16S rDNA V3区域,进行变性梯度凝胶电泳(DGGE)分析,结果如图1所示。第1代泳道中共有17个清晰的条带,在继代培养的过程中,由于低pH值的限制,一些条带逐渐消失,菌群丰度逐渐变小,最后趋于稳定,第八代的泳道中仅剩10个条带。如图1所示,第5代泳道中条带3和12-16等6个条带消失,第8代的泳道中条带2和条带17也消失。总体来看,限制性培养降低了柳枝稷青贮料中菌群的多样性,连续培养8代后,菌群结构趋于稳定,最终获得一个产乳酸量高、适应低pH值、菌群组成稳定的乳酸菌复合系。
|
| 图1 SGL筛选过程中各代培养物的PCR-DGGE分析结果 Figure 1 PCR-DGGE profiles of different generation during the construction of SGL. |
运用PCR方法扩增细菌16S rRNA 基因的V4和V5区进行高通量测序,对SGL进行多样性分析,共获得20693条有效序列,优化序列为19191条,测序覆盖深度(coverage指数)为0.999739,说明本次测序结果能代表样本的真实情况。经过97% 相似度归并后得到21个OTUs,多样性指数如表3所示。Chao和Ace是估计群落中含OTU 数目的指数,二者算法不同[11, 12];Simpson和Shannon是估算样品中微生物的多样性指数,Simpson指数值越大说明群落多样性越低,Shannon值越大说明群落多样性越高[13, 14]。经多样性分析,16S rRNA基因文库的最大OTU丰度指数Chao和Ace分别为23和25,OTU的多样性指数Shannon和Simpson分别为0.69和0.68。
| Sample ID | Similarity 97% | |||||
| OTU | Ace (lci,hci) | Chao (lci,hci) | Coverage | Shannon (lci,hci) | Simpson (lci,hci) | |
| SGL | 21 | 25 (22,41) | 23 (21,33) | 0.999739 | 0.69 (0.68,0.71) | 0.68 (0.67,0.69) |
| lci and hci mean upper limit and lower limit in statistics,respectively. | ||||||
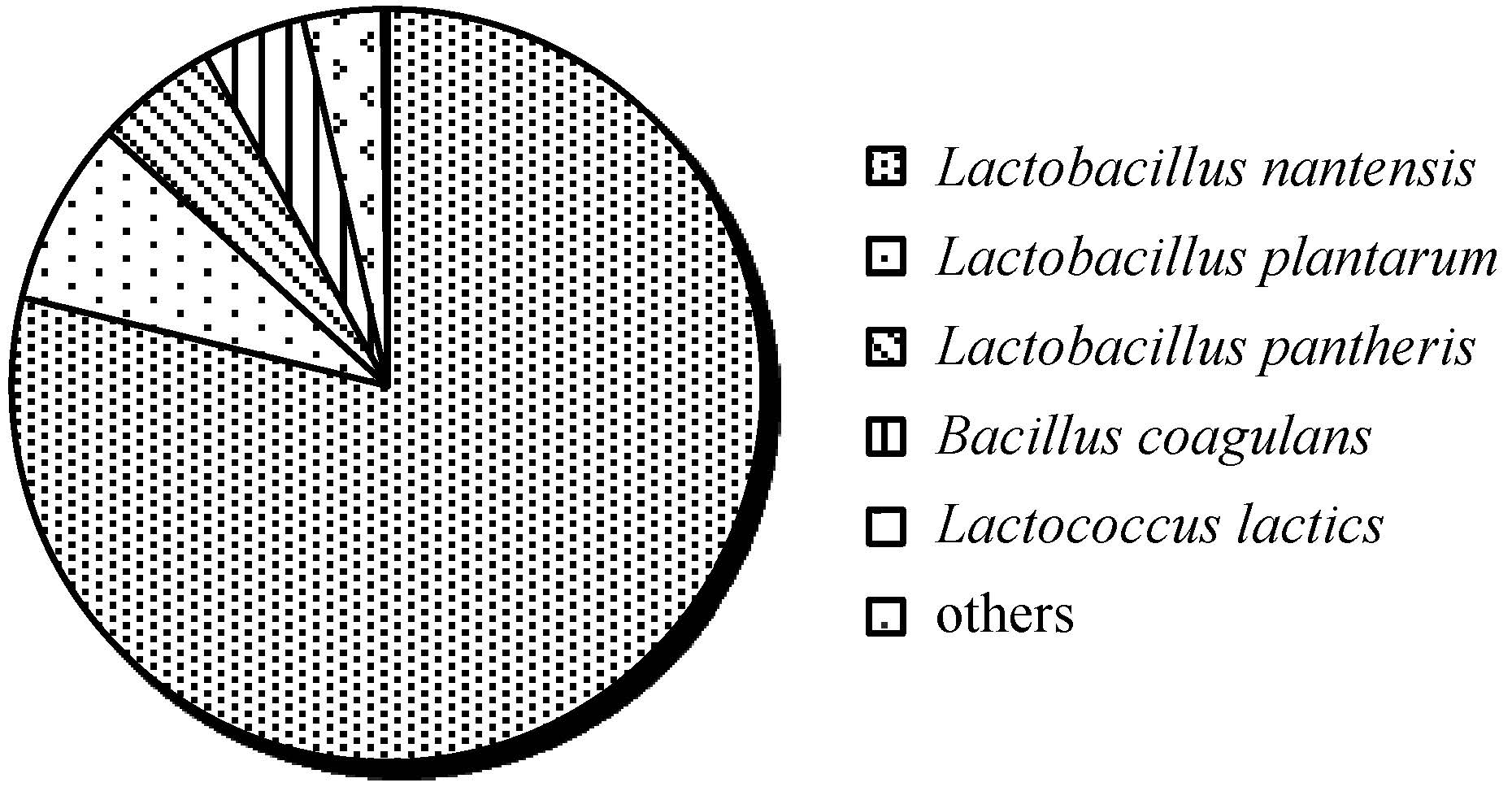
为了得到每个OTU对应的物种分类信息,对97%相似水平的OTU代表序列进行分类学分析,并在属和种水平上统计SGL的群落组成。如图2所示,SGL菌系主要由乳杆菌属、芽孢杆菌属和乳球菌属构成,进一步在种水平上分析可见,SGL主要由Lactobacillus nantensis(78.78%)、Lactobacillus plantarum(7.92%)、Lactobacillus pantheris(5.27%)、Bacillus coagulans(4.41%)、和Lactococcus lactis(3.31%)5个优势菌(相对丰度>0.7%为优势类群),以及其他少量的13种菌(包括Solibacillus silvestris、Brochothrix thermosphacta、Streptococcus unclassified、Pseudomonas azotoformans、Pseudomonas fragi、Moraxella osloensis、Janthinobacterium lividum、Rahnella uncultured bacterium、Acinetobacter johnsonii、Acinetobacter towneri、Arthrobacter unclassified、Myroides unclassified和Psychrobacter immobilis,各菌的相对丰度均<0.05%)组成。
|
| 图2 高通量测序SGL微生物在种水平上的群落组成 Figure 2 Microbial community structure by pyrosequencing of 16S rRNA genes in SGL. |
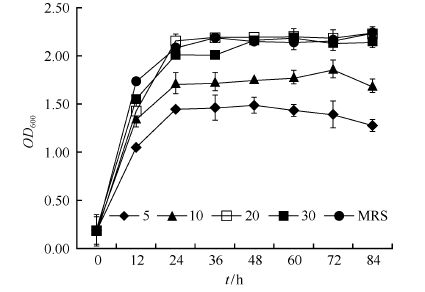
SGL在MRS培养基中生长良好,但MRS培养基成分复杂、成本高。为了简化培养基组成、降低培养成本并保证菌体生长和乳酸产量,在生长培养基中添加不同质量的酵母浸粉(5、10、20和 30 g/L),以期取代MRS培养基作为SGL生长和产酸的营养源。在所有的处理中,初始葡萄糖的浓度均是30 g/L。如图3所示,各处理中SGL的菌体浓度均在24 h达到最高,其中酵母浸粉添加量为20和30 g/L的生长培养基与MRS培养基差异不显著(P>0.05)。
|
| 图3 不同浓度酵母浸粉对SGL菌体生长的影响 Figure 3 Effect of different concentrations of yeast extract on growth of SGL. |
如表4所示,各处理中SGL的乳酸产量均随发酵时间延长而增加,并且20、30 g/L和MRS在36 h后趋于稳定,而5、10 g/L继续增加。结果表明,随着酵母浸粉浓度的增加,底物利用速率和产酸速率提高,乳酸浓度达到最高所需时间缩短。当酵母浸粉的浓度为20 g/L和30 g/L时,发酵48 h,SGL的乳酸产量与MRS培养基差异不显著(P>0.05)。当生长培养基中的酵母浸粉浓度从 5 g/L提高到20 g/L时,发酵液中乳酸浓度从22.11增至37.24 g/L,但底物利用率[底物利用率(%)=(消耗的总糖/初始总糖)×100] 各处理间差异不显著(P>0.05),均高达91%。
结果表明,在生长培养基中添加适量的酵母浸粉可以取代MRS培养基,简化培养基配方,并能满足SGL的生长需要、保证乳酸产量。当酵母浸粉的添加量>20 g/L时,SGL的菌体生长量和乳酸产量不会随之提高。
| t/h | MRS/(g/L) | Yeast extract/(g/L) | ||||||||
| 5 | 10 | 20 | 30 | |||||||
| RG | LA | RG | LA | RG | LA | RG | LA | RG | LA | |
| 0 | 30.00 | 30.00 | 30.00 | 30.00 | 30.00 | |||||
| 12 | 20.54±1.56 | 25.69±0.32 | 22.36±1.55 | 6.08±0.12 | 21.85±0.71 | 10.56±0.91 | 19.70±0.49 | 14.12±0.85 | 22.57±0.63 | 22.39±0.42 |
| 24 | 5.66±0.51 | 32.75±0.82 | 21.77±0.87 | 13.3±0.16 | 17.66±0.62 | 23.45±0.39 | 17.73±0.25 | 26.17±0.59 | 15.33±0.87 | 26.49±0.75 |
| 36 | 2.94±0.10 | 37.98±0.75 | 12.64±0.68 | 18.2±0.40 | 6.31±0.55 | 28.77±0.33 | 3.27±0.58 | 37.30±0.51 | 2.73±0.31 | 37.22±0.73 |
| 48 | 2.73±0.77 | 37.88±0.64 | 2.87±0.41 | 22.1±0.21 | 2.53±0.23 | 30.46±0.66 | 2.73±0.49 | 37.79±0.40 | 2.56±0.52 | 37.24±0.91 |
| RG,Residual glucose; LA,lactic acid. | ||||||||||
当酵母浸粉的添加量为20 g/L时,N元素的浓度是1.80 g/L。在常用的氮源中,酵母浸粉的价格最高,为了进一步降低培养基成本,本研究比较了相同N元素水平(1.80 g/L)的不同碳源,如蛋白胨、酵母浸粉、脲和(NH4)2SO4对SGL代谢特性的影响。如表5所示,生长培养基中氮源的种类对复合系SGL的底物利用率、菌体生长量和乳酸产量的影响显著,有机氮源优于无机氮源,酵母粉优于蛋白胨,(NH4)2SO4优于脲。
| Nitrogen sources |
| Lactic acid/(g/L) |
| Residual glucose/(g/L) |
| Yeast extract | 12 | 13.21±0.21 | 1.43±0.01 | 21.85±0.47 |
| 24 | 26.02±1.51 | 2.12±0.04 | 17.73±0.90 | |
| 36 | 37.48±1.83 | 2.19±0.06 | 3.27±0.11 | |
| 48 | 37.39±0.95 | 2.20±0.03 | 2.75±0.54 | |
| Peptone | 12 | 8.36±0.58 | 0.84±0.02 | 23.88±0.22 |
| 24 | 14.50±0.79 | 1.29±0.01 | 19.09±0.57 | |
| 36 | 20.96±0.25 | 1.34±0.03 | 15.97±0.51 | |
| 48 | 26.70±1.36 | 1.36±0.01 | 14.13±1.16 | |
| Urea | 12 | 1.68±0.74 | 0.18±0.05 | 24.37±0.84 |
| 24 | 2.50±0.13 | 0.19±0.02 | 23.13±0.50 | |
| 36 | 3.60±0.20 | 0.15±0.02 | 22.29±0.72 | |
| 48 | 4.24±0.29 | 0.14±0.04 | 22.45±0.59 | |
| (NH4)2SO4 | 12 | 2.73±0.24 | 0.27±0.01 | 23.61±0.26 |
| 24 | 3.91±0.29 | 0.26±0.06 | 22.64±0.90 | |
| 36 | 6.89±0.48 | 0.36±0.02 | 21.49±0.53 | |
| 48 | 8.59±0.15 | 0.44±0.03 | 19.27±0.66 |
在N元素浓度恒定(1.80 g/L)的基础上,在生长培养基中添加不同比例的酵母浸粉和(NH4)2SO4。如表6所示,SGL的乳酸产量和菌体生长量在添加(NH4)2SO4和酵母粉的培养基中均比在仅有(NH4)2SO4的培养基中高。结果表明,在生长培养基中,适量的减少酵母浸粉的添加量,不但可以降低培养基成本,还不会影响复合系SGL的菌体生长和乳酸产量。当(NH4)2SO4和酵母粉的比例为1∶4时,SGL发酵液中的菌体浓度和乳酸含量与酵母粉添加量为20 g/L时相当。
| (NH4)2SO4:Yeast extract | c(Lactic acid)/(g/L) | OD600 |
| 0.0∶5.0 | 37.39±0.95 | 2.20±0.03 |
| 1.0∶4.0 | 35.25±0.30 | 2.17±0.04 |
| 2.0∶3.0 | 25.36±0.48 | 1.16±0.02 |
| 2.5∶2.5 | 25.28±0.28 | 1.10±0.02 |
| 3.0∶2.0 | 23.78±0.34 | 0.96±0.05 |
| 4.0∶1.0 | 21.85±0.21 | 0.82±0.00 |
| 5.0∶0.0 | 8.59±0.15 | 0.44±0.03 |
关于青贮饲料接种剂或乳酸生产菌株当前有很多报道,大多是单菌或两种菌的简单组合。研究表明,复合系的乳酸产量高于单菌或几种菌的人工组合,并且饲料中接种乳酸菌复合系的青贮效果优于单菌或几种菌的人工组合[5, 6]。
本研究以柳枝稷青贮料中的自然菌群为基础,通过长期限制性培养和定向驯化,筛选到一组功能和组成稳定的乳酸菌复合系,命名为SGL。高通量测序技术可对PCR扩增产物直接进行序列测定,每次分析所得的基因序列数多达几十万到几百万,比DGGE等常规的分子生物学方法具有明显的监测优势,能够较为全面和准确的反映环境微生物群落物种组成和相对丰度[15]。近年来,高通量测序技术广泛应用于土壤、海洋、肠道等复杂生态系统中的微生物多样性分析,但在青贮饲料中的微生物多样性还未有报道。变性梯度凝胶电泳(DGGE)技术虽然不能准确反映样品中的微生物菌群组成,但在直观监测多个样品或发酵过程中样品微生物区系变化时比较有优势[16, 17],已被普遍用于复合系的筛选及传代过程中的稳定性研究。为弥补DGGE的局限性,本研究使用变性梯度凝胶电泳(DGGE)和高通量测序技术,分别分析了筛选过程中微生物菌群结构的动态变化和SGL的物种组成及相对丰度。
PCR-DGGE图谱显示,菌种筛选过程中,SGL的菌群结构从第8代开始稳定,共有10个明显条带;而高通量分析结果显示,SGL由19个菌种组成。高通量测序分析得到的复合系的菌种组成更丰富,能够较为全面的反映复合系的菌种组成,DGGE低估了复合系中微生物的组成。通过高通量测序分析,SGL中的主要菌种包括Lactobacillus nantensis(78.78%)、Lactobacillus plantarum(7.92%)、Lactobacillus pantheris(5.27%)、Bacillus coagulans(4.41%)和Lactococcus lactics(3.31%)等5种产酸细菌。前人筛选的乳酸菌复合系的组成菌株仅包括1-2个菌属,如SFL主要由乳杆菌属(Lactobacillus sakei)和明串珠菌属(leuconostoc inhae)组成[18],SFC-2主要由乳杆菌属Lactobacill fermentum、Lactobacillus plantrum和Lactobacillus paracasei组成[6],AL2主要由乳杆菌属Lactobacillus plantarum、Lactobacillus farciminis,Lactobacillus kimchii和 Lactobacillus pentosus等组成[19]。本文筛选的乳酸菌复合系SGL是目前唯一的、通过自然驯化得到的同时包含乳杆菌属、乳球菌属和芽孢杆菌属等3个主要菌属的乳酸菌复合系。研究表明,复合系的组成多样性有利于不同条件下菌系的稳定,各成员之间具有协同作用[23],使其更能适应各种培养条件。SGL菌种组成多样,不同菌种之间代谢互补,使其对环境的适应性更强,具有很大应用潜力。
Lactobacillus nantensis是从法国小麦酵母中分离得到并命名的,在厌氧条件下生长良好[20]。Lactobacillus plantarum是经常在青贮料中检测到的同型发酵乳杆菌,是常用的青贮饲料添加剂。Lactobacillus pantheris是从北京动物园的美洲豹粪便中分离得到并命名的同型发酵乳杆菌,兼性厌氧,不能代谢阿拉伯糖、木糖和核糖等五碳糖产酸[21]。Bacillus coagulans是能形成孢子、兼性耗氧或者需氧的同型发酵产乳酸的芽孢杆菌,Hammer从酸败的灌装牛奶中分离得到并命名[22],具有益生作用,是被美国、欧盟和日本批准作为饲料添加剂使用的微生物[23]。乳球菌属(Lactococcus)的细菌均为兼性厌氧菌,Lactococcus lactis作为乳球菌属中最具代表性的菌种,是食品发酵特别是干酪制作中主要的菌株之一,它们在决定发酵乳制品的货架期和感官品质时发挥着重要的作用[24]。综上所述,SGL组成多样。研究表明,复合系的组成多样性有利于不同条件下菌系的稳定,各成员之间具有协同作用[25],使其更能适应各种培养条件。综上所述,SGL中的主要菌种均为同型发酵乳酸菌,且为有益菌,适用于青贮饲料添加剂。
3.2 不同氮源对SGL生长代谢的影响菌种和培养基的组成是影响乳酸发酵效率和生产成本关键因素,为了更好的培养乳酸菌,必须深入地了解他们的营养需求和代谢特性,以便在生产实践中寻找和设计一些营养丰富、原料廉价易取,效果良好的乳酸菌培养基。现有的工业乳酸生产菌株多为Lactobacillus cacei、Lactobacillus delbrueckii、Lactobacillus rhamnosus、Lactobacillus brevis、Lactobacillus plantrum和Bacillus sp.strain等单菌或其中两种单菌的组合。为了降低培养基成本,Arasaratnam 等[7]和Nancib等[8]分别研究了在乳清和枣汁中补充酵母浸粉、蛋白胨等有机氮源或脲、(NH4)2SO4等无机氮源对乳酸菌的生长和乳酸产量的影响,至今尚未发现有关不同氮源对自然驯化得到的乳酸菌复合系生长代谢的影响的报道。本研究测定了复合系SGL在含不同氮源的培养基中的生长和产酸特性,为SGL的培养及其在生产中的应用提供理论依据。
乳酸菌对蛋白质的分解能力和氨基酸的合成能力很弱,因此在培养乳酸菌时,普遍需要提供富含各种肽类和氨基酸的有机氮源,如蛋白胨、酵母粉和牛肉膏等。本研究结果表明,酵母浸粉是培养乳酸菌的最佳氮源,这可能与酵母浸粉中含有乳酸菌生长所需氨基酸和维生素等促生长因子有关[26]。但是,生产中若以酵母浸粉作为唯一氮源成本较高。研究表明,在不同的氮源中,(NH4)2SO4 可以作为一种低成本氮源的选择,在枣汁或乳清中添加不同比例的有机氮源(酵母粉)和无机氮源 (NH4)2SO4可以减少酵母浸粉的添加量,促进乳酸菌的生长和产酸,不同比例间差异不显著,(NH4)2SO4可代替75%-80%的有机氮源[7, 8]。本研究以简单的生长培养基提供碳源和无机元素,向其中补充不同氮源不同比例的无机氮源(NH4)2SO4和有机氮源(酵母浸粉),结果表明,(NH4)2SO4/酵母粉比例越高,SGL的生长量和乳酸产量越低;在保证菌体生长量和乳酸产量不变的前提下,(NH4)2SO4能代替25%的有机氮源。优化的培养基成分为葡萄糖 30 g/L、CaCO3 20 g/L、酵母粉16 g/L、(NH4)2SO4 1.7 g/L MgSO4·7H2O 0.58 g/L、MnSO4·4H2O 0.25 g/L、K2HPO4 2 g/L、KH2PO4 2 g/L、FeSO4 0.02 g/L和吐温80 1 mL/L,比MRS成分简单,氮源中少了蛋白胨和牛肉膏,成本降低了20.99%。
综上所述,SGL由多种菌株组成,各菌间代谢互补、高效产酸,作为青贮饲料添加剂,具有很大的应用潜力,本研究为SGL的培养和应用提供了理论依据。各组成菌株间的相互协同关系以及对外界环境(如:温度、酸碱度等)的适应性尚需进一步研究。
| [1] | Mooney DF, Larson JA, English BC, Tyler DD. Effect of dry matter loss on profitability of outdoor storage of switchgrass. Biomass and Bioenergy, 2012, 44: 33-41. |
| [2] | Burns JC, Fisher DS, Pond K R. Ensiling characteristics and utilization of switchgrass preserved as silage. Postharvest Biology and Technology, 1993, 3(4): 349-359. |
| [3] | Luginbuhl JM, Pond KR, Burns JC, Fisher DS. Intake and chewing behavior of steers consuming switchgrass preserved as hay or silage. Journal of Animal Science, 2000, 78(7): 1983-1989. |
| [4] | Panditharatne S, Allen VG, Fontenot JP, Jayasuriya MCN. Ensiling characteristics of tropical grasses as influenced by stage of growth, additives and chopping length. Journal of Animal Science, 1986, 63: 197-207. |
| [5] | 王小芬. 苜蓿青贮接种菌复合系的构建及其在青贮过程中的作用机理. 中国农业大学博士学位论文, 2006. |
| [6] | Gao LJ, Wang XF, Yang HY, Li XM, Cui ZJ. Construction and composition diversity of a lactic acid bacterial community SFC-2. Environmental Science, 2007, 28(5): 1088-1094. (in Chinese) 高丽娟, 王小芬, 杨洪岩, 李献梅, 崔宗均. 秸秆发酵乳酸菌复合系SFC-2的构建及其组成多样性研究. 环境科学, 2007, 28(5): 1088-1094. |
| [7] | Arasaratnam V, Senthuran A, Balasubramaniam K. Supplementation of whey with glucose and different nitrogen sources for lactic acid production by Lactobacillus delbrueckii. Enzyme and Microbial Technology, 1996, 19(7): 482-486. |
| [8] | Nancib N, Nancib A, Boudjelal A, Benslimane C, Blanchard F, Boudrant J. The effect of supplementation by different nitrogen sources on the production of lactic acid from date juice by Lactobacillus casei subsp. rhamnosus. Bioresource Technology, 2001, 78(2): 149-153. |
| [9] | Murray MG, Thompson WF. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Research, 1980, 8(19): 4321-4326. |
| [10] | Wang XF, Wang WD, Gao LJ, Cui ZJ. Protocols of applification of denaturing gradient gel electrophoresis (DGGE) in studies of environmental microorganism. Journal of China Agricultural University, 2006, 11(5): 1-7. (in Chinese) 王小芬, 王伟东, 高丽娟, 崔宗均. 变性梯度凝胶电泳在环境微生物研究中的应用详解. 中国农业大学学报, 2006, 11(5): 1-7. |
| [11] | Chao A, Yang MCK. Stopping rules and estimation for recapture debugging with unequal failure rates. Biometrika, 1993, 80(1): 193-201. |
| [12] | Chao A. Nonparametric estimation of the number of classes in a population. Scandinavian Journal of Statistics, 1984, 11(4): 265-270. |
| [13] | Wang Y, Sheng HF, He Y, Wu JY, Jiang YX, Tam NF, Zhou HW. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271. |
| [14] | Simpson EH. Measurement of diversity. Nature, 1949, 163(4148): 688. |
| [15] | Xia WW, Jia ZJ. Comparative analysis of soil microbial communities by pyrosequencing and DGGE. Acta Microbiologica Sinica, 2014, 54(12): 1489-1499. (in Chinese) 夏围围, 贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价. 微生物学报, 2014, 54(12): 1489-1499. |
| [16] | Ma JX, Ji MJ, Kong J. Overview of limitation and improving methods of PCR-DGGE in microbial diversity study. Food Science, 2008, 29(5): 493-497. (in Chinese) 马俊孝, 季明杰, 孔健. PCR-DGGE技术在微生物物种多样性研究中的局限性及其解决措施. 食品科学, 2008, 29(5): 493-497. |
| [17] | Yu J, Feng X, Xie YH, Liu SC. PCR-DGGE and its application in the research of environmental microbiology. Journal of Northwest A & F University (Natural Science Edition), 2010, 38(6): 227-234. (in Chinese) 于洁, 冯炘, 解玉红, 刘淑琮. PCR-DGGE技术及其在环境微生物领域中的应用. 西北农林科技大学学报(自然科学版), 2010, 38(6): 227-234. |
| [18] | Yang HY, Yuan XF, Liu XP, Wang XF, Cui ZJ. Microbial diversity of a community for ensiling rice straw at low temperature and fermentation dynamics. Acta Microbiologica Sinica, 2011, 51(9): 1248-1255. (in Chinese) 杨洪岩, 袁旭锋, 刘小平, 王小芬, 崔宗均. 水稻秸秆低温复合菌系多样性及发酵动态. 微生物学报, 2011, 51(9): 1248-1255. |
| [19] | Wang XF, Haruta S, Wang P, Ishii M, Igarashi Y, Cui ZJ. Diversity of a stable enrichment culture which is useful for silage inoculant and its succession in alfalfa silage. FEMS Microbiology Ecology, 2006, 57(1): 106-115. |
| [20] | Valcheva R, Ferchichi MF, Korakli M, Ivanova I, Ganzle MG, Vogel RF, Prevost H, Onno B, Dousset X. Lactobacillus nantensis sp. nov., isolated from French wheat sourdough. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(Pt 3): 587-591. |
| [21] | Liu B, Dong XZ. Lactobacillus pantheris sp. nov., isolated from faeces of a jaguar. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(Pt 5): 1745-1748. |
| [22] | Hammer BW. Bacteriological studies on the coagulation of evaporated milk. Iowa: Agricultural Experiment Station Research Bulletin, 1915: 119-131. |
| [23] | Cui DL, Tong JM, Wang YS, Zhang LP. The elementary study of industrial culture medium of Bacillus coagulans fermentation. Food and Fermentation Industries, 2007, 33(12): 73-75. (in Chinese) 崔东良, 佟建明, 王云山, 张利平. 凝结芽孢杆菌工业化发酵培养基初步研究. 食品与发酵工业, 2007, 33(12): 73-75. |
| [24] | Smit G, Smit BA, Engels WJ. Flavour formation by lactic acid bacteria and biochemical flavour profiling of cheese products. FEMS Microbiology Reviews, 2005, 29(3): 591-610. |
| [25] | Kato S, Haruta S, Cui ZJ, Ishii M, Igarashi Y. Stable coexistence of five bacterial strains as a cellulose-degrading community. Applied and Environmental Microbiology, 2005, 71(11): 7099-7106. |
| [26] | Rogosa M, Franklin JG, Perry KD. Correlation of the vitamin requirements with cultural and biochemical characters of Lactobacillus spp. Journal of General Microbiology, 1961, 25(3): 473-482. |
 2015, Vol. 55
2015, Vol. 55