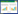中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 欧阳润泽, 贺艳艳, 徐海. 2015
- Runze Ouyang, Yanyan He, Hai Xu. 2015
- 细菌整合子中整合酶基因调控的研究进展
- Advances in integrase regulations of bacteria - A review
- 微生物学报, 2015, 55(10): 1231-1237
- Acta Microbiologica Sinica, 2015, 55(10): 1231-1237
-
文章历史
- 收稿日期:2015-01-07
- 修回日期:2015-03-13
近年来,抗生素的大量使用甚至是滥用导致了细菌耐药性的增强及其耐药基因在基因移动单元中的广泛传播,这对人类健康和环境发展构成了严重的威胁[1]。包括耐药基因转移在内的基因水平转移是细菌进化的重要机制[2]。常见的基因移动元件有转座子、质粒、噬菌体和整合子等[3]。1989年,Stokes等[4]首次提出了整合子(integron)的概念,认为其是耐药基因水平转移的重要途径之一。整合子是通过位点特异性重组来捕获、剪切、整合外源基因(特别是耐药基因)的一类可移动DNA元件[3],在细菌的耐药性传播中发挥着至关重要的作用。
1 整合子的结构和分类 1.1 整合子的结构整合子的基本结构由5’保守区(5’conserved segment,5’CS)、3’保守区(3’conserved segement,3’CS)、可变区(Variable region,VR)三部分组成(图 1)。5’CS主要包括以下几部分:(1)intI基因,编码整合酶(intergrase),由酪氨酸家族构成;(2)attI重组位点,与基因盒上的attC位点特异性组合,使基因盒整合到整合子上;(3)Pc,强启动子,位于attI重组位点的上游,大多数Pc位于整合酶基因的编码区,少数Pc存在于整合酶上游非编码区,负责可变区内基因盒的转录表达;(4)Pint,整合酶启动子,方向与Pc相反,负责整合酶的转录表达[5]。3’CS因整合子种类的不同而有所差异。大部分整合子3’CS含有溴化乙锭耐药基因ΔqacE、磺胺类耐药基因sul1和不明功能的开放式阅读框ORF5[6, 7]。可变区可同时插入一个或多个基因盒(GC),基因盒是由重组位点attC和基因编码区组成,这些基因盒作为独立的功能单位可单独移动。目前在第I类整合子中发现的基因盒已经有80余种,大多数都为耐药性基因盒,可赋予其编码产物一定的抗药性[8]。但可变区并不是整合子的基本结构,有些整合子在两个保守区之间并不存在可变区[9]。
|
| 图 1. I型整合子的结构 Figure 1. General structure of class 1 integrons. |
根据其序列的同源性,整合酶至少被分为五类。I型整合子存在于很多革兰氏阴性菌中,如不动杆菌[10, 11]、大肠杆菌[12, 13]、沙门氏菌[14]以及很多其他的细菌中[15];II型整合子通常与转座子Tn7家族相关,存在于沙门氏菌[16]和志贺氏杆菌中[17];III型整合子与其他两类整合子很相似,但是它与Tn402转座子相关[8];IV和V型整合子是在弧菌中与甲氧苄啶抗性进化有关的整合子[8,18]。其中I型整合子由于其特有的剪切、整合耐药基因盒的功能及在多重耐药菌中存在的普遍性,受到了越来越多研究者的关注。
2 I型整合子对基因盒的捕获、整合与剪切I型整合子中的整合酶催化基因盒上的attC位点与其自身的attI位点发生特异位点重组,使得基因盒被整合到整合子上或被剪切下来。已有研究表明从整合子上剪切下来的基因盒是以闭合环状的形式存在的[19],这些环状DNA也可被整合到整合子上。
attC位点不保守且长度不一[20],主要包括两个含有7个碱基对的不完全反向重复序列和中间的回文区,这两个反向重复序列高度保守,被称为核心位点和反向核心位点。核心位点序列为GTTRRRY(R为嘌呤,T为嘧啶),反向核心位点序列为RYYYAAC[9,21]。位于5'CS末端的attI位点也包括含有7个碱基对的核心位点序列GTTRRRY。整合酶催化的特异位点重组主要发生在核心位点序列的GT之间[19-21]。一般来说整合既可以发生在两个attC位点之间,也可以发生在attC与attI之间,但是更倾向于后者[19]。
3 I型整合酶基因表达的调控 3.1 抗生素对整合酶基因表达的影响之前的学者普遍认为耐药细菌的产生是基于选择压力的条件下,那就意味着只有当抗生素的浓度达到一定范围时,才会对细菌产生作用。然而,最近越来越多的证据表明,即使是特别低的抗生素浓度,只要它存在的时间足够长,也可以刺激耐药性的产生。每年,成百上千吨的抗生素从医疗废水和农业废水流入生态环境中,近日,国内的一份学术报告指出[22],目前我国地表水中含有68种抗生素,且浓度高于一些发达国家,而这广泛存在的抗生素是否会对耐药细菌中整合酶基因的表达存在影响方面的有关研究受到了越来越多的关注。即使是非耐药细菌,在某些抗生素存在的条件下也可存活,这可能是基于细菌本身可被诱导产生的压力应答反应,如SOS反应等。
SOS反应是指当菌体内出现大量单链DNA(ssDNA)时细胞所产生的应激反应。LexA蛋白是SOS反应的抑制物,ssDNA是RecA蛋白的底物,ssDNA/RecA复合物的形成刺激了抑制物LexA蛋白的水解,从而激活了细菌的SOS反应。
Émilie Guerin等[23]通过比对不同基因组上的整合子和可移动的整合子发现在与整合酶启动子Pint重叠的区域存在保守的LexA结合位点,进而证明SOS反应对I型整合子中整合酶的转录表达有一定的作用。他们以β-半乳糖苷酶为标记基因检测I型整合酶的表达,使用抗生素丝裂霉素C、环丙沙星、甲氧苄啶、氨苄青霉素诱导细菌SOS反应,发现SOS反应会分别使整合酶转录水平提高4.5倍(大肠杆菌中)和37倍(霍乱弧菌中),当LexA或RecA发生突变或缺失时,就没有该现象的产生(图 2)。

|
| 图 2. 不同抗生素介导弧菌(A)和大肠杆菌(B)产生SOS反应后Pint活性的变化[23] Figure 2. The strength of Pint inductions in the Vibrio cholerae CI (A )and the Escherichia coli pAT674 class 1 MI- (B)[23]. Mitomycin (M), ciprofloxacin (C), trimethoprim (T), ampicilin(A). The mutants or defectives of recA or lexA: RecA-、LexA(ind-)、LexA(Def); The LexA box mutants: LexA box #A、 LexA boxA #A’、 LexA box #B、LexA box #B’. |
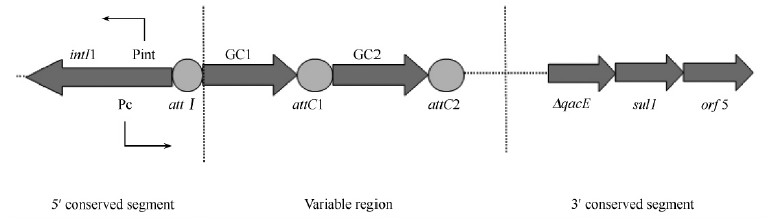
Guillaume Cambray等[24]证明在霍乱弧菌里,LexA通过与类似大肠杆菌中LexA结合位点的结合来调控I型整合酶的表达。在大肠杆菌中,某些抗生素(如甲硝唑、甲氧嘧啶、喹诺酮类、β-内酰胺类抗生素)的加入会激发菌体的SOS反应,导致整合酶表达的增强,增大了基因盒的重排率[23,27]。除抗生素以外,在大肠杆菌和霍乱弧菌中,单链DNA的转移(包括接合和转化)也可以诱发SOS反应,进而上调整合酶的表达,即使这些单链DNA在受体细胞内不能被整合或稳定存在,SOS反应也可以被激活。另外,使用几丁质或过表达TfoX蛋白,也是在转化过程中诱发SOS反应的条件,但最终SOS反应还是被单链DNA诱发的[25, 26]。具体可诱发SOS反应的因素见图 3。
|
| 图 3. SOS反应诱导I型整合酶示意图 Figure 3. Model of intI1 regulation by SOS response. |
但不是所有的抗生素都可以诱发细菌SOS反应,氨基糖苷类抗生素、四环素和氯霉素就不能介导大肠杆菌产生SOS反应。它们可以通过其他的方式,如氧化性损伤、核苷酸池失衡以及其他普通的压力应答反应等方式提高细菌突变率从而使细菌产生抗性,但是至于这些突变对I型整合酶表达方面相关的影响还需做进一步的深入探讨。
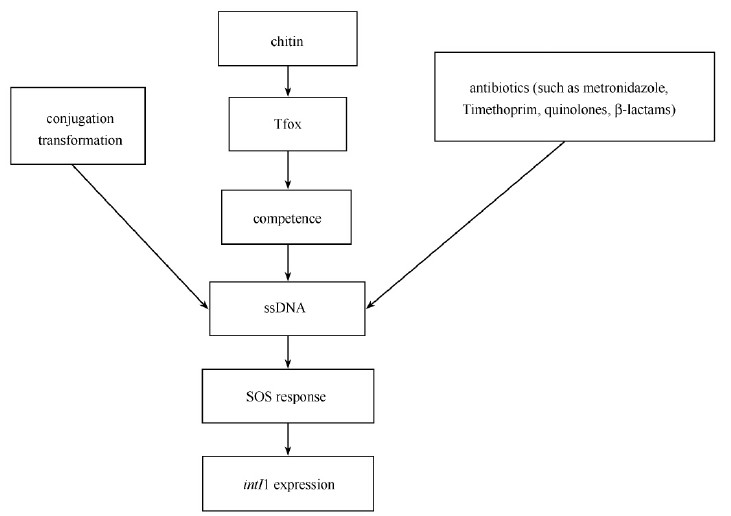
3.2 cAMP-CRP途径对整合酶基因表达的影响在变形菌门中,其对环境的适应性也依赖于碳分解代谢物控制调节(cAMP-CRP途径)[28]。当培养基中最适碳源含量很低时,细菌开始分解其他碳源(如阿拉伯糖或琥珀酸盐),通过激活腺苷酸环化酶来介导CRP相关基因的表达,形成的CRP-cAMP复合体与crp基因结合来调控转录[29]。Zeynep Baharoglu等[26]通过DNase I足迹法确认在整合酶的启动子区存在CRP-cAMP结合位点,进一步实验发现当在培养基中使用不同的碳源时,整合酶的表达也发生变化,几丁质、阿拉伯糖和琥珀酸能通过诱导cAMP促进intI1基因的表达,而葡萄糖则有抑制作用(图 4)。
|
| 图 4. cAMP-CRP诱导I型整合酶表达示意图 Figure 4. Model of intI1 regulation by cAMP-CRP complex. |
I型整合子中的Pc位于整合酶的编码区,从整合酶基因的5'-CS边界开始,共计214个碱基。因此启动子序列的差异也会影响I型整合酶基因的表达。根据其-10区和-35区的序列,Pc主要分为4种,按其强度大小依次为PcS>PcH2> PcH1>PcW[30],见表 1。在大约10%的I型整合子中存在有P2启动子,它是通过在attI结合位点插入GGG三联体形成的,目的是为了弥补强度较弱的Pc变体的不足,在I型整合子中已经鉴定出超过20种Pc-P2结合体[30-31], 其中出现频率最高的为以下几种,按强弱大小依次为:PcW<PcW-P2<PcH1<PcH1-P2<PcWTGN-10<P2<PcWTGN-10<PcH2<PcS-P2<PcS[30]。研究表明Pc启动子的强弱是与整合酶基因的表达和活性呈负相关的。一方面,Pc启动子强度越弱,整合酶的切除活性越强[30]。另一方面,Pc启动子会干扰intI1的转录水平,具体程度取决于Pc的变体不同,最强的PcS变体会阻止intI1的表达,而其他变体刚好相反[32]。因此,Pc-P2结合体不仅与基因盒的表达有关,同时也会影响I型整合子中整合酶基因的表达,进而调节基因盒的重排。
| Promoter | variants | -35 sequence | -10 sequence | Spacer length/bp |
| Pc | PcS | TTGACA | TAAACT | 17 |
| PcW | TGGACA | TAAGCT | 17 | |
| PcH1 | TGGACA | TAAACT | 17 | |
| PcH2 | TTGACA | TAAGCT | 17 | |
| PcSS | TTGATA | TAAACT | 17 | |
| P2 | P2 | TTGTTA | TACAGT | 14 |
| P2 | TTGTTA | TACAGT | 17 |
整合子可以通过特异位点重组的方式来捕获整合和剪切基因盒。这个整合过程主要是2个特异位点之间的相互作用,即整合酶上的attI位点和基因盒上attC之间的作用。整合酶特异性的结合到attC位点的底链上,因此attC底链折叠形成的螺旋外碱基对于整合酶的识别具有重要的作用。André Larouche等[33]通过比较5种整合酶对含有不同attC位点基因盒的整合以及切除作用,发现当基因盒中attC位点为T-N6-G或T-N6-C时,intI1具有较高的切除活性,intI3只能识别几种特定的attC位点, intI2*179E(II型整合酶的一个变体)和SonIntIA(奥奈达湖希瓦氏菌中的一种整合酶)的作用范围最广。因此不同的整合酶有自己偏好的attC位点,这种偏好与它对螺旋外碱基的识别有关。
3.5 拟核相关蛋白对整合酶基因表达的影响除了一些顺式作用元件对整合酶表达的调节,菌体中存在的一些拟核相关蛋白对整合酶的表达也具有一定的影响[33]。Caran等[34]通过调节位点预测实验,发现除LexA外,整合子启动子附近还有拟核相关蛋白H-NS,FIS,IHF的调控位点,经进一步实验发现:(1)FIS会抑制整合酶的表达;(2)当P2的-10区与-35区间隔为17个碱基对时,IHF会激活整合酶的表达;(3)H-NS可以抑制整合酶的表达。迁移实验证明FIS和IHF对整合酶的调节是通过直接与整合酶启动子相互作用的情况下发生的。
3.6 整合子可变区长度对整合酶基因表达的影响基因盒的数量和大小决定了可变区的长度,基因盒被整合酶捕获后通过特异位点重组的方式整合到整合子的可变区,然而可变区的长度并不是无限延长的,目前发现最长的可变区含有9个基因盒[35],I型整合子可变区长度一般在1000-3000 bp之间[36]。冯银等[37]在实验中发现,当可变区长度较短时,其整合酶表达水平更强,具有更强的基因盒捕获能力,继而说明当整合子捕获基因盒后,为了维持其自身的稳定性,可变区的基因盒对整合酶的表达存在一定的负反馈调节作用。
4 小结和展望随着细菌耐药性问题的日趋严重,对细菌耐药性机制的相关研究已经成为一大热点。整合子是多重耐药菌耐药基因传播的主要基因移动元件之一,而其主要是在整合酶的催化下通过特异位点重组的方式捕获、整合和剪切基因盒的。所以关于整合酶基因表达的调控因素越来越受到研究者的广泛关注。目前,已经发现影响I型整合子中整合酶表达的主要因素有以下几个:(1)SOS反应可以影响I型整合酶的表达,导致其表达量增强;(2)cAMP-CRP途径对I型整合酶具有调控作用;(3)Pc-P2启动子强弱的差异也会导致I型整合酶表达量的不同,大体上来说是Pc-P2启动子越强,I型整合酶表达量越低;(4)attC重组位点的差异可以调节I型整合酶的表达,不同的整合酶有自己偏好的attC位点;(5)菌体内的拟核相关蛋白对I型整合酶的表达也具有一定的影响,FIS、H-NS蛋白会抑制I型整合酶的表达,IHF在某种情况下会激活I型整合酶的表达。(6)可变区的基因盒对整合酶的表达存在一定的负反馈调节作用。整合酶基因表达活性越高,相应地捕获整合耐药基因盒到整合子可变区的效率也相对较高,从而使细菌耐药性增强。
目前本实验室在此方面也做了一些工作,通过鉴定实验室已有的大量多重耐药菌的整合子中的启动子,共发现3种Pc启动子(分别为PcW、PcWTGN-10和PcH1),它们的强弱程度依次为 PcWTGN-10>PcH1 >PcW,而与之对应的Pint的强弱刚好相反,说明Pc与Pint的活性是呈现一定的负相关性的。通过采用一些不同条件(不同抗生素、盐浓度、温度以及丝裂霉素C)诱导该启动子,发现抗生素对整合酶启动子基因的表达有上调的作用,也就说明了环境中残留的抗生素通过SOS诱导系统对整合酶基因进行正向调控,强化了耐药基因盒的整合作用,进而促进了耐药性的扩散。
一直以来,大多数研究者认为只有当选择压力存在的条件下,才会有耐药细菌的产生,但越来越多的关于整合酶调控的研究表明当外界没有抗生素压力时,与该压力相对应的耐药基因会暂时沉默,而其他的基因会正常表达。因此,耐药基因并不会消失。现在我国的地表水甚至是自来水中都检测出了抗生素,即使含量甚少,但也会有助于耐药细菌的广泛传递。故为缓解细菌耐药性问题的严峻性,我们不光要从整合酶基因表达的调控因素入手,研究其耐药机制,控制耐药基因的传播,同时也要控制抗生素的使用,只有双管齐下,才可有效抑制整合子介导的耐药菌的传播,降低耐药菌的发生。
| [1] | Martinez JL. The role of natural environments in the evolution of resistance traits in pathogenic bacteria. Proceedings of the Royal Society b: Biological Science , 2009, 276(1667): 2521-2530. |
| [2] | Salyers AA, Gupta A, Wang YP. Human intestinal bacteria as reservoirs for antibiotic resistance genes. Trends in Microbiology , 2004, 12(9): 412-416. |
| [3] | Hall RM, Collis CM. Mobile gene cassettes and integrons: capture and spread of genes by site-specific recombination. Molecular Microbiology , 1995, 15(4): 593-600. |
| [4] | Stokes HW, Hall RM. A novel family of potentially mobile DNA elements encoding site-specific gene-integration functions: integrons. Molecular Microbiology , 1989, 3(12): 1669-1683. |
| [5] | Krin E, Cambray G, Mazel D. The superintegron integrase and the cassette promoters are co-regulated in Vibrio cholerae. PLoS One , 2014, 3(9): e91194. |
| [6] | Naas T, Sougakoff W, Casetta A, Nordmann P. Molecular characterization of OXA-20, a novel class D β-lactamase, and its integron from Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy , 1998, 42(8): 2074-2083. |
| [7] | Paulsen IT, Littlejohn TG, RådstrÖm P, SundstrÖm L, SkÖld O, Swedberg G, Skurray RA. The 3’conserved segment of integrons contains a gene associated with multidrug resistance to antiseptics and disinfectants. Antimicrobial Agents and Chemotherapy , 1993, 37(4): 761-768. |
| [8] | Mazel D. Integrons: agents of bacterial evolution. Nature Reviews Microbiology , 2006, 4(8): 608-620. |
| [9] | Collis CM, Hall RM. Site-specific deletion and rearrangement of integron insert genes catalyzed by the integron DNA integrase. Journal of Bacteriology , 1992, 174(5): 1574-1585. |
| [10] | Petersen A, Guardabassi L, Dalsgaard A, Olsen JE. Class I integrons containing a dhfrI trimethoprim resistance gene cassette in aquatic Acinetobacter spp.. FEMS Microbiology Letters , 2000, 182(1): 73-76. |
| [11] | Gallego L, Towner KJ. Carriage of class 1 integrons and antibiotic resistance in clinical isolates of Acinetobacter baumannii from northern Spain. Journal of Medical Microbiology , 2001, 50(1): 71-77. |
| [12] | Chang CY, Chang LL, Chang YH, Lee TM, Chang SF. Characterization of drug resistance gene cassettes associated with class 1 integrons in clinical isolates of Escherichia coli from Taiwan, ROC. Journal of Medical Microbiology , 2000, 49(12): 1097-1102. |
| [13] | Mazel D, Dychinco B, Webb VA, Davies J. Antibiotic resistance in the ECOR collection: integrons and identification of a novel aad gene. Antimicrobial Agents and Chemotherapy , 2000, 44(6): 1568-1574. |
| [14] | Casin I, Breuil J, Brisabois A, Moury F, Grimont F, Collatz E. Multidrug-resistant human and animal Salmonella typhimuvium isolates in France belong predominantly to a DT104 clone with the chromosome- and integron-encoded β -lactamase PSE-1. The Journal of Infectious Diseases , 1999, 179(5): 1173-1182. |
| [15] | Fluit AC, Schmitz FJ. Resistance integrons and super-integrons. Clinical Microbiology and Infection , 2004, 10(4): 272-288. |
| [16] | Orman BE, Piñeiro SA, Arduino S, Galas M, Melano R, Caffer MI, Sordelli DO, Centrón D. Evolution of multiresistance in nontyphoid Salmonella serovars from 1984 to 1998 in Argentina. Antimicrobial Agents and Chemotherapy , 2002, 46(12): 3963-3970. |
| [17] | Gonzalez G, Sossa K, Bello H, Dominguez M, Mella S, Zemelman R. Presence of integrons in isolates of different biotypes of Acinetobacter baumannii from Chilean hospitals. FEMS Microbiology Letters , 1998, 161(1): 125-128. |
| [18] | Hochhut B, Lotfi Y, Mazel D, Faruque SM, Woodgate R, Waldor MK. Molecular analysis of antibiotic resistance gene clusters in Vibrio cholerae O139 and O1 SXT constins. Antimicrobial Agents and Chemotherapy , 2001, 45(11): 2991-3000. |
| [19] | Collis CM, Hall RM. Gene cassettes from the insert region of integrons are excised as covalently closed circles. Molecular Microbiology , 1992, 6(19): 2875-2885. |
| [20] | Stokes HW, O'Gorman DB, Recchia GD, Parsekhian M, Hall RM. Structure and function of 59-base element recombination sites associated with mobile gene cassettes. Molecular Microbiology , 1997, 26(4): 731-745. |
| [21] | Hall RM, Brookes DE, Stokes HW. Site-specific insertion of genes into integrons: role of the 59-base element and determination of the recombination cross-over point. Molecular Microbiology , 1991, 5(8): 1941-1959. |
| [22] | Wang D, Sui Q, Zhao WT, Lü SG, Qiu ZF, Yu G. Pharmaceutical and personal care products in the surface water of China: A review. Chinese Science Bulletin , 2014, 59(9): 743-751. (in Chinese) 王丹, 隋倩, 赵文涛, 吕树光, 邱兆富, 余刚. 中国地表水环境中药物和个人护理品的研究进展. 科学通报, 2014, 59(9): 743-751. |
| [23] | Guerin E, Cambray G, Sanchez-Alberola N, Campoy S, Erill I, Da Re S, Gonzalez-Zorn B, Barbé J, Ploy MC, Mazel D. The SOS response controls integron recombination. Science , 2009, 324(5930): 1034. |
| [24] | Cambray G, Sanchez-Alberola N, Campoy S, Guerin É, Da Re S, González-Zorn B, Ploy MC, Barbé J, Mazel D, Erill I. Prevalence of SOS-mediated control of integron integrase expression as an adaptive trait of chromosomal and mobile integrons. Mobile DNA , 2011, 2(1): 6. |
| [25] | Baharoglu Z, Bikard D, Mazel D. Conjugative DNA transfer induces the bacterial SOS response and promotes antibiotic resistance development through integron activation. PLoS Genetics , 2010, 6(10): e1001165. |
| [26] | Baharoglu Z, Krin E, Mazel D. Connecting environment and genome plasticity in the characterization of transformation-induced SOS regulation and carbon catabolite control of the Vibrio cholerae integron integrase. Journal of Bacteriology , 2012, 194(7): 1659-1667. |
| [27] | Hocquet D, Llanes C, Thouverez M, Kulasekara HD, Bertrand X, Plésiat P, Mazel D, Miller SI. Evidence for induction of integron-based antibiotic resistance by the SOS response in a clinical setting. PLoS Pathogens , 2012, 8(6): e1002778. |
| [28] | Cameron ADS, Redfield RJ. Non-canonical CRP sites control competence regulons in Escherichia coli and many other γ- proteobacteria. Nucleic Acids Research , 2006, 34(20): 6001-6014. |
| [29] | De Crombrugghe B, Busby S, Buc H. Cyclic AMP receptor protein: role in transcription activation. Science , 1984, 224(4651): 831-838. |
| [30] | Jové T, Da Re S, Denis F, Mazel D, Ploy MC. Inverse correlation between promoter strength and excision activity in class 1 integrons. PLoS Genetics , 2010, 6(1): e1000793. |
| [31] | Vinué L, Jové T, Torres C, Ploy MC. Diversity of class 1 integron gene cassette Pc promoter variants in clinical Escherichia coli strains and description of a new P2 promoter variant. International Journal of Antimicrobial Agents , 2011, 38(6): 526-529. |
| [32] | Guérin E, Jové T, Tabesse A, Mazel D, Ploy MC. High-level gene cassette transcription prevents integrase expression in class 1 integrons. Journal of Bacteriology , 2011, 193(20): 5675-5682. |
| [33] | Larouche A, Roy PH. Effect of attC structure on cassette excision by integron integrases. Mobile DNA , 2011, 2: 3. |
| [34] | Cagle CA, Shearer JES, Summers AO. Regulation of the integrase and cassette promoters of the class 1 integron by nucleoid-associated proteins. Microbiology , 2011, 157(10): 2841-2853. |
| [35] | Partidge SR, Tsafnat G, Coiera E, Iredell JR. Gene cassettes and cassette arrays in mobile resistance integrons. FEMS Microbiology Reviews , 2009, 33(4): 757-784. |
| [36] | Liu PM, Yao HL, Lu SH, Zhuang N. Integron-mediated multidrug resistance in clinical multi-resistant Pseudomonas aeruginosa. Chinese Journal of Clinical Laboratory Science , 2009, 27(3): 180-182. (in Chinese) 刘培明, 姚慧琳, 陆士海, 庄楠. 多重耐药铜绿假单胞菌中I类整合子的研究. 临床检验杂志, 2009, 27(3): 180-182. |
| [37] | 冯银. 细菌整合子可变区长度及质粒消除对整合酶I表达的影响. 中南大学硕士学位论文, 2013. |
 2015, Vol. 55
2015, Vol. 55